不同光质对黄秋葵幼苗生长、光合色素和气孔特征的影响
2016-09-01李慧敏陆晓民高青海赵诗浩
李慧敏,陆晓民,高青海,赵诗浩
(安徽科技学院生命科学学院,安徽 凤阳 233100)
不同光质对黄秋葵幼苗生长、光合色素和气孔特征的影响
李慧敏,陆晓民,高青海,赵诗浩
(安徽科技学院生命科学学院,安徽 凤阳 233100)
以黄秋葵品种‘五福’为试材,采用单因素随机区组设计,探讨不同光质对黄秋葵幼苗生长、光合色素和气孔特征的影响。试验结果表明:与荧光灯(CK)处理相比,蓝光(B)、紫光(P)、红光(R)和蓝红复合光(BR)处理下的黄秋葵幼苗的鲜质量、干质量及其叶片的光合色素含量等指标均有不同程度的增加,且以BR处理为最高;在黄秋葵幼苗叶片气孔特征方面,其上表皮的气孔密度以BR和R处理下最大,而下表皮的气孔密度仅BR处理下最大;上、下表皮的气孔长轴长度,以BR处理下最大,B处理次之;上表皮的气孔短轴长度及气孔弧长均在BR处理下最大,而下表皮的气孔短轴长度、气孔弧长以B处理下最大,BR处理次之。可见,BR处理能显著促进黄秋葵幼苗的生长,幼苗生长快速健壮,并提高了叶片光合色素的含量,气孔发育相对较好,因此可采用BR作为黄秋葵育苗的人工光源。
光质; 黄秋葵; 生长; 光合色素; 气孔特征
黄秋葵(Abelmoschusesculentus)又名咖啡黄葵、秋葵、羊角豆,为锦葵科秋葵属一年或多年生草本植物,其以嫩荚为食,因富含蛋白质、胡萝卜素、维生素C、糖以及矿物质、黄酮、游离氨基酸等多种营养和生物活性成分而备受人们青睐[1]。黄秋葵现分布于世界各地,以热带和亚热带最为普遍,我国南北方各地已均有栽培[2]。其属短日照植物,对光照条件尤为敏感[3]。在我国长江三角洲及其以北的地区,由于气候、光照等因素的限制,黄秋葵主要采用设施栽培模式。因此,早春弱光天气已成为了培育健壮幼苗的限制性因素,采用人工光源调控设施育苗与栽培已成为必要的光调控手段[4-5]。
光既作为一种能源控制着光合作用,还是一种触发信号,影响着植物的生长和发育。采用不同波长的光照射植物,发现植物对紫外光UV-A(320~380 nm)、紫外光UV-B(280~320 nm)、蓝光(380~500 nm)、红光(620~700 nm)和远红光(700~800 nm)特别敏感[6]。其中,蓝光在叶绿素形成、叶绿体发育和气孔开放等方面发挥着重要作用[7]。在设施栽培中利用人工光源补充自然光照的不足或者代替自然光已经成为环境控制植物生长和发育的重要手段。目前,长期使用的人工光源主要有白炽灯、荧光灯、高低压钠灯、金属卤化物灯和镝灯等,其中高压钠灯和镝灯是发光效率和有效光合成效率较高的光源,但是其发射光谱不能与植物的光合作用吸收光谱相吻合,不能对植物近距离照射,对植物生长光激励效率不高,而且热辐射多、效率低、耗电量大、成本高[8]。因此,引进发光性能好、节能、产热低、寿命长的新型光源,对提高植物育苗设施内的电能和空间利用率、降低成本具有重要意义。而稀土植物生长灯是利用稀土三基色荧光粉的选择配比和运用,调出适合植物生长所需的光谱,其光效分布均匀,是其他同瓦数节能灯的两倍,一般日光灯的3倍,而且使用寿命长[9]。近年来,利用人工光源进行环境调控植物生长的研究逐渐引起国内外学者的关注。国内外的学者已经开展了一些相关光调控植物生长的应用研究,其部分结果已证实光对植物的生长发育和生理特性表现出了显著促进效应[4-5,10-26],但是也发现了不同植物物种或品种产生的光生物学效应是具有明显差异的。因此,为了筛选适合黄秋葵育苗的人工光源,优化设施秋葵人工育苗和栽培体系,有必要利用优质人工光源进行光源环境调控技术方面的研究。本试验以荧光灯(CK)为对照,采用蓝光(B)、紫光(P)、红光(R)和蓝红复合光(BR),研究了不同光质对黄秋葵幼苗生长、光合色素和气孔特征的影响,筛选适合黄秋葵幼苗生长的光源与相关技术,以期为黄秋葵工厂化育苗中光源的选择提供理论依据和技术支持。
1 材料与方法
1.1材料准备
黄秋葵品种‘五福’种子购于合肥合丰种业有限公司。于2015年3月至8月开展本试验。挑选大小一致、饱满的种子,播于装满蛭石的穴盘中,并将穴盘悬浮在盛有水的周转箱中进行水培育苗。7~10 d子叶展平后,将幼苗移栽至基质为蛭石+草炭+珍珠岩(1.5V∶1.5V∶1V)的营养钵中。
1.2试验设计
采用单因素随机区组设计。根据保持光强相同的原则,将幼苗随机放置在荧光灯(CK,T5-28W,飞利浦照明工业有限公司,中国扬州)、蓝光(B)、紫光(P)、红光(R)和蓝红复合光(BR)(40W,上海合鸣照明电器有限公司, 中国上海)下进行照射(各光谱分布见表1)。以荧光灯为对照,其中光强均为100 μmol/(m2·s),光周期为12 h/d,处理45 d。以浇灌Hoagland’s营养液进行常规管理,环境温度保持24~26℃,相对湿度为55%~60%,试验重复3次,每个处理60株,每次300株。
1.3测定方法与指标
幼苗光处理45 d后,从每处理取30株,每小区随机取10株,进行生长分析。先记录根长、茎粗、节间距和株高。同时测定鲜样质量,并在烘干后测定干样质量。壮苗指数的计算采用以下公式:茎粗/株高×全株干样质量[27]。在幼苗经光处理45 d 后,从每处理取15株,每小区随机取5株,进行生理指标分析。采用80%丙酮提取法测定光合色素含量[28]。在上午9:00-10:00选取健康、完整的黄秋葵主茎功能叶(倒2、3叶),采用印迹法观察气孔。从每处理取15株,每小区随机取5株,先用脱脂棉蘸水轻轻擦拭叶片上、下表皮去掉灰尘。然后在上、下表皮中部靠近主脉两侧1 cm处快速涂上一层薄薄的透明指甲油,待风干结成膜后,用贴有两面黏性透明胶带的载玻片压在叶片上。然后轻轻剥下叶片,使指甲油印膜粘在透明胶带上,用中性树胶封片,制成临时片,用MOTIC-BA210显微镜及其摄影成像系统拍照与测量,主要测量的项目有气孔长轴长度、短轴长度和气孔弧长,气孔频度是由单位面积内的气孔数目来表示[29]。
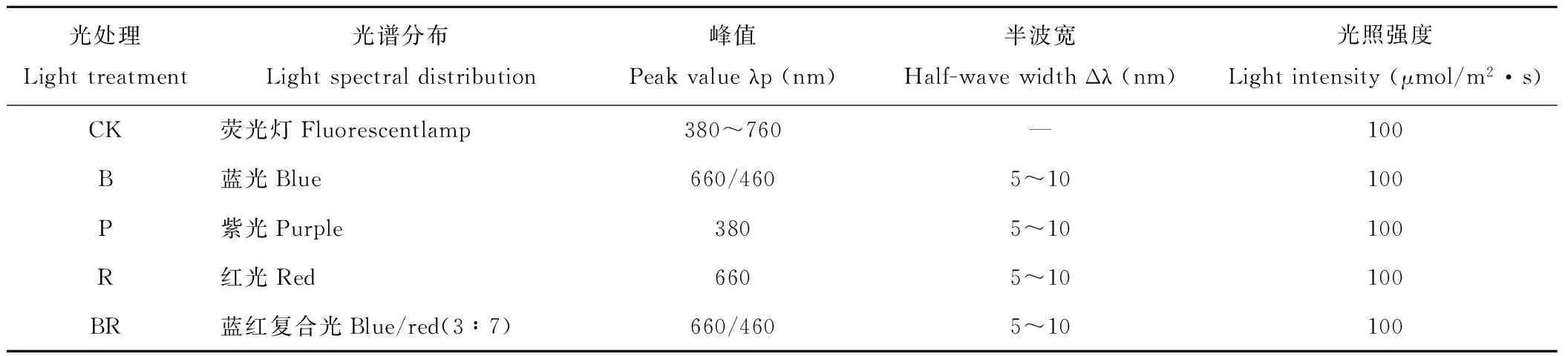
表1 不同光谱分布的主要技术参数Table 1 Major technique parameters of light spectral distribution under rare earth lights
1.4数据整理与分析
采用Microsoft Excel 2003和SPSS 16.0系统进行单因素方差分析和显著性差异检测(Duncan法,P<0.05)。
2 结果与分析
2.1不同光质对黄秋葵幼苗生长的影响
与对照(CK)相比(表2),蓝光(B)、蓝红复合光(BR) 、红光(R)和紫光(P)处理的黄秋葵幼苗的鲜样质量、干样质量、根长、茎粗、节间距、株高和壮苗指数不同程度增加,并均以BR处理最高,其增幅分别为33.65%,38.64%,22.15%,33.67%,46.13%,35.22%和37.05%,且均达到显著水平(P<0.05);B处理的鲜样质量、干样质量、根长、茎粗、节间距、株高和壮苗指数分别比CK显著增加23.39%,22.73%,7.42%,19.13%,25.81%,15.72%和26.34%,但显著低于BR处理;R处理下的鲜样质量、干样质量、根长、节间距和壮苗指数,分别比CK显著增加18.62%,15.91%,9.59%,32.26%和14.42%, 其中茎粗和株高与CK无显著差别,但所有指标都显著低于BR处理,其中茎粗、株高和壮苗指数也显著低于B处理,其他指标与B处理无显著差别;P处理的鲜样质量、干样质量、根长、茎粗和壮苗指数与CK无显著差别,其节间距比对照显著增加13.87%,株高显著低于CK,但是所有指标均显著低于BR和B处理。可见,B、BR和R处理相比于CK,都能不同程度促进黄秋葵幼苗的生长,尤其以BR表现更为突出。
2.2不同光质对黄秋葵幼苗叶片光合色素含量的影响
黄秋葵叶片中叶绿素a、叶绿素b和叶绿素总量在各光质处理间表现趋势基本一致(图1),即BR处理下均最大,显著高于CK处理28.40%,38.71%和37.10%,其次为B处理,显著高于CK 处理10.58%,22.58%和19.91%,再者为CK和P处理,R处理下最小,除P和R处理下的叶绿素b,各处理下的叶绿素a、叶绿素b和叶绿素总量均有显著差别(P<0.05);类胡萝卜素的含量在BR处理,其次为B处理,二者显著高于CK处理28.57%和14.29%,其次为P处理和CK无显著差别,R处理下最小。由此得出,BR及B处理显著提高了黄秋葵幼苗叶片光合色素的含量,但是R却降低了光合色素的含量。
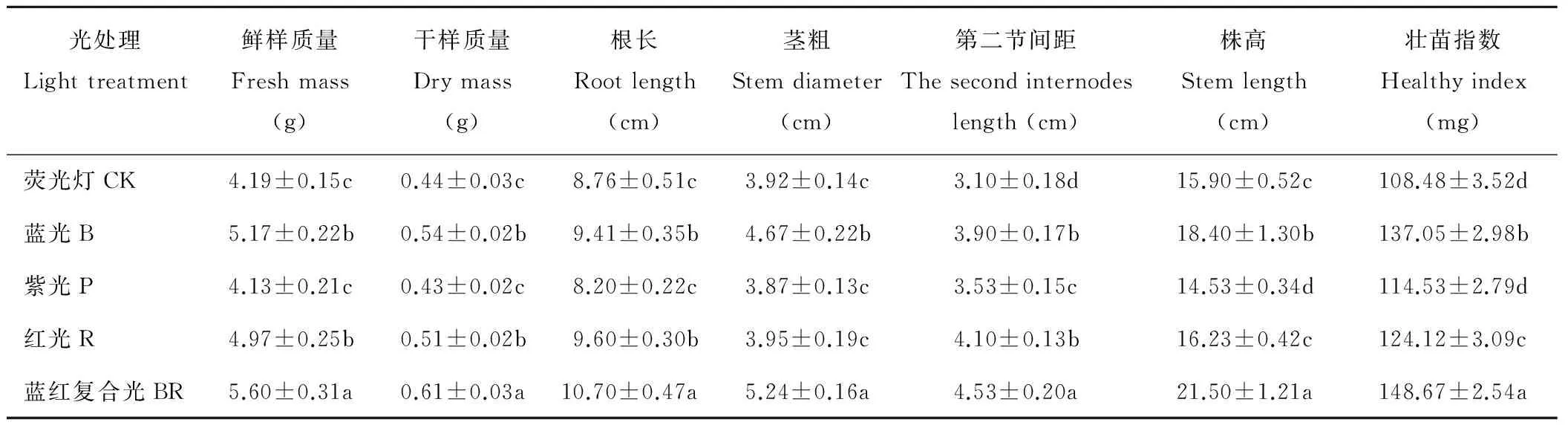
表2 不同光质对黄秋葵幼苗生长的影响Table 2 Effects of different light quality on growth of okra seedling
注:同列的不同字母表示处理间 (n=3)在P<0.05 水平存在显著性差异。
Note: Different letters within the same column indicate significant differences among treatments atP<0.05 according to Duncan’s test (n=3).
2.3不同光质对黄秋葵幼苗叶片气孔特征的影响
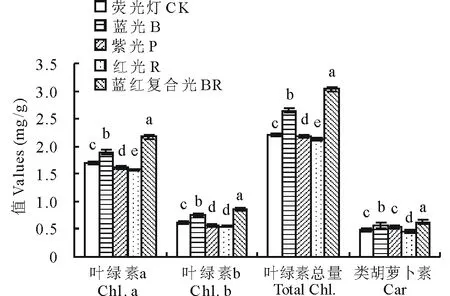
图1 不同光质下黄秋葵幼苗光合色素含量的变化Fig.1 The photosynthetic pigment content of okra seedling under different light quality 不同字母表示处理间(n=3)在P<0.05水平存在显著性差异;下同。Different normal letters indicate significant differences among treatments at P<0.05 level according to Duncan’s test (n=3). The same below.
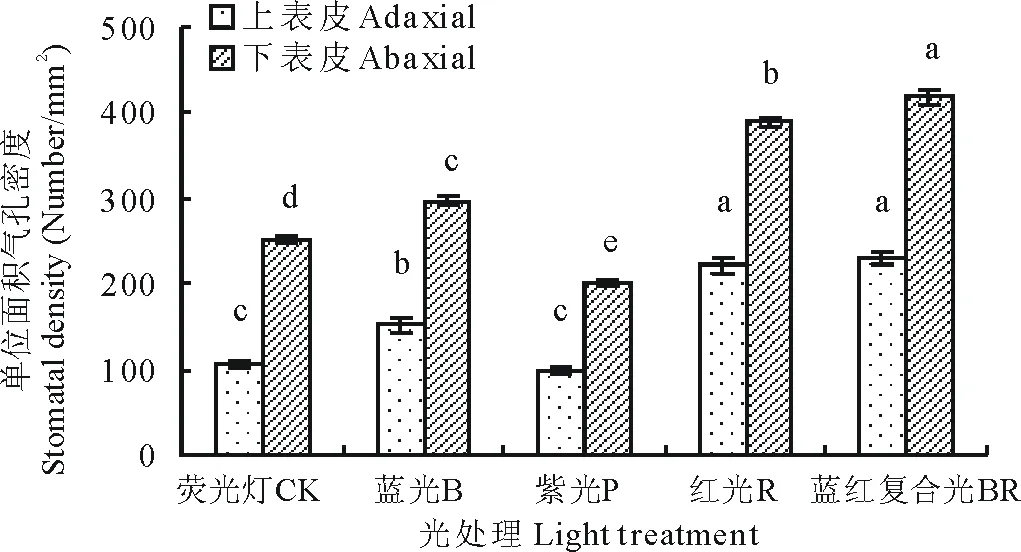
图2 不同光质下黄秋葵幼苗气孔密度的变化Fig.2 The stomatal density of okra seedling under different light quality
黄秋葵叶片的上表皮的气孔密度以BR和R处理下最大(图2,图3),其次为B处理,三者显著高于CK处理116.34%,109.19%和43.47%,P处理和CK无显著差别(P<0.05);黄秋葵叶片的下表皮的气孔密度在BR处理下最大,其次为R和B处理,三者显著高于CK处理66.18%,54.59%和17.87%,CK和P处理下较小,二者无显著差别,其中各处理下的下表皮的气孔密度约为上表皮的2~3倍。可见,BR处理增加了黄秋葵上、下表皮的单位面积气孔数目,其中下表皮单位气孔数目要多于上表皮。
黄秋葵叶片的上表皮的气孔长轴长度在BR处理下最大(图4,图5),其次为B处理,再者为R和P处理,四者显著高于CK处理34.22%,23.30%,14.11%和13.04%,R和P处理下二者无显著差别(P<0.05);黄秋葵叶片的下表皮的气孔长轴长度的变化趋势与上表皮一致;黄秋葵叶片的上、下表皮气孔的长轴长度差别不大。本结果表明,黄秋葵的气孔长轴长度在BR和B处理下较大,其中上、下表皮单位气孔长轴长度无明显差别。
黄秋葵叶片的上表皮的气孔短轴长度在BR处理下最大(图5,图6),其次为B处理,再者为R和P处理,四者显著高于CK处理47.81%,28.36%,16.44%和13.70%,R和P处理下二者无显著差别(P<0.05);黄秋葵叶片的下表皮的气孔短轴长度以B处理下最大,其次为BR,再者为P处理和R处理,四者显著高于CK处理59.52%,50%,15.60%和7.00%,CK处理下最小。其中,下表皮气孔的短轴长度要高于上表皮。结果说明,黄秋葵气孔上、下表皮的短轴长度在BR和B处理下较大。

图3 不同光质对黄秋葵幼苗气孔特征的影响 (40倍)Fig.3 Effects of different light quality on stomatal characteristic of okra seedling (40×) CK,荧光灯;B,蓝光;P,紫光;R,红光;BR,蓝红复合光;U:上表皮;D:下表皮;Ep: 表皮; Sto:气孔; 标尺:20 μm。CK, Fluorescent lamp; B, 100% blue light; P, 100% purple lights; R, 100% red light; BR=3∶7, 30% blue plus 70% red light; U: Upper; D: Down; Ep: Epidermis; Sto: Stomata; Bar: 20 μm.下同The same below.
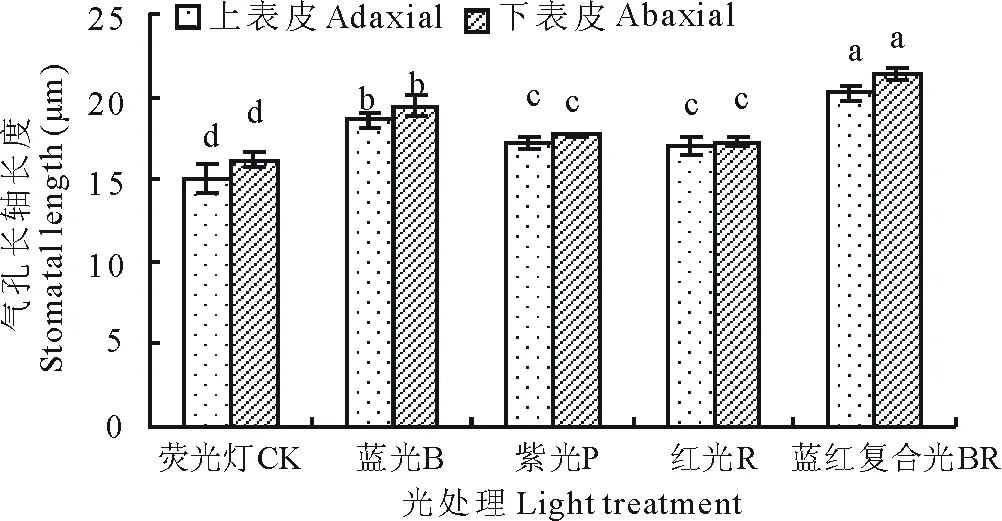
图4 不同光质下黄秋葵幼苗气孔长轴长度的变化Fig.4 The stomatal length of okra seedling under different light quality
黄秋葵叶片的上表皮的气孔弧长在BR处理下最大(图5,图7),其次为B和P处理,三者显著高于CK处理17.74%,9.05%和5.18%,R处理下最小(P<0.05);黄秋葵叶片的下表皮的气孔弧长以B处理下最大,其次为BR处理,二者显著高于CK处理20.31%和2.40%,再者为P处理和CK处理无显著差别,R处理下最小。可见,黄秋葵气孔上、下表皮的弧长在BR和B处理下较大。
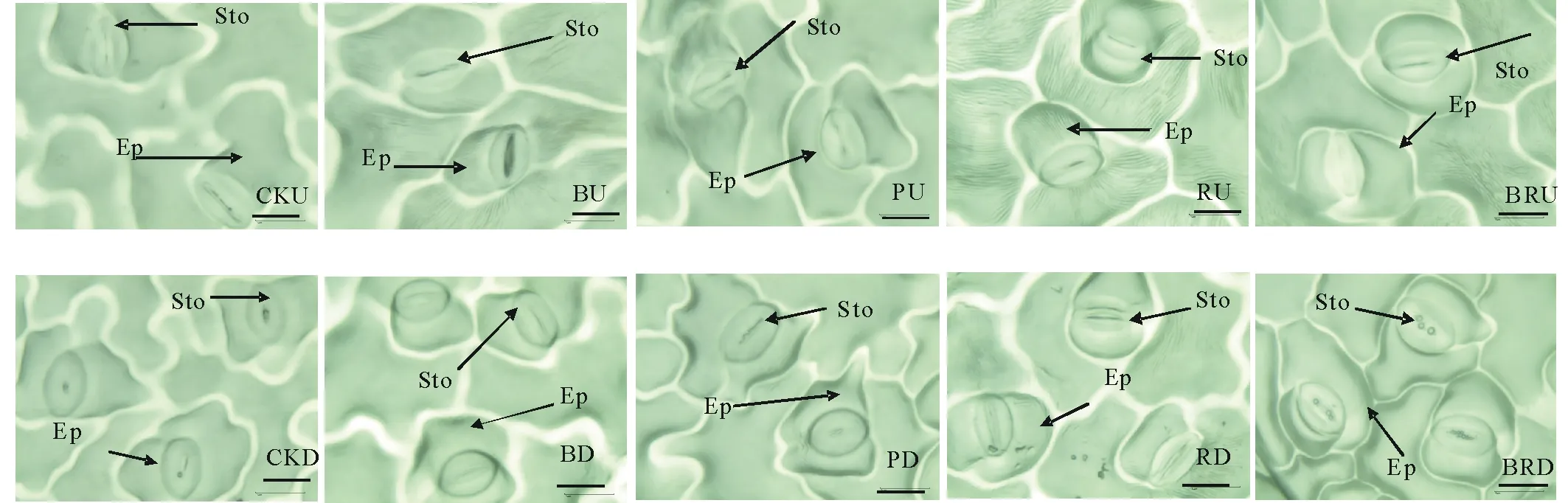
图5 不同光质对黄秋葵幼苗气孔特征的影响 (100倍)Fig.5 Effects of different light quality on stomatal characteristic of okra seedling (100×) 标尺:1 μm。Bar: 1 μm.
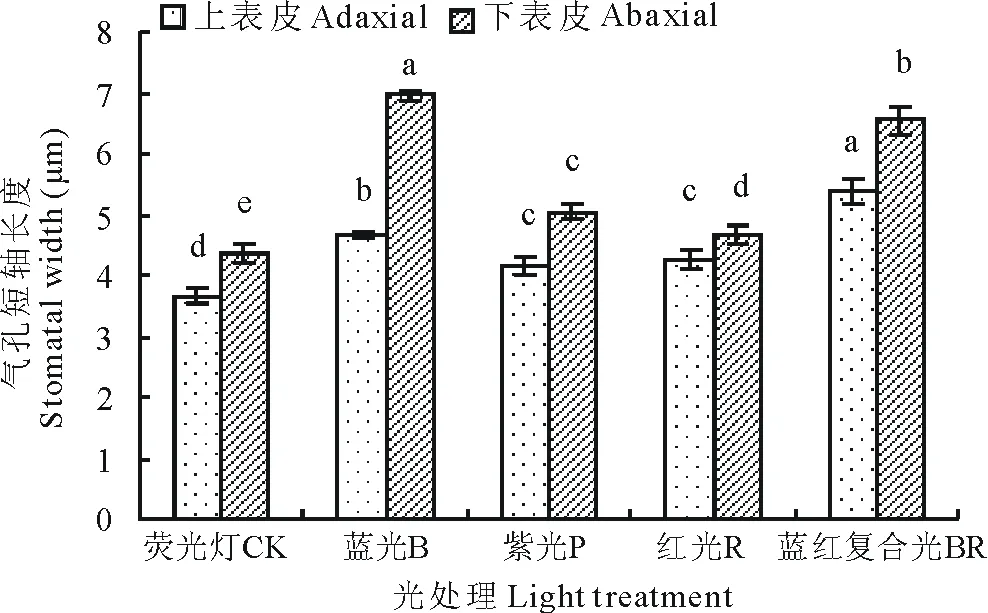
图6 不同光质下黄秋葵幼苗气孔短轴长度的变化Fig.6 The stomatal width of okra seedling under different light quality
3 讨论
3.1光质调控植物的生长
蓝光受体(隐花色素和向光素)和红/远红光受体(光敏色素)的联合吸收光谱与光合色素的相重叠,其可能是通过引发色素受体和其他蛋白质相互作用的变化,进而引起光信号蛋白亚细胞定位的改变、离子内稳态、其他细胞活动的变化或基因表达,最终植物发育上产生了变化[30-32]。崔瑾等[10]发现黄瓜(Cucumissativus)、辣椒(Capsicumfrutescens)和番茄(Lycopersiconesculentum)幼苗的鲜、干样质量在补充蓝红复合光后较高。蓝红复合光促进了辣椒、红甜菜(Betavulgaris)、水稻(Oryzasativa)、甘蓝型油菜(Brassicanapus)、叶用莴苣(Lactucasativa)和不结球白菜(Brassicarapa)幼苗生物量的积累[11-16]。王婷等[17]却发现蓝红黄复合光有利于不结球白菜干物质的积累。蓝红绿复合光照射的叶用莴苣生物量更高[18]。吴家森等[19]也发现蓝红远红复合光下萝卜(Raphanussativus)叶片鲜、干质量最大。刘振威等[4]报道了双色和三色复合光促进番茄幼苗地下干质量、地上干质量、地下鲜质量和地上鲜质量。本研究发现,蓝红复合光下黄秋葵的鲜、干样质量等指标显著提高,幼苗生长较健壮。综上所述,复合光质促进了植物的生长。蓝红复合光对植物的生长发育能产生积极影响, 主要可能是由于蓝光受体(隐花色素和向光素)和红光受体(光敏色素)的光谱能量分布与叶绿素吸收光谱的峰值区域一致[33],但是具体适合的光源比例可能因植物的种属而异[20]。本研究认为,蓝红复合光有利于黄秋葵幼苗的生长。
3.2光质调控植物气孔的发育
气孔是植物叶片与外界进行气体交换的重要通道。通过气孔扩散的气体有O2、CO2和水蒸气。植物在光下进行光合作用,经由气孔吸收CO2,所以气孔必须张开,但气孔张开又不可避免地发生蒸腾作用,气孔可以根据环境条件的变化来调节自己开度的大小而使植物在损失水分较少的条件下获取最多的CO2。不同植物气孔的大小、数目和分布不同。大部分植物叶的上、下表皮都有气孔,但不同类型的植物其叶上、下表皮气孔数量不同[34]。常涛涛等[21]发现,番茄幼苗叶片的气孔密度在蓝光、蓝红复合光和蓝红绿复合光下的较高。马绍英等[22]发现葡萄(Vitisvinifera)试管苗在蓝红复合光下的气孔频度大。Heo等[23]却发现,荧光灯和LEDs混合照射下万寿菊(Tageteserecta)和鼠尾草(Salviajaponica)的气孔数目较多,而远红光辅助荧光灯下万寿菊的气孔数目最多。Poudel等[24]发现蓝光下葡萄气孔数目较多同时叶绿素值也较高,光敏色素对气孔发育有着直接的影响。Li等[25]发现甘蓝型油菜在蓝红3∶1 LEDs下光合色素含量最高,同时其下表皮气孔频度也最大。Li等[20]发现陆地棉(Gossypiumhirsutum)组培苗叶片的上、下表皮的气孔频度在红光LEDs下最大,蓝红1∶3和荧光灯下居中,蓝光下较小,但是其叶片的叶绿素含量在蓝光LEDs下最大,其次为蓝红1∶1 LEDs,荧光灯和红光下较小。Kim等[26]发现蓝红复合1∶1下,幼苗生长较好,但是气孔数目较少,在荧光灯下的幼苗生长较差,但是气孔数量较多。袁莉民等[35]认为气孔在叶片上分布的密度大小和气孔结构的发达程度与叶片光合能力密切相关。本研究发现,黄秋葵叶片的上、下表皮的气孔密度以BR和B处理下较大(图2),同时叶片的光合色素含量在BR和B处理下也较大(图1)。蓝光可能通过光合色素接受激发一系列信号途径来引起在红光背景下气孔的发育[36-38]。本研究认为,蓝红复合光和蓝光增加了黄秋葵单位叶面积下的气孔数目和光合色素含量,其中光合色素的含量可能与气孔数目存在一定的相关性。
气孔运动实质上由于两个保卫细胞内水分得失引起的体积或形状变化,进而导致相邻两壁间隙的大小变化。光是主要控制气孔运动的环境信号。一般情况下,光照使气孔开放,黑暗使气孔关闭。一般认为不同波长的光对气孔运动的影响与对光合作用过程的影响相似,即蓝光和红光最有效。蓝光可激活质膜上的质子泵,促使保卫细胞质子的外流、钾的吸收、淀粉的水解和苹果酸的合成[34]。气孔开放的作用光谱与光合作用的相似,对植物的生命活动极其重要[39]。Kraepiel和Mipiniac[40]强调了蓝光在气孔开启中的重要作用。常涛涛等[20]发现,蓝红、蓝红绿复合光和蓝光下的番茄叶片的气孔面积较大。Li 等[25]发现陆地棉组培苗叶片的气孔面积在蓝光下最大,蓝红1∶1和蓝光促进了气孔的开启。马绍英等[22]发现葡萄试管苗在蓝红复合光下的气孔长×宽最小。Li 等[25]报道了甘蓝型组培苗在蓝红3∶1和蓝光下叶片气孔面积最大,蓝红3∶1和蓝光有利于甘蓝型油菜组培苗叶片气孔的开放。Kim等[26]发现蓝红复合1∶1下,幼苗生长较好,气孔开度大。苏天星等[41]却认为红膜、蓝膜和黄膜可有效诱导温室甜椒(Capsicumannuum)叶片气孔的开放。Heo等[23]也报道了鼠尾草的气孔开度在蓝光下较小,而金盏菊(Calendulaofficinalis)的气孔开度在蓝光下没有太大变化。本研究发现,蓝红复合光和蓝光下黄秋葵的长轴、短轴和弧长都较大,气孔开度较大。Lawrence等[42]认为蓝光可能是通过改变玉米(Zaemays)黄质光受体的状态来直接影响气孔的开闭,促进气孔开放。可见,不同植物在气孔上表现出的光效应是有差异的,但是叶片上气孔的数目、大小和分布可能因植物的种属而异。本研究认为,蓝红复合光和蓝光有利于黄秋葵气孔的发育。
4 结论
不同光质照射黄秋葵后,幼苗的生长、叶片光合色素和气孔特征等指标产生了不同的光响应特征,其中,BR能有效促使幼苗生长健壮,并且显著提高了黄秋葵幼苗的鲜、干样质量等生长指标、叶片中光合色素含量,BR和B处理显著提高了气孔特征包括单位面积密度、长轴、短轴长度和弧长等指标。因此,在黄秋葵育苗或栽培时,可以采用BR作为首选的人工光源。本研究结果为今后黄秋葵工厂化育苗、设施栽培技术的光调控措施提供了理论依据。21世纪将是生态农业的世纪,应用于植物工厂化育苗和设施栽培中的光源调控技术是一项经济有效、简单易行且节能环保的新方法,具有广泛前景。
References:
[1]Kahlon T S, Chapman M H, Smith G E.Invitrobinding of bile acids by okra, beets, asparagus, eggplant, turnips, green beans, carrots and cauliflower. Food Chemistry, 2007, 103(2): 676-680.
[2]Zeng R Q, Hong J J,Yao Y F,etal. Biological characteristics and ecological adaptability evaluation of okra resources. Chinese Journal of Tropical Crops, 2015, 36(3): 523-529.
[3]Gao L, Liu D F, Xu L. Research progress and prospects of okra. Chinese Journal of Tropical Agriculture, 2014, 34(11): 22-29.
[4]Liu Z W, Sun L, Fang T T,etal. Effects of different light qualities on growth and physiological characteristics of tomato seedlings. Acta Agriculturae Boreali-Sinica, 2015, 30(5): 141-145.
[5]Pu G B, Liu S Q, Liu L,etal. Effects of different light qualities on growth and physiological characteristics of tomato seedlings. Acta Horticulturae Sinica, 2005, 32(3): 420-425.
[6]Liu M, Zhao Q, Wang X J,etal. Plant photoreceptors and regulation mechanism. Bulletin of Biology, 2005, 40(5): 10-12.
[7]Senger H. The effect of blue light on plants and microorganisms. Photochemistry Photobiology, 1982, 35: 911-920.
[8]Xu J Z, Li T K, Ge D Y,etal. Study advances on selective absorption to light wavelengths in the development of plants. Hebei Journal of Forestry and Orchard Research, 2002, 17(2): 180-184.
[9]Li H M, Lu X M. Effects of light quality on the quality of broad bean (ViciafabaLinn.) sprouts. Auhui Agricultural Science Bulletin, 2013, 19(10): 26, 89.
[10]Cui J, Ma Z H, Xu Z G,etal. Effects of supplemental lighting with different light qualities on growth and physiological characteristics of cucumber, pepper and tomato seedlings. Acta Horticulturae Sinica, 2009, 36(5): 663-670.
[11]Brown C S, Schuerger A C, Sager J C. Growth and photomorphogenesis of pepper plants under red light-emitting diodes with supplemental blue or far-red lighting. Journal of the American Society for Horticultural Science, 1995, 120: 808-813.
[12]Chen W H, Xu Z G, Liu X Y,etal. Effect of LED light source on the growth and quality of different lettuce varieties. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(7): 1434-1440.
[13]Li H M, Lu X M. Growth and physiological characteristics of rapeseed seedlings under different light quality. Acta Botanica Boreali-Occidentalia Sinica, 2015, 35(11): 2251-2257.
[14]Guo Y S, Gu A S, Cui J. Effects of light quality on rice seedlings growth and physiological characteristics. Chinese Journal of Applied Ecology, 2011, 22(6): 1485-1492.
[15]Shin K S, Murthy H N, Heo J W,etal. Induction of betalain pigmentation in hairy roots of red beet under different radiation sources. Biologia Plantarum, 2003, 47(1): 149-152.
[16]Li H M, Tang C M, Xu Z G,etal. Effects of different light sources on the growth of non-heading Chinese cabbage (BrassicarapaL.). Journal of Agriculture Science, 2012, 4(4): 262-273.
[17]Wang T, Li W L, Gong F E,etal. Effects of different LED light qualities on growth and physiological characteristics of non-heading Chinese cabbage. Journal of Gansu Agricultural University, 2011, 46(4): 69-73.
[18]Kim H H, Goins G H, Wheeler R M,etal. Green-light supplementation for enhanced lettuce growth under red- and blue-light-emitting diodes. HortScience, 2004, 39(7): 1617-1622.
[19]Wu J S, Hu J Y, Zhou Q Z,etal. Influence of illumination supplement used a LED light on growth and photosynthesis of radish. Northern Horticulture, 2009, 10: 30-33.
[20]Li H M, Xu Z G, Tang C M. Effect of light-emitting diodes on growth and morphogenesis of upland cotton (GossypiumhirsutumL.) seedlinginvitro. Plant Cell Tissue Organ and Culture, 2010, 103: 155-163.
[21]Chang T T, Liu X Y, Xu Z G,etal. Effects of light spectral energy distribution on growth and development of tomato seedlings. Scientia Agricultura Sinica, 2010, 43(8): 1748-1756.
[22]Ma S Y, Li S, Niu J Y,etal. Effects of different LED light on physiological and biochemical characters of grape rootstock plantlets. Journal of Gansu Agricultural University, 2010, 45(5): 56-62.
[23]Heo J W, Lee C W, Chakrabarty D,etal. Growth responses of marigold and salvia bedding plants as affected by monochromic or mixture radiation provided by a light emitting diode (LED). Plant Growth Regulation, 2002, 38: 225-230.
[24]Poudel P R, Kataoka I, Mochioka R. Effect of red and blue light-emitting diodes on growth and morphogenesis of grapes. Plant Cell Tissue and Organ Culture, 2008, 92: 147-153.
[25]Li H M, Tang C M, Xu Z G. Effect of light emitting diodes on growth and morphogenesis of Rapeseed (BrassicanapusL) plantletsinvitro. Scientia Horticulturae, 2013, 150: 117-124.
[26]Kim S J, Hahn E J, Heo J W,etal. Effects of LEDs on net photosynthetic rate, growth and leaf stomata of chrysanthemum plantletsinvitro. Scientia Horticulturae, 2004, 101: 143-151.
[27]Zhang Z X, Wang P L, Liu S Q,etal. Vegetable Physiology[M]. Beijing: China Agricultural Science and Technology Press, 1993.
[28]Wang X K. Principles and Techniques of Plant Physiology and Biochemistry Experiment (Second Edition)[M]. Beijing: Higher Education Press, 2006: 130.
[29]Zeng B, Wang Q Y, Tang C M. Anatomic analysis on heterosis in three transgenic Bt pest-resistant hybrid cotton (G.hirsutumL.). Acta Agronomica Sinica, 2008, 34(3): 496-505.
[30]Smith H. Phytochromes and light signal perception by plants-an emerging synthesis. Nature, 2000, 407: 585-591
[31]Quail P H. Phytochrome photosensory signaling networks. Nature Reviews Molecular Cell Biology, 2002, 3: 85-93.
[32]Wang H, Deng X W. Dissecting the phytochrome A-dependent signaling network in higher plants. Trends in Plant Science, 2003, 8: 172-178.
[33]Yang Q C. Application and prospect of light-emitting diode (LED) in agriculture and bio-industry. Journal of Agricultural Science and Technology, 2008, 10(6): 42-47.
[34]Li H S. Modern Plant Physiology (Third Edition)[M]. Beijing: Higher Education Press, 2012: 45-46.
[35]Yuan L M, Qiu M, Wang P,etal. Structure characteristics of stomata in leaves and vascular bundles in culms of transgenic rice expressing C4photosynthesis enzymes. Scientia Agricultura Sinica, 2006, 39(5): 902-909.
[36]Kinoshita T, Doi M, Suetsugu N,etal.Phot1 andphot2 mediate blue light regulation of stomatal opening. Nature, 2001, 414: 656-660.
[37]Doi M, Shigenaga A, Emi T,etal. A transgene encoding a blue-light receptor, phot1, restores blue light responses in theArabidopsisphot1phot2 double mutant. Journal of Experimental Botany, 2004, 55: 517-523.
[38]Shimazaki K, Doy M, Assmann S M,etal. Light regulation of stomatal movement. Annual Review of Plant Biology, 2007, 58: 219-247.
[39]Outlaw J R, William H. Integration of cellular and physiological functions of guard cells. Critical Reviews Plant Sciences, 2003, 22: 503-529.
[40]Kraepiel Y, Mipiniac E. Photomorphogenesis and phytohormones. Plant Cell and Environment, 1997, 20: 807-812.
[41]Su T X, Yang Z Q, Huang H J,etal. Effect of light quality on stomatal conductance of sweet pepper in greenhouse. Arid Meteorology, 2010, 28(4): 443-448.
[42]Lawrence D T, Ganke N, Arise O. Green light reversal of blue light stimulated stomatal opening is found in a diversity of plant species. American Journal of Botany, 2002, 89(2): 366-368.
[2]曾日秋, 洪建基, 姚运法, 等. 黄秋葵资源的植物学特征特性与生态适应性评价. 热带作物学报, 2015, 36(3): 523-529.
[3]高玲, 刘迪发, 徐丽. 黄秋葵研究进展与前景. 热带农业科学, 2014, 34(11): 22-29.
[4]刘振威, 孙丽, 方婷婷, 等. 不同光质及组合对番茄幼苗生长及生理特性的影响. 华北农学报, 2015, 30(5): 141-145.
[5]蒲高斌, 刘世琦, 刘磊, 等. 不同光质对番茄幼苗生长和生理特性的影响. 园艺学报, 2005, 32(3): 420-425.
[6]刘明, 赵琦, 王小菁, 等. 植物的光受体及其调控机制的研究. 生物学通报, 2005, 40(5): 10-12.
[8]徐景致, 李同凯, 葛大勇, 等. 植物生长发育对光波段选择性吸收的研究进展. 河北林果研究, 2002, 17(2): 180-184.
[9]李慧敏, 陆晓民. 不同光质对大叶蚕豆芽苗菜品质的影响. 安徽农学通报, 2013, 19(10): 26, 89.
[10]崔瑾, 马志虎, 徐志刚, 等. 不同光质补光对黄瓜、辣椒和番茄幼苗生长及生理特性的影响. 园艺学报, 2009, 36(5): 663-670.
[12]陈文昊, 徐志刚, 刘晓英, 等. LED光源对不同品种生菜生长和品质的影响. 西北植物学报, 2011, 31(7): 1434-1440.
[13]李慧敏, 陆晓民. 不同光质对甘蓝型油菜幼苗的生长和生理特性的影响. 西北植物学报, 2015, 35(11): 2251-2257.
[14]郭银生, 谷艾素, 崔瑾. 光质对水稻幼苗生长及生理特性的影响. 应用生态学报, 2011, 22(6): 1485-1492.
[17]王婷, 李雯琳, 巩芳娥, 等. LED光源不同光质对不结球白菜生长及生理特性的影响. 甘肃农业大学学报, 2011, 4: 69-73.
[19]吴家森, 胡君艳, 周启忠, 等. LED灯补光对萝卜生长及光合特性的影响. 北方园艺, 2009, 10: 30-33.
[21]常涛涛, 刘晓英, 徐志刚, 等. 不同光谱能量分布对番茄幼苗生长发育的影响. 中国农业科学, 2010, 43(8): 1748-1756.
[22]马绍英, 李胜, 牛俊义, 等. LED不同光质对葡萄砧木试管苗生理生化特性的影响. 甘肃农业大学学报, 2010, 45(5): 56-62.
[27]张振贤, 王培伦, 刘世奇, 等. 蔬菜生理[M]. 北京: 中国农业科技出版社, 1993.
[28]王学奎. 植物生理生化实验原理和技术(第二版)[M]. 北京: 高等教育出版社, 2006: 130.
[29]曾斌, 王庆亚, 唐灿明. 三个转Bt基因杂交棉杂种优势的解剖学分析. 作物学报, 2008, 34: 496-505.
[33]杨其长. LED在农业与生物产业的应用与前景展望. 中国农业科技导报, 2008, 10(6): 42-47.
[34]李合生. 现代植物生理学(第3版)[M]. 北京: 高等教育出版社, 2012: 45-46.
[35]袁莉民, 仇明, 王朋, 等. C4转基因水稻秧苗叶片气孔与叶鞘维管束结构特征. 中国农业科学, 2006, 39(5): 902-909.
[41]苏天星, 杨再强, 黄海静, 等. 不同光质对温室甜椒气孔导度的影响. 干旱气象, 2010, 28(4): 443-448.
*Effects of different light qualities on the growth, photosynthetic pigments and stomatal characteristics of okra (Abelmoschusesculentus) seedlings
LI Hui-Min, LU Xiao-Min, GAO Qing-Hai, ZHAO Shi-Hao
CollegeofLifeScience,AnhuiScienceandTechnologyUniversity,Fengyang233100,China
In order to identify suitable lighting for the artificial breeding of okra (Abelmoschusesculentus), this study used pot experiments to evaluate the effects of different light qualities on the growth, pigment content and stomatal characteristics of okra seedlings. The ‘Wufu’ cultivar was used as test material and, using a single factor randomized block design, the seedlings were exposed to five types of lighting: fluorescent (CK, control), blue (B), purple (P), red (R) and blue plus red (BR). The results showed that compared to CK the seedlings’ fresh mass, dry mass and photosynthetic pigment contents increased by varying degrees under the four treatments, with the largest increases recorded for BR lighting. Stomatal frequency on the adaxial surface of leaves was greatest in seedlings grown under BR and R. Stomatal frequency on abaxial surfaces was greatest under BR. Stomatal length on the adaxial and abaxial surfaces of leaves was greatest under BR, followed by B. Stomatal width and stomatal arc length on adaxial surfaces were greatest under BR, while on abaxial surfaces they were highest under B, followed by BR. Okra seedlings grew well under BR lighting, which promoted growth, photosynthetic pigments and stomatal characteristics. BR is suitable for okra seedlings and can be used as a priority light in okra culture systems.
light quality; okra; growth; photosynthtic pigment; stomatal characteristic
10.11686/cyxb2016035
http://cyxb.lzu.edu.cn
2016-01-21;改回日期:2016-03-08
安徽省高校省级自然科学研究重点项目(KJ2014A053),安徽省现代农业产业技术体系专项(AHCYTX-13)和安徽科技学院重点学科(AKZDXK2015C05)资助。
李慧敏(1981-),女,山东金乡人,讲师,博士。E-mail: hmli0621@163.com
李慧敏,陆晓民,高青海,赵诗浩. 不同光质对黄秋葵幼苗生长、光合色素和气孔特征的影响. 草业学报, 2016, 25(6): 62-70.
LI Hui-Min, LU Xiao-Min, GAO Qing-Hai, ZHAO Shi-Hao. Effects of different light qualities on the growth, photosynthetic pigments and stomatal characteristics of okra (Abelmoschusesculentus) seedlings. Acta Prataculturae Sinica, 2016, 25(6): 62-70.
