荒漠灌木蒙古岩黄芪对干旱胁迫的生理响应
2016-09-01吕娥娥周向睿周志宇赵桂琴
吕娥娥, 周向睿, 周志宇, 赵桂琴*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
荒漠灌木蒙古岩黄芪对干旱胁迫的生理响应
吕娥娥1, 周向睿1, 周志宇2, 赵桂琴1*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.草地农业生态系统国家重点实验室,兰州大学草地农业科技学院,甘肃 兰州 730020)
采用盆栽实验,研究了不同程度干旱胁迫(重度、中度、轻度、对照,分别为15%、30%、50%、70%田间最大持水量)对荒漠灌木蒙古岩黄芪幼苗光合特性、抗氧化特性和渗透调节物质的影响。结果显示,在中度和重度干旱胁迫下,除胞间CO2浓度外,其余各光合指标均显著下降;在轻度干旱胁迫下,蒙古岩黄芪幼苗净光合速率、PSⅡ的潜在活性与对照相比上升了20.7%和5.7%。中度和重度胁迫下蒙古岩黄芪叶片的丙二醛(MDA)含量、细胞相对质膜透性、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)以及过氧化物酶(POD)活性显著高于对照,而在轻度干旱胁迫下无明显变化。叶片中游离脯氨酸含量和可溶性糖含量以及K+含量随干旱胁迫的加剧而显著增加;根、茎、叶中的Na+含量在干旱胁迫处理中均显著下降。蒙古岩黄芪在干旱胁迫下采取协同升高叶片中SOD、 CAT、POD活性,提高脯氨酸和可溶性糖含量,同时选择性吸收K+的策略来减小干旱对植株所造成的伤害。实验结果可为蒙古岩黄芪适应干旱胁迫的策略提供理论依据,为其保护利用以及干旱与半干旱区的植被恢复提供参考。
蒙古岩黄芪;干旱胁迫;光合特性;抗氧化特性;渗透调节物质
干旱已成为全球最严重的自然灾害之一[1]。目前,干旱和半干旱区已占我国国土面积的49%。而随着全球气候变化和人类活动的影响,将会有越来越多的干旱和半干旱区受到干旱胁迫的影响,严重影响这些地区的生产和生态环境。干旱胁迫不仅能直接对植物的生长状况、形态结构与生理生态过程产生显著影响,还是区域景观植被破碎化和荒漠化的直接驱动者。土壤水分匮乏影响植物的形态建成和生理生化过程,限制了植物的存活和分布[2]。研究干旱和半干旱区代表性植物对不同干旱胁迫强度的响应与适应,是深入探讨植物干旱适应能力及对策的有效手段,对这些地区的植被恢复和生态环境建设具有重要的参考价值[3]。
蒙古岩黄芪(又名踏郎、杨柴,Hedysarummongolicum),豆科岩黄芪属,主要分布在我国的内蒙古、陕西、宁夏、甘肃等省区,是一种沙生灌木、根系发达、耐沙埋,具有良好的防风固沙、保持水土作用[4]。蒙古岩黄芪耐寒、抗旱、耐高温、抗风蚀耐沙埋,能在-30~-50℃的条件下正常生长。另外,蒙古岩黄芪饲用价值很高,其枝叶营养丰富且适口性好,含有动物生长所需的多种氨基酸,其含量大多高于玉米粉,与美国脱水苜蓿粉近似或略高,被称为沙漠的“红花苜蓿”[5]。蒙古岩黄芪的再生性强、成活率高、生长迅速,是扦插造林的良好树种,扦插造林时一般以沙障形式多见[4]。其种子扁平并有皱纹,撒布在沙面上不易产生位移,这为飞播播种造林提供了良好的条件[4]。近年来,对于蒙古岩黄芪抗旱性方面的报道主要集中耗水规律、水分利用效率、干旱胁迫时黄芪甲苷的积累[6]、解剖结构的抗旱性分析[7]以及干旱胁迫下生物量的积累和生长活动方面的影响[8]。但是,关于蒙古岩黄芪幼苗的抗旱性机理的研究报道尚少。本研究拟分析不同强度的干旱胁迫对蒙古岩黄芪光合特性、渗透调节物质、抗氧化特性的影响,从而为干旱环境下蒙古岩黄芪资源的保护与利用提供理论基础,也为荒漠区植被的恢复提供科学参考。
1 材料与方法
1.1试验材料与实验设计
蒙古岩黄芪种子于2012年9月采自陕西省靖边县。在甘肃农业大学实验室挑选籽粒饱满的蒙古岩黄芪种子,用75%乙醇浸泡1 min,然后用蒸馏水冲洗3次,再用蒸馏水浸泡24 h,催芽,待用。当地农田土带回实验室盛在花盆中(直径22 cm,高21 cm)浇透水,待自然耗水至田间最大持水量的70%,将发芽2 d后的幼苗移栽到花盆中,培养8周。8周龄蒙古岩黄芪幼苗按以下水分梯度进行处理:对照(田间最大持水量的70%)、轻度干旱胁迫(田间最大持水量的50%)、中度干旱胁迫(田间最大持水量的30%)和重度干旱胁迫(田间最大持水量的15%)。人工给水后,采用自然耗水的方法,用感量为0.005 kg的电子秤,控制盆栽土壤含水量的水分梯度[9]。每个处理4个重复,每个花盆20株苗。测定各项指标的时间以植株开始出现萎蔫为标准(处理7 d后)。
1.2生理指标的测定
1.2.1光合生理参数在光强为(1000±50) μmol/(m2·s)的卤素灯下,于上午 9:00-11:30 用 LI 6400 便携式光合仪(LI2COR, USA)测定连体成熟叶片的净光合速率(Pn),气孔导度(Gs),胞间 CO2浓度(Ci)。叶绿素的测定采用丙酮比色法[10]。按以下公式计算叶绿素含量:叶绿素含量(mg/g FW)=(8.02×OD663+20.20×OD645)×V/(1000×W) 。式中,V为丙酮提取液的体积(mL);W为所取样品的鲜重(g)。
1.2.2叶绿素荧光动力学参数的测定测定仪器使用 PAM2100 叶绿素荧光仪,测定时间为上午9:00-12:30。 测定的叶片叶绿素荧光动力学参数:PSⅡ的初始荧光 (F0)、最大荧光 (Fm)、可变荧光(Fv)、最大光能转换效率(Fv/Fm)、PSⅡ潜在活性(Fv/F0) 以及光合电子传递速率(ETR),测定前叶片均暗适应20 min。
1.2.3丙二醛(MDA)含量和相对质膜透性的测定取高度一致的叶片,剪成碎片,称取0.5 g放入研钵中,采用硫代巴比妥酸法测定丙二醛[11]。参考Gibon等[12]的方法,用DDS-ⅡA型电导率仪测定电导率。根据下列公式计算组织MDA的含量:MDA(μmol/g)=[6.45(A532-A600)-0.56A450]NW-1。式中,N为上清液的总体积,W为称取植物材料的鲜重(g)。
1.2.4抗氧化酶活性的测定称取0.5 g新鲜叶片于预冷的研钵中,加10 mL pH 7.8,50 mmol/L 预冷的磷酸缓冲液,在冰浴上研磨成匀浆,匀浆在4℃下12000 r/min 离心20 min,上清液用于超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)活性的测定。用氮蓝四唑(NBT)法测定SOD活性[13];用紫外吸收法测定过氧化氢酶活性[13];用愈创木酚法测定过氧化物酶活性[13]。
1.2.5有机渗透调节物质的测定叶片的可溶性糖含量用蒽酮比色法测定[10];叶片脯氨酸含量采用酸性茚三酮染色法[14]测定。
1.2.6K+、Na+浓度的测定将烘至恒重的植物根、茎、叶干样捣碎后放入20 mL试管中,加入100 mmol/L的冰乙酸10 mL。然后密封试管,置于90℃沸水中水浴2 h,冷却,过滤,稀释适当倍数后,在火焰光度计(2655-00)上测定离子含量。
1.3数据处理方法
数据分析使用SPSS 16.0软件,绘图使用Origin 8.0。
2 结果与分析
2.1不同干旱胁迫对蒙古岩黄芪叶片光合特性的影响
叶片净光合速率(Pn)在轻度干旱胁迫下显著高于其他处理,与对照相比上升了20.7%,而中度和重度胁迫下则分别下降了30.3%和55.5%(图1A)。轻度干旱处理的叶片气孔导度(Gs)与对照无显著性差异; 而中度和
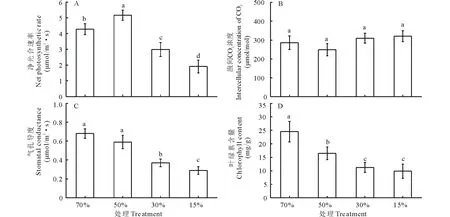
图1 不同干旱胁迫对蒙古岩黄芪叶片净光合速率(Pn)、胞间CO2浓度(Ci)、气孔导度(Gs)及叶绿素含量的影响Fig.1 Effects of different drought stress on the net photosynthetic rate, intercellular CO2 concentration, stomatal conductance and chlorophyll content in the leaves of H. mongolicum 不同字母表示不同处理间差异显著(P<0.05)。下同。Different letters indicate a significant difference among treatments (P<0.05). The same below.
重度处理显著低于对照,分别下降了45.6%和57.4% (图1C)。叶绿素含量随土壤含水量的降低呈逐渐下降趋势,与对照相比,分别下降了32.7%,54.1%和59.8%(图1D)。各处理间胞间CO2浓度(Ci)差异不显著(图1B)。
由表1可知,在轻度胁迫下,PSⅡ的潜在活性(Fv/F0)与对照相比上升了5.7%,而在中度和重度胁迫下下降了6.2%和7.6%。PSⅡ原初光能转换效率(Fv/Fm)和电子传递速率(ETR)在轻度胁迫下与对照相比差异不显著,中度和重度胁迫下分别下降了2.5%、5.4%和5.0%、6.8%。
2.2不同干旱胁迫对蒙古岩黄芪渗透调节物质的影响
随土壤水分梯度的下降,叶片中的游离脯氨酸含量呈不断上升的趋势,重度处理含量最高,与对照相比,轻度、中度和重度胁迫下脯氨酸含量分别增加了15.3%,42.6%和55.4%(图2A)。可溶性糖含量在中度和重度处理显著高于对照,分别增加了51.2%和25.2%;轻度和对照处理间差异不显著(图2B)。
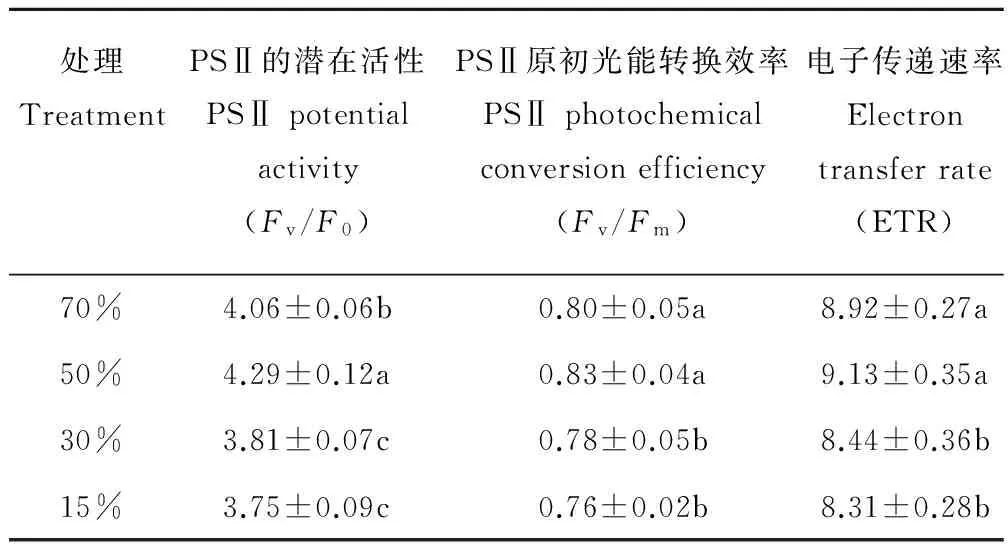
表1 不同干旱胁迫对蒙古岩黄芪叶片 叶绿素荧光动力学参数的影响Table 1 Effects of different drought stress on the chlorophyll fluorescence parameters in the leaves of H. mongolicum
不同字母表示不同处理间差异显著(P<0.05)。Different letters indicate a significant difference among treatments (P<0.05).
K+含量在根和茎中不同处理间无显著性差异;但在叶中随干旱胁迫的增加有增加的趋势,分别上升了6.3%,18.7%和24.4%(图2C)。与对照相比,Na+含量在其他处理中均显著下降,在根中分别降低了39.1%,43.9%和24.4%;在茎中分别降低了43.8%,37.8%和48.3%;在叶中分别降低了23.1%,24.4%和34.8%(图2D)。
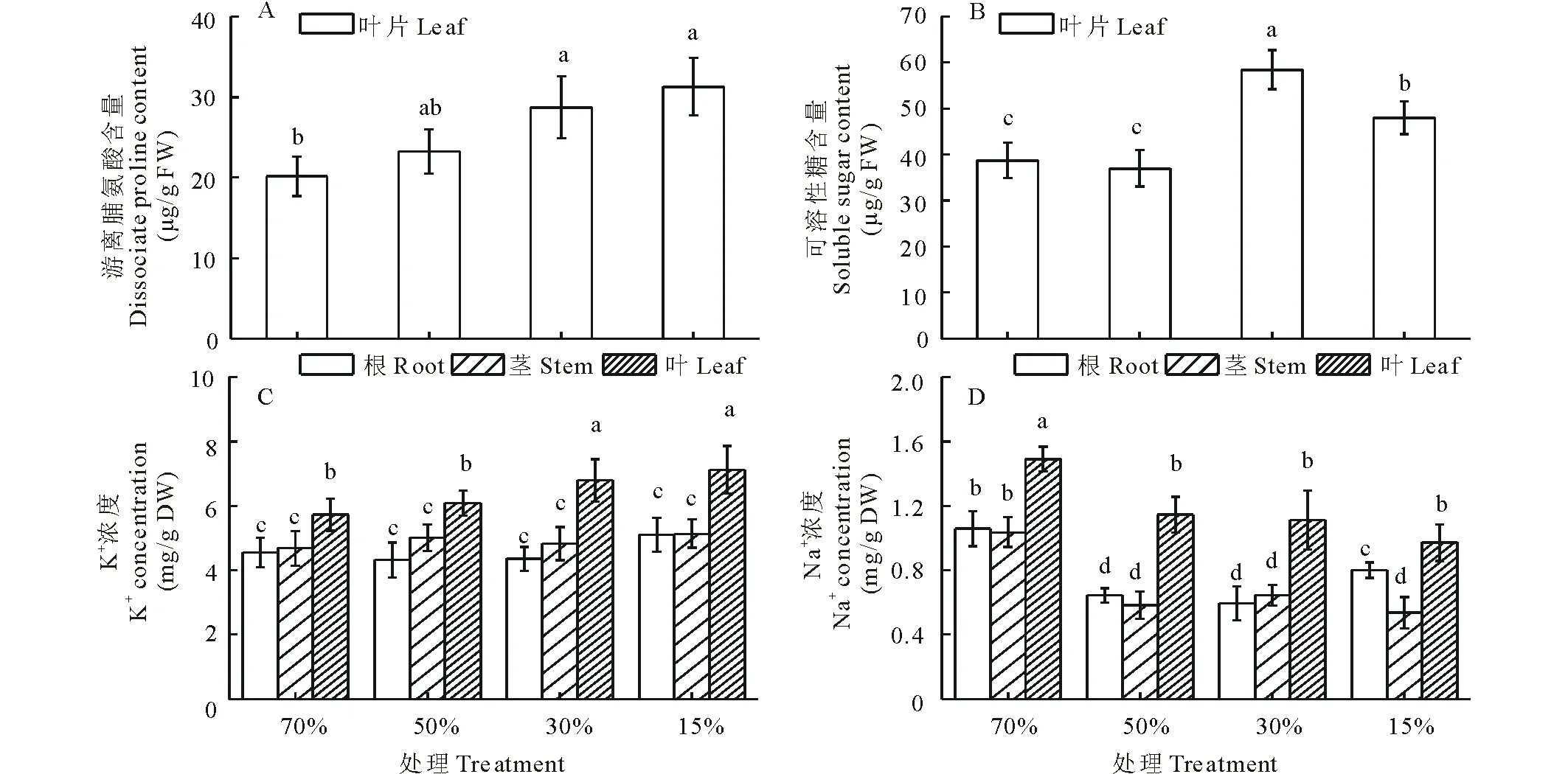
图2 不同干旱胁迫对蒙古岩黄芪叶片脯氨酸含量、叶片可溶性糖、根茎叶K+和Na+含量的影响Fig.2 Effects of different drought stress on the contents of proline and soluble sugar in the leaves and K+ and Na+ in the roots, stems and leaves of H. mongolicum
2.3不同干旱胁迫对蒙古岩黄芪抗氧化特性的影响
蒙古岩黄芪叶片MDA含量在对照和轻度处理间无显著性差异,但在中度和重度处理显著高于对照,分别增加了20.8%和61.1%(图3A)。随着干旱程度的增加,相对质膜透性呈逐渐升高的趋势。与对照相比,轻度处理与对照无显著性差异,中度与重度处理显著高于对照,分别增加了153%和174%(图3B)。SOD在轻度、中度和重度处理下均显著高于对照,分别增加了34.8%,127.9%和70.0%(图3C)。CAT活性在轻度处理与对照差异不明显;在中度和重度处理显著提高,分别增加了80.5%和39.8%(图3D)。POD活性随干旱胁迫程度的增加而逐渐增加,与对照相比分别增加了12.2%,47.9%和106.0%(图3E)。
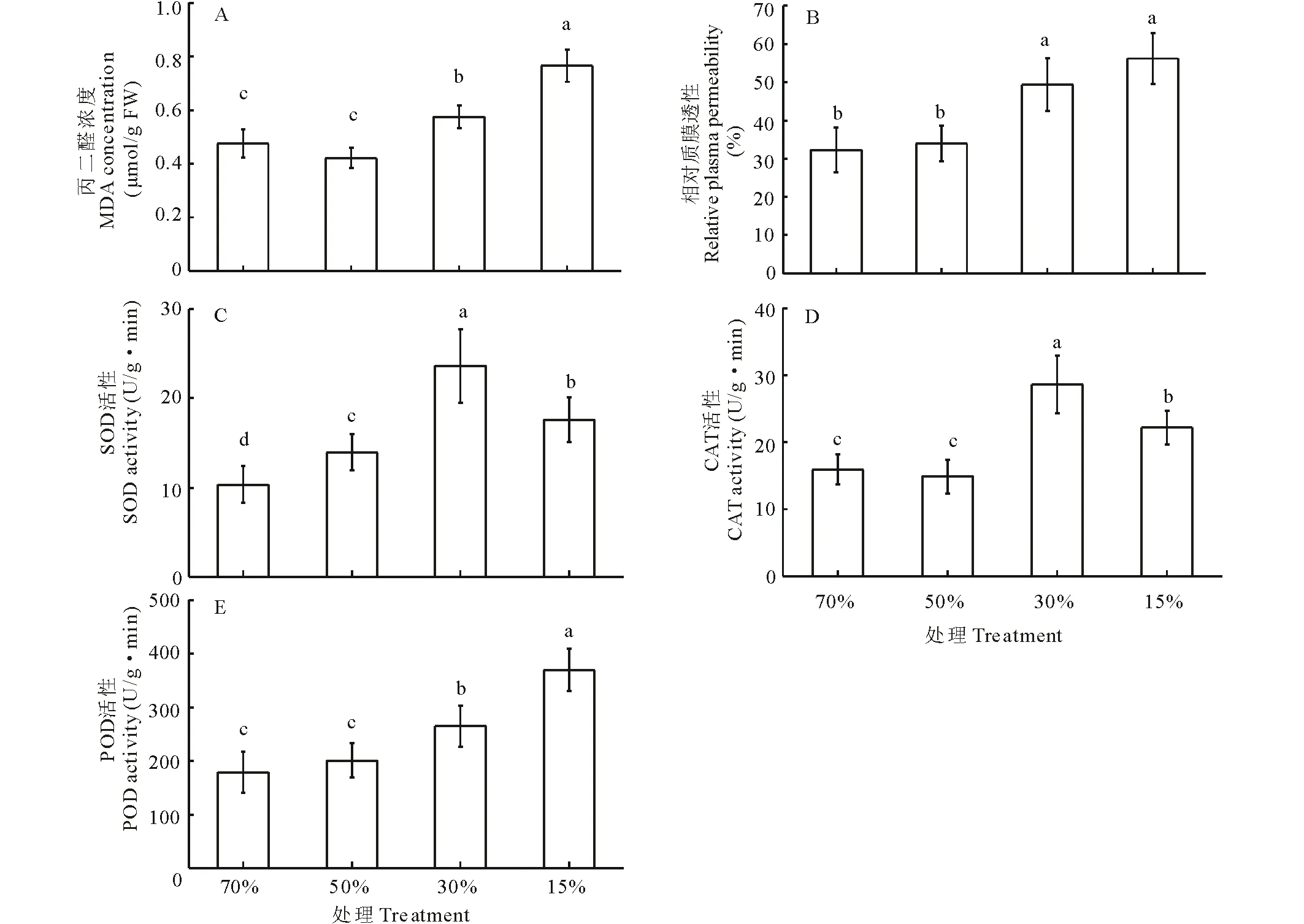
图3 不同程度干旱胁迫下蒙古岩黄芪叶片丙二醛(MDA)浓度
3 讨论
3.1干旱胁迫对蒙古岩黄芪光合特性的影响
光合作用是植物体内重要的代谢过程,它的强弱对植物生长、产量及其抗逆性都具有十分重要的影响。光合作用不仅可以用来作为判断植物生长的指标,还可以用来作为判断植物抗逆性大小的指标[15-16]。有研究表明,有两类因素能导致植物在逆境胁迫下引起它的叶片光合速率降低,即(1)有气孔的部分关闭导致的气孔限制,(2)叶肉细胞光合活性的下降导致的非气孔限制。若出现Ci、Gs同时下降,则气孔因素是主要限制因素;否则,非气孔限制是主导因素[17]。在本研究中,蒙古岩黄芪叶片净光合速率(Pn)在轻度干旱胁迫处理下上升明显,在中度和重度干旱胁迫处理下却显著下降(图1A);叶片胞间CO2浓度(Ci)在不同处理间变化不大(图1B);而叶片气孔导度(Gs)在中度和重度干旱胁迫处理显著下降(图1C)。这些结果表明,在干旱胁迫下,蒙古岩黄芪幼苗光合速率的下降是由于叶肉细胞的光合活性下降所致。
叶片光合色素含量是反映植物光合能力的一个重要指标。而叶绿体色素含量的变化又会受到环境因子的影响,环境因子的变化会引起其含量发生明显的改变,进而引起光合性能的改变。有研究表明,环境胁迫能引起叶绿素酶的含量明显的增加[18]。而叶绿素酶含量的增加势必又会引起植物叶绿素的降解,使其发生明显的下降,进而影响叶片的光合作用[18]。本研究中也得到类似结果,与对照相比,轻度、中度和重度干旱胁迫下蒙古岩黄芪叶片叶绿素含量均显著下降(图1D)。说明随干旱程度增强蒙古岩黄芪从光中吸收能量越少,转变的碳水化合物越少,当达到一定程度干旱时,蒙古岩黄芪从光中吸收能量趋于平稳,转变的碳水化合物也趋于平稳值。
光合系统Ⅱ(PSⅡ)是植物光合系统中主要的组成部分,对光合作用起着重要的作用[19]。叶绿素荧光动力学技术在测定叶片光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用,与“表观性”的气体交换指标相比,叶绿素荧光参数更具有反映“内在性”特点[20-21]。因此,叶绿素荧光动力学技术被称为测定叶片光合能力的快速、无损伤的探针[22-23]。PSⅡ的潜在活性(Fv/F0)、PSⅡ原初光能转换效率(Fv/Fm)、电子传递速率(ETR)在轻度干旱胁迫时上升,而在中度和重度干旱胁迫时均下降(表1),表明在轻度(50%田间最大持水量)干旱胁迫PSⅡ反应中心的活性最强。以上结果表明:在轻度干旱胁迫蒙古岩黄芪幼苗光合能力最强。
3.2干旱胁迫对蒙古岩黄芪渗透调节物质的影响
在逆境条件下,大多数植物在体内积累可溶性溶质如脯氨酸和可溶性糖等,它们对调节渗透势具有重要的作用[24]。这种作用主要表现为保护植物细胞在逆境胁迫下的渗透失衡[25],稳定亚细胞组织如细胞膜和蛋白质,清除抗氧化系统[26]。脯氨酸大量积累,除了作为植物细胞内渗透调节物质具有较好的水合作用、提高原生质胶体的稳定性、降低细胞的水势、扩大细胞的溶解容积的作用外,还在降低细胞酸性、解除氨毒以及作为能量库调节细胞氧化还原势等方面起重要作用[27-30]。可溶性糖也是植物体内一种有机渗透调节物质。逆境胁迫下,植物可通过积累可溶性糖等有机溶质来降低其渗透势,抵抗外界水分胁迫[31], 如在干旱和模拟干旱胁迫下,蚕豆(Viciafaba)[32]和野生大豆(Glycinesoja)[33]的可溶性糖明显累积。这些现象说明,植物体内可溶性糖累积也是对逆境条件下的应激反应,是一种适应性的表现。本试验结果表明:蒙古岩黄芪受到干旱胁迫时,叶片中脯氨酸含量随土壤水分条件发生变化,且积累量与胁迫强度相关。在轻度干旱胁迫下游离脯氨酸迅速积累,重度胁迫下累积量最大(图2A),该结果与小麦(Triticumaestivum)和豇豆(Vignaunguiculata)上所得的结果一致[34-35]。随着干旱胁迫不断加重,可溶性糖含量经历了下降-上升-下降的过程(图2B),在轻度胁迫下比对照略有下降;中度胁迫下显著上升;重度胁迫下比中度胁迫有所下降,但与对照相比还是有所积累(图2B)。说明在中度干旱胁迫下,蒙古岩黄芪叶片内可溶性糖的作用最显著。
Na+在适应干旱环境时起到渗透调节作用,尤其对于多浆旱生植物来说,其适应干旱环境的有效策略之一是积累Na+[36]。K+是植物细胞中含量最丰富的阳离子之一,能调节植物体的许多生理功能,如增强植物光合作用,增强植株体内物质合成和转运,提高能量代谢等。本实验结果显示,随着干旱胁迫加重,K+含量显著上升(图2C),Na+含量却显著下降(图2D),表明蒙古岩黄芪适应干旱环境的有效策略主要是积累K+,同时也说明K+和Na+由于原子半径相似,在进入植物体时存在竞争关系[36-38]。
3.3干旱胁迫对蒙古岩黄芪抗氧化特性的影响
对植物来说,一个最普遍的氧化破坏就是膜脂过氧化,这是确定氧化胁迫的主要指标之一[11]。有研究表明,在干旱胁迫下,若叶片中的膜脂过氧化显著增加,则能表明干旱胁迫引起了氧化胁迫[13,36,39]。植物叶片的膜脂过氧化的产物之一是MDA,其含量的高低可表示细胞膜脂过氧化程度和植物对逆境条件反应的强弱。同样,对植物来说,细胞膜是细胞与环境之间交流的屏障,各种不良环境对植株的影响,往往首先作用于细胞膜,改变它的透性,细胞的相对质膜透性大小能够反映植株受伤害的程度[40]。本研究中蒙古岩黄芪叶片的MDA含量在中度和重度干旱胁迫下显著增加,且在重度干旱胁迫下最高(图3A),说明随着干旱胁迫的加剧,蒙古岩黄芪受到的伤害也越来越严重。细胞的相对质膜透性在中度和重度胁迫下显著高于对照(图3B),说明在中度和重度干旱胁迫下,蒙古岩黄芪受到的伤害越大,重度胁迫下植株出现明显的萎蔫,叶片脱落。
SOD、CAT和POD对植物体内的抗氧化性至关重要,是植物体内清除活性氧的3种重要保护酶。植物在遭受干旱胁迫等特殊环境条件时,清除活性氧的酶活性均会增加[41]。SOD是防御ROS对细胞损害的第一道防线,歧化超氧阴离子自由基为O2和H2O2。本研究发现蒙古岩黄芪叶片SOD活性随水分胁迫的增强先升高后降低(图3C),这与刺槐(Robiniapseudoacacia)[42]和花棒(Hedysarumscoparium)[43]上的研究一致。但也有研究表明干旱胁迫加剧SOD活性增加[44-45]。本实验中,叶片SOD活性在中度干旱胁迫下最高,说明蒙古岩黄芪叶片中SOD有效清除超氧阴离子自由基是一个非常重要的保护机制。然而超氧阴离子自由基清除的同时伴随H2O2过量产生。CAT能够清除H2O2使其转化成H2O和O2,POD也可以用一些酚类化合物(例如愈创木酚)作为主要的还原剂[46]氧化进而清除H2O2。有研究认为,植物中CAT和POD活性在水分胁迫下有所增加[47];也有研究认为,CAT和POD的活性随干旱胁迫增强有先增加后降低的趋势[48]。本实验结果显示,蒙古岩黄芪叶片中CAT和POD活性是随着干旱胁迫加剧而增加的,POD在重度胁迫下活性最高,CAT在中度胁迫下活性最高,均显著高于对照(图3D,E)。表明在中度干旱胁迫下蒙古岩黄芪叶片CAT在清除H2O2时起到主要作用,而在重度干旱胁迫下其清除H2O2的能力相比中度胁迫有所降低。在重度胁迫下POD的活性很高,表明其在清除H2O2时起到主要作用。
4 结论
蒙古岩黄芪的光合作用在中度和重度干旱胁迫下明显受到抑制,其原因是叶肉细胞光合活性下降,而不是由气孔部分关闭所造成。蒙古岩黄芪能协同升高叶片中的SOD、CAT、POD活性,提高脯氨酸、可溶性糖含量,同时选择性吸收K+,来减小干旱对植株所造成的伤害。
References:
[1]Peng K S, Xu X B, Hu J F,etal. The harm of drought to the west region and its prevention strategy. Journal of Shijiazhuang University of Economics, 2002, 25(3): 257-262.
[2]Huang Z C. Drought resistance and the relationship of water in desert plants. Journal of Gansu Forestry Science and Technology, 1922,14(2): 1-7.
[3]Li F L, Bao W K, Wu N. Morphological and physiological responses of current sophora davidii seedlings to drought stress. Acta Ecologica Snica, 2009, 29(10): 5406-5416.
[4]Guo X Z, Sun W, Ma Z J.HedysarummongolicumTurez Sandy afforestation art. Inner Mongolia Forestry Investigation and Design, 2005, 28(1): 23-24.
[5]Huang H Y. Desert alfalfa in red flower-HedysarummongolicumTurez. Feed Research, 1984, 3: 55.
[6]Han K. Physiological Characteristucs and Astragaloside iv of Three Provenances of Astragalus under Water Stress[D]. Yangling: Northwest A&F University, 2010.
[7]Han G, Li S X, Xu P,etal. Analysis of drought resistance on anatomical structure of leave of six species of shrubs. Journal of Northwest Forestry University, 2006, 04: 43-46.
[8]Li Y J. Effect of Drought Stress on Growth and Water Physiology of Six Xeric Shubs[D]. Yangling: Northwest A&F University, 2008.
[9]Pei B, Zhang G G, Zhang S Y,etal. Effects of soil drought stress on photosynthetic characteristics and antioxidant enzyme activities inHippophaerhamnoidesLinn.seedings. Acta Ecologica Sinica, 2013, 33(5): 1386-1396.
[10]Shen W Q. Extraction of mixed solutiou for determination of chlorophyll content in rice leaf blade. Plant Physiology Communications, 1988, 3: 62-64.
[11]Peever T L, Higgins V J. Electrolyte leakage, lipoxygenase, and lipid peroxidation induced in tomato leaf tissue by specific and non specific elicitors fromCladosporiumfluvum. Plant Physiology, 1989, 90: 867-875.
[12]Gibon Y M, Bessieres A, Larher F. Is glycine betaine a non-compatible solute in higher plants that do not accumulate it. Plant Cell and Environment, 1997, 20(3): 329-340.
[13]Zou Q. Plant Physiology and Biochemistry Experimental Guidance[M]. Beijing:China Agriculture Press, 2000.
[14]Wu Y M, Wang P, Liu H S. Effects of PEG stress on phytomass, active oxygen metabolism and proline content ofLeymuschinensisseedlings under split-root condition. Journal of Gansu Agricultural University, 2008, 43(2): 114-119.
[15]Zhao B S, Yi Y J, Liu J Y. Exogenous betaine improves the growth and photosynthesis of wheat seedlings under drought/salt stress. Chinese Bulletin of Botany, 2001, 18(3): 378-380.
[16]Yao J, Liu X B, Cui X,etal. Effects of NaCl stress on substances linked to osmotic adjustment and on photosynthetic physiology ofMelilotoidesruthenicain the seeding stage. Acta Prataculturae Sinica, 2015, 24(5): 91-99.
[17]Farquhar G D, Sharkey T D. Stomatal conductance and photosynthesis. Annual Review of Plant Physiology, 1982, 33: 317-345.
[18]Cheeseman J M. Mechanism of salinity tolerance in plants. Plant Physiology, 1988, 87: 547-550.
[19]Powle S B. Photo inhibition of photosynthesis induced by visible light. Annual Review of Plant Physiology, 1984, 35: 15-44.
[20]White A J, Critchley C. Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus. Pho-tosynth Research, 1999, 59: 63-72.
[21]Massacci A, Nabiv S M, Pietrosanti L,etal. Response of photosynthesis apparatus of cotton to the onset of drought stress under field conditions by gas change analysis and chlorophyll fluorescence imaging. Plant Physiology Biochemistry, 2008, 46: 189-195.
[22]Genty B, Briantais J M, Baker N R. The relationship between the quantum yield of photosynthetic electron transport and quenching of chlorophyll fluorescence. Biochemica et Biophysica Acta, 1989, 990: 87-92.
[23]Zhang S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance. Chinese Bulletin of Botany, 1999, 16(4): 444-448.
[24]Heuer B. Osmoregulatory Role of Proline in Water and Salt Stressed Plants[M]. New York: Handbook of Plant and Crop Stress, 1994: 363-381.
[25]Heuer B. Influence of exogenous application of proline and glycinebetaine on growth of salt-stress tomato plants.Plant Science, 2003, 165(4): 693-699.
[26]Ashraf M, Foolad M A. Improving plant abiotic-stress resistance by exogenous application of osmoprotectants glycine betaine and proline. Environmental Experiment Botany, 2007, 59(2): 206-216.
[27]Li L, Zhong Z C. The physiological and biochemical responses and adaptive capacity to water stress inOrgchorphragmusviolaceus. Journal of Southwest China Normal University (Natural Science), 2000, 01: 33-37.
[28]Li J W, Wang D, Si H J. Physiological response of test-tube plant lets of potato under water stress. Journal of Gansu Agricultural University, 2005, 40(3): 319-323.
[29]Cui X M. Wang X F, Xu H,etal. Response of physiological-biochemical characters of sweet pepper seedlings during different degree water stress to rewatering. Chinese Agricultural Science Bulletin, 2005, 21(5): 225-229.
[30]Miao X M, Zhang L J, Chen X L,etal. The relationship of fatty acid composition and resistance ofArtemisiasphaerocephalaseedings under water stress. Acta Prataculturae Sinica, 2015, 24(2): 55-61.
[31]Chen M, Qiu N W, Ding S H,etal. Effect of NaCl treatment on growth, solutes accumulation of cellular level and whole level ofSuaedasalsaL. Shan Dong Science, 2001, 02: 21-27.
[32]Bao S W, Tan F, Liao Z H. Effects of soil drought on the osmoregulating ability of viciafaba leaves. Journal of Southwest Agricultural University, 2001, 04: 353-355, 359.
[33]Zhang M Y, Qian J, Zhen S Z. Studies on free proline and soluble sugar of Wild Soybeans (Glycinesoja) under osmotic sress. Journal of Fudan University (Natural Science), 2001, 05: 558-561.
[34]Kang L P, Wang Y M, Zhang L. Effect of water Stress on the water state, stoma and physiological-biochemistry in the leaves ofVignasinensisEndl. Acta Agriculae Boreali-Sinica, 2005, (Albums): 21-23.
[35]Zhang D Z, Wang P H, Zhao H X. Determination of the content of free proline in wheat leaves. Plant Physlology Communications, 1990, (4): 62-65.
[36]Wang S, Wan C, Wang Y. The characteristics of Na+, K+and free proline distribution in several drought resistant plants of the Alax Desert. China Journal of Arid Environments, 2004, 56: 525-539.
[37]Blumwald E, Aharon G, Apse M. Sodium transport in plant cells. Biochimicaet Biophysica Acta, 2000, 1465: 140-151.
[38]Sharma P, Dubey R S. Drought in duced oxidative stress and enhances the activities of antioxidan ten zymes in growing rice seedlings. Plant Growth Regular, 2005, 46: 209-221.
[39]Zhu H S, Wang B P, Dong X Y,etal. Effects of drought stress and rewatering on the growth and physiological characteristics of Shaixi wildPoapratensisseedings. Acta Prataculturae Sinica, 2015, 24(7): 79-88.
[40]Li X Y, Song Z W, Dong Z X. Plantphysiological response to salt stress. Journal of Northwest Normal University (Natural Science), 2004, 40(3): 106-111.
[41]Sairam R K, Srivastava G C. Water stress tolerance of wheat (TriticumaestivumL.): variations in hydrogen peroxide accumulation and antioxidant activity in tolerant and susceptible genotypes. Journal of Agronomy Crop Science, 2001, 186: 63-70.
[42]Selote D S, Khanna C R. Drought acclimation confers oxidative stress tolerance by inducing coordinated antioxidant defense at cellular and subcellular level in leaves of wheat seedlings. Physiologia Plantarum, 2006, 127: 494-506.
[43]Sofo A, Dichio B, Xiloyannis C,etal. Antioxidant defences in olive trees during drought stress: changes in activity of someant ioxidant enzymes. Functional Plant Biology, 2005, 32: 45-53.
[44]Gao J, Gong C, Liu X. Influence of different water stress to glutathione ant ioxidant defense system inRobiniapseudoacacia. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(7): 1409-1414.
[45]Han G, Dong Q , Zhao Z. Response of antioxidati on protection system ofHedysarumscopariumto drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2008, 28(5): 1007-1013 .
[46]Srivalli B, Sharma G, Khanna C R. Ant ioxidative defense system in anuplan drice cultivar subjected to in creasing intensity of water stress followed by recovery. Physiologia Plantarum, 2003, 119: 503-512.
[47]Shao H, Chu L,Wu G,etal. Changes of some ant ioxidative physiological indices under soil water deficits among 10 wheat (TriticumaestivumL.) gen otypes at tillering stage. Colloids and Surfaces B: Biointerfaces, 2007, 54: 143-149.
[48]Bai J, Gong C M, Wang G,etal. Antioxidative characteristics ofReaumuriasoongoricaunder drought stress. Acta Botanica Boreali-Occidentalia Sinica, 2010, 30(12): 2444-2450.
[1]彭珂珊, 徐宣斌, 胡晋辉, 等. 干旱是西部地区生态系统受损的关键因素. 石家庄经济学院学报, 2002, 25(3): 257-262.
[3]李芳兰, 包维楷, 吴宁. 白刺花幼苗对不同强度干旱胁迫的形态与生理响应. 生态学报, 2009, 29(10): 5406-5416.
[4]郭秀珍, 孙巍, 马占军. 蒙古岩黄芪沙地造林艺术. 内蒙古林业调查设计, 2005, 28(1): 23-24.
[5]黄鹤羽. 沙漠里的红花苜蓿-杨柴. 饲料研究, 1984, 3: 55.
[6]韩凯. 水分胁迫对3种黄芪抗旱特性及黄芪甲苷含量的影响[D]. 杨凌: 西北农林科技大学, 2010.
[7]韩刚, 李少雄, 徐鹏, 等. 6种灌木叶片解剖结构的抗旱性分析. 西北林学院学报, 2006, 04: 43-46.
[8]李彦瑾. 干旱胁迫对六种旱生灌木生长及水分生理特征的影响[D]. 杨凌: 西北农林科技大学, 2008.
[9]裴斌, 张光灿, 张淑勇, 等. 土壤干旱胁迫对沙棘叶片光合作用和抗氧化酶活性的影响. 生态学报, 2013, 05: 1386-1396.
[11]沈伟其. 测定水稻叶片叶绿素含量的混合液提取法. 植物生理学通讯, 1988, 3: 62-64.
[13]邹琦主编. 植物生理生化实验指导[M]. 北京: 中国农业出版社, 2000.
[14]吴银明, 王平, 刘洪升, 等. 分根PEG胁迫对羊草幼苗植物量, 活性氧代谢及脯氨酸含量的影响. 甘肃农业大学学报, 2008, 43(2): 114-119.
[15]赵博生, 衣艳君, 刘家尧. 外源甜菜碱对干旱盐胁迫下的小麦幼苗生长和光合功能的改善. 植物学通报, 2001, 18(3): 378-380.
[16]姚佳, 刘信宝, 崔鑫, 等. 不同NaCl胁迫对苗期扁蓿豆渗透调节物质及光合生理的影响. 草业学报, 2015, 24(5): 91-99.
[23]张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16(4): 444-448.
[27]李莉, 钟章成. 诸葛菜对水分胁迫的生理生化反应和调节适应能力. 西南师范大学学报(自然科学版), 2000, 01: 33-37.
[28]李建武, 王蒂, 司怀军. 水分胁迫下马铃薯试管苗的生理响应. 甘肃农业大学学报, 2005, 40(3): 319-323.
[29]崔秀敏, 王秀峰, 许衡. 甜椒对不同程度水分胁迫——复水的生理生化响应. 中国农学通报, 2005, 21(5): 225-229.
[30]缪秀梅, 张丽静, 陈晓龙, 等. 水分胁迫下白沙蒿幼苗抗性与其膜脂构成关系研究. 草业学报, 2015, 24(2): 55-61.
[31]陈敏, 邱念伟, 丁顺华, 等. NaCl处理对盐地碱蓬整株及细胞水平的生长、溶质积累的影响. 山东科学, 2001, 2: 21-27.
[32]鲍思伟, 谈锋, 廖志华. 土壤干旱对蚕豆叶片渗透调节能力的影响. 西南农业大学学报, 2001, 4: 353-355, 359.
[33]张美云, 钱吉, 郑师章. 渗透胁迫下野生大豆游离脯氨酸和可溶性糖的变化. 复旦学报(自然科学版), 2001, 5: 558-561.
[34]康利平, 王羽梅, 张禄. 水分胁迫对豇豆幼苗水分状况、气孔变化及生理生化指标的影响. 华北农学报, 2005, (专辑): 21-23.
[35]张殿忠, 汪沛洪, 赵会贤. 测定小麦叶片游离脯氨酸含量的方法. 植物生理学通讯, 1990, (4): 62-65.
[39]朱慧森, 王保平, 董晓燕, 等. 干旱及复水对山西野生草地早熟禾幼苗生长与生理特性的影响. 草业学报, 2015, 24(7): 79-88.
[48]白娟, 龚春梅, 王刚, 等. 干旱胁迫下荒漠植物红砂叶片抗氧化特性. 西北植物学报, 2010, 30(12): 2444-2450.
*Physiological responses of the desert shrubHedysarummongolicumto drought stress
LV E-E1, ZHOU Xiang-Rui1, ZHOU Zhi-Yu2, ZHAO Gui-Qin1*
1.CollegeofPrataculturalScience,GansuAgriculturalUniversity,KeyLaboratoryofGrasslandEcologySystem,MinistryofEducation,Sino-U.S.CentersforGrazinglandEcosystemSustainability,Lanzhou730070,China; 2.StateKeyLaboratoryofGrasslandAgro-ecosystems,CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China
A pot experiment was conducted to determine the effects of drought stress on the photosynthetic characteristics, antioxidant properties and osmotic adjustment substances of the desert shrubHedysarummongolicum. The experiment used four different water treatments of 70%, 50%, 30% and 15% field moisture capacity, representing serious (SED), moderate (MOD) and mild (MID) stresses and the control (CK), respectively. The photosynthetic characteristics (except intercellular CO2concentration) under MOD and SED were significantly lower than those under CK. Compared to CK, the net photosynthetic rate and PSⅡ potential activity under MID increased 20.7% and 5.7% respectively. The malondialdehyde content, relative plasma permeability, and the activities of superoxide dismutase, catalase and peroxidase were significantly higher under the MOD and SED treatments than CK, while there was no significant difference between MID and CK. The contents of proline, soluble sugar and K+in leaves showed significant increase trends with the degree of drought stress. Compared to CK, Na+contents in leaves, roots and stems showed significant decline trends. These results show that in response to stressH.mongolocumincreases the activities of SOD (superoxide dismutase), CAT (catalase) and POD (peroxidase), increases relative plasma permeability in leaves, improves the contents of proline and soluble sugar, and enhances the selective absorption of K+, thereby reducing the damage of drought to the plant. Our findings provide the theoretical basis for understandingH.mongolocumadaptation to drought stress. The study also provides references for the protection and utilization of this plant and for vegetation restoration in arid and semiarid areas.
Hedysarummongolocum; drought stress; photosynthetic characteristics; antioxidant properties; osmotic adjustment substances
10.11686/cyxb2015274
http://cyxb.lzu.edu.cn
2015-05-28;改回日期:2015-09-08基金项目:国家自然基金资助项目(31201849)和农业部牧草种质资源保护项目(2013014)资助。
吕娥娥(1988-),女,甘肃静宁人,硕士。E-mail: 1402595393@qq.com
Corresponding author. E-mail: zhaogq@gsau.edu.cn
吕娥娥, 周向睿, 周志宇, 赵桂琴. 荒漠灌木蒙古岩黄芪对干旱胁迫的生理响应. 草业学报, 2016, 25(6): 42-50.
LV E-E, ZHOU Xiang-Rui, ZHOU Zhi-Yu, ZHAO Gui-Qin. Physiological responses of the desert shrubHedysarummongolicumto drought stress. Acta Prataculturae Sinica, 2016, 25(6): 42-50.
