微波辅助提取榛子叶多糖提取工艺研究
2016-09-01申希峰张莲姬
申希峰,林 松,张莲姬
(吉林省延边大学理学院化学系,吉林 延吉 133002 )
微波辅助提取榛子叶多糖提取工艺研究
申希峰,林松,张莲姬
(吉林省延边大学理学院化学系,吉林延吉133002 )
以经石油醚和95%乙醇处理过的榛子叶粉为原料,主要研究微波辅助提取榛子叶多糖的工艺条件。分别考察了浸提温度、浸提时间、料液比、微波处理时间对榛子叶多糖得率的影响,并采用L9(34)正交试验优化提取工艺,最后得出的最佳提取工艺条为:浸提温度为60 ℃,浸提时间为2 h,料液比为1:25(w:V),微波处理时间为3 min,此条件下榛子叶多糖得率为2.67%。
榛子叶;多糖;微波辅助
榛子叶为桦木科植物榛(Corylus heterophylla Fish.ex Bess)的叶,榛为每年生灌木,分布在我国东北、华北、西北及西南等地,资源非常丰富。关于榛子叶的研究较晚,近几年国内外逐渐开始研究榛子叶的化学成分及生物活性。金哲雄等首次从榛子叶中分离得到8种鞣质化合物[1],在此基础上王立等进一步研究榛子叶中的鞣质成分,得到一个新的鞣花二聚体成分榛叶素B[2]。刘畅等的研究结果表明榛子叶鞣质成分具有体外抗肿瘤作用[3]。除了鞣质类外榛子叶中还含有丰富的黄酮类物质[4-6]。
多糖是很重要的生理活性物质,从动物、植物、微生物中提取得到的多糖具有免疫调节[7]、抗肿瘤[8]、降血糖[9]、降血脂[10]、抗辐射[11]、抗氧化[12]等多种生理活性。但目前尚未见关于榛子叶多糖的研究报道。
本文采用水提醇析的方法从榛子叶粉末中提取多糖。在讨论提取时间、提取温度、料水比、微波时间等单因素对榛子叶多糖提取率影响的基础上,通过L9(34)正交试验,确定微波辅助提取榛子叶多糖的最佳提取工艺。本研究为榛子叶的进一步的研究与开发应用提供了一定的依据。
1 材料与方法
1.1实验材料与试剂
榛子叶,采集于吉林省延吉市帽儿山。实验所用试剂均为分析纯。
1.2仪器
HH-2数显恒温水浴锅,江苏省金坛市科析仪器有限公司;FA/JA型电子天平,上海精密科学仪器有限公司; V15-723紫外分光光度计,上海精密科学仪器有限公司;80-2型台式离心机,江苏省金坛市科析仪器有限公司。
2 实验方法
2.1榛子叶多糖的提取
取依次用石油醚和95%乙醇抽提至提取液颜色近无色的榛子叶粉,加入蒸馏水,然后在280 W微波功率下处理一定时间,冷却,置于恒温水浴锅中,在一定温度下提取数小时后,离心20 min(3500 r/min)。所得滤液中加入3倍体积的95%乙醇,搅匀,在4 ℃冰箱中静置过夜,离心20 min(3500 r/min),所得沉淀依次用95%乙醇、丙酮、乙醚洗涤,置于50 ℃干燥箱中干燥,获得榛子叶粗多糖。
2.2榛子叶粗多糖的精制
将榛子叶粗多糖溶解于蒸馏水,加10倍体积的10%三氯乙酸, 放入冰箱静置24 h,离心(4500 r/min, 10 min), 弃沉淀。所得粗多糖液浓缩至一定体积后,加3倍体积的95%乙醇沉析, 离心(4500 r/min, 10 min),取沉淀加蒸馏水溶解,加入粗多糖溶液质量3%的活性炭,在80 ℃搅拌脱色30 min,趁热抽滤,浓缩滤液、加3倍体积的95%乙醇沉析,离心(4500 r/min, 10 min),沉淀依次用95%乙醇、丙酮、乙醚洗涤, 置于60 ℃干燥箱中干燥,获得白色无定型粉末状榛子叶多糖。
2.3榛子叶多糖含量的测定及得率的计算
多糖含量测定采用硫酸-苯酚法。
2.3.1标准曲线的绘制
配制浓度为0.020 mg·mL-1、0.040 mg·mL-1、0.060 mg·mL-1、0.080 mg·mL-1、0.100 mg·mL-1的葡萄糖标准溶液,分别取1.0 mL上述溶液,置于锥形瓶中,加入1.0 mL 5%苯酚溶液,摇匀,迅速加入浓硫酸5.0 mL,立即摇匀,室温放置30 min,在最大吸收波长484 nm处测定吸光度,得标准曲线回归方程C=0.095×A+0.007,R2=0.9966。结果表明,葡萄糖标准溶液在0.020~0.100 mg·mL-1范围内与吸光度值呈良好的线性关系。
2.3.2榛子叶多糖含量的计算
多糖得率=C×D×V×f/W×100%
式中:C——样品溶液中葡萄糖浓度,mg·mL-1
D——测定时的稀释倍数
f——换算因子
V——多糖样品溶液总体积,mL
W——样品的质量,mg
2.4单因素试验
主要研究不同的浸提温度、浸提时间、料液比、微波时间对多糖得率的影响。
浸提温度的选择: 设定料液比为1:30 (w:V),浸提时间为3 h, 比较浸提温度为40、50、 60、70、80、90 ℃时的榛子叶多糖得率。
浸提时间的选择: 设料液比为1:30(w:V),浸提温度为60 ℃, 比较浸提时间为0.5、1、2、3、4 h时的榛子叶多糖得率。
料液比的选择: 设定浸提温度为60 ℃,浸提时间为2 h,比较料液比为1:15、1:20、1:25、1:30、1:35 (w:V)时的榛子叶多糖得率。
微波处理时间的选择:设定浸提温度为60 ℃,浸提时间为2 h,料液比为1:30,微波功率为280 W,比较微波处理时间为1 min,2 min,4 min,6 min,8 min时的榛子叶多糖得率。
2.5正交试验
在上述单因素试验的基础上,选取浸提温度、浸提时间、料液比、微波时间进行四因素、三水平的正交试验, 得出最佳提取条件。试验按L9(34)正交表设计。
3 结果与讨论
3.1单因素试验
3.1.1浸提温度对榛子叶多糖得率的影响
由图1可知,浸提温度40~60 ℃范围内,多糖得率随着温度的升高而增加,当温度超过60 ℃后,多糖得率逐渐减小。温度过低,扩散系数小,提取速度慢[13],温度升高,活化分子数增加,有利于多糖的提取,而过高温度可能导致部分多糖降解,会对多糖的结构与活性有一定影响[14]。所以选取60 ℃作为浸提温度。

图1 浸提温度对多糖得率的影响
3.1.2浸提时间对榛子叶多糖得率的影响

图2 浸提时间对多糖得率的影响
由图2可知,榛子叶多糖的得率,在0.5~2 h范围内随浸提时间的增加而显著增加,在2~4 h范围内也逐渐增加,但2 h 后增加不明显,考虑到能耗问题,选取浸提时间为2 h。
3.1.3料液比对榛子叶多糖得率的影响

图3 料液比对多糖得率的影响
增加料液比,有利于提高扩散速度,由图3可知,在1:15~1:20范围内,随着料液比的增加,榛子叶多糖的得率明显增加,之后缓慢增加, 料液比达1:30之后,增加杂质的溶出量,不利于提取多糖,因此得率反而下降。考虑到增加料液比会增加后续的浓缩成本,所以选取料水比为1:20。
3.1.4微波处理时间对榛子叶多糖得率的影响

图4 微波时间对得率的影响
由图4可知,微波处理时间在1~3 min范围内,随着料液比的增加,榛子叶多糖得率增加,但3 min以后,其得率反而下降,这说明微波处理时间为3 min时,细胞破壁已经很充分,多糖得率也达最大值,再增加时间,可能溶出更多杂质,影响多糖得率。
3.2多因素综合影响实验
在单因素实验的基础上,采用L9(34)正交设计试验,见表1。实验数据按正交法进行处理,选择最优提取条件,结果见表2。

表1 正交试验因素水平表

表2 正交试验结果与分析
从正交试验结果可以看出, 3个因素对多糖提取影响大小为: A>D>B>C。即浸提温度对多糖得率的影响最大, 其次是微波处理时间, 料液比的影响最小。根据极差分析得到的结果来看最佳工艺条件为: A3B2C2D3。即浸提温度为60 ℃,料液比为1:25,浸提时间为2 h,微波处理时间为3 min。但从表2中可以看出,得率最高的组是A3B1C2D3。因此对这两个组合进行对比试验, 其结果见表3。
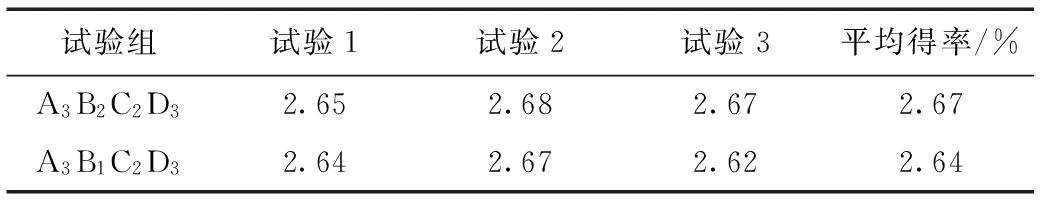
表3 试验组的多糖得率结果
由表3可知,A3B2C2D3组合优于A3B1C2D3, 所以最佳浸提条件为A3B2C2D3, 即浸提温度为60 ℃,料液比为1:25,浸提时间为2 h,微波处理时间为3 min。
4 结 论
本文采用微波辅助提取榛子叶多糖,以多糖得率为指标,通过单因素试验和正交试验,确定了最佳提取工艺条件为:浸提温度为60 ℃,料水质量比1:25,提取时间为2 h,微波处理时间为3 min。在最佳工艺条件下,榛子叶多糖的得率为2.67%。
[1]金哲雄,张秀娟.榛子叶鞣质类化学成分研究[J].中草药,2001,32(3):193-195.
[2]王立,金哲雄,任君刚.榛子叶化学成分研究(Ⅱ)[J].中草药,2004,35(6):606-608.
[3]刘畅,金哲雄,孙希. 榛子叶鞣质成分的体外抗肿瘤作用[J].黑龙江医药,2015,28(2):242-244.
[4]薛健飞,王春宇,李平亚. 榛子叶化学成分及其生物活性的研究[J].特产研究,2009,1:37-39.
[5]Amaral JS,Ferreres F,Andrade PB,et al. Phenolic profile of hazelnut(Corylus avellana L.) leaves cultivars grown in Portugal [J].Nat Prod Res,2005,19(2): 157-163.
[6]赵明慧,姜子涛,李荣. 榛子叶中黄酮类化合物微波提取及纯化的研究[J].食品工业科技,2013,34(19):196-200.
[7]宫春宇,胡清秀,韩永超,等. 黄伞菌丝体多糖提取工艺及免疫调节作用研究[J].食品工业,2012,33(8):48-51
[8]孙新华,郑国强,滕安国,等. 冷溶性琼脂多糖抗肿瘤作用的研究[J].食品科技,2012,37(6):220-223.
[9]王士苗,康文艺,周俊国,等. 2个品种南瓜有机溶剂提取物和多糖成分降血糖作用研究[J].食品科技,2015,40(4):263-267.
[10]韩春然,徐丽萍. 黑木耳多糖的提取、纯化及降血脂作用的研究[J].2007,7(1):54-58.
[11]臧聚玲, 张京良, 黄菊艳,等. 成团泛菌胞外多糖吸湿保湿和抗辐射活性[J].中国食品学报,2013,39(10):11-15.
[12]彭峰.绿色化学的发展与广州化工的对策[J]. 广州化工,2001,29(01):3-4.
[13]姜艳,许海丹.超声波辅助提取牛膝多糖的工艺研究[J].广州化工,2015,43(13):109-110.
[14]颜军,郭晓强,邬晓勇,等.银耳多糖的提取及其消除自由基作用[J].成都大学学报(自然科学版),2006,25(1):35-38.
Study on the Technology of Microwave-assisted Extraction of Hazelnut Leaf Polysaccharide
SHEN Xi-feng, LIN Song, ZHANG Lian-ji
(Department of Chemistry, College of Science, Yanbian University, Jilin Yanji 133000, China)
With petroleum ether and 95% ethanol treated hazelnut leaf powder as raw material, microwave-assisted extraction of hazelnut leaf polysaccharide was studied. The impact of leaching temperature, leaching time, the solid-liquid ratio and microwave processing time on polysaccharide yield of hazelnut leaf were investigated. As the result, the optimum conditions obtained by L9(34) orthogonal experiment were as follows: leaching temperature was 60 ℃, leaching time was 2 h, solid-liquid ratio was 1:25 (w:V), microwave processing time was 3 min. Under the above conditions, the polysaccharide yield of hazelnut leaf was 2.67%.
hazelnut leaf; polysaccharide; microwave assisted
申希峰(1995-),男,吉林省延边大学理学院化学系本科在读生。
张莲姬,女,副教授,主要研究天然物质的提取和活性。
TS201.4
A
1001-9677(2016)01-0086-03
