正交设计优化尼莫地平脂质体的制备工艺*
2016-09-01王婷玉吴云明杨宜华
王婷玉, 厉 瑶, 张 鑫,吴云明,2, 杨宜华,2
(1 徐州医学院药学院,江苏 徐州 221004;2 江苏省新药研究与临床药学重点实验室,江苏 徐州 221004)
正交设计优化尼莫地平脂质体的制备工艺*
王婷玉1, 厉瑶1, 张鑫1,吴云明1,2, 杨宜华1,2
(1 徐州医学院药学院,江苏徐州221004;2 江苏省新药研究与临床药学重点实验室,江苏徐州221004)
优化了尼莫地平脂质体的制备工艺。利用乙醇注入法制备尼莫地平脂质体,以包封率为评价指标,采用正交试验优化制备工艺,并考察脂质体形态、粒径、Zeta 电位和包封率。结果表明:优化工艺条件为药物-磷脂的质量比1:20,胆固醇-磷脂的质量比1:10,脱氧胆酸钠-磷脂的质量比1:10,磷脂浓度1%;尼莫地平脂质体外观接近球形,平均粒径(122.8±5.3)nm,平均Zeta 电位(-23.69±1.24)mV,包封率84.27%±0.58%。结论:优选得到的尼莫地平脂质体制备工艺合理,为尼莫地平新制剂的研发提供依据。
尼莫地平;脂质体;正交设计
尼莫地平(nimodipine),在丙酮、三氯甲烷或乙酸乙酯中易溶,在乙醇中溶解,在乙醚中微溶,在水中几乎不溶[1]。尼莫地平属于双氢吡啶类钙拮抗剂,可有效阻止Ca2+进入细胞内、抑制平滑肌收缩,从而达到解除血管痉挛的目的。目前在临床上多用于缺血性脑血管病,轻或中度高血压,偏头痛等的治疗[2-4]。但其水溶性差,具有肝脏首过效应,生物利用度低;在体内的半衰期很短,仅有1~2 h,有效作用时间短,均直接影响临床药效的发挥[5-6]。将尼莫地平制成脂质体,有助于增加其吸收,延长作用时间,为尼莫地平新制剂的研发提供参考与依据。
1 材 料
1.1仪器
B-260型恒温水浴锅,上海亚荣生化仪器厂;R系列旋转蒸发仪,上海中生科技有限公司;JY92ⅡN超声波细胞粉碎仪,宁波新芝生物科技股份有限公司;DF-101S型集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;UV-2450 型紫外可见分光光度计,日本岛津公司;H-7650透射电镜,日本日立公司;Nicomp 380 ZLS粒度分析仪,美国Particle sizing systems公司;25-3.5K透析袋,上海绿鸟科技发展有限公司;0.45 μm/0.22 μm微孔滤膜,上海市新亚净化器件厂。
1.2试剂
大豆磷脂酰胆碱S 100(注射级),德国Lipoid 公司;胆固醇,上海阿拉丁生化科技股份有限公司;脱氧胆酸钠,上海阿拉丁生化科技股份有限公司;尼莫地平原料药,西安东晓生物科技有限公司;尼莫地平对照品(规格 50 mg,批号 100270-200002),中国食品药品检定研究院;无水乙醇(AR),国药集团化学试剂有限公司;其他试剂为分析纯。
2 方法与结果
2.1脂质体的制备
称取适量尼莫地平、磷脂和胆固醇,加无水乙醇适量溶解形成类脂溶液,置于磁力搅拌器上。脱氧胆酸钠溶于pH 6.8磷酸盐缓冲液(PBS)中,50 ℃下将类脂溶液缓慢滴加入其中,继续搅拌至无水醇味。利用探头超声仪超声3 min,依次过0.45 μm滤膜和0.22 μm滤膜,即得乳白色的尼莫地平脂质体混悬液。
2.2制备工艺优化
根据前期的探索性单因素试验,确定药物-磷脂的质量比(A),胆固醇-磷脂的质量比(B),脱氧胆酸钠-磷脂的质量比(C),磷脂浓度(D)为影响因素,每个因素选取3个水平,见表1。精密称取尼莫地平20 mg,以包封率为优化指标,采用正交实验确定最佳工艺。正交实验结果见表2,方差分析结果见表3。

表1 因素水平设计

表2 L9(34)正交实验结果

表3 方差分析结果
续表3

C4.85121.00019.000D460.433294.91519.000*误差4.852
*P<0.05。
由表2中的极差值可以看出,四个因素对脂质体药物包封率的影响程度为A>D>B>C,最佳工艺条件为A2B2C2D2,即药物-磷脂的质量比1:20,胆固醇-磷脂的质量比1:10,脱氧胆酸钠-磷脂的质量比1:10,磷脂浓度1%。
2.3脂质体的形态、粒径与电位
取适量盐酸川芎嗪脂质体混悬液,在电镜下观察,脂质体外观接近球形,形态较为完整(图1)。利用粒度分析仪测定其平均粒径(122.8±5.3)nm,平均Zeta 电位(-23.69±1.24)mV。
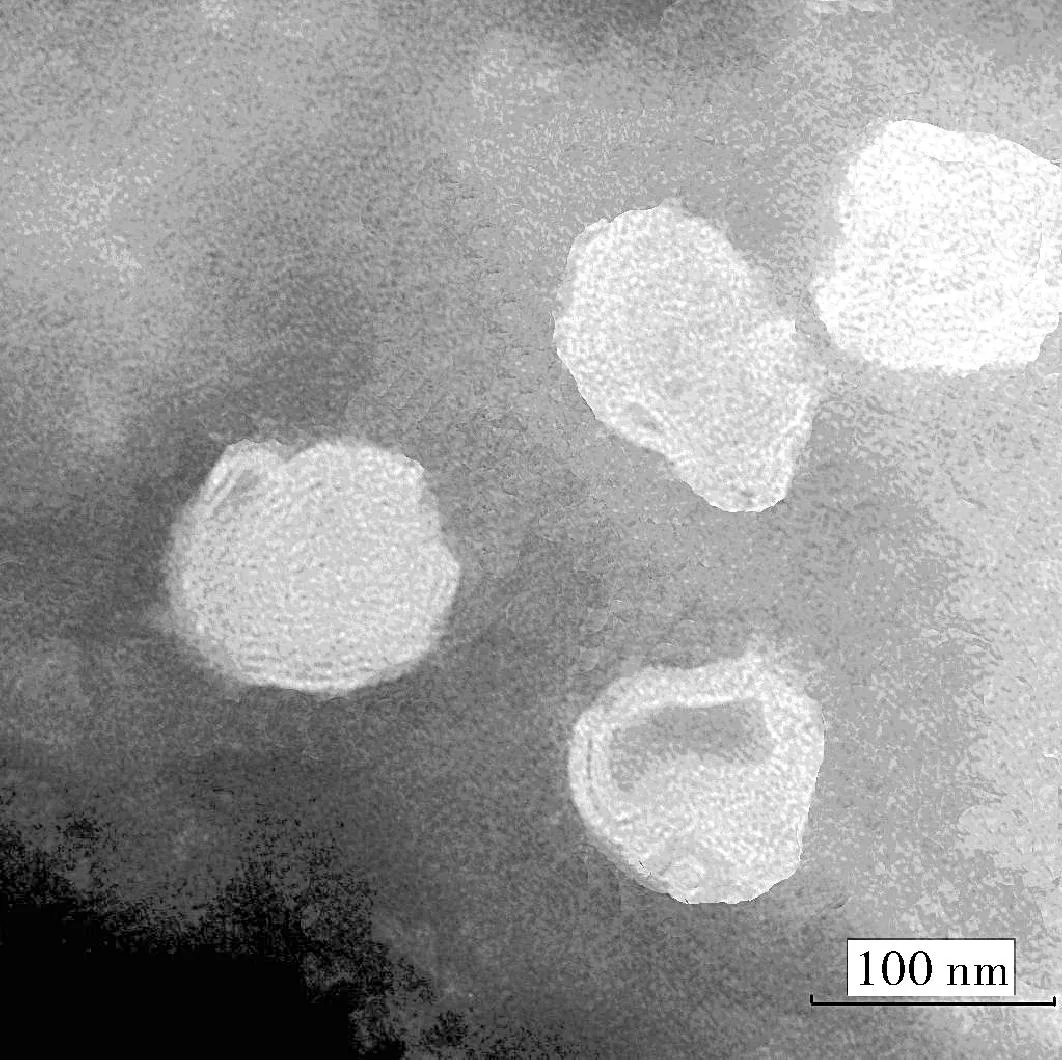
图1 尼莫地平脂质体电镜形态
2.4包封率的测定
2.4.1尼莫地平标准曲线的建立
精密称取尼莫地平对照品20 mg,置于100 mL容量瓶中,用无水乙醇稀释到刻度,即得浓度为0.20 mg/mL的尼莫地平储备液。分别取1,2,3,4和5 mL尼莫地平储备液于100 mL容量瓶中,用无水乙醇定容,稀释成浓度为0.002,0.004,0.006,0.008,0.010 mg/mL的系列标准溶液,在238 nm波长处测定尼莫地平吸光度(A),以质量浓度(C)对A 回归,得标准曲线方程为C=73.55 A+0.0135 (r=0.9999)。结果表明,尼莫地平在0.002~0.010 mg· mL-1范围内线性关系良好。
2.4.2精密度实验
取浓度为0.006 mg/mL的尼莫地平标准溶液连续测定吸光度5次,其平均含量RSD为0.98%,表明日内精密度良好。
取浓度为0.006 mg/mL的尼莫地平标准溶液每天在同一时间测定吸光度,连续5 d,其平均含量RSD为1.05%,表明日间精密度良好。
2.4.3稳定性实验
取脂质体适量,用无水乙醇破乳,并定容,制成供试品溶液,分别于0,2,4,6,8 h测定吸光度值,计算浓度,其RSD为2.03%,表明样品在8 h内稳定性较好。
2.4.4加样回收实验
取浓度为0.006 mg/mL的尼莫地平标准溶液5 mL,加入不含尼莫地平的空白脂质体中,无水乙醇破乳,其回收率为100.13%±0.64%。
2.4.5包封率的测定
精密移取脂质体1 mL,加入无水乙醇破乳并定容,测定吸光度值,并计算药物浓度,以及总药量(W总)。精密移取脂质体2 mL置于透析袋内,两端用透析夹夹紧,以pH 6.8 PBS为透析液,置于磁力搅拌器上搅拌,透析8 h达到平衡后,精密移取透析袋内溶液1mL ,转移至容量瓶中,加入无水乙醇破乳并定容,计算药物浓度,以及包封药量(W包)。按照式(1)计算包封率。
包封率=W包/W总×100%
(1)
按最佳工艺制备3批脂质体,并计算包封率。其平均包封率为84.27%±0.58%。
3 讨 论
尼莫地平对光敏感,在强光(日光直射等强光或紫外线)照射下会产生光解现象,光解产物在 270 nm处有新的吸收峰出现[7]。有文献报道,尼莫地平溶液于50 mL透明容量瓶中静置于室内光照处,48 h 内其浓度变化RSD<2%,说明尼莫地平标准液在室内自然光下稳定性良好[1]。故在操作时应尽量在室内弱光或避光下进行,避免日光直射等强光照射,尽量采用避光操作。
脱氧胆酸钠为表面活性剂,脂质体中加入脱氧胆酸钠,可以提高其稳定性,增加包封率。
4 结 论
利用乙醇注入法,以包封率为评价指标,采用正交试验优化制备工艺,得到的尼莫地平脂质体外观近球形,平均粒径(122.8±5.3)nm,平均Zeta 电位(-23.69±1.24)mV,包封率84.27%±0.58%。优选得到的尼莫地平脂质体制备工艺合理,为尼莫地平新制剂的研发提供依据。
[1]常思. 尼莫地平 PLGA 微球的制备方法改良及其特性研究[D]. 天津:天津大学化工学院, 2012.
[2]Langley MS, Sorkin EM. Nimodipine. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic potential in cerebrovascular disease [J]. Drugs, 1989, 37(5): 669-699.
[3]Blardi P, Urso R, De Lalla A, et al. Nimodipine: drug pharmacokinetics and plasma adenosine levels in patients affected by cerebral ischemia [J]. Clin. Pharmacol. Ther., 2002, 72(5): 556-561.
[4]周业旺, 郑金瓯. 尼莫地平治疗蛛网膜下腔出血后脑血管痉挛的研究进展[J]. 医学综述, 2011, 17(12): 1858-1860.
[5]Chalikwar SS, Belgamwar VS, Talele VR, et al. Formulation and evaluation of nimodipine-loaded solid lipid nanoparticles delivered via lymphatic transport system[J]. Colloids Surf B: Biointerfaces, 2012, 97: 109-116.
[6]Fu Q., Sun J., Ai X., et al. Nimodipine nanocrystals for oral bioavailability improvement: role of mesenteric lymph transport in the oral absorption[J]. Int. J. Pharm. 2013, 448(1): 290-297.
[7]Zanocco A L, Diaz L, Lopez M, et al. Polarographic study of the photodecomposition of nimodipine[J]. Journal of Pharmaceutical Sciences, 1992, 81(9): 920-924.
Optimization of Preparation Process of Nimodipine Liposomes by Orthogonal Design*
WANG Ting-yu1, LI Yao1, ZHANG Xin1, WU Yun-ming1,2, YANG Yi-hua1,2
(1 School of Pharmacy, Xuzhou Medical College, Jiangsu Xuzhou 221004;2JiangsuKeyLaboratoryofNewDrugResearchandClinicalPharmacy,JiangsuXuzhou221004,China)
To optimize preparation process of nimodipine liposomes, the nimodipine liposomes were prepared by ethanol injection method. The preparation technology was optimized by orthogonal design with encapsulation efficiency as index. Morphology, average particle size, Zeta potential and entrapment efficiency of nimodipine liposomes were investigated. Results showed that the ideal preparation technology was as follows: ratio of nimodipine to phospholipid was 1:20, ratio of cholesterol to phospholipid was 1:10, ratio of sodium deoxyeholate to phospholipid was 1:10, the concentration of phospholipid was 1%, under these conditions, liposomes were nearly spherical, average particle size was (122.8±5.3) nm and Zeta potential was (-23.69±1.24) mV, average encapsulation efficiency of liposomes was 84.27%±0.58%. The selected preparation process of nimodipine liposomes could be rational which provided references for research of formulation of nimodipine.
nimodipine; liposomes; orthogonal design
江苏省大学生实践创新训练计划项目(No. 201310313055X)。
王婷玉(1991-),女,从事药物新剂型与新制剂研究。
杨宜华(1977-),女,讲师,从事药物新剂型与新制剂研究。
R944.9
A
1001-9677(2016)01-0068-03
