告达庭丙酸酯及丙二酸酯的合成*
2016-09-01陶雪芬
陶雪芬
(浙江中医药大学药学院,浙江 杭州 310053)
告达庭丙酸酯及丙二酸酯的合成*
陶雪芬
(浙江中医药大学药学院,浙江杭州310053)
以耳叶牛皮消CynanchumauriculatumRoyle ex Wight 的块根为原料,经乙醇、氯仿提取,经硅胶柱色谱分离获得告达庭单体,并以其为原料,经半合成获得告达庭丙酸酯和告达庭丙二酸酯,以便进一步对其进行抗肿瘤活性研究。以告达庭为原料,在DCC和少量DAMP的催化下与酸反应成酯。结果表明:合成了告达庭丙酸酯和丙二酸酯,结构经1H NMR和13C NMR鉴定,并开展药理活性实验。通过该实验方法能合成告达庭酯类化合物。
告达庭;丙酸酯;丙二酸酯;合成
我国植物资源丰富,而且众多植物具有药用活性成分[1],如生物碱、多糖、苷等。其中,从玄参科、毛茛科等[2]植物中发现的C21甾体衍生物,因具有抗炎、抗肿瘤等功能,目前被广泛应用于临床中。这类生物活性物质还普遍存在于萝摩科植物,如白薇C.atratumBunge、徐长卿C.paniculatumKitagawa、白首乌Cunanchumauriculatum等。尽管C21甾体苷有良好的药理活性,但由于其在植物中含量很低,而且提取、分离、纯化以及鉴定等工作比较繁琐。相比较而言,获取苷元显得比较简便[3]。通过得到的苷元,对其进行结构修饰,改变其水溶性,有利于提高其生物利用度。因此,本实验探究以白首乌提取的告达庭苷元为中间体,通过半合成的方法制备C21甾体苷,具有实际意义。
1 实验部分
1.1仪器与试剂
DHJF-8002低温恒温搅拌反应浴,郑州长城科工贸有限公司;恒温磁力搅拌仪;ZF-7型暗箱三用紫外线分析仪,上海嘉鹏科技有限公司;旋转蒸发仪,郑州长城科工贸易有限公司。
丙酸(分析纯),天津博迪化工股份有限公司;丙二酸(分析纯),天津博迪化工股份有限公司;4-二甲氨基吡啶(DMAP),上海源叶生物技术有限公司;N,N-二环己基碳二亚胺(DCC),上海源叶生物技术有限公司。
白首乌经浙江省医学科学院药物所张治国研究员鉴定为耳叶牛皮消CynanchumauriculatumRoyle ex Wight 的块根,购自四川省。
1.2合成路线
以自行提取得到的告达庭苷元(1)为原料,在DCC和DMAP的催化下与酸反应得告达庭酯(2a~b)。结构式、合成路线见图1、图2。
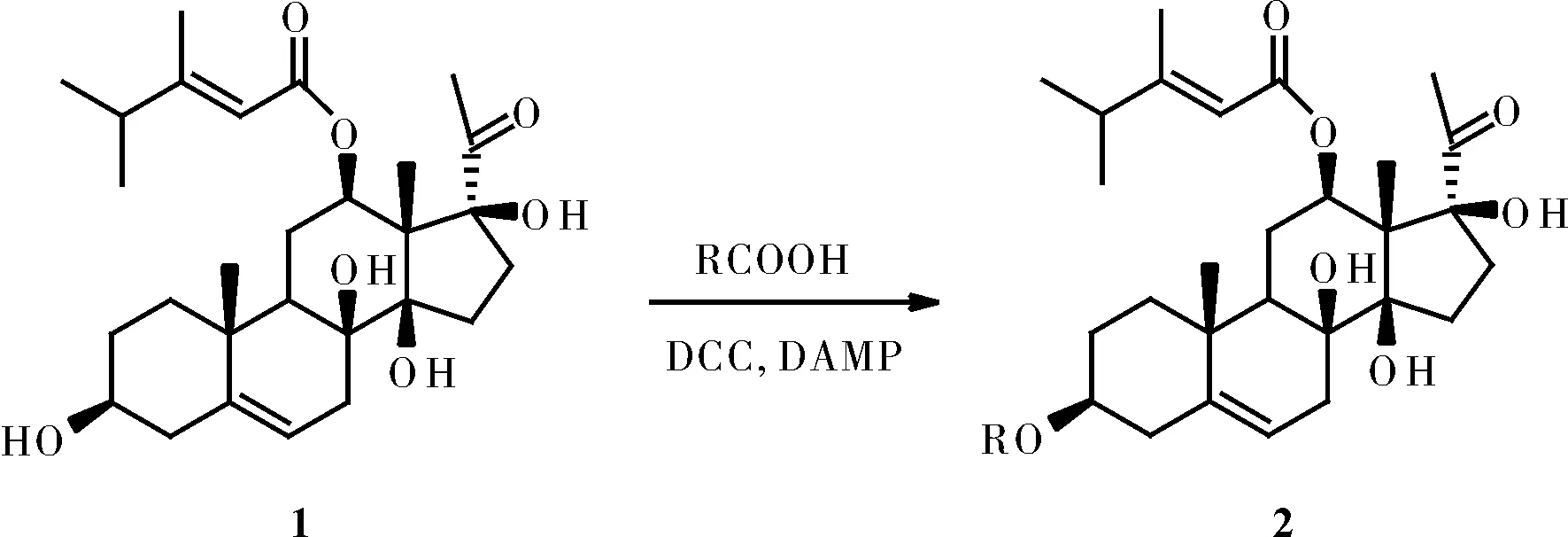
图1 合成路线
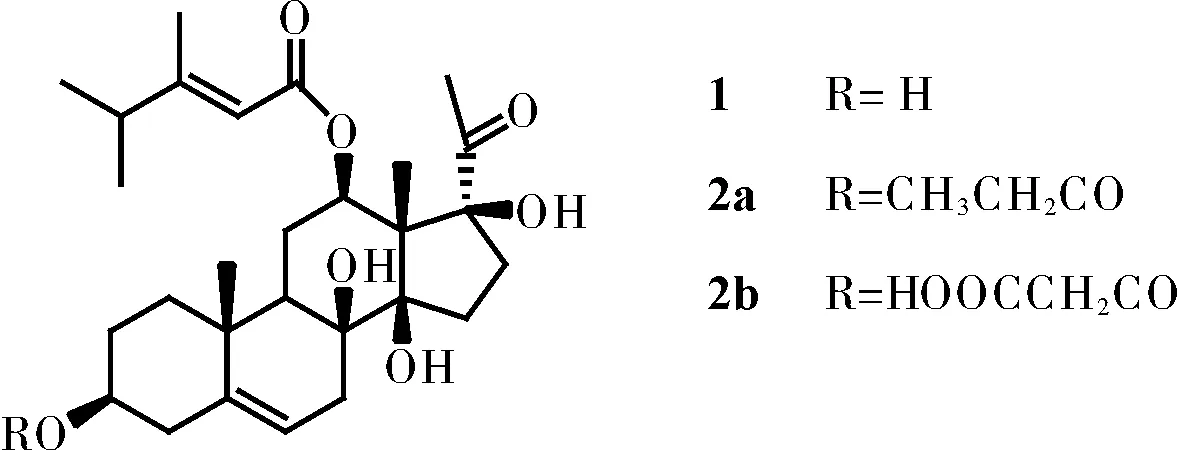
图2 告达庭及其衍生物的结构
1.3告达庭苷元的提取分离
1.3.1总苷提取[4-6]
取白首乌干燥块根10 kg,粉碎,加入240 L MeOH,回流提取3次(每次2 h),合并提取液,减压回收溶剂,得MeOH提取物880 g。往该提取物中加入8 L氯仿,水浴加热2 h,冷却后过滤,减压回收氯仿,得氯仿提取物320 g。再将氯仿提取物浸入3 L n-C6H14中,加热回流2次(每次30 min),得n-C6H14不溶部分,干燥,得总苷305 g。
1.3.2酸水解[7-8]
取总苷32.4 g,加入250 mL 10%HCl-乙醇溶液,加热回流4 h,反应至TLC不显示原料斑点。待反应结束,将反应产物置于室温环境自然冷却。
1.3.3酸水解产物处理分离
用40% NaOH溶液中和至pH=7,减压浓缩干燥,在硅胶柱中进行洗脱,洗脱剂CH2Cl2:CH3OH=80:1(V:V),得到化合物1。化合物1的1H NMR和13C NMR数据与文献[9]报道中告达庭苷元数据相符。
1.4告达庭酯的合成
1.4.1告达庭丙酸酯(2a)合成
在50 mL的三颈瓶中依次加入告达庭苷元 98 mg(0.2 mmol),DMAP4.9 mg(0.04 mmol),丙酸11 mg(0.24 mmol),二氯甲烷溶液(8 mL),冰水浴冷却至0 ℃后加入DCC 49.5 mg(0.24 mmol),加毕自然升温至室温,维持室温反应直到TLC不显示原料斑点。过滤反应液,用二氯甲烷(10 mL)洗3次。合并二氯甲烷液,再用5%盐酸(3×20 mL),饱和碳酸氢钠溶液(3×20 mL)和饱和氯化钠溶液(3×20 mL)洗。取有机相用无水硫酸钠干燥,过滤,滤液减压浓缩,硅胶色谱柱纯化得白色非结晶粉末 27.3 mg,产率25%。结构经1H NMR 分析,并通过与告达庭苷元的1H NMR比较,确定为告达庭丙酸酯。
1.4.2告达庭丙二酸酯(2b)合成
依次加入告达庭苷元 98 mg(0.2 mmol),DMAP4.9 mg(0.04 mmol),丙二酸11 mg(0.24 mmol),二氯甲烷溶液(8 mL),冰水浴冷却至0 ℃后加入DCC 49.5 mg(0.24 mmol),加毕自然升温至室温,维持室温反应直到TLC不显示原料斑点。过滤反应液,用二氯甲烷(10 mL)洗3次。合并二氯甲烷液,再用5%盐酸(3×20 mL),饱和碳酸氢钠溶液(3×20 mL)和饱和氯化钠溶液(3×20 mL)洗。取有机相用无水硫酸钠干燥,减压浓缩,硅胶色谱柱纯化得白色非结晶粉末 23.04 mg,产率20%。结构经1H NMR 分析,并通过与告达庭苷元H信号比较,确定为目标产物告达庭丙二酸酯。
1.5分离与纯化
1.5.1洗脱剂的选择
良好的洗脱剂应满足以下两个条件:能使待测组分分开且Rf值在0.25~0.3之间。在本实验中,尝试了不同的有机溶剂配比对反应物的洗脱能力,经过比较,最终选择了二氯甲烷:甲醇=60:1(V:V)作洗脱剂。
1.5.2装柱和上样
取柱层析硅胶适量,加入二氯甲烷搅拌溶解成流体,加至约柱长的2/3,让其沉降至不再变动,将上述反应产物溶于少量二氯甲烷中,上样。
1.5.3洗脱
二氯甲烷:甲醇=60:1(V:V)为洗脱剂进行洗脱,以20 mL试管接洗脱液,TLC检测(以告达庭苷元为对照),结果显示告达庭丙酸酯:试管1~10无斑点,11~14有斑点(为产物),17~19有斑点(为原料),15~16、20~25无斑点;告达庭丙二酸酯:试管1~8无斑点,9~11有斑点(为产物),14~15有斑点(为原料),12~13、16~21无斑点。将显示同一斑点的试管内容物收集,用旋转蒸发仪旋干,即得产物与原料。
2 讨论与结论
C21甾体衍生物是一类具有抗炎、抗肿瘤等功能的生物活性物质。目前就抗肿瘤方面,近年来有大量的实验人员做了相关实验,来验证C21甾体苷有抗肿瘤作用。例如,张如松等[10]研究发现耳叶牛皮消甾体总苷具广谱的抗肿瘤作用;王冬艳等[11]通过小鼠造模实验,探究并推测了白首乌C21甾体苷对肝癌实体瘤细胞的凋亡作用及其机制;印敏等[12]通过体外抗肿瘤实验,发现白首乌甾体总苷对4种人癌细胞株(人大肠癌细胞、人前列腺癌细胞、人宫颈癌细胞、人肺癌细胞)均有较强的体外细胞毒作用,且呈浓度依赖性。但由于C21甾体苷在植物中含量很低,提取、分离、纯化以及鉴定等工作比较繁琐,相比较而言,获得苷元比较简便。因此,探究以苷元为中间体,通过半合成的方法制备各种C21甾体苷,为后续进行药理活性实验具有实际意义。
在本次实验中,采用了酸水解来获得告达庭苷元。由于总苷水解率较低,通过改变酸的浓度比较水解产率,最终发现并选择适当提高酸的比例,从而使水解相对趋向完全。在分离纯化时,考虑到柱效问题,因此选择了细长型的层析柱。此外,在上样时,由于产物的量比较少,故采用了湿法上样。湿法上样时,加入了少量二氯甲烷来溶解,并用滴管吸取后淹层析柱的内壁缓慢滴加,以保证产物转移完全,减少损失。在TLC检测时,有时候斑点因边缘效应或制备缺陷而难以判断,所以为避免影响判断,使用了交叉点板。
现代药理研究表明C21甾体衍生物有显著抗肿瘤效果,对资源的开发和利用起到了积极作用,但实验合成的目标产物告达庭丙酸酯及丙二酸酯,还需进一步研究其抗肿瘤活性。
[1]金玺. 我国药用植物资源利用的研究[J]. 中国资源利用,2011, 29(4): 39-41.
[2]陶雪芬, 徐佳丽, 张如松. 萝藦科各属植物C21甾体苷类成分及药理活性研究进展[J]. 中国民族民间医药,2009, 17: 40-42.
[3]陶雪芬, 张如松. 告达庭葡萄糖苷的合成及抗肿瘤活性研究[J]. 中国现代应用药学, 2011, 28(7): 644.
[4]宋康, 张锋, 杜方岭. 不同提取工艺下白首乌C21甾苷含量研究[J]. 中国食物与营养,2010, (10): 47-49.
[5]刘海港,黄雄,谢光辉,等. 白首乌中一个新的C21甾体苷类化合物[J]. 中国药科大学学报,2009, 40(1): 34-36.
[6]张如松, 叶益萍, 李晓誉等. 黑鳗藤中C21甾体苷的分离和结构测定[J]. 化学学报, 2003, 61(12): 1991-1996.
[7]赵鑫,沈舒,李友宾. 白首乌中C21甾总苷盐酸水解条件的优化[J]. 现代中药研究与实践, 2011, 25(1): 39-41.
[8]徐佳丽. 白首乌总苷A(CGA)酸水解产物的抗肿瘤作用研究[D]. 浙江, 浙江中医药大学, 2010:12.
[9]Bando H,Amiya T,Sato E.Mitsuhashi H.Studies on the constituents of Asclepiadaceae plants. XI. VIII.5α, 6α-epoxycaudatin, a new polyoxypregnane derivative from Cynanchum caudatum Max[J]. Chem Pharm Bull, 2000, 28(7): 2258-2260.
[10]张如松, 叶益萍, 刘雪莉. 白首乌甾体总苷的体外抗肿瘤作用[J]. 中草药,2000, 31(8): 599-601.
[11]王冬艳,张洪泉,李心. 白首乌C21甾体苷诱导肝癌细胞凋亡的作用及其机制[J].药学学报, 2007, 42(4): 366-370.
[12]印敏,冯煦,董云发,等.白首乌化学成分与药理活性研究进展[J].中国野生植物资源,2004, 23(2): 8-11.
Synthesis of 3-O-propionyl Caudatin and 3-O-(α-carboxyl) Acetyl Caudatin*
TAOXue-fen
(College of Pharmaceutical Science, Zhejiang Chinese Medicinal University, Zhejiang Hangzhou 310053, China)
3-O-propionyl Caudatin and 3-O-(α-carboxyl) acetyl Caudatinin were synthesized to further research. The target compounds of 3-O-propionyl Caudatin and 3-O-(α-carboxyl) acetyl Caudatin were synthesized from Caudatin by reaction with acid catalyzed by DCC and DAMP. Results showed that 3-O-propionyl Caudatin and 3-O-(α-carboxyl) acetyl Caudatin were synthesized. Bytheexperimental methods of the products 3-O-propionyl Caudatin and 3-O-(α-carboxyl) acetyl Caudatin were synthesized.
caudatin; propionate; malonate; synthesis
浙江省教育厅科研项目 (Y201327138);浙江中医药大学科研基金重点项目(2012ZZ08)。
陶雪芬(1977-),女,讲师,博士,主要从事药物设计与研发。
TQ914.1
A
1001-9677(2016)02-0042-03
