响应性高分子抗肿瘤药物纳米微胶束的构筑
2016-09-01袁建超骆雯博宋开润曾宪武
袁建超,骆雯博,宋开润,曾宪武
(1.西北师范大学化学化工学院,甘肃省高分子材料重点实验室,甘肃兰州 730070;2.甘肃省肿瘤医院,甘肃兰州 730050)
响应性高分子抗肿瘤药物纳米微胶束的构筑
袁建超1,骆雯博1,宋开润1,曾宪武2
(1.西北师范大学化学化工学院,甘肃省高分子材料重点实验室,甘肃兰州730070;2.甘肃省肿瘤医院,甘肃兰州730050)
合成了聚(4-甲基丙烯酰-醛基苯甲酸酯)-聚乙二醇-聚叶酸[P(HBA-TMOBA)-PEG-PFA]两亲性嵌段聚合物.透射电镜(TEM)照片显示制备的胶束成球形,平均粒径约为106 nm.模拟细胞内释药结果表明,在体外药物输送过程中,仅有14.62%的阿霉素在48 h释放,而在pH=5.0的条件下(在胞内体/溶酶体内),48 h释放率达到78.87%.细胞毒性(MTT)证明合成的聚合物P(HBA-TMOBA)-PEG-PFA纳米药物载体微胶束对正常组织细胞无毒性,并且对人体宫颈癌(HeLa)细胞有良好的抑制作用.
药物载体;胶束;叶酸靶向;缩醛;细胞毒性
近年来,肿瘤已经成为威胁人类健康的重大疾病.化学药物疗法是目前肿瘤治疗的主要手段之一,其中阿霉素小分子的抗肿瘤药物常用于肿瘤的治疗[1].然而小分子的游离阿霉素药物不仅能够杀死肿瘤细胞,对正常的组织细胞也同样有较大损害[2-4].针对这种情况,纳米药物载体通过包载或化学键合的方式携载小分子化疗药物[5-6],实现靶向和缓控释给药,并能够增加药物的稳定性,减少用药量,提高生物利用度,降低毒副作用[7-8].随着纳米技术和对肿瘤特性认识的深入,纳米药物载体的肿瘤靶向策略不断发展优化.由最初的被动靶向利用ERP效应使纳米载药系统通过长循环富集于肿瘤部位,然而并不能使药物有效的输送至肿瘤细胞[9];依据肿瘤细胞膜能特征表达或过量表达一系列抗原或受体,以满足肿瘤细胞过度增殖所需要的各种刺激和营养需求,主动靶向分子如小分子、多肽片段、蛋白质、适配体和多糖等被研究增强纳米药物载体与细胞之间的相互作用以利于细胞摄取,但其不利于纳米载体在肿瘤部位的富集[10].结合被动靶向和主动靶向的优点,环境刺激响应性智能靶向纳米药物载体如酸响应、酶响应、还原响应、光、温度刺激响应性的纳米载体[11-16]被合成来提高肿瘤的治疗效果,降低毒副作用.纳米载体如胶束、脂质体、碳纳米管、量子点、凝胶和囊泡等常被用于药物的运载.目前已经大量合成了含有智能释放键的两亲性嵌段聚合物[17-20],在水中自组装形成胶束,作为新型纳米药物载体.但是同时具备智能释放系统与特异性靶向的聚合物纳米胶束药物载体的研究还比较少.鉴于此,合成了叶酸靶向的pH刺激响应性纳米微胶束药物载体.
通过RAFT聚合合成两嵌段和三嵌段聚合物P(HBA-TMOBA)-PEG和P(HBA-TMOBA)-PEG-PFA[21].以酸刺激响应性缩醛功能化单体作为疏水内核,生物相容性好的PEG作为亲水部分,人体宫颈癌(Hela)细胞特异性识别的靶向配体叶酸在最外层靠着水介质(图1).紫外分光光度计在282 nm处测定3,4,5-三甲氧基苯甲酸监测聚合物模拟体外水解的吸光度,聚合物包裹阿霉素在一定时间间隔取样测定药物体外释放.动态光散射和透射电镜对所制备的胶束形貌进行表征.细胞实验证明该聚合物胶束无细胞毒性,有望成为良好的抗肿瘤药物载体.
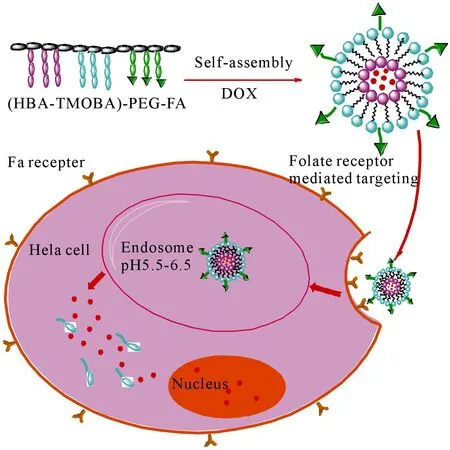
壳外是功能化的叶酸靶向配体;壳是亲水性的聚乙二醇;核是pH响应性的缩醛键连接3,4,5-三甲氧基苯甲酸(TMOBA))包封药物阿霉素(DOX.
图1P(HBA-TMOBA)-PEG-PFA树状两亲性嵌段聚合物自组装形成的胶束
Fig 1Fabrication of micelles from P(HBA-TMOBA)-PEG-PFA comb-like amphiphilic triblock copolymers
1 实验部分
1.1仪器与试剂
聚乙二醇(PEG, 99%,聚合物科学有限公司,美国);对羟基苯甲醛(98%)、甲基丙烯酰氯(98%),1,1,1-三羟甲基乙烷(HME,97%)、叶酸(FA,99%)、丙烯胺(98%)、3,4,5-三甲氧基苯甲酸(TMOBA, 99%), N,N′-二环己基碳(DCC,99%)、4-二甲氨基吡啶(DMAP, 99%)、2,2′-偶氮二异丁腈(AIBN,99%)均购自北京百灵威科技有限公司;二甲基亚砜(DMSO)、3A分子筛和丙酮购自天津市富宇精细化工有限公司.核磁共振(NMR)400 MHz(瓦里安公司,美国),用D2O或DMSO-d6作为溶剂和四甲基硅烷(TMS) 作为内标;粒径和粒径分布(多分散性指数PDI)测定通过动态光散射(DLS),在25 ℃使用马尔文激光电位测定仪器(马尔文仪器有限公司,英国);透射电子显微镜(TEM, 美国);Hela细胞和共聚焦显微镜(甘肃省肿瘤医院).树状两亲性嵌段共聚物的合成路线见图1.
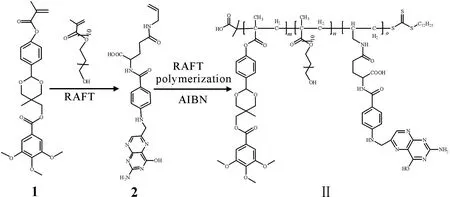
图2 树状两亲性嵌段共聚物P(HBA-TMOBA)-PEG和P(HBA-TMOBA)-PEG-PFA的合成
1.2合成缩醛单体
1.2.1合成HBA(4-O-Acryloyl benzaldehyde)对羟基苯甲醛(1.25 g,10.3 mmol)和三乙胺(1.56 mL,1.14 g,11.3 mmol)溶解在50 mL二氯甲烷中,冷却至0 ℃.甲基丙烯酰氯(1.04 mL,0.98 g,10.8 mmol)逐滴加入到该溶液中,同时搅拌.将反应混合物室温搅拌过夜,然后将混合物用100 mmol·L-1pH=8.0的磷酸缓冲液洗涤3次,并用无水硫酸钠干燥.将溶剂用减压旋转蒸发除去,产物用硅胶色谱法纯化(乙酸乙酯和石油醚1∶10洗脱),得到无色油状液体1.19 g,产率为61%.
1.2.2合成HBA-1,1,1-三羟基乙烷1,1,1-三羟甲基乙烷(1.9 g,16 mmol)和HBA(0.19 g,1 mmol)溶解于40 mL四氢呋喃,加入3 g 3 A分子筛干燥.然后加入对甲苯磺酸(69 mg,0.38 mmol)催化,混合物在室温下搅拌过夜.待反应完成后,2 mL三乙胺加入以中和酸,减压过滤除去分子筛,再将溶剂通过减压旋转蒸发除去,残余物溶解在40 mL二氯甲烷溶液中.再用100 mmol·L-1pH=8.0的磷酸缓冲液洗涤3次,并用无水硫酸钠干燥,得到白色固体0.61 g, 产率为72%.
1.2.3合成HBA-TMOBA以上产物(0.29 g,1 mmol)溶解于30 mL二氯甲烷中, 冰浴条件下,加入N,N′-二环己基碳(0.41 g,2 mmol),4-二甲氨基吡啶(0.12 g,1 mmol)和3,4,5-三甲氧基苯甲酸(0.42 g,2 mmol).混合物搅拌过夜,沉淀过滤除去,溶剂旋转蒸发,粗产物通过硅胶色谱柱纯化(乙酸乙酯/石油醚=1∶7)得到白色固体(1)0.33 g,产率为68%.
1.3合成叶酸单体
称取叶酸(500.0 mg,1.13 mmol)溶解于30 mL二甲基亚砜溶液中,50 ℃下油浴搅拌,用DCC(233.0 mg,1.13 mmol)活化6 h.活化后的叶酸冷却至室温后加入4-二甲氨基吡啶(276.0 mg,2.26 mmol)和烯丙基胺(129 mg,2.26 mmol),在室温下过夜. 产生的DCU通过过滤除去,粗产物加入过量的丙酮沉淀,过滤,用丙酮洗涤3次,并在真空下干燥,得到单体(2)(385.9 mg, 产率71%)[17].
1.4合成聚合物Ⅰ
取RAFT试剂(4 mg,0.01 mmol)、缩醛单体(54 mg,0.11 mmol)和AIBN(10 mg,0.06 mmol)溶解在2 mL DMSO中,将混合物抽真空,在冰浴中充氮气30 min后,将Schlenk烧瓶放入恒温油浴中60 ℃下24 h,然后加入酸响应PEG单体(52.6 mg,0.1 mmol),并补充AIBN继续在氮气保护、60 ℃油浴中聚合24 h.粗产物在石油醚/乙酸乙酯中沉淀,得到聚合物Ⅰ的白色固体87 mg,产率为81%.
1.5合成聚合物Ⅱ
取聚合物Ⅰ(0.1 g,0.01 mmol,Mn=1.06×104g·mol-1)、叶酸单体(24 mg,0.05 mmol)和AIBN(26 mg,0.156 mmol)溶解于3 mL DMSO中,将混合物抽真空,在冰浴中充氮气30 min后,将Schlenk烧瓶放入恒温油浴中在60 ℃下24 h.混合物在乙醚中沉淀,得到聚合物Ⅱ浅黄色粉末0.1 g,产率为77%.
1.6聚合物胶束的制备及形貌表征
取共聚物10 mg溶解在1 mL THF溶液中,逐滴加入10 mL蒸馏水使达到浓度1 mg·mL-1,然后将溶剂通过减压旋转蒸发除去,缓慢搅拌过夜形成胶束.取胶束3 mL放入3000分子量透析袋中,针对蒸馏水透析24 h,采用动态光散射(DLS)在37 ℃对上述制备的聚合物载药胶束的粒径及粒径分布进行检测.胶束的形貌采用透射电镜(TEM)进行观察.透射电镜(TEM)制样:将铜网放入少量载药胶束溶液中取出,置于空气中自然干燥,采用TEM检测,加速电压 200 kV.
1.7聚合物胶束pH刺激响应性水解
聚合物Ⅱ的水解是通过测定3,4,5-三甲氧基苯甲酸在282 nm处的紫外吸收(UV/vis)得到.将10 mL(1 mg·mL-1)的聚合物胶束平均分成两份于3 000分子量透析袋中,再分别置于250 mL的pH=7.4和pH=5.0的缓冲溶液中,37 ℃下搅拌,在适当的时间间隔取出3 mL的透析液测定其UV/vis(取出透析液放回,保证透析液总体积以及3,4,5-三甲氧基苯甲酸总量不变).最后,在两个样品中分别加入2滴HCl测定100%水解的吸光度,计算相应时间的水解率.
1.8DOX的加载和体外释放
在室温搅拌下,将磷酸盐缓冲液(5 mL的10 mmol·L-1, pH=7.4)加到0.5 mL DMSO,5 mg共聚物和2 mg阿霉素的溶液中,得到DOX的胶束溶液.在室温下黑暗中将该溶液透析在磷酸盐缓冲液(10 mmol·L-1,pH=7.4)中,以除去胶束溶液中的DMSO,形成包裹DOX的胶束.
体外释放DOX.共聚物胶束是在pH=7.4的磷酸盐缓冲液和pH=5.0的乙酸盐缓冲液中,在37 ℃用UV/Vis可见光谱测量482 nm的吸光度.负载DOX的胶束悬浮液转移到透析袋(截留分子量3000),浸入100 mL蒸馏水中,并在37 ℃搅拌12 h,除去未被包裹的DOX,然后取出分别放入到pH=7.4和pH=5.0的缓冲溶液中,在所需的时间间隔取3 mL释放介质,用UV/Vis可见光谱在482 nm测量吸光度,然后将取出的介质放回保持培养基等体积.标准曲线由配制不同浓度的DOX溶液对应的在482 nm测量吸光度绘制得到,每个浓度平行测定3次,数据表示为平均值±标准差.载药量(DLC)由UV/Vis光谱测定. DOX的加载胶束悬浮液冷冻干燥,溶于DMF中,并用UV/Vis可见光谱法进行分析.使用DOX/DMF溶液中含有不同浓度的阿霉素,得到标准曲线.
载药量(DLC)按下式计算:

载药效率(DLE)按下式计算:

1.9细胞毒性实验
HeLa细胞的培养按常规方法复苏,在37 ℃含10%小牛血清的RPMI-1640培养液中,5% CO2,饱和湿度培养.分别按1∶3,1∶2比例传代.采用四氮唑盐还原法(MTT)对HeLa 细胞株进行试验:取处于对数生长期的宫颈癌HeLa 细胞,将细胞浓度调为每毫升2×104个,在96孔培养板中每孔加入90 μL,边缘孔用无菌PBS填充.在5% CO2,37 ℃孵育,培养箱中放置待贴壁后再加药.对于高分子聚合物Ⅰ和Ⅱ,均分别设定浓度为0.01,0.1,0.5,1,10,20 μg·mL-16个梯度.实验组与对照组均设3个复孔,加药后细胞在37 ℃的二氧化碳培养箱内继续分别培养48 h后,取出先离心,后弃去96孔板内的上清培养液,用PBS冲洗2~3次,每孔加人20 μL MTT(四氮唑,5 mg·mL-1,即0.5% MTT)溶液,置于37 ℃的二氧化碳培养箱内继续培养4 h.终止培养,小心吸去孔内培养液.每孔加入150 μL的DMSO,置摇床上低速振荡10 min,使结晶物充分溶解.在酶标仪570 nm测定各孔的吸光OD值.重复3次,根据下式计算药物对瘤细胞的抑制率:
存活率(%)=(实验组平均OD值/对照组平均OD值)×100%.
采用Logit法计算IC50值:
其中,X为最大浓度;I为稀释倍数的对数;P为抑制率的总和;Pm和Pn分别为最大值和最小值.
2 结果与讨论
2.1合成嵌段聚合物
嵌段聚合物Ⅰ是通过RAFT试剂聚合制备的功能化缩醛单体[RAFT∶缩醛单体∶PEG=1∶11∶10],并进一步聚合亲水性的PEG制备而成.由核磁谱图中PEG亚甲基在化学位移δ=3.62~3.85,40H与缩醛单体苯基在化学位移δ=7.33,2H的比为400∶22,说明PEG和缩醛单体的聚合度分别为10和11.嵌段聚合物Ⅱ是由聚合物Ⅰ进一步聚合针对人体宫颈癌特异性识别的叶酸靶向配体获得.由核磁谱图聚合物中PEG亚甲基在化学位移δ=3.62~3.85,40H与叶酸单体杂环氢在δ=8.65,1H的比例为400∶5,说明叶酸单体的聚合度为5.由以上核磁结果表明成功的合成了三嵌段聚合物,其摩尔百分含量以及总分子量见表1.

图3 聚合物Ⅰ(a)和聚合物Ⅱ(b)的核磁谱图

嵌段聚合物PEG/%a叶酸/%aHBA-TMBA/%aMna/(g·mol-1)聚合物Ⅰ49.5-50.51.06×104聚合物Ⅱ40.418.541.11.30×104
注:a用1HNMR测定.
2.2胶束的制备和表征
胶束制备通过溶剂交换法.图4分别为聚合物Ⅱ的动态光散射图(a)和透射电镜照片(b).动态光散射(DLS)测量聚合物Ⅱ形成的胶束平均粒径为106 nm且分布较窄.结果显示透射电镜照片得出的粒径与动态光散射仪的测定值相同.

图4 聚合物Ⅱ动态光散射图(a)和透射电镜照片(b)
2.3聚合物胶束pH引发的降解
聚合物缩醛键的水解是在37 ℃,pH=7.4,10 mmol·L-1磷酸缓冲溶液或pH=5.0,10 mmol·L-1醋酸缓冲溶液中进行的.使用UV/Vis光谱,监测在282 nm处水解产物3,4,5-三甲氧基苯甲酸的特征吸收强度来研究水解率.水解总量可由核磁谱峰面积计算得出:取5 mg 聚合物Ⅰ,Ⅱ分别制成1 mg·mL-1胶束在250 mL缓冲溶液中进行水解,其中所含3,4,5-三甲氧基苯甲酸的含量分别为0.006 5和0.005 3 mg·mL-1,对照标准曲线方程y=0.025 2+81.372 1x(R=0.999 8),可计算出对应的吸光度分别为0.554,0.457.水解和降解总量也可由加入HCl完全水解测定,完全水解后最大吸光度分别为0.540,0.446,与标准曲线所测定值接近,降解总量以加入HCl后值为准.在不同pH 缓冲溶液条件中,随着时间的变化,用紫外吸收光谱测出3,4,5-三甲氧基苯甲酸在282 nm处吸收强度的变化对照标准曲线,测出3,4,5-三甲氧基苯甲酸释放率-时间曲线(图5).在pH=7.4条件下,48 h后聚合物Ⅰ和Ⅱ的降解百分率分别为14.44%和15.02%,在pH=5.0的条件下降解率逐渐增大,最终分别达到97.78%和97.08%.由两种聚合物降解结果显示该聚合物在体内循环过程中(pH=7.4)稳定性较好,而在细胞内体/溶酶体(pH=5.0)条件下近似完全降解.

图5 聚合物pH引发的3,4,5-三甲氧基苯甲酸释放:在pH=7.4 或pH=5.0的3,4,5-三甲氧基苯甲酸释放率-时间曲线
2.4体外控制释放阿霉素
载药胶束DOX的体外模拟释放是在37 ℃下,pH=7.4模拟体内输送环境或pH=5.0模拟胞内体/溶酶体中微酸性环境,使用UV/Vis光谱,监测不同时间在480 nm处释放阿霉素的特征吸收强度来研究阿霉素的释放率.对照阿霉素浓度-吸收强度标准曲线得到阿霉素释放速率-时间曲线(图6).结果表明,聚合物Ⅰ和Ⅱ在pH=7.4时只有18.39%和17.95%的DOX在48 h从DOX的装载胶束释放;在pH=5.0的条件下,DOX在前12 h内释放量分别达到55.80%和57.75%,而在48 h内可达到86.45%和78.87%.结果表明,pH响应性胶束能够在体内稳定运输到靶向部位累积,且有效分解释放药物.
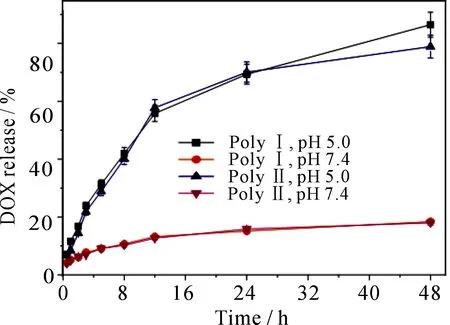
图6 pH响应性聚合物体外模阿霉素拟释放:聚合物Ⅰ和聚合物Ⅱ在 pH=7.4和pH=5.0下阿霉素释放率-时间曲线
2.5细胞毒性和成像
细胞实验结果显示,48 h后聚合物P(HBA-TMOBA)-PEG-PFA和P(HBA-TMOBA)-PEG胶束在浓度低于1 mg·mL-1基本无毒性(细胞的存活率>90%,如图7a).并且制备的载药聚合物胶束对人体宫颈癌(HeLa)细胞有良好的抑制作用,以叶酸为靶向的聚合物对HeLa细胞的抑制作用又强于没有带靶向基团的聚合物.3种药物的抑制作用分别为:聚合物Ⅱ>单独药物>聚合物Ⅰ,同时也可以看到聚合物Ⅱ载药胶束对HeLa细胞IC50(半抑制浓度)为0.64 μg DOX,此值低于以前报道过的公认的酸刺激响应性胶束的IC50(1.38 μg DOX),并且此结果与游离阿霉素的IC50值1.1 μg DOX eq/mL相接近,明显高于其他已经报道的可降解的载药嵌段聚合物胶束的IC50(0.75 μg·mL-1[22],3.2 μg·mL-1[23])说明靶向基团叶酸在聚合物载药系统抑制HeLa细胞的增殖过程中发挥中重要的作用(图7b).

图7聚合物P(HBA-TMOBA)-PEG 和P(HBA-TMOBA)-PEG-PFA对人体宫颈癌(HeLa)细胞毒性(a)和载药胶束和游离阿霉素的抗肿瘤活性(b)
Fig 7In vitro cytoxicity of P(HBA-TMOBA)-PEG and P(HBA-TMOBA)-PEG-PFA to HeLa (a) and anti-tumor activity (b)
3 结论
以Hela细胞受体阳性的叶酸作为主动靶向,以亲水性好且无生物毒性的聚乙二醇(PEG)作为亲水外壳,同时以酸响应性的缩醛单体作为疏水内核.运用RAFT试剂逐步聚合形成两亲性的三嵌段共聚物,在水溶液中自组装成为纳米微胶束.动态光散射仪和透射电镜对所制备胶束的形貌粒径进行了表征,结果显示成良好的球形.负载药物阿霉素模拟体外释放,在正常组织细胞液中仅有14.62%的释放率,而在pH=5.0的条件下78.87%的药物释放.最后细胞实验证明了胶束浓度低于1 mg·mL-1的情况下对细胞无毒性,以及载药后聚合物胶束具有较高的细胞抑制率.这种具有叶酸靶向的酸响应释放的聚合物载药胶束可以成为一种有效的药物化疗方法.
[1]DU Y Z,WENG Q,YUAN H,et al.Synthesis and antitumor activity of stearate-g-dextran micelles for intracellular doxorubicin delivery[J].ACSNano,2010,4:6894.
[2]SMITH L A,CORNELIUS V R,PLUMMER C J,et al.Cardiotoxicity of anthracycline agents for the treatment of cancer:systematic review and meta-analysis of randomised controlled trials[J].BMCCancer,2010,10:337.
[3]NUKOLOVA N V,OBEROI H S,COHEN S M,et al.Folate-decorated nanogels for targeted therapy of ovarian cancer[J].Biomaterials,2011,32:5417.
[4]UPADHYAY K K,BHATT A N,MISHAR A K,et al.The intracellular drug delivery and anti-tumor activity of doxorubicin loaded poly(γ-benzyl lglutamate)-b-hyaluronan polymersomes[J].Biomaterials,2010,31:2882.
[5]PEER D,KARP J M,HONG S,et al.Nanocarriers as an emerging platform for cancer therapy[J].NatNanotechnol,2007,2:751.
[6]XU S,LUO Y,GRAESER R,et al.Development of pH-responsive core-shell nanocarriers for delivery of therapeutic and diagnostic agents[J].BioorgMedChemLett,2009,19:1030.
[7]PARVEEN S,SAHOO S K.Polymeric nanoparticles for cancer therapy[J].DrugTarget,2008,16:108.
[8]PARK T G,JEONG J H,KIM S W.Current status of polymeric gene delivery systems[J].AdvDrugDelivRev,2006,58:467.
[9]MAEDA H,NAKAMURA H,FANG J.The EPR effect for macromolecular drug delivery to solid tumors:improvement of tumor uptake,lowering of systemic toxicity,and distinct tumor imaging in vivo[J].AdvDrugDelivRev,2013,65:71.
[10]BARTLEET D W,SU H,HILDEBTANDT I.Impact of tumor-specific targeting on the biodistribution and efficacy of siRNA nanoparticles measured by multimodality in vivo imaging[J].PNatlAcadSci,2007,104:15549.
[11]YANG B,LV Y,ZHU J.A pH-responsive drug nanovehicle constructed by reversible attachment of cholesterol to PEGylated poly(L-lysine)via catechol-boronic acid ester formation[J].ActaBiomater,2014,10:3686.
[12]CHENG R,MENG F,DENG C,et al.Dual and multi-stimuli responsive polymeric nanoparticles for programmed site-specific drug delivery[J].Biomaterials,2013,34:3647.
[13]WANG M,KIM J C.Light- and temperature-responsive liposomes incorporating cinnamoyl Pluronic F127[J].IntJPharmaceut,2014,468:243.
[14]FAMIN Q,RAMI M,LI Z,et al.Artificial bacterial flagella functionalized with temperature-sensitive liposomes for controlled release[J].SensorActuatBchem,2014,196:,676.
[15]HUANG H,ZHANG X,YU J,et al.Fabrication and reduction-sensitive behavior of polyion complex nano-micelles based on PEG-conjugated polymer containing disulfidebonds as a potential carrier of antitumor paclitaxel[J].ColloldSurfaceB,2013,110:59.
[16]YIN Q,SHEN J,ZHANG Z,YU H,LI Y.Reversal of multidrug resistance by stimuli-responsive drug delivery systems for therapy of tumor[J].AdvDrugDeliverRev,2013,65:1699.
[17]YUAN J,XU W,CHEN J,et al.Dual passively active tumor-targeting micelles for pH-triggered intracellular anticancer drug release[J].BioactiveandCompatiblePolymers:BiomedicalApplications,2014,29:415.
[18]HUANG X,SEVIMLI S I,BULMUS V.pH-labile sheddable block copolymers by RAFT polymeri-zation:synthesis and potential use as siRNA conjugates[J].EurPolymJ,2013,49:2895.
[19]KONSTANTINOS P,RICHARD G,HOLDICH,et al.Synthesis and micellization of a pH-sensitive diblock copolymer for drug delivery[J].IntJPharmaceut,2013,455:5.
[20]HE Y,ZHANG Y,XIAO Y,et al.Dual-response nanocarrier based on graft copolymers with hydrazone bond linkages for improved drug delivery[J].ColloidSurfaceB,2010,80:145.
[21]JOHN T L,DEBBY F,RONALD S.Functional polymers from novel carboxyl-terminated trithiocarbonates as highly efficient RAFT agents[J].Macromolecules,2002,35:6754.
[22]CHEN W,ZHONG P,MENG F,et al.Redox and pH-responsive degradable micelles for dually activated intracellular anticancer drug release[J].JControlRelease,2013,169:171.
[23]CHRISTIE R J,ANDERSON D J,GRAINGER D W.Comparison of hydrazone heterobifunctional cross-linking agents for reversible conjugation of thiol-containing chemistry[J].BioconjugateChem,2010,21:1779.
(责任编辑陆泉芳)
Build of responsive polymer anti-cancer nano-micelles
YUAN Jian-chao1,LUO Wen-bo1,SONG Kai-run1,ZENG Xian-wu2
(1.Key Laboratory of Polymer Materials of Gansu Prorince,College of Chemistry and Chemical Engineering,Northwest Normal University,Lanzhou 730070,Gansu,China;2.Gansu Province Cancer Hospital,Lanzhou 730050,Gansu,China)
The poly(4-methacryloxy-aldehyde benzoate)-polyethylene glycol-poly folic acid [P(HBA-TMOBA)-PEG-PFA]amphiphilic block polymer is prepared.TEM shows that prepared micelles is spherical and particle size is about 106 nm.The in vitro release DOX under physiological conditions is only 14.62% of the doxorubicin release after 48 h,and under the pH=5.0 condition,78.87% of DOX release.Cytotoxicity tests demonstrate polymer P(HBA-TMOBA)-PEG-PFA nano-micelles is non-toxic to normal tissues and has higher activity to human cervical carcinoma(Hela) cells.
pharmaceutical carriers;micelles;folic acid targeting;acetals;cytotoxic
10.16783/j.cnki.nwnuz.2016.04.013
2016-03-02;修改稿收到日期:2016-05-20
国家自然科学基金资助项目(21364011,20964003)
袁建超(1964—),男,山东菏泽人,教授,博士,博士研究生导师.主要研究方向为靶向抗肿瘤高分子药物、金属有机催化和配位聚合、生物高分子材料.E-mail:jianchaoyuan@nwnu.edu.cn
TQ 317.5
A
1001-988Ⅹ(2016)04-0057-07
