我国猪伪狂犬病变异株研究概况
2016-09-01向广韬罗玉子夏水利雷建林仇华吉中国农业科学院哈尔滨兽医研究所黑龙江哈尔滨150069
向广韬 孙 元 罗玉子 夏水利 雷建林 仇华吉(中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨 150069)
我国猪伪狂犬病变异株研究概况
向广韬 孙 元 罗玉子 夏水利 雷建林 仇华吉*
(中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨 150069)
伪狂犬病(Pseudorabies,PR)是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的、严重危害养猪业的一种烈性传染病。在过去的几十年里,我国通过在猪群中广泛使用Bartha-K61 株基因缺失弱毒疫苗,使PR得到了有效控制。但自2011 年以来,在全国范围内,许多Bartha-K61 株疫苗免疫猪群出现了PR疫情。研究证实,该疫情是由PRV变异株引起的,与以往毒株相比,PRV变异株致病性明显增强,且Bartha-K61 株不能对猪只提供完全的免疫保护。目前针对PRV变异株的疫苗正在研制中,其中基因缺失活疫苗能够对当前流行的PRV变异株提供完全的免疫保护,这些疫苗大多处于转基因安全评价阶段。在诊断方法上,已经建立了能够有效区分Bartha-K61 疫苗株、PRV经典强毒株和变异株的三重荧光定量PCR方法。利用安全有效的基因缺失疫苗和配套的鉴别诊断技术,并结合有效的生物安全防控措施,对PR进行净化和根除,是未来必由之路。本文对我国当前PR的流行病学、诊断方法、疫苗研制和防控策略等进行了简述和讨论。
伪狂犬病;新疫情;变异株;疫苗研制;防控
1 伪狂犬病与伪狂犬病病毒
伪狂犬病(Pseudorabies,PR)又称奥耶茨基氏病,是由伪狂犬病病毒(Pseudorabies virus,PRV)引起的猪、羊、牛等多种家畜及野生动物的一种以发热、奇痒(猪除外)、脑脊髓炎、呼吸和神经系统障碍为主要特征的急性传染病[1]。猪是本病的贮存宿主和主要传染源。可通过消化道和呼吸道水平传播,也可通过精液、胎盘垂直传播。不同日龄的猪均可感染,其中妊娠母猪感染后可发生流产、死胎、木乃伊胎;哺乳仔猪感染后出现神经症状、麻痹、衰竭死亡,死亡率几乎高达100%;成年猪感染耐过后多会长期带毒和排毒,成为最危险的传染源,严重影响养猪生产,给PR的净化带来了极大的困难[2,3]。
PRV病毒粒子在电镜下呈圆形或椭圆形,成熟的病毒粒子由内向外依次是核酸、衣壳、皮层以及囊膜[3]。PRV的基因组为双链线性DNA,大小约为143 kb,G + C含量高达73%。其结构上由独特长臂(UL)、独特短臂(US)及US两侧的内部重复序列(IR)和末端重复序列(TR)组成。PRV编码11种糖蛋白,即gI、gK、gL、gH、gB、gE、gD、gG、gC、gM和gN糖蛋白,其中gD、gH、gL、gB和gC糖蛋白是介导病毒粒子吸附到宿主细胞表面和病毒囊膜与细胞膜融合的蛋白[4]。PRV毒力受多个基因编码蛋白的影响,如gE、gI、TK、gB、gC、gD、gH对PRV的毒力具有决定性的作用。
2 伪狂犬病新疫情
Bartha-K61株弱毒疫苗对我国PR的防控起到了关键作用,该疫苗株是将PRV强毒株经猪肾细胞、鸡胚及鸡胚成纤维细胞反复传代致弱所获得[5],后来证实,该疫苗株为基因缺失疫苗(gE和US9基因全部缺失,gI和US2基因部分缺失)[6]。
2011 年以来,我国多个地区相继暴发了PR,至2015年底,我国除少数地区外,均有该病暴发的报道,给我国养猪业造成了严重的经济损失[7]。据报道,具有PR新疫情的猪场大多免疫过Bartha-K61 株弱毒疫苗;gE抗体阳性率较高;在临床上主要表现为妊娠母猪流产、死胎,仔猪发病急、死亡快、死亡率高,个别感染猪还出现了发痒的症状[8-11]。
3 伪狂犬病病毒变异株的鉴定
3.1伪狂犬病病毒变异株的分子特征
此次PR新疫情暴发后,国内多家机构研究证实该疫情是由PRV变异株引起的[9,12-14]。全基因组测序分析证实,与经典的PRV毒株(如Kaplan株和Becker株等)相比,当前流行的PRV变异株多个基因存在突变(主要集中在gI、gE、gH以及间隔区序列);基因进化树分析显示,新的流行毒株处于相对独立的分支,与经典强毒株亲缘关系较远[8,12,15]。
3.2伪狂犬病病毒变异株的致病力
我国多家研究机构分离获得了PRV变异株,并对其致病力进行了研究。与PRV经典毒株相比,新分离的PRV变异株的致病力明显增强,具体表现为,对小鼠的半数致死剂量(LD50)大大降低,如TJ株的LD50为102.3TCID50,JS-2012 株的为102.37TCID50,而SC株(经典毒株)的LD50大于103.0TCID50[11,12]。由于PRV在猪体上的致病力与毒株、感染途径、感染剂量、猪只日龄等有很大的关系,虽然有许多关于PRV变异株在猪体上的致病力的报道,但不能够确定不同PRV变异毒株的毒力是否有差异,但与SC株相比,同等感染条件下,感染PRV变异株的猪只,出现临床症状更早、临床表现和病理剖检变化更严重、死亡率更高,而相近日龄的猪只接种相同剂量的同一PRV毒株时,滴鼻途径对猪只的致死率则明显高于肌注途径[11,12]。当前流行的PRV变异株最主要的特点是,Bartha-K61 株弱毒疫苗免疫猪只不能够抵抗变异株的攻击,表现为免疫猪在攻毒后出现发热、排毒、个别组织器官出现病变[8,11,12,14,16]。不同PRV变异株与经典毒株对猪只的致病力见表1。

表1 不同PRV变异株与经典毒株对猪只的致病力

▼续表1
4 伪狂犬病病毒变异株疫苗的研制
为了控制PR新疫情,多家研究单位致力于新型疫苗的研究,在灭活疫苗和基因缺失活疫苗研制上取得了一定的进展。
4.1灭活疫苗
与活疫苗相比,灭活疫苗更加安全,不需要复杂的转基因安全评价,因此,研究进展较快。目前,国内有3 种针对PRV变异株的灭活疫苗正处于临床评价中。基于能区分野毒感染和疫苗免疫动物(differentiation between infected and vaccinated animals,DIVA)特性考虑,灭活疫苗所用毒株一般都进行了基因(主要是gE和gI基因)缺失,如vZJ01△gE/gI株[17]、vPRVHN1201△gE株[18]和JS-2012-△gI/gE株[19]。评价结果显示,这些疫苗安全(接种仔猪和母猪后无任何不良反应)、能够诱导产生针对变异株的中和抗体,并且能够保护猪只抵抗PRV变异株的攻击[19]。但是基于综合评估,此类疫苗应用前景不是很乐观,如免疫剂量大、成本高、诱导的细胞免疫反应不及活疫苗、不能阻止排毒。因此,弱毒疫苗或基因缺失活疫苗是防控变异株PR流行的主要工具,也是疫苗研制的重点。
4.2基因缺失活疫苗
PRV变异株活疫苗基本上都是基因缺失标记疫苗,缺失的基因大多是主要毒力基因如gI、gE和TK基因。相继报道的双基因缺失活疫苗有rPRVTJ-delgE/gI[10]、JS-2012-△gE/gI[19],三基因缺失活疫苗有rSMX△gI/gE△TK[16]、vPRVHN1201TK-/gE-/gI-[21]和rPRVTJ-delgE/gI/TK[22]。本团队研究结果显示,双基因缺失疫苗在日龄较大的仔猪上较为安全,对新生仔猪及小鼠和绵羊仍有一定的毒力;相比而言,三基因缺失疫苗无论是在绵羊、小鼠还是仔猪上均有非常高的安全性[22]。免疫效力评价结果显示,无论是双基因缺失疫苗还是三基因缺失疫苗,都能够使免疫猪完全抵抗致死性PRV变异株的攻击[16,22]。基于不同PRV变异株的疫苗免疫效力见表2。
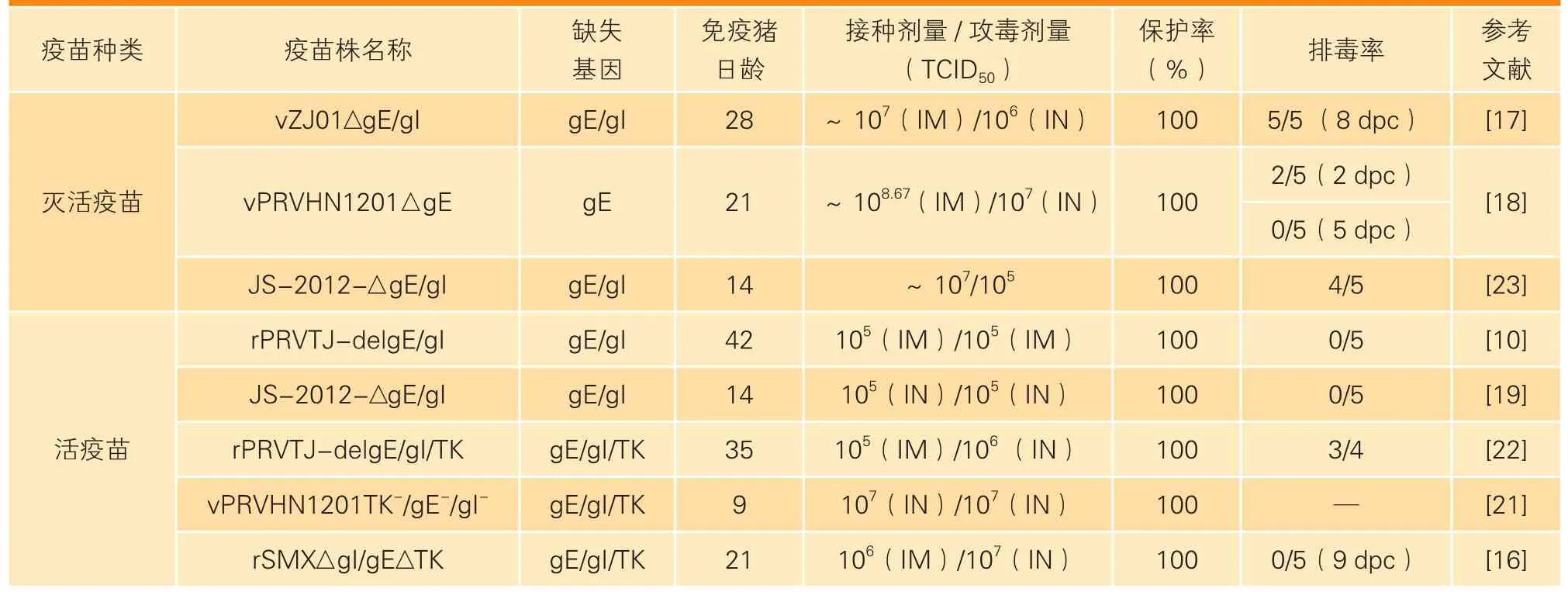
表2 基于不同PRV变异株的疫苗对猪只的免疫效力
5 检测方法
目前,对于当前流行的PR的诊断,主要还是基于gE/gI抗体的ELISA和基于特定基因的PCR检测以及病毒分离鉴定。ELISA方法操作简单,能够对大批量的样品进行高通量、快速的检测,适用于疫情监测和流行病学调查。同样简便易行的还有胶体金免疫层析技术(GICA),GICA是一种固相标记免疫检测技术,可将抗原抗体的免疫学反应结果直接在固相载体上显示出来,据此研制的检测试纸条可实现快速准确的检测,非常适合于现场检测。但ELISA和GICA方法不能检测到PRV强毒早期感染和潜伏感染,而PCR方法可达到此目的[24]。其中由本团队建立的三重荧光定量PCR方法能够对Bartha-K61株弱毒疫苗、PRV经典强毒株和当前流行毒株进行区分[25]。目前使用的PRV血清学方法(包括gE-ELISA)仍然可以用于变异株的检测。
6 防控策略
尽管Bartha-K61 株等现行伪狂犬病疫苗不能对PRV变异株提供完全免疫保护,但还是可以提供一定交叉保护,因此适当增加免疫次数,可以提高抗体水平,减少感染和排毒。一旦出现PR疫情,可以用现行疫苗实施紧急预防接种。对于PRV变异株野毒阳性场,应当坚决淘汰PRV带毒公猪(杜绝输入PRV阳性精液);对新生仔猪实行1~3 日龄滴鼻免疫,并于70~90 日龄进行加强免疫;通过适当增加免疫频次(每年3~4 次),逐步减少gE阳性母猪的比例,待阳性率降至10%以下时,可以开始实施全群净化措施。另外要在全场实行灭鼠、灭蚊、灭蝇行动,禁止猫狗等宠物出入,减少病毒的传播。有条件的猪场可以试用基于PRV变异株的基因缺失疫苗。
7 结语和展望
对于我国新出现的PRV变异毒株,不同团队都证实其与以往毒株不同,在遗传进化树上处于独立的分支,其抗原性出现了变异,在基因水平和氨基酸水平上出现了突变。PRV变异株疫苗研究以基因缺失活疫苗为主,尤其是三基因缺失疫苗,此类疫苗安全,且能够对当前流行的PRV变异株提供完全的保护,但该类疫苗进展缓慢,大多处于转基因安全评价当中。在诊断方法的研制上,三重荧光定量PCR方法能够对Bartha-K61 株弱毒疫苗、PRV经典强毒株和当前流行毒株进行区分。这些研究对PRV变异株致病机制、疫苗研制、综合防控及净化等方面的研究提供了良好的基础。
对于我国PR的防控和净化,安全高效的基因缺失活疫苗及与之配套的鉴别诊断方法将会起到至关重要的作用。另外,科学合理的生物安全防控措施也是不可忽视的。相信在政府部门、科研工作者、生物制品生产单位及养殖户的共同努力下,我国PR的净化乃至根除是可望实现的。
[1] Marcaccini A, López Peña M, Quiroga MI, et al. Pseudorabies virus infection in mink: a hostspecific pathogenesis[J]. Veterinary Immunology and Immunopathology, 2008, 124(3-4):264-273.
[2]Schoenbaum MA, Beran GW, Murphy DP. Pseudorabies virus latency and reactivation in vaccinated swine[J]. American Journal of Veterinary Research, 1990, 51(3):334-338.
[3]Pomeranz LE, Reynolds AE, Hengartner CJ. Molecular biology of pseudorabies virus: impact on neurovirology and veterinary medicine[J]. Microbiology and Molecular Biology Reviews, 2005, 69(3):462-500.
[4]Nauwynck HJ. Functional aspects of Aujeszky's disease (pseudorabies) viral proteins with relation to invasion, virulence and immunogenicity[J]. Veterinary Microbiology, 1997, 55(1-4):3-11.
[5]McFerran JB, Dow C. Experimental Aujeszky's disease (pseudorabies) in rats[J]. British Veterinary Journal, 1970, 126(4):173-179.
[6]Szpara ML, Tafuri YR, Parsons L, et al. A wide extent of inter-strain diversity in virulent and vaccine strains of alphaherpesviruses[J]. PLoS Pathogens, 2011, 7(10):e1002282.
[7]Sun Y, Luo Y, Wang CH, et al. Control of swine pseudorabies in China: Opportunities and limitations[J]. Veterinary Microbiology, 2016, 183:119-124.
[8]An TQ, Peng JM, Tian ZJ, et al. Pseudorabies virus variant in Bartha-K61-vaccinated pigs, China, 2012[J]. Emerging Infectious Diseases, 2013, 19(11):1749-1755.
[9]Wu R, Bai C, Sun J, et al. Emergence of virulent pseudorabies virus infection in northern China[J]. Journal of Veterinary Science, 2013, 14(3):363-365.
[10]Wang CH, Yuan J, Qin HY, et al. A novel gE-deleted pseudorabies virus (PRV) provides rapid and complete protection from lethal challenge with the PRV variant emerging in Bartha-K61-vaccinated swine population in China[J]. Vaccine, 2014, 32(27):3379-3385.
[11]Tong W, Liu F, Zheng H, et al. Emergence of a Pseudorabies virus variant with increased virulence to piglets[J]. Veterinary Microbiology, 2015, 181(3-4):236-240.
[12]Luo Y, Li N, Cong X, et al. Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China[J]. Veterinary Microbiology, 2014, 174(1-2):107-115.
[13]Yu X, Zhou Z, Hu D, et al. Pathogenic pseudorabies virus, China, 2012[J]. Emerging Infectious Diseases, 2014, 20(1):102-104.
[14]Gu Z, Hou C, Sun H, et al. Emergence of highly virulent pseudorabies virus in southern China[J]. Canadian Journal of Veterinary Research, 2015, 79(3):221-228.
[15]Ye C, Guo JC, Gao JC, et al. Genomic analyses reveal that partial sequence of an earlier pseudorabies virus in China is originated from a Bartha-vaccine-like strain[J]. Virology, 2016, 491:56-63.
[16]Hu RM, Zhou Q, Song WB, et al. Novel pseudorabies virus variant with defects in TK, gE and gI protects growing pigs against lethal challenge[J]. Vaccine, 2015, 33(43):5733-5740.
[17]Gu Z, Dong J, Wang J, et al. A novel inactivated gE/gI deleted pseudorabies virus (PRV) vaccine completely protects pigs from an emerged variant PRV challenge[J]. Virus Research, 2015, 195:57-63.
[18]Wang T, Xiao Y, Yang Q, et al. Construction of a gE-deleted pseudorabies virus and its efficacy to the new-emerging variant PRV challenge in the form of killed vaccine[J]. Biomed Research International, 2015, 2015:684945.
[19]Tong W, Li G, Liang C, et al. A live, attenuated pseudorabies virus strain JS-2012 deleted for gE/gI protects against both classical and emerging strains[J]. Antiviral Research, 2016, 130:110-117.
[20]Yang QY, Sun Z, Tan FF, et al. Pathogenicity of a currently circulating Chinese variant pseudorabies virus in pigs[J]. World Journal of Virology, 2016, 5(1):23-30.
[21]Zhang C, Guo L, Jia X, et al. Construction of a triple gene-deleted Chinese Pseudorabies virus variant and its efficacy study as a vaccine candidate on suckling piglets[J]. Vaccine, 2015, 33(21):2432-2437.
[22]Cong X, Lei JL, Xia SL, et al. Pathogenicity and immunogenicity of a gE/gI/TK gene-deleted pseudorabies virus variant in susceptible animals[J]. Veterinary Microbiology, 2016, 182:170-177.
[23]李国新, 童武, 郑浩, 等. 猪伪狂犬病毒变异毒株的特性及其疫苗的研究现状[J]. 猪业科学, 2016, 33(1):52-53.
[24]马力, 杨丽梅, 徐倩倩, 等. 猪伪狂犬病病毒gE蛋白在野毒诊断中的应用进展[J]. 中国畜牧兽医, 2014, 41(2): 249-253.
[25]Meng XY, Luo Y, Liu Y, et al. A triplex real-time PCR for differential detection of classical, variant and Bartha-K61 vaccine strains of pseudorabies virus[J]. Archives of Virology, 2016, 161(9):2425-2430.
S858.28
A
1673-4645(2016)08-0010-05
2016-06-20
仇华吉,huajiqiu@hvri.ac.cn
