NADPH氧化酶抑制剂apocynin对力竭运动大鼠运动性蛋白尿的影响*
2016-09-01陈丽娜侯少华
陈丽娜,周 刚,吴 乐,侯少华
(湖南大学体育学院,长沙 410082)
NADPH氧化酶抑制剂apocynin对力竭运动大鼠运动性蛋白尿的影响*
陈丽娜,周刚△,吴乐,侯少华
(湖南大学体育学院,长沙 410082)
目的:研究 NADPH氧化酶抑制剂apocynin对力竭运动大鼠运动性蛋白尿产生的影响及其机制。方法:32只SD雄性大鼠随机分为安静对照组(C组)、对照+药物组(CA组)、力竭运动组(E组)、力竭运动+药物组(EA组)。药物注射按10 mg/kg体重,每天一次,连续3 d,并在末次药物注射1 h后进行一次性跑台力竭运动。测定运动后尿UP、血液BUN水平、肾脏ROS浓度、NOS活性、NOS与3-NT蛋白含量。结果:结果显示,E组UP、肾脏ROS、iNOS含量及活性、3-NT明显升高,而EA组的这些指标与C组相比无显著性差异。结论:力竭运动可明显增加肾组织NADPH氧化酶活性,从而产生大量的ROS,后者可迅速地与由肾脏iNOS催化生成的NO反应,产生过量的ONOO-,诱发运动性蛋白尿的生成。
NADPH氧化酶;运动性蛋白尿;活性氧;过氧亚硝基阴离子;一氧化氮
自1877年Vonleub首次报告士兵行军和野营训练后出现蛋白尿以来,运动性蛋白尿的研究已有一百多年的历史。关于运动性蛋白尿产生的机制,从氧自由基角度进行的研究越来越受关注。来自动物实验和人体实验的报告已证明运动导致的氧应激诱发了运动性蛋白尿的产生,然而,促使运动性蛋白尿生成的活性氧(reactive oxygen species,ROS)的来源及其后续作用途径并不清楚。
NADPH氧化酶是机体细胞ROS生成的最重要途径之一。在病理条件下,肾脏NADPH氧化酶活性增加,促使肾组织ROS生成增加。已有研究表明,NADPH氧化酶诱导的ROS也是运动性蛋白尿生成的重要途径[1]。组织中过量生成的ROS可与NO反应生成过氧亚硝基阴离子(peroxynitrite,ONOO-),而ONOO-是比O2-更强的氧化剂,它可以介导更强的氧化应激损伤。已有报道运动性蛋白尿生成时ONOO-增加[2],但尚不清楚运动性蛋白尿伴随的ONOO-生成是否依赖于NADPH氧化酶生成的ROS。本研究通过大鼠力竭跑台运动构建运动性蛋白尿模型,对大鼠尾部注射NADPH氧化酶抑制剂apocynin,研究NADPH氧化酶依赖的ONOO-途径对运动性蛋白尿生成的影响。
1 材料与方法
1.1实验动物
SD雄性大鼠32只,体重240~260 g,购于湖南斯莱克景达实验动物有限公司,许可证号SCXK(湘)2013-0004。分笼饲养,每笼4只,室温环境为20-25℃,自由饮食、饮水,自然昼夜变化光照。
1.2实验分组及处理方法
32只大鼠随机分为4组,每组8只,分别为安静对照组(C组)、对照+药物组(CA组)、力竭运动组(E组)、力竭运动+药物组(EA组)。
运动模型根据Kocer[1]的实验改进,采用中等强度一次性力竭跑台运动,具体运动强度参照Bedford[3]等人对大鼠最大摄氧量的研究。ZH-PT跑台,购于淮北正华生物仪器设备有限公司。动物购入后饲养3 d,然后E组和EA组进行3 d跑台适应性运动,5 m/min,每天1次,无坡度。正式运动时以5 m/min开始,每5 min增加5 m,直至增加到25 m/min,无坡度,持续运动至力竭,在整个运动过程中用电刺激进行强迫运动,电刺激强度小于1 mA。经实验统计,大鼠在力竭运动的时间平均在90~120 min之间,观察到大鼠汗毛竖起,四肢瘫软,眼神无光,翻转后无法进行翻正反射,电刺激无法继续运动即为达到力竭状态。
力竭运动前两天开始各组大鼠进行尾部静脉注射,其中CA组、EA组注射NADPH氧化酶抑制剂apocynin,购于Sigma-aldrich,STBD7270V。注射剂量为10 mg/kg体重,每天1次,连续3 d;C组、E组注射同等剂量的生理盐水。E组和EA组在末次注射1 h后开始一次性力竭运动测试。
1.3样本的采集与处理
1.3.1血液采集一次性力竭运动后,立刻乙醚麻醉,用5 ml一次性无菌注射器左心室取血,即刻测定血尿素氮(BUN)。
1.3.2尿的取样用微量注射器抽取膀胱尿液,随即检测尿总蛋白浓度。
1.3.3肾组织的取样迅速取出左右两肾,置于冰上去除脂肪及结缔组织,生理盐水冲洗余血,并用滤纸吸干水分,密封保存在-80℃超低温冰箱中以备匀浆。称取肾组织1 g左右放于冰上剪碎,按1 mg∶5 μl的比例加入PBS匀浆液(PH 7.4,mmol/L,磷酸5、蔗糖250、EDTA 0.1、PMSF 1和DTT 1),匀浆后分装两个离心管,一管以3 000 r/min,离心10 min,取上清液分装后-80℃保存,用于ROS、NOS活性、蛋白定量测定;另一管以12 000 r/min,离心10 min,取上清液继续离心10 min后取上清液分装-80℃保存,用于神经型一氧化氮合酶(nNOS)、诱导型一氧化氮合酶(iNOS)、内皮型一氧化氮合酶(eNOS)、硝基酪氨酸(3-NT)蛋白测定。
1.4指标的测定
尿蛋白浓度(UP):CBB法测定,试剂盒购于南京建成生物工程研究所。血尿素氮(BUN):比色法测定,试剂盒购于南京建成生物工程研究所。
肾活性氧(ROS):采用荧光探针(DCFH-DA)检测[4],试剂购于碧云天生物技术研究所。96孔板中测定孔每孔加入200 μl肾组织匀浆液,及100 μmol/L NADPH(对照孔加入等量SOD)和10 μmol/L DCFH-DA,混匀,37℃恒温孵育30 min,多功能酶标仪检测,激发波长485 nm,发射波长525 nm。
肾NOS活性:采用荧光探针法(DAF-2DA)检测nNOS、iNOS、eNOS活性[4],试剂均购于碧云天生物技术研究所。96孔板中测定孔每孔加入20 μl肾组织匀浆液,然后分别加入含NOS抑制剂(nNOS抑制剂Spermidine,iNOS抑制剂1400W,eNOS抑制剂L-NAME)的PBS 100 μl,再每孔加入100 μl DAF-2DA PBS(μmol/L L-arginine,2 mmol/L Ca2+,1 μmol/L DAF-2 DA),37℃恒温孵育60 min,多功能酶标仪检测,激发波长485 nm,发射波长525 nm。
肾NOS、磷酸甘油醛脱氢酶(GAPDH)、3-NT蛋白:蛋白免疫印迹法(Western blot)检测肾脏nNOS、iNOS、3-NT蛋白含量,以GAPDH做内参。GAPDH抗体购于杭州贤至生物科技有限公司,nNOS、iNOS、eNOS、二抗抗体购于武汉博士德生物工程有限公司,3-NT抗体购于美国Sigma-aldrich公司。
肾组织蛋白定量:采用BCA蛋白浓度测定法,试剂盒购于碧云天生物技术研究所。
1.5统计学处理
2 结果
2.1力竭运动对大鼠尿蛋白、血尿素氮的影响
由表1可见,通过一次性力竭运动,E组的尿蛋白浓度约是C组的3倍(P<0.01),EA组UP与E组相比下降明显(P<0.05),表明一次性力竭运动可明显导致运动性蛋白尿生成增加,而NADPH氧化酶抑制剂apocynin也明显抑制了UP生成。


GroupUP(mg/L)BUN(mg/dl)C74.63±14.924.18±1.34CA60.37±8.344.04±0.20E228.16±40.26**##7.00±1.97*#EA161.39±24.75△7.47±1.45*#
C:Control group;CA:Control apocynin group;E:Exercise group;EA:Exercise apocynin group
*P<0.05,**P<0.01 vs C;#P<0.05,##P<0.01 vs CA;△P<0.05 vs E
2.2力竭运动对肾组织ROS的影响
由图1可见,一次性力竭运动后,E组肾脏ROS与C组相比明显升高(P<0.05),提示力竭运动可明显增加肾脏ROS生成;EA组较E组ROS生成量亦显著性降低(P<0.05),表明apocynin明显抑制了NADPH氧化酶活性,导致ROS生成明显减少。
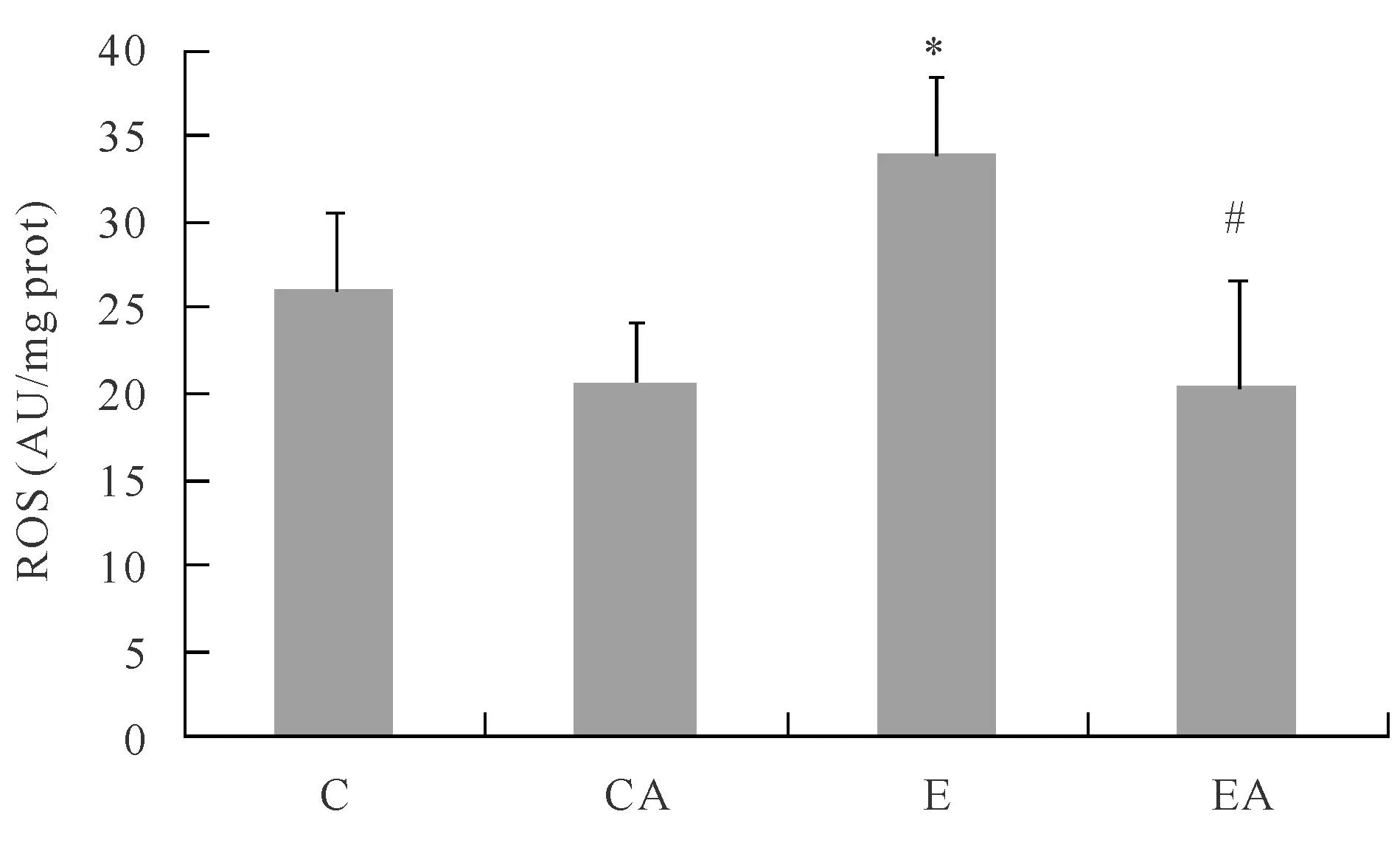

C:Control group;CA:Control apocynin group;E:Exercise group;EA:Exercise apocynin group
*P<0.05 vs C;#P<0.05 vs E
2.3力竭运动对肾NOS的影响
肾组织的一氧化氮合酶(NOS)有nNOS、iNOS和eNOS三种亚型。分别用Spermidine,1400W和L-NAME抑制NOS的活性,检测到E组和EA组肾iNOS活性较C组明显增加(P<0.05),而nNOS和eNOS的活性未见变化。同时,Western blot测定肾NOS蛋白,也仅见E组和EA组肾iNOS蛋白表达明显增加(P<0.05),而nNOS和eNOS未见变化。力竭运动后iNOS蛋白表达与活性的变化见图2。
2.4力竭运动对肾ONOO-生成的影响
过氧亚硝酸阴离子ONOO-具有很强的氧化性,可使蛋白质中的酪氨酸硝基化。ONOO-在机体内产生后迅速消失,不易检测,但可以通过检测其反应的产物3-硝基酪氨酸(3-NT)来推测其生成量。由图3可见,E组较C组肾3-NT生成量显著增加(P<0.01),而EA组与E组相比明显降低(P<0.05),说明一次性力竭运动明显造成ONOO-生成量增加,而注射NADPH氧化酶抑制剂apocynin可减少ONOO-的生成。

Fig.2Effects of exhaustive exercise on iNOS protein expression and activity
C:Control group;CA:Control apocynin group;E:Exercise group;EA:Exercise apocynin group
*P<0.05 vs C;#P<0.05 vs CA

Fig.3Effects of exhaustive exercise on renal 3-NT generation
C:Control group;CA:Control apocynin group;E:Exercise group;EA:Exercise apocynin group
**P<0.01 vs C;#P<0.05 vs E
3 讨论
安静时正常人体的尿液中只有极微量的蛋白随肾脏随尿排出,但在急性的剧烈运动或长期过度训练情况下,由于肾小球通透性增大,超出了肾小管的重吸收能力,导致运动性蛋白尿发生[5]。本研究采用了中等强度的跑台力竭运动,大鼠力竭时间约在90~120 min。从大鼠力竭后膀胱抽取的尿液检测到,力竭运动组尿蛋白含量较安静组上升了近2倍(P<0.01),同时,血BUN水平也明显升高(P<0.05)。
造成力竭运动后尿蛋白增加的原因,可能与运动引起的肾脏缺血/再灌注引起的肾功能受损有关。运动时,骨骼肌血流量增加,而肾血流量急剧减少,并随运动过程的持续和强度递增表现得更加明显。由于肾血流量的下降,肾小球的滤过率随之下降,但滤过分数反而上升,这反而有利于血浆蛋白进入到原尿中。并且,肾脏在缺血一段时间后,血液再灌注时氧分子重新进入组织内,反而使缺血造成的肾功能损伤加剧[6]。此外,在运动性蛋白尿增加的同时,由于肾功能受损,肾小球滤过率减少,尿素的清除率减低,致使这些含氮的产物在体内蓄积而潴留,血中非蛋白含量增高,尿素排出量减少,血中尿素增加[7]。
3.1力竭运动导致的蛋白尿依赖于NADPH氧化酶途径生成的ROS
相关研究表明,肾脏的缺血/再灌注与肾脏组织ROS的生成有密切的联系[6],力竭运动可导致肾脏的氧化损伤,并进一步导致了蛋白尿的形成[1]。然而,诱导运动性蛋白尿生成的ROS的来源及其后续的作用机制并不清楚。
近年来,一些学者提出运动引起的骨骼肌以外组织的ROS增加源于NADPH氧化酶[1]。在肾脏中,NADPH氧化酶成分大量表达在肾血管、肾小球系膜、足细胞致密斑、厚升支段、远端小管和集合管内。在生理状态下,这些细胞的NADPH氧化酶活性很低,而各种生长因子、细胞因子、高血糖和脂质代谢障碍的刺激可使此酶激活,产生ROS[8],作为信号传递分子或自由基的来源导致氧化损伤[9]。apocynin是一种NADPH氧化酶的强抑制剂。有研究表明apocynin可以降低NADPH氧化酶活性,抑制氧化应激,减少微量蛋白尿的分泌,延缓肾脏病进展,在糖尿病肾病中具有保护作用[10]。本研究采用apocynin来抑制NADPH氧化酶活性,结果提示一次性力竭运动可明显增加肾组织ROS的生成,而注射apocynin的力竭运动组由于apocynin抑制了肾组织中NADPH氧化酶活性,使ROS的生成减少。因此,可以认为,力竭运动诱导的肾组织ROS生成增加,与NADPH氧化酶活性增加有关。
本研究参照了Kocer的力竭运动模型。在Kocer的研究中发现,运动性蛋白尿模型的跑台力竭运动明显造成大鼠肾脏脂质过氧化产物和NADPH氧化酶活性增加,而给大鼠连续4天注射diphenyleneiodonium chloride(DPI,一种NADPH氧化酶的抑制剂),力竭运动后大鼠肾脏NADPH氧化酶活性受抑制,ROS生成量减少,蛋白尿生成也随之减少。推测肾脏NADPH氧化酶活性的增高可能源于力竭运动诱发的中性粒细胞或巨噬细胞对肾组织的浸润,也可能是运动期间肾脏组织增加的自由基激活了位于肾小球的NADPH氧化酶[1]。
总之,本研究与Kocer等的研究结果均观察到,抑制肾脏NADPH氧化酶活性可以消除力竭运动导致的肾脏氧应激的发生,并防止运动性蛋白尿的生成。这些研究结果表明,NADPH氧化酶活性的增加,是力竭运动导致肾脏ROS增加的一个重要来源,是诱发运动性蛋白尿的重要途径。为了了解NADPH氧化酶产生的ROS的后续作用,即ROS是如何进一步诱导运动性蛋白尿生成的,本研究从ONOO-途径进行了进一步研究。
3.2力竭运动诱导肾脏ONOO-生成
在NO存在的情况下,O2-.可与NO反应生成ONOO-。ONOO-具有很强的强氧化性和硝基化作用,可硝基化蛋白质中酪氨酸残基并生成3-NT,并能改变酶活性、造成线粒体损伤及细胞凋亡。
由于ONOO-在体内的半衰期极短,因此研究中常选择ONOO-的生物标志物3-NT来推测ONOO-生成量。3-NT的检测已被广泛地运用于肾脏疾病的研究。在运动模型的研究中,李丽、田振军等的研究均推测过度训练导致肾脏产生过量NO可迅速与O2-.反应,结合生成ONOO-,并进一步造成肾组织的过氧化损伤[11]或直接造成DNA损伤[12]。然而,前述推测国内并未见实证研究。本研究通过Western blot检测到了力竭运动后肾脏3-NT的变化,显示一次性力竭运动可明显增加大鼠肾组织3-NT表达(P<0.01),而力竭运动+药物组大鼠与力竭运动组相比3-NT表达明显降低(P<0.05),提示力竭运动可导致肾组织ONOO-增加,而通过apocynin抑制NADPH氧化酶活性后,ONOO-生成减少,说明前述力竭运动导致的NADPH氧化酶途径生成的ROS参与了肾组织ONOO-的生成。并且,NADPH氧化酶途径的ROS生成量、ONOO-生成量与尿蛋白的生成保持同步变化,提示ONOO-的过量生成也可能是运动性蛋白尿形成的诱导因素。
Gülsen等[2]采用大鼠连续5 d的跑台力竭运动,在末次运动24 h之后,检测到力竭组大鼠尿液中蛋白质和糖类均显著增加,同时肾曲小管部位ONOO-显著增加。作者认为,肾小球和肾小管是力竭运动导致蛋白质、糖类及类固醇排泄增加的敏感区域,ONOO-也可能主要产生于这些部位。来自离体的肾缺血/再灌注的研究发现,小剂量的ONOO-可能对肾功能产生生理保护效应,而应用大剂量的ONOO-灌注,尿钠排泄显著增多,提示ONOO-对肾小管的重吸收功能有损伤作用[13]。运动性蛋白尿形成与肾小管的重吸收能力不足有关[5],因此力竭运动时肾脏产生的过量ONOO-也可能损伤了肾小管的重吸收功能,从而导致蛋白尿的发生。
为进一步了解力竭运动导致肾脏ONOO-生成增加的NO的来源,本研究对力竭运动大鼠肾脏中三种NOS蛋白(nNOS、iNOS、eNOS)及其活性均进行了检测,结果未检测到nNOS和eNOS蛋白表达及其活性有变化,而无论是力竭组还是力竭+药物组,均显示iNOS蛋白表达明显增加(P<0.05),并且,与之相一致的是iNOS活性也见明显增高(P<0.05)。可以认为,力竭运动通过激活肾脏iNOS蛋白表达及其活性,使肾脏组织内NO生成增多。董静梅[14]也证明了过度训练可激活NADPH氧化酶活性,iNOS生成增多,ROS产生增加,并通过补充谷氨酰胺可抑制NADPH氧化酶活性,减少ROS生成。
有研究表明,在肾脏缺血/再灌注过程中,可引起肾iNOSmRNA表达上调,iNOS表达增多,而力竭运动所致的血液重新分配即可诱发肾脏缺血/再灌注。Evans研究发现,肾小球cNOS蛋白含量在缺血/再灌注1 h后明显增高,而肾小管iNOS活性在5 h后表达明显,iNOS活性增强后生成过量的NO导致肾组织器官损伤,而这一机制可能与ONOO-的生成有关[15]。田振军等在一项不同强度的大鼠跑台训练的研究中发现,在运动状态下,NOS的3种亚型的表达均呈增高趋势,且运动强度越大,生成的NO越多,对肾脏的损伤也越大。结果表明,不同强度运动引起NOS在肾脏皮质区的表达与缺血/再灌注可诱导其表达的情形相一致,表明运动状态下NOS 在肾脏的表达类似于肾脏缺血/再灌注损伤。并进一步推测肾脏皮质区过量生成的NO与O2-.反应生成更强氧化性的ONOO-[10]。
综上所述,力竭运动可明显增加肾组织NADPH氧化酶活性,从而产生大量的O2-.,后者可与主要由肾脏iNOS催化生成的NO反应,产生大量的ONOO-,进而引起运动性蛋白尿的生成。
[1]Kocer G,Sentürk UK,Kuru O,et al.Potential sources of oxidative stress that induce postexercise proteinuria in rats[J].J Appl Physiol,2008,104(4):1063-1068.
[2]?ner G,Cirrik S.The nephrotoxicity risk in rats subjected to heavy muscle activity[J].J Sports Sci Med,2009,8(3):481-488.
[3]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[4]Zhou G,Kamenos G,Pendem S,et al.Ascorbate protects against vascular leakage in cecal ligation and puncture-induced septic peritonitis[J].Am J Physiol Regul Integr Comp Physiol,2012,302(4):R409-416.
[5]Poortmans JR.Evidence of increased glomerular permeability to proteins during exercise in healthy men[J].Contrib Nephrol,1988,68:136-140.
[6]傅晓龙,刘洪珍.运动性肾组织氧化损伤与抗氧化能力[J].中国临床康复,2006,10(36):123-125.
[7]王岩,吴任宏,陶洪涛.过度运动与肾脏损伤的机制探讨[J].现代预防医学,2013,40(17):3003-3006.
[8]钟林娜,黄国良,冯敏,等.缬沙坦对人肾小球系膜细胞糖基化终产物受体表达的影响[J].中国应用生理学杂志,2011,27(3):338-342.
[9]何丽娟.西藏胡黄连提取物对糖尿病肾病大鼠的肾脏保护作用[D].南方医科大学,2008.
[10]Joy KL,Rajeshkumar NV,Kuttan G,et al.Effect of Picrorrhiza kurroa extract on transplanted tumours and chemical carcinogenesis in mice[J].J Ethnopharmacol,2000,71(1-2):261-266.
[11]李丽,常波.过度训练导致大鼠运动性蛋白尿机制的研究[J].西安体育学院学报,2007,24(3):80-83.
[12]田振军,孟辕丽.不同强度运动对大鼠肾脏皮质区NOS、Bcl-2/Bax表达的影响[J].陕西师范大学学报,2006,34(2):105-109.
[13]王新良,陈晓玲,王佩薇,等.肾缺血再灌注后大鼠肾组织一氧化氮的代谢研究[J].昆明医学院学报,2005,26(3):59-63.
[14]董静梅,陈佩杰.二联苯碘合并谷氨酰胺干预对过度训练引起的中性粒细胞功能的调控及机制研究[J].中国应用生理学杂志,2013,29(4):339-344.
[15]Evans RG,Fitzgerald SM.Nitric oxide and superoxide in the renal medulla:a delicate balancing act[J].Curr Opin Nephrol Hypertens,2005,14(1):9-15.
Effect of NADPH oxidase inhibitor apocynin on the exercise induced proteinuria in rats
CHEN Li-na,ZHOU Gang△,WU le,HOU Shao-hua
(College of Sport,Hunan University,Changsha 410082,China)
Objective:To investigate the effect of NADPH oxidase inhibitor apocynin on exercise-induced proteinuria and its related mechanism.Methods:Thirty-two SD rats were randomly divided into the control group(group C),control + drug group(group CA),exhaustive exercise group(group E),exhaustive exercise + drug group(group EA).The rats were administrated apocynin at 10 mg/kg weight,once a day for three days,and one hour after the drug injection,a one-time exhaustive exercise was performed.After exhaustive exercise,urine protein,blood urea nitrogen(BUN),and kidney reactive oxygen species(ROS)concentration,NOS activity,NOS and 3-NT concentration were detected.Results:In comparison to control group urinary protein(UP),ROS,inductible nitric oxide synthase(iNOS),3-NT levels increased significantly in group E while those in group EA did not change.Conclusion:The elevated renal NADPH oxidase activity by exhaustive exercise induced ROS that can rapidly react with NO,and then produces excess peroxynitrite,which contributes to occurrence of exercise-induced proteinuria.
NADPH oxidase;exercise-induced proteinuria;reactive oxygen species(ROS);peroxynitrite(ONOO-);nitric oxide
湖南省自然科学基金资助(12JJ3093)
2015-05-25
2015-11-11
△Tel:13548644844;E-mail:zg460@126.com
G804.5
A
1000-6834(2016)02-116-05
10.13459/j.cnki.cjap.2016.02.006
