脾源性酪氨酸激酶基因启动子甲基化与髓母细胞瘤细胞侵袭转移的关系*
2016-09-01吉海龙史鹏飞毛天明罗永康周开宇
吉海龙,史鹏飞,周 洁,毛天明,罗永康,陈 茜,周开宇△
(1.温州医科大学附属第一临床学院,浙江 温州 325000;2.浙江省台州学院医学院,台州 318000;3.浙江省台州市立医院神经外科,台州 318000;4.浙江省台州市立医院病理科,台州 318000)
脾源性酪氨酸激酶基因启动子甲基化与髓母细胞瘤细胞侵袭转移的关系*
吉海龙1,史鹏飞1,周洁2,毛天明3,罗永康3,陈茜4,周开宇1△
(1.温州医科大学附属第一临床学院,浙江 温州 325000;2.浙江省台州学院医学院,台州 318000;3.浙江省台州市立医院神经外科,台州 318000;4.浙江省台州市立医院病理科,台州 318000)
目的:探讨甲基化转移酶抑制剂5-氮杂-2-脱氧胞苷(5-aza-CdR)抑制脾源性酪氨酸激酶(Syk)基因启动子的甲基化后对髓母细胞瘤Daoy细胞侵袭转移能力的影响。方法:用甲基化转移酶抑制剂5-aza-CdR处理体外培养的髓母细胞瘤Daoy细胞,通过甲基化特异性PCR(MSP)、Real time-PCR、Western blot及Transwell实验方法分别检测不同浓度5-aza-CdR处理后髓母细胞瘤Daoy细胞中脾源性酪氨酸激酶(Syk)基因启动子区甲基化、mRNA表达、蛋白表达及细胞穿膜数的变化。结果:髓母细胞瘤Daoy细胞中Syk基因启动子存在过甲基化,与对照组比较,经不同浓度5-aza-CdR处理后,其Syk基因启动子区甲基化受到不同程度抑制,Syk mRNA的表达量最高上调(3.40±0.24)倍(P<0.01);Syk蛋白的表达量最高上调(3.23±0.19)倍(P<0.01);细胞侵袭及转移能力降低(P<0.05),差异有统计学意义。结论:髓母细胞瘤Daoy细胞中Syk基因启动子甲基化导致其表达下调,可能是髓母细胞瘤发生转移的机制之一;而甲基化转移酶抑制剂5-aza-CdR可抑制其启动子区的甲基化,使Syk的表达水平上调,抑制肿瘤细胞侵袭及转移能力。
髓母细胞瘤;脾源性酪氨酸激酶(Syk)基因;甲基化;5-氮杂-2-脱氧胞苷;侵袭转移
髓母细胞瘤(medulloblastoma,MB)是一种儿童最常见的颅内恶性肿瘤,其治疗手段主要包括手术切除和术后放化疗,随着手术技巧与放化疗策略的逐步改进,患者的5年生存率有所提高,但仍有相当一部分患者死于肿瘤的早期复发和转移,而放化疗所带来的严重的认知障碍、生长发育迟滞、血液系统抑制及内分泌系统紊乱等后遗症,使大部分存活者饱受折磨。近年来随着对MB发生发展的分子生物学研究的深入,分子靶向治疗引起人们的重视。相对传统的术后放化疗,分子靶向治疗药物毒性低,更有针对性,产生的后遗症也较少。但面临的首要问题是MB发病的分子机制尚未完全明确。WHO将MB分为Ⅵ级:经典型(classic medulloblastoma)、促纤维增生/结节型(desmoplastic/nodular medulloblastoma,D/N)、广泛结节形成型(medulloblastoma with extensive nodularity,MBEN)、大细胞型(large cell medulloblastoma)和间变型(anaplastic medulloblastoma),其中大细胞型和间变型预后最差,统称为LC/A型。部分学者为更好的解释患者预后差异,从基因与分子水平将MB进一步分为Wnt型、SHH型、Group 3和Group 4四种类型[1]。这四种类型在发病年龄、临床表现、预后等方面都有明显区别,相较传统病理分型,新的分型可以更好的反映出了肿瘤的生物学行为和恶性程度,也为分子靶向治疗药物的寻找提供了更明确的方向。
脾源性酪氨酸激酶(spleen tyrosine kinase,Syk)是一种蛋白酪氨酸激酶,在适应性免疫受体信号途径有重要的作用,还参与调节其他多种生物功能,包括细胞粘附、固有免疫识别、破骨细胞成熟、血小板激活及血管形成等[2]。自从Syk首次被发现与乳腺癌的侵袭性相关,具有抑癌作用后,Syk作为一个具有抑癌作用的蛋白酪氨酸激酶成为研究热点。现已有大量研究表明[2,3],在多种恶性肿瘤中Syk基因都存在启动子区的甲基化,导致其表达降低或缺失,从而影响肿瘤的发生发展、恶性程度、侵袭转移及预后等。而Syk与MB的发生发展及其生物学行为的关系尚不明确。本研究将探讨Syk在MB中是否存在甲基化及其与MB侵袭转移的关系。
1 材料与方法
1.1材料
髓母细胞瘤Daoy细胞购自美国ATCC公司;甲基化转移酶抑制剂5-氮杂-2-脱氧胞苷(5-aza -2-deoxycytidine,5-aza-CdR)购自Sigma公司;RNA抽提试剂Trizol购自Invitrogen公司;兔抗人Syk单克隆抗体(D3Z1E)购自Cell Signaling公司;兔抗人GAPDH抗体购自杭州贤至生物科技有限公司;辣根过氧化物酶标记的羊抗兔IgG二抗购自北京索来宝生物科技有限公司;胎牛血清、DMEM培养基及PBS缓冲液购自Gibco公司;EZ DNA Methylation-GoldTMKit(D5005)购自ZYMO Research公司;2×Taq PCR MasterMix、SYBR Green实时荧光定量PCR试剂盒、cDNA第一链合成试剂盒及甲基化特异性PCR试剂盒均购自北京天根生化科技有限公司;DNA提取试剂盒购自凯基生物公司;Transwell小室(3422,孔径8.0 μm,直径6.5 mm)购自Corning公司;Matrigel Basement Membrane Matrix 购自美国BD公司。
1.2细胞培养与药物处理
髓母细胞瘤Daoy细胞接种于含10%胎牛血清、1×105U/L青霉素及1×105U/L链霉素的DMEM培养液中(pH7.2),在37℃、含5%CO2湿润空气的恒温密闭式培养箱中培养,待细胞贴壁至80%~90%时,用胰蛋白酶消化后按5×104cells/ml每瓶接种于25 cm2的培养瓶中,待细胞完全贴壁后,用含有不同浓度的5-aza-CdR(0.1 μmol/L、1 μmol/L、10 μmol/L)的培养液给细胞换液,继续培养72 h后收集细胞。
1.3DNA提取及MSP(甲基化特异性PCR)
以PBS漂洗细胞两次后胰酶消化,将细胞混悬液转移至离心管中离心收集细胞,按DNA提取试剂盒说明书,以离心吸附柱法提取细胞基因组DNA。按照EZ DNA Methylation-Gold KitTM试剂盒操作步骤对提取的DNA样品进行处理,使未甲基化的的胞嘧啶转化为胸腺嘧啶。简述如下:取DNA样品20 μl,加入130 μl CT Conversion Reagent,98℃加热10 min,64℃处理2.5 h,转移到一个Zymo-Spin IC管中,再加入600 μl M-Binding Buffer,10 000×g离心30 s;加100 μl M-Wash Buffer,12 000×g离心30 s;加入200 μl M-Desulphonation Buffer,室温放置15~20 min;12 000×g离心30 s后加入200 μl M-Wash Buffer 12 000×g离心30 s,并重复一次;将10 μl M-Elution Buffer 直接加到吸附柱基质中并12 000×g离心30 s洗脱DNA。修饰后的DNA于-20℃保存。采用巢式PCR对甲基化和非甲基化序列进行扩增。巢式PCR反应各引物序列及反应条件参照Yuan[6]等文献。反应结束后,取5 μl产物经2.5%琼脂糖凝胶电泳、EB染色后在凝胶分析系统检测并分析。
1.4RT-PCR
按Trizol试剂说明书操作提取经不同浓度5-aza-CdR处理后的细胞总RNA,并用紫外分光光度计测定其A260/A280,比值在1.8~2.1之间为符合纯度要求。以琼脂糖凝胶电泳检测18 S和28 S以观察其完整性。按cDNA第一链合成试剂盒说明书进行逆转录反应合成cDNA,反应体系20 μl:取各处理组细胞总RNA 2 μl,oligo(dT)15 2 μl,Super Pure dNTPs(2.5 mmol/L each)2 μl,RNase-Free ddH2O定容至14.5 μl,70℃加热5 min后迅速冰上冷却2 min,简短离心后加入4 μl 5×First-Strand Buffer(含DTT),0.5 μl Rnasin,加入1 μl(200U)TIANScript M-MLV,42℃温浴50 min,95℃加热5 min终止反应,置于冰上,用RNase-Free ddH2O将反应体系稀释至50 μl。参照实时荧光定量PCR试剂盒说明书,分别加入2 μl上述cDNA溶液,2.5×RealMasterMix/20×SYBR Solution混合反应液9 μl,正反向引物(10 μmol/L)各0.5 μl,加ddH2O定容至20μl。置于美国Applied Biosystems公司的Step One Real-Time PCR 仪中进行反应。Real-time PCR以GAPDH基因为内参照。Syk引物序列为:F:5’-CATGTCAAGGATAAGAA-3’,R:5’-AGTTCACCACGTCATAGTAGTAATT-3’;GAPDH引物序列为:F:5’-CATCAGCAATGCCTCCTGCAC-3’,R:5’-TGAGTCCTTCCACGATACCAAAGTT-3’。结果用相对定量法(Comparative Delta-delta Ct)计算。
1.5Western blot
将不同浓度5-aza-CdR处理后的细胞分别用5 ml预冷的PBS液漂洗两次后各加入250 μl预冷的RIPA裂解液,置于冰上20 min使其充分裂解细胞。将细胞裂解液转移至1.5 ml EP管中,4℃,12 000 r/min离心5 min,取上清,用BCA法检测蛋白浓度。于样品中加入5×SDS凝胶电泳上样缓冲液,100℃变性10 min。制作10%分离胶和5%浓缩胶的SDS-聚丙烯酰胺凝胶,按药物浓度由低到高的顺序加样进行电泳分离,然后将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭1 h,一抗4℃孵育过夜,二抗室温孵育1 h,ECL发光液反应5 min,置于曝光仪中进行检测。每个样本重复3次。实验以GAPDH蛋白表达水平作为内参照,利用图像分析软件对各条带进行分析,以Syk蛋白条带与GAPDH条带的比值作为Syk蛋白的相对表达量。
1.6细胞体外侵袭实验
Matrigel从-20℃取出,4℃解冻后置于冰上,以0℃预冷的无血清DMEM培养基将matrigel稀释至50 mg/L,按每孔50 μl加入Transwell小室的上室,超净台内风干过夜。使用前每孔加入100 μl含1%BSA的无血清DMEM培养液,37℃静置1 h后吸去小室内液体备用。将经0.1 μmol/L、1 μmol/L、10 μmol/L的5-aza-CdR处理72 h的Daoy细胞制成3.0×105cells/ml的细胞悬液,每孔200 μl加入Transwell小室的上室,下室加入500 μl含10%胎牛血清的DMEM培养液。置于细胞培养箱培养24 h后,将Transwell小室取出,以90%乙醇固定15 min,0.1%结晶紫染色5 min,自来水漂洗5 min,然后用棉签将小室滤膜上室面的细胞及Matrigel小心拭去,将小室置于33%醋酸溶液中洗涤10 min以脱色,取洗脱液于紫外分光光度计测570 nm处吸光度值,实验重复3次,取平均值。
1.7细胞体外迁移实验
实验中Transwell小室的上室面无Matrigel包被,穿膜时间设定为12 h,其余操作与细胞侵袭实验相同。
1.8统计学分析
2 结果
2.1Syk基因启动子区甲基化情况
甲基化特异性PCR产物电泳检测发现,髓母细胞瘤Daoy细胞Syk基因启动子区存在甲基化,经甲基化转移酶抑制剂5-aza-CdR处理后,Syk基因的甲基化被抑制(图1)。

Fig.1MSP was carried out to detect Syk gene promotor methylation status of Daoy cell line
MSP:Methylation specific PCR;ME:Methylated;UM:Unmethylated;M:DL2000 Marker;1-3:Drug groups;4-6:Control groups
2.25-aza-CdR对髓母细胞瘤Daoy细胞中Syk mRNA表达的影响
髓母细胞瘤Daoy细胞经不同浓度的5-aza-CdR处理不同时间后,分别提取各组细胞总RNA,合成cDNA后进行Real-time PCR,结果用相对定量法2-ΔΔCt计算,未经药物处理的细胞Syk表达量按100%计算。Real-time PCR结果显示(表1),与对照组相比,药物组的mRNA表达量明显增加,且该作用具有时间-浓度依赖性。
2.35-aza-CdR对髓母细胞瘤Daoy细胞中Syk蛋白表达的影响
未经药物处理的细胞作为对照组,经不同浓度药物处理后的细胞作为处理组,GAPDH蛋白量作为内参照。Western blot检测结果见图2。软件分析结果显示,与对照组比较,经浓度分别为0.1 μmol/L、1 μmol/L和10 μmol/L的5-aza-2-CdR处理72 h后,Syk蛋白相对表达量分别为1.97±0.15(P<0.05)、2.37±0.24(P<0.01)和3.23±0.19(P<0.01)。
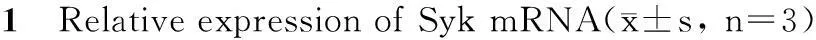
Tab.
RT-PCR was carried out to determine the relative expression of Syk mRNA after treatment with different concentration of 5-aza-2-CdR(0.1 μmol/L,1 μmol/L and 10 μmol/L)for 24 h,48 h and 72 h.mRNA of GAPDH was used as internal control
RT-PCR:Real-time PCR
**P<0.01 vs control;#P<0.05,##P<0.01 vs 24 h;△P<0.05 vs 48 h
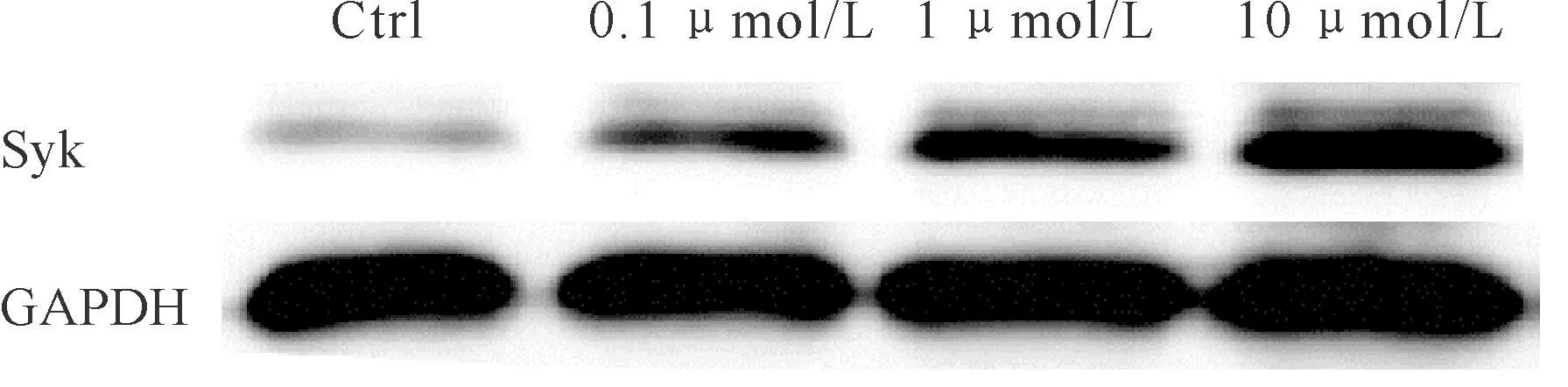
Fig.2Western blot analysis of Syk expression in Daoy cell line using the anti-sykmAb GAPDH was used as internal control
2.45-aza-CdR对髓母细胞瘤Daoy细胞侵袭和迁移能力的影响
Transwell侵袭和迁移是以穿过人工基底膜和聚酯碳酸膜的细胞数量表示细胞侵袭和运动能力的大小。实验结果表明,与对照组相比,经不同浓度5-aza-2-CdR处理72 h的细胞,其侵袭和迁移能力均降低,且呈现一定的浓度依赖性(表2)。
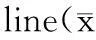

5-aza-2-CdRAvalueofinvasionAvalueofmigrationControl0.376±0.0150.493±0.0140.1μmol/L0.359±0.0130.474±0.0181.0μmol/L0.238±0.018*0.324±0.021*10μmol/L0.143±0.021**0.220±0.017**
*P<0.05,**P<0.01 vs control
3 讨论
表观遗传学改变与肿瘤发生和发展密切相关,这些改变包括抑癌基因的过甲基化、原癌基因的低甲基化以及基因印记丢失等。DNA的甲基化一直是表观遗传学研究的一个热点,其在功能上与DNA突变一样可导致基因功能缺失,但两者的不同在于,DNA的甲基化修饰是可以被抑制的,如果能够抑制其甲基化,那么原本因甲基化而沉默的基因将会重新表达。而5-aza-CdR作为一种甲基化转移酶抑制剂,是第一个被美国FDA批准用于治疗恶性肿瘤的去甲基化药物,主要用于骨髓增生异常综合征的治疗[4]。一项体外实验[5]显示5-aza-CdR联合DZNep、TSA共同作用于人AML细胞后表现出了明显的协同抗肿瘤的作用。这些都表明5-aza-CdR作为临床抗肿瘤药物有着较好的应用前景。
Syk是一种非受体型酪氨酸蛋白激酶,最初被认为是造血细胞特有的信号分子,并且在淋巴细胞成熟和免疫细胞活化中起着重要作用[2]。而随后的研究表明,Syk与多种肿瘤的增殖、转移及患者的预后都有密切关系[3],从而引起国内外的广泛关注。Sada[6]等研究发现,Syk的表达缺失会导致免疫细胞发育、成熟障碍,从而引起机体免疫监测功能下降,对突变或异常增生的细胞失去免疫力,最终导致肿瘤的发生。Yuan[7]等研究发现,乳腺癌中Syk基因启动子区5’端CpG岛的甲基化是其表达沉默的重要机制之一,而甲基化转移酶抑制剂5-aza-2-CdR可以使其重新表达。多项研究发现,Syk在多种恶性肿瘤中都发挥着抑癌基因的作用。如在结直肠癌[8]、非小细胞肺癌[9]及胰腺癌[10]中,Syk抑制肿瘤侵袭转移且与患者预后和生存率呈正相关性。
本研究以髓母细胞瘤Daoy细胞为研究对象,旨在探讨Syk在髓母细胞瘤中是否存在过甲基化现象及其与髓母细胞瘤侵袭转移的关系。结果发现,Syk基因在髓母细胞瘤Daoy细胞中存在启动子区的过甲基化,导致其表达水平明显降低。用甲基化转移酶抑制剂5-aza-2-CdR处理细胞后,Syk在mRNA和蛋白水平的表达均显著增加(P<0.01);同时,髓母细胞瘤Daoy细胞的侵袭及迁移能力则明显降低(P<0.05)。实验结果表明Syk对髓母细胞瘤Daoy细胞的侵袭及迁移能力有明显的抑制作用,其作用的IC50值分别为7.7 μmol/L与8.5 μmol/L。Syk基因启动子甲基化导致其表达下调可能在髓母细胞瘤发生侵袭转移的分子机制中起着一定的作用。
Carter[11]等研究认为,Syk是一个与癌基因HER2/neu的功能相反的抑癌基因,Syk通过抑制HER2/neu基因的收缩血管内皮细胞的作用,来抑制肿瘤细胞的转移。Layton[10]等研究发现,胰腺癌中Syk表达缺失会导致CD171的表达上调,而CD171可以诱导侵袭转移相关基因的表达,并且能增强体外培养细胞的侵袭和迁移能力。他们推测因Syk表达缺失而导致基因表达的“链式变化”,最终引起了肿瘤表型变化。张[12]等研究表明,5-aza-2-CdR可降低全基因组甲基化水平,这意味着原本由于甲基化而表达受抑制的某些癌基因也会因此而重新表达,因此如何寻找更具针对性的去甲基化药物也是一个尚待解决的难题。目前为止,Syk基因的的具体作用及其所涉及的信号通路仍不清楚。Syk基因的表达缺失是多因素的,甲基化只是其机制之一,而且究竟是甲基化的发生促进了肿瘤的发生发展,还是肿瘤的形成引发了甲基化,这些问题都需要继续深入的研究来解决。
本研究表明,在体外细胞水平,Syk在髓母细胞瘤Daoy细胞中发挥着一定的抑癌基因的作用,主要表现为抑制肿瘤细胞的侵袭性生长及远处转移,而在临床实体肿瘤的发生与发展中是否存在Syk基因启动子的过甲基化和表达水平下调,及其作用如何,需进一步研究以明确。
[1]Taylor MD,Northcott PA,Korshunov A,et al.Molecular subgroups of medulloblastoma:the current consensus[J].Acta Neuropathol,2012,123(4):465-472.
[2]Mócsai A,Ruland J,Tybulewicz VL.The SYK tyrosine kinase:a crucial player in diverse biological functions[J].Nat Rev Immunol,2010,10(6):387-402.
[3]Coopman PJ,Mueller SC.The Syk tyrosine kinase:a new negative regulator in tumor growth and progression[J].Cancer Lett,2006,241(2):159-173.
[4]Momparler RL,CØté S,Momparler LF,et al.Epigenetic therapy of acute myeloid leukemia using 5-aza-2'-deoxycytidine(decitabine)in combination with inhibitors of histone methylation and deacetylation[J].Clin Epigenetics,2014,6(1):19.
[5]Issa JP,Kantarjian HM,Kirkpatrick P.Azacitidine[J].Nat Rev Drug Discov,2005,4(4):275-276.
[6]Sada K,Takano T,Yanagi S,et al.Structure and function of Syk protein-tyrosine kinase[J].J Biochem,2001,130(2):177-186.
[7]Yuan Y,Mendez R,Sahin A,et al.Hypermethylation leads to silencing of the Syk gene in human breast cancer[J].Cancer Res,2001,61(14):5558-5561.
[8]Yang Z,Huo L,Chen H,et al.Hypermethylation and prognostic implication of Syk gene in human colorectal cancer[J].Med Oncol,2013,30(2):586-588.
[9]Peng C,Sun Q,Hao Y,et al.Syk is low-expressed in non-small-cell lung cancer and inversely correlates with patient's survival[J].Acta Biochim Biophys Sin,2013,45(2):149-151.
[10]Layton T,Stalens C,Gunderson F,et al.Syk tyrosine kinase acts as a pancreatic adenocarcinoma tumor suppressor by regulating cellular growth andinvasion[J].Am J Pathol,2009,175(6):2625-2636.
[11]Carter WB,Hoying JB,Boswell C,et al.HER2/neu over expression induces endothelial cell retraction[J].Int J Cancer,2001,91(3):295-299.
[12]张楹恬,田卫平,梅玫.miR-21与DNA甲基化在不同乳腺癌细胞中的相互作用[J].中国应用生理学杂志,2015,31(3):220-224.
The relationship between hypermethylation of Syk gene promoter and medulloblastoma cell invasion and metastasis
JI Hai-long1,SHI Peng-fei1,ZHOU Jie2,MAO Tian-ming3,LUO Yong-kang3,CHEN Xi4,ZHOU Kai-yu1△
(1.The First Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000;2.Taizhou University Medical School,Taizhou 318000; 3.Department of Neurosurgery,Zhejiang Taizhou Municipal Hospital,Taizhou 318000; 4.Department of Pathology,Zhejiang Taizhou Municipal Hospital,Taizhou 318000,China)
Objective:To investigate the effect of demethylation of Syk gene promoter by the methylation transferase inhibitor 5-aza-CdR on the invasion and metastasis of medulloblastoma cell line Daoy.Methods:Medulloblastoma cell line Daoy was treated with 5-aza-CdR in vitro.Methylation-specific PCR,real time-PCR and Western blot were used to detect Syk gene promoter methylation status,Syk mRNA and protein expression respectively.Transwell was employed to study the invasion and metastasis of medulloblastoma cell line Daoyby counting the cells that had invaded through Matrigel and migrated to the undersurface of the membrane before and after treatment of 5-aza-CdR.Results:In comparison to control group,Syk gene promoter of 5-aza-CdR-treated groups was demethylated and expression of Syk mRNA and protein was significantly up-regulated by 3.40±0.24 folds(P<0.01)and 3.23±0.19 folds(P<0.01)respectively.The invasiveness and metastasis of medulloblastoma cell line Daoy was decreased(P<0.05).Conclusion:Hypermethylation of Syk gene promoter is responsible for the down-regulation of Syk gene expression in medulloblastoma cell line Daoy,which may be one of the mechanisms that enhanced cell invasion and metastasis.While 5-aza-CdR can reverse the hypermethylation of Syk gene promoter and restore Syk gene expression and thus suppresses invasiveness and metastasis of tumor cells.
medulloblastoma;Syk gene;methylation;5-aza-CdR;invasion and metastasis
台州市科技局科技计划资助项目(14SF05);浙江省中医药管理局科技计划资助项目(2013ZA133,2015ZB133)
2015-11-02
2015-12-09
△Tel:13957680507;E-mail:kerry2000year@163.com
R-3
A
1000-6834(2016)02-132-05
10.13459/j.cnki.cjap.2016.02.010
