宫颈癌组织中HSG、Ki67表达观察
2016-08-31李昌红车玲玉宋丹阳白云
李昌红,车玲玉,宋丹阳,白云
(华北理工大学生命科学学院,河北唐山063000)
宫颈癌组织中HSG、Ki67表达观察
李昌红,车玲玉,宋丹阳,白云
(华北理工大学生命科学学院,河北唐山063000)
目的观察宫颈癌组织中细胞增殖抑制基因(HSG)和增殖细胞核抗原(Ki67)的表达变化。方法采用免疫组织化学的方法检测72例宫颈癌组织,51例CIN(CINⅠ级27例、CINⅡ级10例、CINⅢ级14例),25例正常宫颈组织中HSG、Ki67的表达。结果宫颈癌组织、CINⅠ组织、CINⅡ组织、CINⅢ组织、正常宫颈组织中HSG阳性表达率分别为20.83%、44.44%、30.00%、28.75%和60%(15/25);Ki67阳性表达率分别为88.89%、51.85%、60%.00、85.71%和48.00%。宫颈癌组织中HSG阳性表达率低于CINⅠ组织、正常宫颈组织(P均<0.05);Ki67阳性表达率高于CINⅠ组织、CINⅡ组织、正常宫颈组织(P均<0.01)。HSG、ki67表达与宫颈癌临床分期和分化程度有关(P均<0.05),与患者年龄、病理类型及淋巴转移情况无关(P均>0.05)。结论宫颈癌组织中HSG阳性表达率降低,Ki67阳性表达率升高,HSG、Ki67的异常表达可能与宫颈癌的发生发展有关。
宫颈癌;细胞增殖抑制基因;线粒体融合蛋白2;增殖细胞核抗原
在女性生殖系统恶性肿瘤中,宫颈癌的发病率和病死率居第二位,严重威胁患者生命。细胞增殖抑制基因(HSG)又称线粒体融合蛋白2(Mfn2),定位于人1号染色体短臂36.22,此区域易发生基因突变,出现异位或缺失[1]。HSG常存在于线粒体外膜,与线粒体的融合功能有关,对维持线粒体正常形态和功能有重要作用[2,3]。增殖细胞核抗原(Ki67)是一种DNA结合蛋白,参与细胞合成代谢功能,与多种肿瘤的发病有关。目前,国内外未见HSG在宫颈癌中的相关研究报道。我们观察了宫颈癌组织中HSG、Ki67的表达变化,探讨HSG、Ki67在宫颈癌发生发展中的作用。
1 材料与方法
1.1宫颈病变组织标本来源收集2010年7月~2015年7月华北理工大学附属医院妇科手术切除的宫颈癌组织标本72例、CINⅠ组织标本27例、CINⅡ组织标本10例、CINⅢ组织标本14例、正常宫颈组织标本25例。宫颈癌患者中,FIGO分期Ⅰ期32例、Ⅱ期19例、Ⅲ~Ⅳ期21例。四类标本来源、患者年龄等临床资料差异无统计学意义。
1.2试剂与仪器兔抗人HSG单克隆抗体购自美国Santa Cruz公司,鼠抗人Ki67多克隆抗体、SP-9001免疫组化染色试剂盒购自北京中杉金桥生物技术有限公司,OLYMPUS光学显微镜华北理工大学提供。
1.3HSG、Ki67检测采用免疫组化法。将脱蜡完全的标本进行抗原修复,暴露抗原决定簇,过氧化氢溶液除去内源性氧化酶;滴加一抗Ki67,置于4 ℃的冰箱中过夜;将5 μL的HSG与1 000 μL的稀释液均匀混合配制成二抗(HSG),置于4 ℃冰箱中过夜;DAB显色剂显色,用蒸馏水洗去DAB显色剂,然后进行脱水,风干;中性树脂封片,封片完成后在显微镜下观察。HSG阳性表达为细胞质中出现棕黄色颗粒;Ki67阳性表达为细胞核出现棕色颗粒;计算阳性细胞百分比,0~5%为阴性,>5%~10%为弱阳性,>10%~60%为阳性,>60%为强阳性,弱阳性~强阳性判定为蛋白表达阳性。
1.4统计学方法采用SPSS13.0统计软件。计数资料采用χ2检验及Fisher′s检验。P<0.05为差异有统计学意义。
2 结果
2.1宫颈病变组织及正常宫颈组织中HSG、ki67的表达变化宫颈癌组织、CINⅠ组织、CINⅡ组织、CINⅢ组织、正常宫颈组织中HSG阳性表达率分别为20.83%(15/72)、44.44%(12/27)、30.00%(3/10)、28.75%(4/14)和60.00%(15/25);Ki67阳性表达率分别为88.89%(64/72)、51.85%(14/27)、60.00%(6/10)、85.71%(12/14)和48.00%(12/25)。宫颈癌组织中HSG阳性表达率低于CINⅠ组织、正常宫颈组织(P均<0.05);Ki67阳性表达率高于CINⅠ组织、CINⅡ组织、正常宫颈组织(P均<0.01)。
2.2HSG、Ki67表达与宫颈癌临床病理参数的关系HSG、Ki67表达与宫颈癌临床分期和分化程度有关(P均<0.05),与患者年龄、病理类型及淋巴转移情况无关(P均>0.05)。见表1。
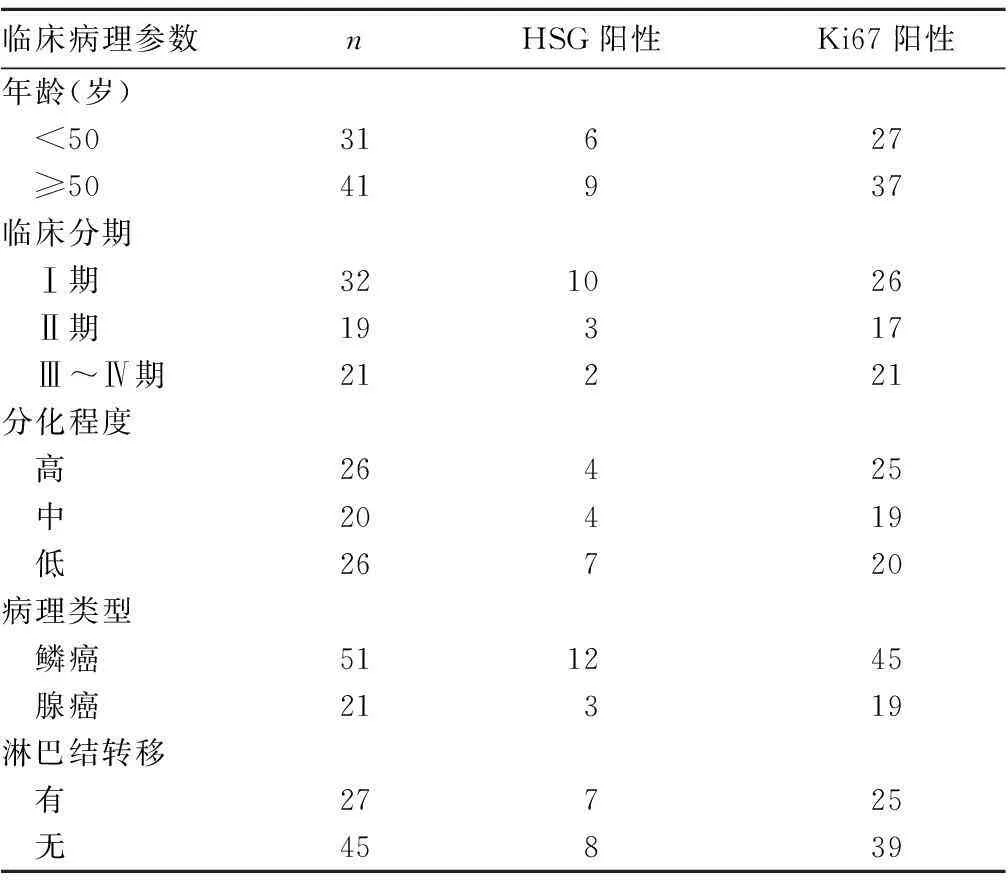
表1 HSG/Mfn、Ki67表达与宫颈癌临床病理参数的关系(例)
3 讨论
宫颈癌的发生发展是非常复杂的病变过程,与多种抑癌基因表达、调控密切相关[4]。HSG是一种由75个氨基酸组成的、具有抑制细胞增殖作用的融合蛋白,也是一种高度保守的跨膜GTP酶。HSG可使多种肿瘤传代细胞系的细胞周期停滞在G0/G1期,诱导细胞凋亡;能抑制ras蛋白,调节ERK/MARP通路,控制线粒体融合[5];HSG还参与调节多种生理病理过程[6],如细胞信号转导、能量代谢、增殖及凋亡等[7]。目前认为HSG基因在肿瘤中的作用是促进肿瘤细胞凋亡并抑制肿瘤细胞增殖[8]。本研究结果显示,HSG在宫颈癌组织中的阳性表达率低于正常宫颈组织和CIN组织,且与宫颈癌临床分期、分化程度有关,提示HSG低表达的宫颈癌恶性程度更高、侵袭能力更强,其在宫颈癌的浸润和转移方面起着重要作用[9]。HSG是潜在的抑癌基因,具有抗肿瘤效应,也是一种潜在的生物标志物[10],可能有助于宫颈癌的早期诊断或预后判断。
Ki67是一种增殖细胞相关的核蛋白质,它有提示细胞增殖活跃程度的作用,在宫颈癌及CINⅢ存在异常活跃的细胞增殖群体,且在CINⅡ以上的级别越高,细胞增殖越活跃。Ki67在细胞增殖中也不可或缺[11],作为细胞增殖标记物,Ki67起作用于增殖周期中的人类细胞,其半衰期短检测结果明显优于半衰期长的,能较全面的反映细胞群体的增殖活性,因此Ki67在恶性肿瘤中常呈高表达[12]。Ki67在细胞增殖的各期(G1、S、G2和M)中均有表达,但在细胞静止期G0期不表达。在病理报告中的指数高低与许多肿瘤分化程度、浸润、转移及预后密切相关。已有研究[13]显示,Ki67与乳腺癌等多种肿瘤的发生、发展、分级、分期、预后等密切相关。Ki67还被认为是反映宫颈癌细胞增殖活性的敏感、准确的生物学指标[14]。此外,Ki67的表达水平也有助于肿瘤患者预后评价及治疗方案的制定[15,16]。本研究中,Ki67在宫颈癌组织中高表达,在CIN组织中的阳性表达率随级别增高而增高,这与雷蕾[17]、徐秋霞等[18]研究结果一致,提示随着宫颈病变程度的加重,Ki67表达逐渐增强,细胞增殖活性增大,最终导致宫颈癌的发病。我们还发现,Ki67在宫颈癌组织中的表达与临床分期和分化程度有关,Ki67的表达水平与宫颈癌病情和患者预后密切相关。
结合上述研究结果,我们认为,HSG和Ki67的异常表达可能参与了宫颈癌的发病,并可能成为宫颈癌诊断和预后判断的参考指标。关于HSG和Ki67在宫颈癌发生发展中的具体作用机制及两者之间的相互作用仍需进一步研究。
[1] Hofmann WK,Takeuchi S,Xie D,et al.Frequent loss of heterozygo-sity in the region of D1 S450 at lp36.2 in myelidysplastic syndromes[J].Leuk Res,2001,25(5):855-858.
[2] Rojo M,Legros F,Chateau D,et al.Membrane topology andmito-chondrial targeting ofmitofusins,ubiquitous mammalian homologs of the transmembrane GTPase Fzo[J].Cell Sci,2002,115(8):1663-1674.
[3] Eura Y,Ishihara N,Yokota S,et al.Twomitofusin proteins,mam-malian homologues of FZO,with distinct functions are both required formitochondrial fusion[J].J Biochem,2003,134(3):333-344.
[4] Sehnal B,Driák D,Neumannová H,et al.Prevalence of anal human papillomavirus infection among women and its relation to cervical HPV infection[J].Ceska Gynekol,2012,77(3):210-214.
[5] Chen KH,Guo X,Ma D,et al.Dysregulation of HSG triggers vascular proliferative disorders [J].Nat Cell Biol,2004,6(9):872-883.
[6] Ma LI,Chang Y,Yu L,et al.Pro-apoptotic and anti-proliferative effects of mitofusin-2 via PI3K/Akt signaling in breast cancer cells[J].Oncol Lett,2015,10(6):3816-3822.
[7] Zhang Y,Jiang L,Hu W,et al.Mitochondrial dysfunction during in vitro hepatocyte steatosis is reversed by omega-3 fatty acid-inducedup-regulation of mitofusin[J].Metabolism,2011,60(6):767-775.
[8] Li PT,Zhu SY,Wu XP,et al.Association of Polymorphisms inMitofusin-2 Gene with Type 2 Diabetes in Han Chinese[J].J Bio Med Biotechnol,2012,42(7):1-7.
[9]邓秀娟,吴海根.Ki67、PTEN在卵巢浆液性肿瘤中的表达及临床意义[J].实用癌症杂志,2011,26(4):365-371.
[10] Sebastian D,Hernandez-Alvarez MI,Segales J,et al.Mitofusin 2(Mfn2)links Mitochondrial and endoplasmic reticulum function with insulin signaling and is essential for normal glucose homeostasis[J].Proc Natl Acad Sci U S A,2012,109(14):5523-5528.
[11] 刘嵘,濮德敏,祝达,等.uPA、Ki67和VEGF在宫颈癌组织中的表达及相关性研究[J].华中科技大学学报(医学版),2014,43(5):516-519.
[12] 黄宇,胡晓桦,刘志辉.Ki-67表达与鼻咽癌、乳腺癌化疗疗效及预后的临床分析[J].中华临床医师杂志,2013,7(2):641-645.
[13] 常丽琴,吴素慧.Ki67、Sur vivin在早期宫颈癌中的表达与预后相关性分析[J].中国医药科学,2013,3(7):20-22.
[14] Aller R,De Luis DA,Izaola O,et al.Role of -55CT polymorphism of UCP3 gene on non alcoholic fatty liver disease and insulin resistance in patients with obesity[J].Nutr Hosp,2010,25(4):572-576.
[15] Zhang GE,Jin HL,Lin XK,et al.Anti-Tumor Effects of Mfn2 in Gastric Cancer[J].Int J Mol Sci,2013,14(7):13005-13021.
[16] Misko A,Jiang S,Wegorzewska I,et al.Mitofusin 2 is necessary for transport of axonal mitochondria and interacts with the Miro/Milton complex[J].Neuro Sci,2010,30(12):4232-4240.
[17] 雷蕾,叶斌,王西川,等.p16、p53和Ki67在宫颈癌中的表达及其临床意义[J].实用医院临床杂志,2014,11(4):123-125.
[18] 徐秋霞,关红琼.p16INK4A、p14AR和Ki67在宫颈癌中的表达特点[J].海南医学院学报,2010,16(1):17-19.
河北省科技计划资助项目(13277714D);华北理工大学大学生创新计划资助项目(X2015176)。
白云(E-mail: baiyun6349@163.com)
10.3969/j.issn.1002-266X.2016.27.029
R737.33
B
1002-266X(2016)27-0082-03
2016-01-22)
