ALK阳性非小细胞肺癌脑转移患者的治疗
2016-08-31吕嘉林张权秦娜杨新杰张新勇吴羽华李曦张卉王敬慧张树才
吕嘉林 张权 秦娜 杨新杰 张新勇 吴羽华 李曦 张卉 王敬慧 张树才
全球范围内,肺癌的发病率和死亡率均居恶性肿瘤的前列。大多数患者由于确诊时已为晚期,5年总生存率仅为16%。随着基础研究及药物研发的进展,近10年来,靶向治疗已成为晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)的重要治疗模式之一。表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitors, EGFR-TKIs)在EGFR突变患者中的显著疗效,给肺癌的治疗带来革命性的改变[1,2]。间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)重排是继EGFR突变之后被发现的肺癌另一个重要的驱动基因[3]。ALK阳性患者占NSCLC 5%-8%,一系列ALK抑制剂的大样本随机对照试验结果奠定了克唑替尼一线治疗的地位,克唑替尼治疗ALK阳性晚期NSCLC的客观缓解率为59.8%-74%,中位疾病无进展生存期为7.7个月-10.9个月[4-6]。
肺癌脑转移比例超过40%,脑部也是ALK阳性晚期NSCLC的常见转移部位,脑转移的治疗效果是影响患者预后的重要因素。至此,ALK阳性脑转移患者的治疗模式尚无前瞻性随机对照的循证医学证据,报告也较少。本研究对我院确诊的ALK阳性NSCLC脑转移患者进行回顾性分析,了解ALK阳性脑转移患者的治疗状况及生存情况,为临床医生提供思路。
1 资料与方法
1.1 入组患者 北京胸科医院2013年3月-2016年3月期间,确诊IV期ALK阳性NSCLC患者共84例,22例(26.2%)确诊时有脑转移,3例合并EGFR突变被剔除,19例纳入分析。全部患者接受胸计算机断层扫描(computed tomography, CT)、头核磁共振/CT、骨扫描、腹部CT或核磁、浅表淋巴结彩超等分期检查。记录患者的临床资料,包括性别、年龄、吸烟状况、美国东部协作肿瘤组体力活动状态(Eastern Cooperative Oncology Group performance status, ECOG PS)评分、分期、组织学类型、治疗情况及转归等。肿瘤-淋巴结-转移(tumor-nodemetastasis, TNM)分期以美国癌症联合会(American Joint Committee for Cancer, AJCC)第七版分期系统为标准。
1.2 治疗方案
1.2.1 化疗 化疗方案包括培美曲塞、吉西他滨、紫杉醇、多西紫杉醇、长春瑞滨等联合铂类的方案。
1.2.2 靶向治疗 克唑替尼250 mg,bid,po,如有明显药物相关不良反应,可减量至200 mg,bid,po。
1.2.3 放疗 全脑放疗(whole brain radiotherapy, WBRT)的剂量为30 GY/10 f;立体定向放射外科治疗(stereotactic radiosurgery, SRS)在外院进行。
1.3 疗效评价 疗效评价采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1版。疗效判定包括完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD)。客观缓解率(objective response rate, ORR)包括CR和PR,疾病控制率 (disease control rate, DCR)包括CR、PR和SD。初始治疗1个月后进行脑部病灶的疗效评价,之后每2个月-3个月随访一次。
1.4 ALK重排检测方法 每例福尔马林固定石蜡包埋的组织标本或胸水细胞块切取4 μm厚度的切片,采用D5F3兔克隆抗体(Cell Signal Technology, U.S.)、Optiview DAB IHC检测试剂盒和Optiview放大试剂盒在Benchmark XT(瑞士)自动免疫组化染色机上检测(操作方法按照Benchmark XT自动组化染色机操作规程及ALK检测程序进行),每例设兔单克隆IgG阴性。由病理科医师负责判读结果,任何比例的肿瘤细胞胞浆呈强染色即为ALK阳性,肿瘤细胞胞浆无强染色为阴性。
1.5 统计学方法 颅内疾病无进展生存期(progression-free survival, PFS)为一线治疗开始至脑部疾病进展或死亡的时间,总生存期(overall survival, OS)为从确诊脑转移至任何原因导致死亡的时间,全组随访日期截止至2016年5月31日。采用统计软件SPSS 22.0进行数据分析。PFS和OS采用Kaplan-Meier法计算,组间差异采用Log-rank分析。P<0.05为差异有统计学意义,P值均采用双侧检验。
2 结果
2.1 一般情况 84例患者IV期ALK阳性NSCLC中,中位年龄52岁,男性45例,腺癌76例,不吸烟57例。其中22例为初诊脑转移患者,脑转移发生率为26.2%,剔除3例EGFR与ALK双突变患者,共19例患者可供分析,其中2例为胸部病灶术后的脑转移患者,17例为晚期。19例患者的一般情况见表1。
2.2 治疗情况 19例脑转移患者中,4例未接受任何抗肿瘤治疗,其余15例患者的一线治疗情况:化疗5例(26.3%),化疗+SRS 1例(5.3%),克唑替尼3例(15.8%),克唑替尼+WBRT 3例(15.8%),克唑替尼+SRS 1例(5.3%),手术2例(10.5%)。全程治疗中共10例接受局部治疗(WBRT/SRS/手术),10例接受克唑替尼治疗,其中一线7例,二线及以上3例。
2.3 疗效 15例中13例可评价疗效,2例CR,1例PR,10例SD,颅内ORR为23.1%(3/13),DCR为100%。
2.4 PFS 13例患者中9例(69.2%)进展,4例(30.8%)未进展,中位颅内PFS为12个月(95%CI: 1.845-22.155)。分析显示,患者的临床特征,包括性别、年龄分组(<60岁与≥60岁)、颅内转移灶数量、是否有神经系统症状、是否有颅外转移与PFS无相关性,差异均无统计学意义(P>0.05)。因PS评分、吸烟状态及病理类型各亚组例数不均衡,未做统计学处理。一线接受局部治疗患者的PFS优于未接受局部治疗患者(图1),一线接受克唑替尼治疗的患者PFS优于未接受克唑替尼治疗患者(图2)。因例数少未做Cox多因素分析(表2)。但需注意的是,一线接受克唑替尼治疗的7例患者中4例同时接受了脑部的局部治疗,这4例患者的中位颅内PFS为27.0个月,3例单纯克唑替尼治疗患者的中位PFS仅为4.2个月,因例数少,尚不能进行统计学分析,但上述结果显示出克唑替尼联合局部治疗较单纯靶向治疗对延长PFS的明显优势。

表 1 患者的一般情况Tab 1 Patient characteristics (n= 19)
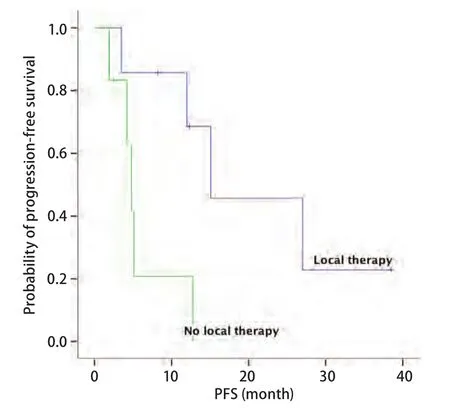
图 1 一线是否接受脑部局部治疗患者的颅内PFSFig 1 Intracranial PFS for patients according first-line brain local therapy

图 2 一线是否接受克唑替尼治疗患者的颅内PFSFig 2 Intracranial PFS for patients according first-line crizotinib therapy
2.5 OS 全组19例患者12例(63.2%)存活,6例(31.6%)死亡,1例(5.3%)失访,因生存事件不足50%,尚不能统计生存结果。12例存活中的9例均接受了克唑替尼和脑部的局部治疗(图3)。
2.6 脑转移进展后的治疗 本组患者中6例脑转移进展后的治疗:1例克唑替尼,1例WBRT,1例靶向联合WBRT和SRS,3例WBRT并继续服用克唑替尼,其中3例患者均为既往接受过克唑替尼治疗,6例患者均在随访中。

表 2 患者的颅内PFSTab 2 Intracranial PFS for patients
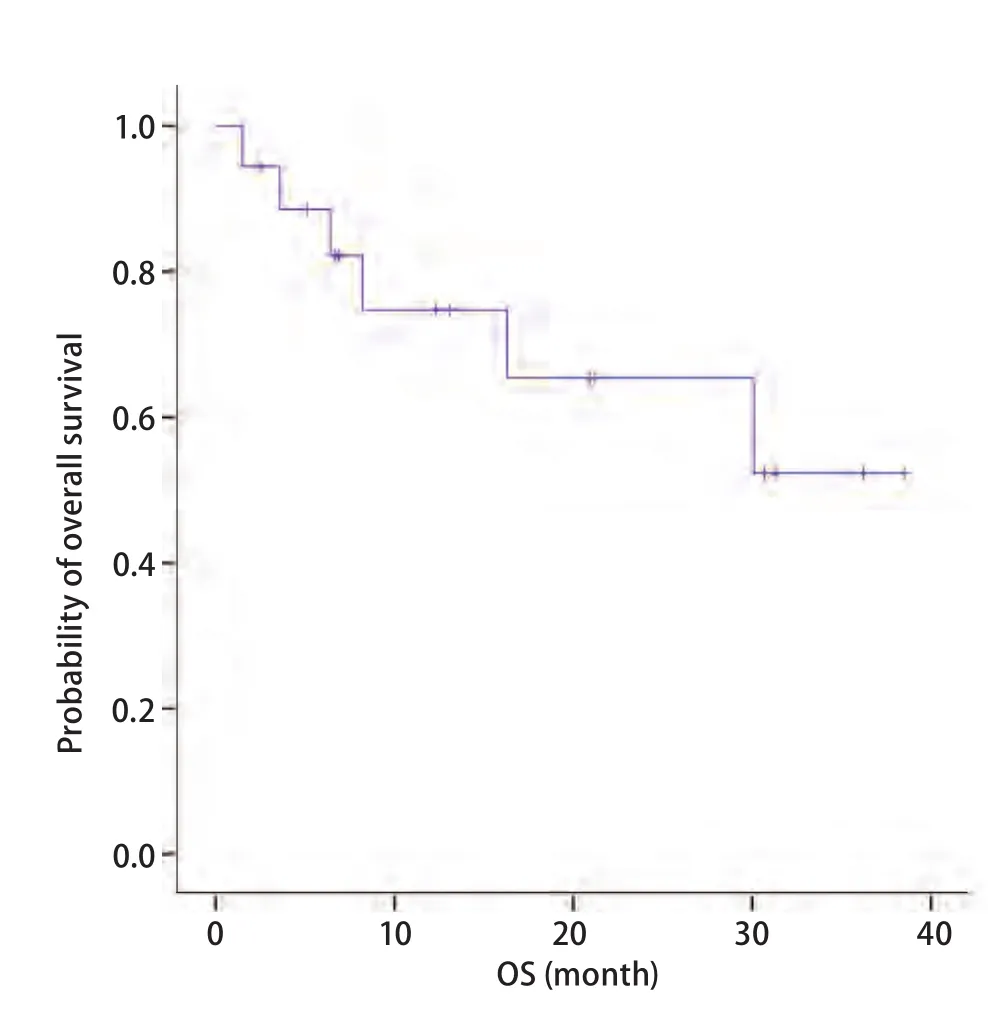
图 3 全组患者的OS曲线Fig 3 OS for all of patients. OS: overall survival.
3 讨论
肺癌脑转移患者的自然病程仅3个月,尽管传统化疗对脑转移患者也有一定的效果,但作用有限;WBRT、SRS和手术是脑转移患者重要的局部治疗方法,其中WBRT应用最为广泛。随着肺癌驱动基因研究的进展,NSCLC患者分型越来越细,靶向治疗成为EGFR突变、ALK阳性等患者的重要治疗手段,EGFR-TKIs和ALK抑制剂等均为小分子药物,可通过血脑屏障,起到治疗脑转移的作用,因此对脑部转移病灶有很好的治疗作用。但是,对于ALK阳性脑转移患者的治疗,放疗、靶向药物如何选择,尚无前瞻性随机对照临床研究证据。文献[5,7,8]报告,ALK阳性NSCLC脑转移的发生率为20%-35%,而且脑转移也是克唑替尼治疗后发生耐药的主要进展部位,约占60%,研究探讨此类患者的治疗模式对于指导临床实践有重要意义。
本研究共入组84例IV期ALK阳性NSCLC患者,临床特征分析显示中位年龄52岁,多见于腺癌、不吸烟患者,其中22例为初诊脑转移患者,脑转移发生率为26.2%,较以往研究相似。近些年来,对于多驱动基因发生共突变的现象已屡有报道,Bar等[9]研究显示8.3%的NSCLC患者肿瘤组织中存在2种或者2种以上的驱动基因突变。在本研究中,存在3.6%(3/84)的ALK/EGFR共突变。
我们对19例初诊ALK阳性NSCLC脑转移患者的临床资料进行回顾性分析,15例经过化疗或克唑替尼联合或不联合WBRT/SRS,颅内疾病ORR为23.1%,中位颅内PFS为12.0个月,存活患者为63.2%,中位OS还未达到,克唑替尼与局部治疗能良好地控制患者的颅内疾病,延长生存期。
Costa等[8]对Profile1005和Profile1007两项前瞻性临床试验中的脑转移患者进行分析,其中109例未治疗过的无症状脑转移患者,克唑替尼治疗后的颅内ORR为18%,12周的DCR为56%,颅内PFS为7个月,显示克唑替尼对ALK阳性NSCLC脑转移患者的良好控制。另外一项研究报告克唑替尼治疗40例脑转移的ORR为25%,PFS为7个月[10]。Solomon等[11]对Prol file 1014研究中脑转移患者进行分析,证实克唑替尼对全身疾病和颅内疾病的控制均优于化疗。本组患者颅内PFS为12.0个月,高于上述文献报告的结果,原因有两个,一是本组例数较少,二是与本组有些患者接受克唑替尼治疗,有些患者同时接受克唑替尼及局部治疗(WBRT或SRS)有关,本组患者中PFS较长的几例均接受了克唑替尼治疗联合WBRT或SRS治疗,因此,强烈提示靶向治疗联合局部治疗能够明显延长PFS。Johung等[12]对来自六个研究中心的90例ALK阳性NSCLC脑转移患者(包括27例初诊时脑转移及治疗后出现的63例脑转移)分析发现,发生脑转移后的中位OS为49.5个月,中位颅内PFS为11.9个月,研究的结论是SRS和/或WBRT联合TKI可延长ALK阳性脑转移患者的生存,同时研究者建议一线使用SRS。本文结果与此项研究相似。
三项研究显示ALK阳性NSCLC患者的OS超过4年,也包括脑转移患者,证实晚期ALK阳性NSCLC脑转移患者同样可以获得长期生存[12-14]。生存获益一方面来自于靶向治疗(包括一代、二代ALK抑制剂)、局部治疗,另一方面也同样来自于化疗、重复使用ALK抑制剂及支持治疗等。本组患者由于存活患者比例占63.2%,尚不能统计生存资料,OS 范围为1.5个月-38.5个月,存活时间最短的患者未做任何抗肿瘤治疗,现仍存活的12例患者中9例接受了克唑替尼治疗和局部治疗,提示ALK抑制剂与局部治疗联合可明显延长ALK阳性脑转移患者的生存。
文献[15-17]报告克唑替尼治疗后出现的脑内转移患者,接受WBRT或SRS并继续克唑替尼口服仍可获得数月的PFS,生存仍可获益。对于克唑替尼治疗的脑转移患者,脑转移再次进展后的治疗,目前尚无循证医学证据。本组9例治疗后颅内进展的患者中的6例接受了补救性治疗,分别为1例WBRT,1例靶向治疗,1例口服克唑替尼联合SRS和WBRT治疗,3例行WBRT同时继续靶向治疗,其中3例患者均为既往接受过克唑替尼治疗,目前这6例颅内疾病均得到控制,处于随访中。脑转移再次进展后的治疗,如局部治疗(WBRT/SRS/手术)、化疗、一代/二代ALK抑制剂等方案可根据患者的病情进行选择。研究证实,二代ALK抑制剂,色瑞替尼、alectinib对脑转移患者也有很好的疗效,也包括对克唑替尼耐药的病例[18-20]。色瑞替尼(NCT02336451,II期)、Brigatinib(NCT01449461,I期/II期)治疗ALK阳性NSCLC脑转移的临床研究正在进行中。此外,Alectinib、AP26113、PF-06463922也可透过血脑屏障,对脑转移有效。
WBRT和SRS联合可提高颅内控制,但有多项前瞻性研究证实对于转移数目少的患者仅行SRS并不降低OS[21,22]。然而,对于脑内多发转移,应常规行WBRT。WBRT的缺点是局部控制劣于SRS或手术,而且伴有神经认知的损害。日本一项大样本的研究显示,SRS对于5个-10个转移灶的控制并不劣于2个-4个[23]。ALK阳性患者生存期长,需认真考虑WBRT对神经认知功能的损害。本组患者3例一线接受WBRT,2例一线接受SRS,补救性治疗中5例接受WBRT,1例同时接受SRS,本文统计分析显示,接受一线脑部局部治疗的患者的PFS优于未接受一线局部治疗患者。局部治疗作为重要的脑转移控制手段,如何与全身治疗配合,使患者的生存获益是临床医生面临的挑战。
综上所述,克唑替尼联合局部治疗可使ALK阳性NSCLC脑转移患者获得良好的颅内疾病控制,脑转移进展后继续克唑替尼治疗联合局部治疗仍可继续延长PFS。本文的不足在于例数偏少,治疗不统一,尚不能做OS分析,我们将对全组患者继续随访。鉴于在ALK阳性脑转移患者中,ALK抑制剂与局部治疗(WBRT/SRS)的最佳顺序尚不明确,因此,今后有必要开展多中心的前瞻性对照研究,以靶向治疗为基础,权衡靶向治疗与局部治疗的合理顺序,探索最佳的治疗模式,做好患者的全程管理,使得患者生存获益最大化。
