五倍子抗菌微胶囊的制备及其结构探究*
2016-08-29张梦星饶秉钧高晶王富军王璐吴静黄颂臣
张梦星饶秉钧高晶王富军王璐吴静 黄颂臣
1. 东华大学纺织学院,上海 201620;2. 东华大学纺织面料技术教育部重点实验室,上海 201620;3. 海澜之家股份有限公司,江苏 江阴 214400
五倍子抗菌微胶囊的制备及其结构探究*
张梦星1,2饶秉钧1,2高晶1,2王富军1,2王璐1,2吴静1,2黄颂臣3
1. 东华大学纺织学院,上海 201620;2. 东华大学纺织面料技术教育部重点实验室,上海 201620;3. 海澜之家股份有限公司,江苏 江阴 214400
以海藻酸钠、壳聚糖为壁材,对采用锐孔造粒法制备五倍子抗菌微胶囊的工艺进行研究。通过单因素试验和正交试验,以包覆率、成形效果为主要评价指标,系统探讨制备五倍子抗菌微胶囊的最优工艺配置,结果表明:当氯化钙质量分数为4.0%、海藻酸钠质量分数为1.5%、壳聚糖质量分数为0.1%、海藻酸钠与五倍子提取物的投料质量比为3.5︰1.0时,所得五倍子抗菌微胶囊的包覆率高达(80.16±1.02)%,且外形良好、孔洞较多,为后续微胶囊抗菌性的深入探究奠定了基础。
微胶囊,海藻酸钠,壳聚糖,五倍子,包覆率
随着科学技术的不断发展,微胶囊技术已引起人们极大的关注,其可广泛应用于生物、医学、纺织品、食品等领域。虽然其起步较晚,其中有关微胶囊及其在纺织品上的应用研究近年才崭露头角[1 - 10],但发展速度迅猛;且与此同时,其在医用纺织材料抗菌方面的应用已引起科学界的广泛研究与讨论[11 - 12]。可以说,微胶囊技术现已逐步进入产业化发展状态。
微胶囊一般由壁材和芯材两部分组成。芯材通常与微胶囊的用途、使用场合有关,但壁材也扮演着极其重要的角色。不同的壁材会赋予微胶囊不同的性能,其原料、结构与性能都会影响微胶囊各项基本性能的发挥[13]。天然高分子材料、半合成高分子材料、合成高分子材料、无机材料等都可作为壁材[14],其中又以来源广泛、无毒、生物性能良好的天然高分子材料最为常见。
海藻酸钠和壳聚糖都是天然高分子材料,两者均具有良好的生物性能,如生物相容性、生物可降解性、生物抑菌性、生物黏附性等,且安全无毒、可降解,在医用敷料产品中早有应用[15 - 16]。它们还经常被作为天然高分子壁材应用于包覆材料中[17],如制备水溶性芯材微胶囊。加之,海藻酸钠和壳聚糖分别为聚阳离子和聚阴离子的天然高分子材料[18],海藻酸钠分子链上有大量的羧基,壳聚糖分子链上有大量的伯氨基,两者通过正负电荷吸引形成聚电解质膜[19],可有效防止被包覆物在释放过程中因外界环境引起微胶囊过早破裂[20]。此外,壳聚糖还具有良好的广谱抗菌性,其早已应用到织物抗菌整理中[21],且有研究表明其还具有明显的抗静电效果[22 ],可作为织物抗静电整理剂,与抗菌作用相辅相成,使效果倍增且耐久[23]。
目前,微胶囊技术已应用到中草药保健功能纺织品的开发中[24]。本文顺应时代发展趋势,选用中草药五倍子提取物作为芯材,其所含鞣质的质量分数最高可达70%以上[25],且分子结构中含有较多的酚羟基[26],可与壁材即海藻酸钠和壳聚糖的分子链上的羧基、伯氨基发生较好的价键结合,从而形成结构与成形良好的抗菌微胶囊,为解决抗菌效果差、抗菌周期短的难题提供了良好的方案。
1 试验材料及仪器
试验所用材料及仪器如表1所示。

表1 试验材料及仪器
2 测试方法和结果讨论
2.1五倍子抗菌微胶囊的制备
锐孔造粒法[27]制备五倍子抗菌微胶囊的具体操作步骤:
(1) 一定温度下取适量去离子水,加入海藻酸钠,利用磁力搅拌器搅拌,配成一定质量分数的海藻酸钠溶液;
(2) 向搅拌均匀的海藻酸钠溶液中加入一定量的五倍子提取物,继续搅拌均匀,记为溶液A;
(3) 一定温度下取适量去离子水,加入适量冰醋酸溶液,搅拌均匀后加入氯化钙,搅拌至溶解均匀后加入壳聚糖,继续搅拌均匀,记为溶液B;
(4) 使用一定规格的注射器以一定速率将溶液A逐滴加入溶液B中,继续搅拌一定时间后,加入适量戊二醛溶液,待微胶囊成形,记为溶液C;
(5) 过滤溶液C,将制备成形的微胶囊置于烘箱中烘干,得到五倍子抗菌微胶囊成品。
2.2五倍子抗菌微胶囊包覆率的测定与计算
2.2.1五倍子提取物的紫外光谱标准曲线的绘制
五倍子提取物的紫外光谱曲线如图1所示,其最大吸收波长为256 nm;根据最大吸收波长绘制出不同质量分数下五倍子提取物的紫外光谱标准曲线(图2),其回归方程:
y=2.547 76x+0.075 47
R2=0.997 08
式中:x——五倍子提取物的质量浓度,mg/L;
y——吸光度。

图1 五倍子提取物的紫外光谱曲线

图2五倍子提取物的紫外光谱标准曲线
2.2.2五倍子抗菌微胶囊包覆率的测定
将制得的五倍子抗菌微胶囊置于研钵中研碎,精密称取一定量的微胶囊粉末,加入适量甲醇溶液,利用超声仪进行超声溶解;再使用微孔膜过滤,于最大吸收波长256 nm处测定其吸光度;然后根据图2的五倍子提取物的紫外光谱标准曲线得出对应的五倍子提取物质量浓度,再换算成对应的五倍子提取物质量,即为五倍子抗菌微胶囊中的药物质量;再根据下式计算出五倍子抗菌微胶囊的包覆率(EF):
2.3单因素试验
2.3.1氯化钙质量分数
保持海藻酸钠质量分数为1.5%、壳聚糖质量分数为0.3%、海藻酸钠与五倍子提取物的投料质量比为3.5∶1.0、溶液C的pH值为5.5、搅拌温度为45 °C,分别选取质量分数为1.0%、2.0%、3.0%、4.0%、5.0%的氯化钙溶液制备五倍子抗菌微胶囊,所得包覆率结果如图3所示。
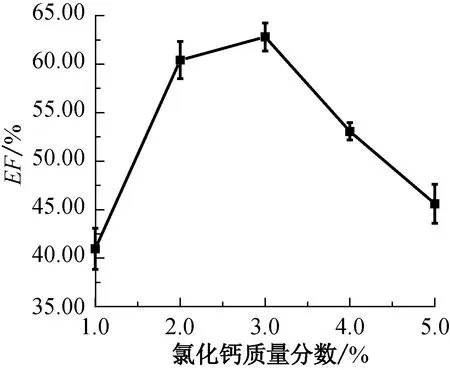
图3 氯化钙质量分数对五倍子抗菌微胶囊包覆率的影响
氯化钙在五倍子抗菌微胶囊的形成过程中发挥着固化剂的作用。从图3可以看出,氯化钙质量分数的变化对五倍子抗菌微胶囊的包覆率有显著影响:当氯化钙质量分数较低时,五倍子抗菌微胶囊外壳较为柔软,故而在制备过程中易因转子搅拌而破裂,造成包覆率较低;随着氯化钙质量分数增加到3.0%,五倍子抗菌微胶囊的包覆率达到最高值;继续增大氯化钙质量分数,壁材间相互接触的概率变大,芯材与壁材间相互接触的概率变小,附着性能下降,包覆率降低,且生成的五倍子抗菌微胶囊壁材较厚。
2.3.2海藻酸钠质量分数
保持氯化钙质量分数为3.0%、壳聚糖质量分数为0.3%、海藻酸钠与五倍子提取物的投料质量比为3.5 ∶1.0、溶液C的pH值为5.5、搅拌温度为45 °C,在海藻酸钠质量分数分别为1.0%、1.5%、2.0%、2.5%、3.0%的条件下制备五倍子抗菌微胶囊,所得包覆率结果如图4所示。

图4 海藻酸钠质量分数对五倍子抗菌微胶囊包覆率的影响
从图4可以看出:在形成五倍子抗菌微胶囊的过程中,当壳聚糖与氯化钙的质量分数一定时,海藻酸钠质量分数过低会导致壁材强度偏低,加之芯材处于溶胀状态,五倍子抗菌微胶囊易破裂;而海藻酸钠质量分数过高则易造成溶液A黏度过大,针孔易堵塞,挤出较困难,这会使五倍子提取物利用率降低,进而造成包覆率降低。试验发现,当海藻酸钠质量分数为1.5%时,五倍子抗菌微胶囊的包覆率可达到最大。
2.3.3壳聚糖质量分数
保持氯化钙质量分数为3.0%、海藻酸钠质量分数为1.5%、海藻酸钠与五倍子提取物的投料质量比为3.5 ∶1.0、溶液C的pH值为5.5、搅拌温度为45 °C,在壳聚糖质量分数分别为0.1%、0.3%、0.5%、0.7%、0.9%的条件下制备五倍子抗菌微胶囊,所得包覆率结果如图5所示。

图5 壳聚糖质量分数对五倍子抗菌微胶囊包覆率的影响
从图5可以看出壳聚糖质量分数的变化对微胶囊包覆率的影响颇为明显:当壳聚糖质量分数较低时,壁材中壳聚糖紧缺,造成囊壁过薄易破裂、芯材包覆不完全,故而包覆率较低;随着壳聚糖质量分数的增大,囊壁逐渐增厚,其强度也随之提高;但当壳聚糖质量分数过高时,过厚的囊壁易在干燥后开裂,造成芯材外露,包覆率降低。
2.3.4海藻酸钠与五倍子提取物的投料质量比
保持氯化钙质量分数为4.0%、海藻酸钠质量分数为1.5%、壳聚糖质量分数为0.3%、溶液C的pH值为5.5、搅拌温度为45 °C,在海藻酸钠与五倍子提取物的投料质量比分别为1.5∶1.0、2.5∶1.0、 3.5∶1.0、4.5∶1.0、5.5∶1.0的条件下制备五倍子抗菌微胶囊,所得包覆率结果如图6所示。

图6 海藻酸钠与五倍子提取物的投料质量比
对五倍子抗菌微胶囊包覆率的影响
从图6可以看出:海藻酸钠与五倍子提取物的投料质量比较低时,芯材无法被完全包覆,故而五倍子抗菌微胶囊包覆率较低;但当两者的投料质量比过高时,海藻酸钠会使得溶液A的黏稠性增加,造成制得的五倍子抗菌微胶囊之间易黏连、团聚,而分离这些微胶囊易引起破损,导致包覆率降低;只有在海藻酸钠与五倍子提取物的投料质量比为2.5∶1.0时达到最佳匹配,所得五倍子抗菌微胶囊的包覆率最大。
2.4正交试验确定最佳工艺条件
由上述单因素试验可知,氯化钙质量分数、海藻酸钠质量分数、壳聚糖质量分数、海藻酸钠与五倍子提取物的投料质量比等对五倍子抗菌微胶囊包覆率的影响较大。因此本文对这4个因素各选取3个水平,按照L9(34)正交表设计试验,以包覆率来衡量五倍子抗菌微胶囊的优异性,优化其制备工艺。选取试验因素水平见表2,正交试验结果及分析见表3和表4。
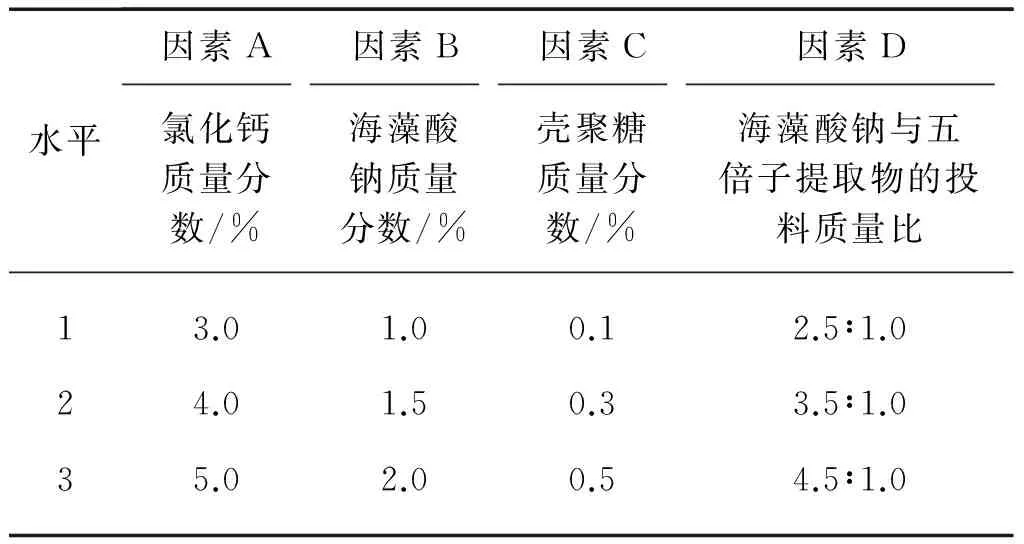
表2 因素水平表

表3 正交试验结果

表4 方差分析结果
由表3和表4可知:4种因素对五倍子抗菌微胶囊包覆率影响的程度顺次为D(海藻酸钠与五倍子提取物的投料质量比)>B(海藻酸钠质量分数)>A(氯化钙质量分数)>C(壳聚糖质量分数);制备五倍子天然抗菌微胶囊的最佳工艺配置为A2B2C1D2,即氯化钙质量分数为4.0%、 海藻酸钠质量分数为1.5%、壳聚糖质量分数为0.1%、海藻酸钠与五倍子提取物的投料质量比为3.5∶1.0。
为进一步说明,对所得最佳工艺条件进行了验证。在此工艺条件下制备3批五倍子抗菌微胶囊,考察其包覆率、形貌与内部结构等。结果表明,在此最优工艺条件下制备的微胶囊成形效果好、粒径稳定、平均包覆率为(80.16±1.02)%。
2.5五倍子天然抗菌微胶囊的形貌与内部结构表征
2.5.1SEM照片分析
选取最佳工艺配置及表3中3种包覆效果较好的五倍子抗菌微胶囊的工艺配置,并在相同工艺配置下制备了4种未包覆五倍子提取物的微胶囊,用于比较(表5和图7)。

表5 包覆/未包覆五倍子提取物的微胶囊的制备及其包覆率
从表5和图7可以看出:包覆五倍子提取物的a、b、c、d微胶囊的表面孔洞相对于未包覆五倍子提取物的e、f、g、h微胶囊的多,而更多孔洞的存在有利于芯材五倍子提取物的对外释放;此外,随着a、b、c、d这4种五倍子抗菌微胶囊包覆率的降低,微胶囊的表面光滑度和形状规则度都随之下降。

图7 包覆/未包覆五倍子提取物的微胶囊SEM照片
2.5.2微胶囊粒径分析
图8就a~h这8种微胶囊进行了粒径对比与分析。

图8 包覆/未包覆五倍子提取物的微胶囊粒径分布
结合图7和图8可以看出:包覆五倍子提取物的a、b、c、d这4种微胶囊在粒径上皆比相应的未包覆五倍子提取物的e、f、g、h这4种微胶囊大;第一对照组(即a与e)在粒径上表现出较小的波动和差异,两者包覆效果更优异。
2.5.3FTIR-ATR分析
就芯材五倍子提取物和a、e微胶囊,采用傅里叶变换红外光谱仪(FTIR),对它们的化学结构进行表征和比较,波数扫描范围为4 000~500 cm-1(图9和图10)。
结合图9和图10可以看出,包覆五倍子提取物的a微胶囊在1 617、1 326、1 039、757 cm-1处均出现了五倍子提取物的特征吸收峰,这有效证明了微胶囊已包覆五倍子提取物。此外,图10 中,包覆五倍子提取物的a微胶囊保留了未包覆五倍子提取物的e微胶囊的原有基团,这充分说明了包覆过程未改变原有微胶囊的分子结构。

图9 芯材五倍子提取物的红外光谱
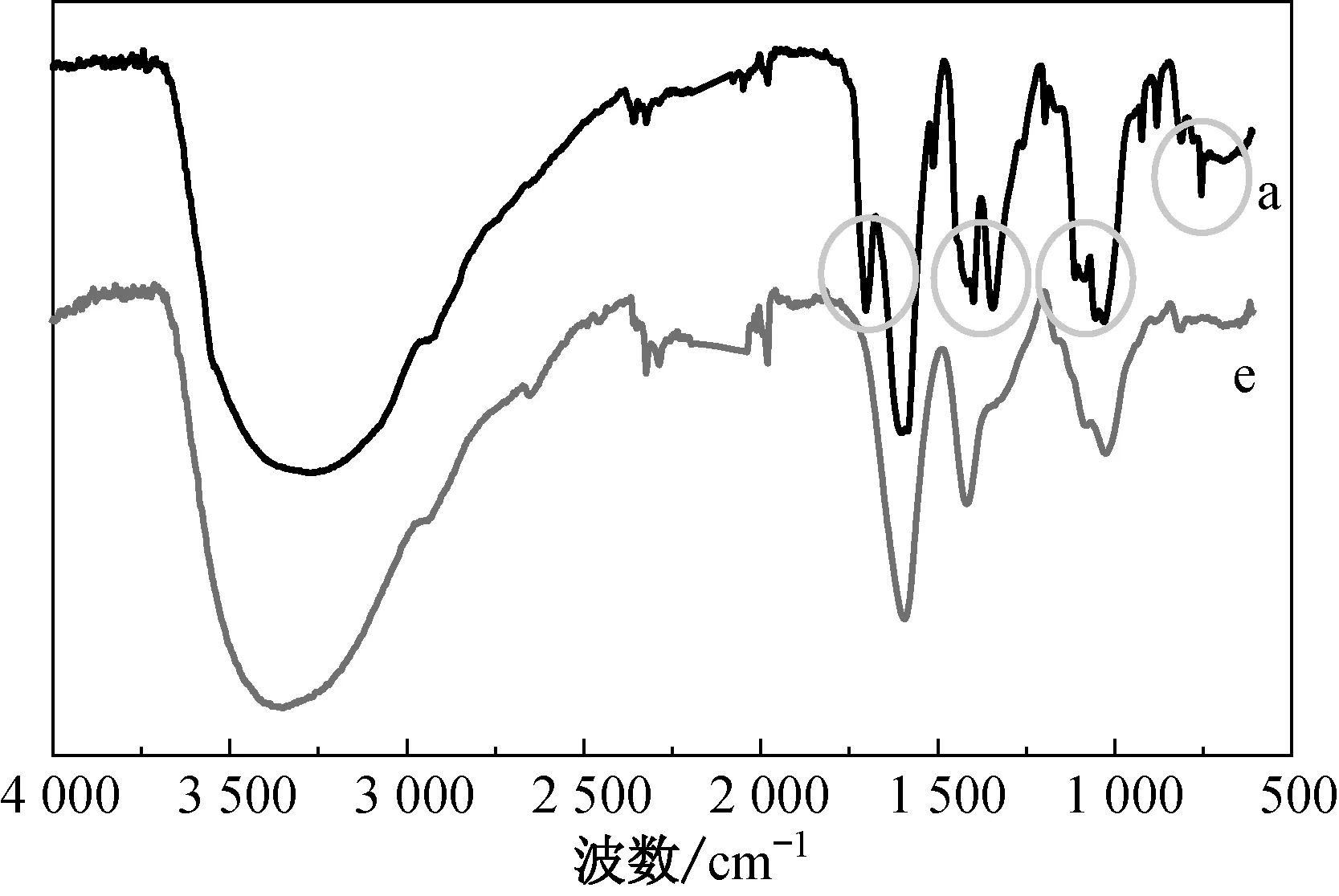
图10 a与e微胶囊的红外光谱
3 结论
利用锐孔造粒法制备五倍子抗菌微胶囊,经单因素试验和正交试验得到制备五倍子抗菌微胶囊的最佳工艺配置:氯化钙质量分数为4.0%、海藻酸钠质量分数为1.5%、壳聚糖质量分数为0.1%、海藻酸钠与五倍子提取物的投料质量比为3.5∶1.0,所得五倍子抗菌微胶囊的包覆率高达(80.16±1.02)%,且外形良好、孔洞较多。并通过药物包覆率、SEM分析、粒径分析、FTIR分析发现,五倍子提取物包覆效果较好,且包覆过程并未改变无芯材状态时微胶囊的分子结构,这为后续抗菌性的研究提供了理论依据。
[1] FUJIMOTO N,FUJITA S,TSUJI T,et al. Microencapsulated feeder cells as a source of soluble factors for expansion of CD34+hematopoietic stem cells [J]. Biomaterials, 2007, 28(32):4795-4805.
[2] 张英,王为,吕国军,等.体外培养和冷冻保存对微囊化细胞生长和内皮抑素表达的影响 [J].生物工程学报, 2007, 23(2):303-309.
[3] CHENG D,SEFTON M V. Dual delivery of placental growth factor and vascular endothelial growth factor from poly(hydroxyethyl methacrylate-co-methyl methacrylate) microcapsules containing doubly transfected luciferase-expressing L929 cells [J]. Tissue Eng.Part A,2009, 15(8):1929-1939.
[4] MURUA A,ORIVE G,HERNANDEZ R M,et al. Xenogeneic transplantation of erythropoietin-secreting cells immobilized in microcapsules using transient immunosuppression [J]. Journal of Control Release, 2009, 137(3):174-178.
[5] ZHANG Xulang,WANG Wei,YU Weiting, et al. Development of an in vitro multicellular tumor spheroid model using microencapsulation and its application in anticancer drug screening and testing [J]. Biotechnology Progress,2005, 21(4):1289-1296.
[6] LUO Dawei,PULLELA S R,MARQUEZ M,et al. Cell encapsules with tunable transport and mechanical properties [J]. Biomicrofluidics, 2006,1(3):463-472.
[7] ROSINSKI S, LEWINSKA D,WOJCIK M,et al. Mass transfer characteristics of poly-lysine, poly-ornithine and poly-methylene-co-guanidine membrane coated alginate microcapsules [J]. Journal of Membrane Science, 2005, 254(1-2):249-257.
[8] 张芸, 李俊. [TC]2非接触式三维测量系统的应用研究 [J] .东华大学学报(自然科学版),2004,30(3):93-96, 113.
[9 ] 蒋挺大.甲壳素 [M].北京:化学工业出版社,2005:1-43.
[10 ] 张梦星,高晶,王富军,等.酸性染料微胶囊的研究与应用进展 [J].毛纺科技,2016,44(3):32-36.
[11 ] 秦益民,李可昌,邓云龙,等. 先进技术在医用纺织材料中的应用 [J]. 产业用纺织品,2015,33(5):1-6,39.
[12 ] 盛云霞,弓太生,李慧.微胶囊技术在抗菌鞋材中的应用及研究进展 [J]. 中国皮革,2014(6):112-115.
[13 ] 李孟轩,刘星,王瑞, 等.药物微胶囊在纺织品中的应用研究 [J].轻纺工业与技术,2014,43(4):74-77.
[14 ] 邱水来,朱雨露,黄峥琦,等.聚合物微胶囊的研究与应用进展 [J].化工新型材料,2014(9):204-206.
[15 ] 张丽,张兴祥. 医用敷料用海藻纤维国内外研究进展 [J]. 产业用纺织品,2009,27(12):1-5.
[16 ] 张洁,钱晓明. 壳聚糖非织造布的制备及壳聚糖非织造医用敷料的研究进展 [J]. 产业用纺织品,2011,29(7):24-27,36.
[17 ] 徐会. 海面溢油综合生物修复剂的制备及其强化海面溢油修复效果评价 [D].青岛:中国海洋大学,2013.
[18 ] 张林朴,王冠华,连小丽,等. 海藻酸钠/壳聚糖复合凝胶的制备与细胞毒性评价 [J].中国组织工程研究,2014(21):3310-3315.
[19 ] 王勇, 解玉冰, 马小军.壳聚糖/海藻酸钠生物微胶囊的研究进展 [J].中国生物工程杂志,1999,19(2):13-16.
[20 ] 刘永庆. 微胶囊印花面面观 [J]. 丝网印刷,2012(2):18-22.
[21 ] 卢娜,邓炳耀,姚静,等.精纺呢绒的壳聚糖抗菌整理 [J].毛纺科技,2006,34(5):9-12.
[22 ] 杨晓琴,邓桦.抗菌羊毛织物的制备及其性能 [J].毛纺科技,2014,42(4):1-5.
[23 ] 余雪满,沈兰萍,李清政.壳聚糖用于毛织物抗静电整理的研究 [J].毛纺科技,2008,36(6):18-21.
[24 ] 张瑞萍,黄洁,吴宇,等. 中草药保健功能纺织品的开发 [J]. 产业用纺织品,2010,28(6):1-5.
[25 ] 李秀萍, 李春远, 渠桂荣, 等. 五倍子的研究概况 [J]. 中医药学报, 2002, 30(3): 72-74.
[26 ] 石碧,狄莹,何有节,等. 鞣质的药理活性 [J].中草药, 1998, 29(7): 487-490.
[27 ] 彭梦侠,陈梓云. 锐孔—凝固浴法制备橙子油微胶囊的工艺研究 [J]. 化工技术与开发,2015,44(5):16-21.
Preparation and structure research of gallnut antibacterial microcapsules
ZhangMengxing1,RaoBingjun1, 2,GaoJing1,2,WangFujun1,2,WangLu1,2,WuJing1,2,HuangSongchen3
1. College of Textiles, Donghua University, Shanghai 201620, China;2. Key Laboratory of Textile Science and Technology, Ministry of Education, Donghua University, Shanghai 201620, China;3. Heilan Home Co., Ltd., Jiangyin 214400, China
The preparation technology using orifice granulation methods of gallnut antibacterial microcapsule with sodium alginate and chitosan as wall materials was studied.Using cladding rate and forming effect as main evaluation indexes, the optimum process condition for preparation of the gallnut antibacterial microcapsule was systematically discussed with single factor experiment and orthogonal experiment.And the results showed that when calcium chloride was at 4.0%wt.,sodium alginate was at 1.5%wt., chitosan was at 0.1%wt., sodium alginate and gallnut drug weight ratio was at 3.5 ∶1.0, gallnut antibacterial microcapsule’s encapsulation efficiency could reach (80.16± 1.02)%, and it had good appearance and more holes,which laid a foundation for subsequent study on antibacterial property of microcapsule.
microcapsule, sodium alginate, chitosan, gallnut, encapsulation efficiency
2016-04-26
张梦星,女,1993年生,在读硕士研究生,研究方向为微胶囊的制备方法与技术
王富军,E-mail:wfj@dhu.edu.cn
TS195.5
A
1004-7093(2016)07-0028-07
* 江苏省科技支撑计划项目(BE2014036);国家自然科学基金(31100682)
