肺炎支原体肺炎患儿外周血CXCL8及其mRNA表达①
2016-08-29卜小芳田恒忠祁庆松孔占一
卜小芳 王 健 倪 宁 田恒忠 祁庆松 孔占一
(安徽省淮南市妇幼保健院儿科,淮南 232007)
肺炎支原体肺炎患儿外周血CXCL8及其mRNA表达①
卜小芳王健②倪宁田恒忠祁庆松孔占一
(安徽省淮南市妇幼保健院儿科,淮南 232007)
①本文为安徽省自然科学基金(No.1308085MH148)、安徽省教育厅自然科学基金重点项目(No.KJ2010A086)、淮南市2015年科技计划项目(No.2015A2406)和安徽省教育厅重大自然科学研究项目(No.KJ2016SD20)。
②安徽理工大学医学院病原学与免疫学教研室,淮南232001。
目的:探讨支原体肺炎患儿外周血CXCL8及其mRNA表达的临床意义。方法:收集2013年10月~2015年3月淮南市妇幼保健院收治的支原体肺炎患儿48例,其中重症12例,轻症36例,以ELISA法检测患儿血清CXCL8含量,PCR法检测患儿外周血单个核细胞内CXCL8 mRNA水平。以GAPDH为参照,以lgcDNA/lgGAPDH比值代表其最终mRNA水平。结果:支原体肺炎患儿外周血血清CXCL8含量及外周血单个核细胞内CXCL8 mRNA水平分别为(298.917±51.860)pg/ml、(1.848±0.525)lgcDNA/lgGAPDH,与正常对照相比差异均有显著统计学意义(P<0.05)。进一步观察发现,重症患儿外周血CXCL8及其mRNA进一步升高,与轻症组相比,血清CXCL8含量差异无显著统计学意义统计学意义(P>0.05),而CXCL8 mRNA水平差异有显著统计学意义(P<0.05)。急性期以红霉素静脉注射7~10 d,使患儿病情得以明显控制,咳嗽症状减轻,肺部炎症逐渐改善,病情得到有效控制,再以阿奇霉素序贯治疗2~3周,患儿病情逐步由急性期转为恢复期,此时患儿外周血CXCL8及其mRNA水平明显降低,与急性期相比,差异有显著统计学意义(P<0.05)。结论:支原体肺炎患儿外周血CXCL8及其mRNA表达水平增高,并与病情的严重程度相关。CXCL8参与支原体肺炎的发病过程,并对病情的轻重程度和转归有一定的提示作用。阿奇霉素可通过抑制肺炎支原体增殖途径降低患儿血清中CXCL8含量、下调CXCL8 mRNA的表达,逐渐抑制由肺炎支原体介导的免疫损伤。
肺炎支原体;支原体肺炎;外周血单个核细胞;CXCL8;mRNA
支原体肺炎(Mycoplasma pneumoniae pneumonia,MPP)亦称原发性非典型性肺炎,是由肺炎支原体(Mycoplasma pneumoniae,MP)引起,并以支气管和肺间质为主要病变的急性炎症,婴幼儿及儿童多见。近年来研究资料显示婴幼儿MP感染率达12.3%,且季度分布从1.5%至27.3%不等[1]。我国婴幼儿MP感染水平亦呈上升趋势[2],且具有好发年龄提前、病程长、易反复等特点,其确切机制有待进一步阐明。目前研究表明,肺炎支原体不仅是病原体,也是重要的变应原,可激活机体免疫系统,诱导强烈的应答反应。细胞免疫在患儿肺间质性炎症病理改变过程中发挥重要调节功能。CXCL8是CXC趋化因子亚家族中的重要成员,是关键的炎症因子,在介导炎症反应中起重要作用[3]。为探讨CXCL8在支原体肺炎疾病转归中的作用,本文选择典型的支原体肺炎患儿,检测其外周血CXCL8及其mRNA,现将结果报道如下。
1 材料与方法
1.1材料
1.1.1临床资料48例支原体肺炎患儿系2013年10月~2015年3月本市妇幼保健院收治的病人,其中男28例,女20例,年龄4月~10岁,其中年龄3~12月者6例,1~3岁者18例,3~10岁者24例。临床诊断依据儿童社区获得性肺炎管理指南(2013修订)的诊断标准[4,5]。入选患儿血清抗-MP-IgM(+),痰培养阴性,无免疫系统疾病,无长期使用皮质激素使用史。依患儿病情分为轻症36例、重症12例两组,依患儿病程分为急性期和恢复期。取同期门诊体检正常30例儿童为对照,男女各为15例,年龄5个月~15岁,无呼吸道及全身感染。
1.1.2试剂与仪器CXCL8酶联免疫检测试剂盒(法国DIACLONE公司);胎牛血清购自美国Bio Basic Inc(BBI)公司;Ficoll-Hypaque分离液(1.077±0.001)购自上海试剂二厂;Trizol试剂购自美国Invitrogen公司;RPMI1640完全培养液购自美国Sigma公司; TIANScript cDNA合成试剂盒购自北京天根生化科技有限公司;LightCyder FastStart DNA Master SYBR Green Ⅰ(德国Roche公司)。EXL-50X全自动洗板机、EXL-808全自动酶标仪均购自美国Bio-Tek公司;5415D台式高速离心机购自德国Eppendorf公司;UV-5800PC紫外可见分光光度计(上海元析仪器有限公司);Nikon E-400荧光显微镜购自日本Nikon公司;TaKaRa梯度PCR仪TP600(日本TaKaRa公司);iCycle(R)荧光实时定量PCR仪(美国Bio-Rad公司);Hema-2000凝胶分析系统(珠海Hema公司)。
1.2方法
1.2.1标本采集采取患儿腹股沟静脉血或外周肘静脉血5 ml,分别置含肝素的无菌Eppendorf管和洁净的Eppendorf管。肝素抗凝血以Ficoll-Hypaque常规分离PBMCs,提取总RNA和CXCL8 mRNA检测;普通管常规分离血清检测CXCL8。
1.2.2CXCL8检测采用固相夹心ELISA法。以试剂盒所配标准品绘制标准曲线。每次检测设空白及标准各2孔,复孔检测。于450 nm处读取吸光度值,每孔测定2次,取均值,根据样品OD值从标准曲线确定样品CXCL8含量。
1.2.3PBMCs总RNA提取及其浓度、纯度鉴定参照王健等[6]方法提取PBMCs,并进一步提取总RNA,核酸凝胶图像分析仪下可见清晰的28S、18S、5.8S三条带,且28S条带密度是18S条带密度的2倍以上;分光光度计测OD260/OD280值为1.8~2.0,见图1。
1.2.4CXCL8 mRNA检测以随机引物分别将所提取的总RNA逆转录为cDNA。根据GeneBank中人CXCL8基因序列,以Primer Express软件设计特异性引物和探针,以磷酸甘油醛脱氢酶(Glyceralde-hyde phosphate dehydrogenase,GAPDH)为内参,引物和探针序列见表1。所有引物和探针均购自上海生工生物工程技术服务有限公司。检测步骤参照王健等[6]步骤。为克服系统误差,以GAPDH为内参照,
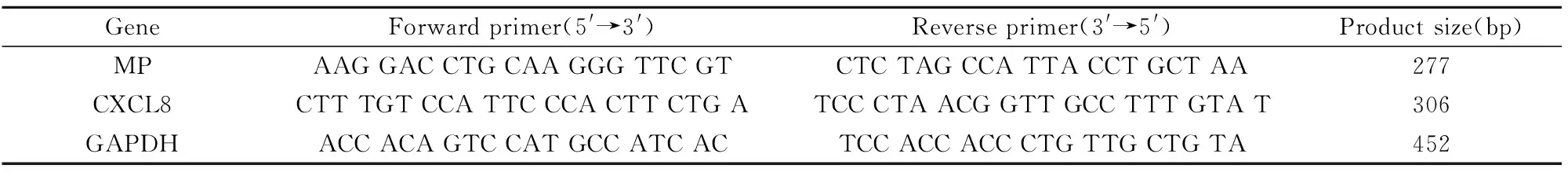
表1 MP、CXCL8、CXCR1、CXCR2、CD16、GAPDH引物和探针序列Tab.1 Primer sequences of MP,CXCL8,CXCR1,CXCR2,CD16,GAPDH
以lgcDNA/lgGAPDH比值代表其最终mRNA水平。
2 结果
2.1患儿CXCL8表达支原体肺炎患儿外周血CXCL8水平较正常对照组显著升高,差异有显著性(P<0.05),以重症患儿外周血CXCL8含量升高更显著;对比观察轻症和重症患儿外周血CXCL8水平,差异有显著性(P>0.05)。但动态观察发现患儿急性期CXCL8升高明显,急性期与恢复期相比,差异有显著性(P<0.05)。见图2。
2.2患儿PBMCs内CXCL8 mRNA表达支原体肺炎患儿PBMCs内CXCL8 mRNA水平较正常对照组显著上调,差异有显著性(P<0.05),进一步对比观察,发现无论是轻症和重症患儿之间,还是急性期与恢复期相比,CXCL8 mRNA载量均有显著增加,彼此相比差异有显著性(P<0.05)。如图3、图4。凝胶灰度扫描示重症患儿外周血CXCL8mRNA的扫描激发荧光条带亮度增强,如图4。
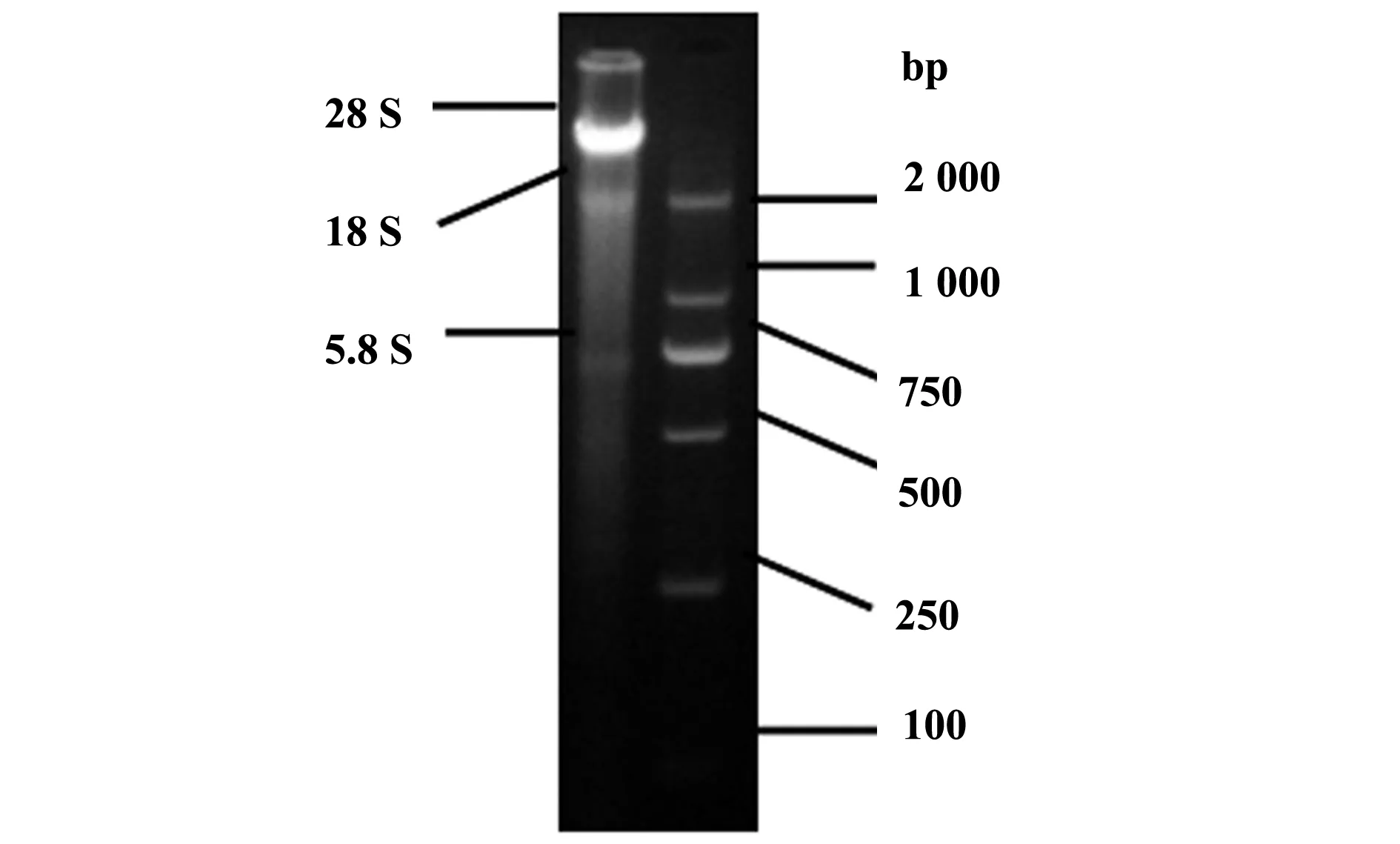
图1 PBMCs总RNA电泳图Fig.1 Electrophorogram of total RNA from PBMCs
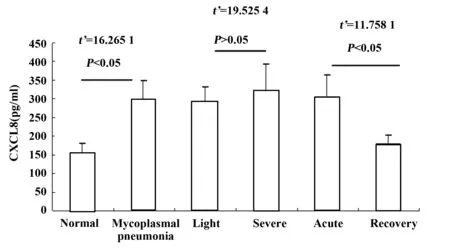
图2 支原体肺炎患儿外周血CXCL8表达水平Fig.2 Levels of CXCL8 in peripheral blood of Mycoplasma pneumoniae
2.3患儿胸部X线特征改变支原体肺炎患儿以轻症病例为主,胸部X线呈现两肺斑点状和斑片状模糊状阴影,以右肺多见,如图5A示;而重症患儿胸片可见大片状模糊阴影,以右肺大叶性肺炎多见,如图5C示。予红霉素、阿奇霉素序贯治疗3~4周,患儿病情得以明显控制,咳嗽症状缓解,肺部炎症逐渐吸收,肺部斑点状和斑片状模糊阴影明显吸收,病情逐步由急性期转归为恢复期,如图5B、D。
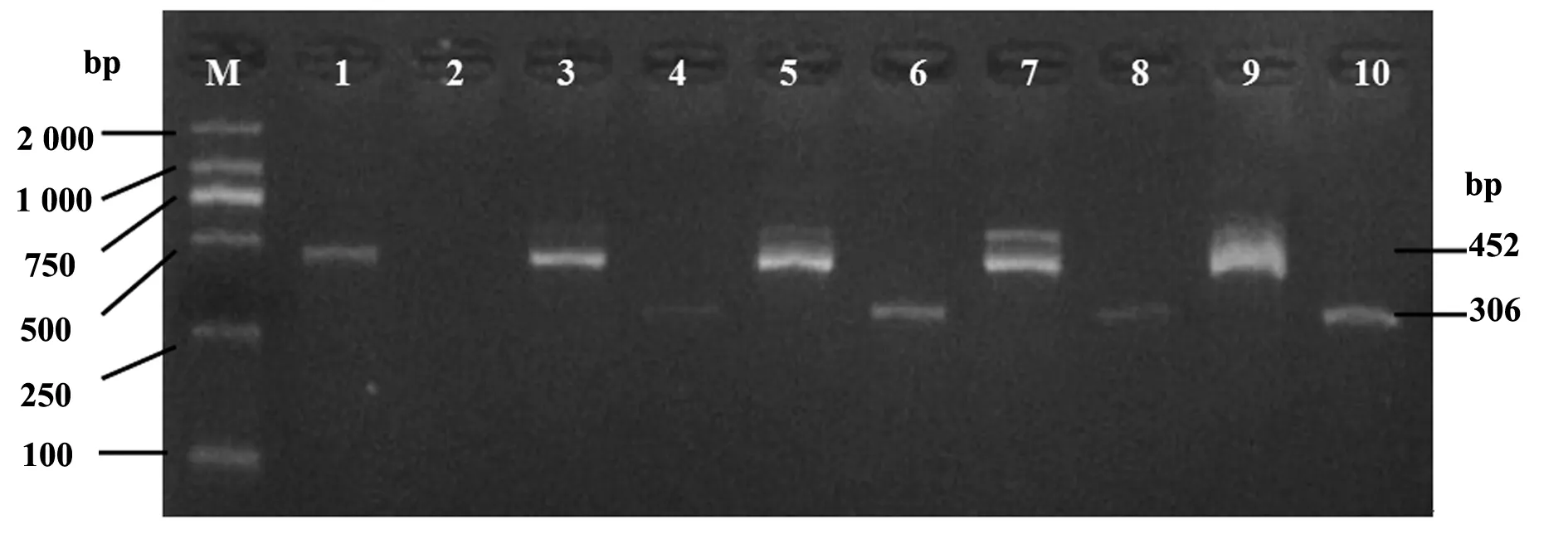
图3 支原体肺炎患儿外周血CXCL8及其mRNA表达Fig.3 Expression of CXCL8 mRNA in PBMCs of mycoplasmal pneumoniaNote: M.DL2000;1,2.GAPDHC and XCL8 of normal control;3-6.GAPDH and CXCL8 of mycoplasmal pneumonia(light 1 and light 2);7-10.GAPDH and CXCL8 of mycoplasmal pneumonia (severe 1 and sever 2).
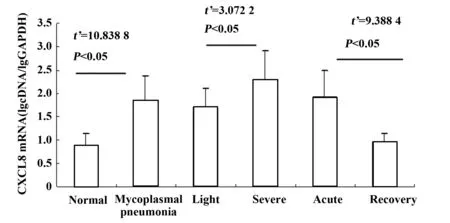
图4 支原体肺炎患儿PBMCs内CXCL8 mRNA表达水平Fig.4 Levels of CXCL8 mRNA in PBMCs of Mycopla-sma pneumoniae
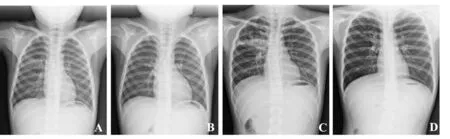
图5 支原体肺炎治疗前后影像学特征Fig.5 Iconography features of Mycoplasma pneumoniae before and after treatmentNote: A and B.Before and after treatment of the patient (Light);C and D.Before and after treatment of the patient (Severe).
3 讨论
支原体肺炎以间质性炎性浸润和急性毛细支气管炎为主要病理改变。其以特殊顶端结构中的P1表面蛋白(170 kD)和P30(32 kD)为主要黏附素,黏附于宿主上皮细胞表面,定植于细胞间隙,导致宿主细胞损伤[7,8]。其毒性代谢产物如神经毒素、磷脂酶C、过氧化氢等使宿主纤毛细胞运动减弱甚至脱落消失,继发引起宿主黏膜上皮细胞损伤。浸润性炎症沿支气管、肺血管周围发展,达肺泡间隔,并累及肺泡,引起肺小叶、肺泡间隔的间质性浸润[9]。
细胞免疫在其致病机制中起重要作用。当肺炎支原体感染,触发机体免疫系统,产生多种趋化因子如CXCL8、TNF-α等[10],参与局部和全身炎症反应。适度的炎症反应有利于清除致炎因子,对机体起保护作用,过度的炎症反应可致免疫病理损伤,并不有利于病情恢复。CXCL8属ELR+CXC趋化因子,来源于多种免疫细胞,如单核细胞、巨噬细胞、中性粒细胞、淋巴细胞、血管内皮细胞和肝细胞等[11],其趋化吸引多种炎症细胞至肺部组织浸润积聚,释放血管活性物质,引起组织免疫损伤。现有研究表明支原体肺炎时肺部的浸润细胞主要是单核巨噬细胞、淋巴细胞及中性粒细胞[12]。
CXCL8是一种分子量约8~10 kD并具有高度活性的小分子多肽,是一种多源性来源的促炎反应细胞因子[13,14]。本文研究结果显示,支原体肺炎患儿外周血CXCL8水平较正常对照组显著升高,提示定植于气管、支气管上皮细胞的MP释放毒性代谢产物,不仅可引起局部上皮细胞损伤,支气管水肿、炎症浸润,还可沿支气管、肺血管累及肺泡间隔和肺泡,引起肺小叶、肺泡间隔呈间质性炎症。此外,肺炎支原体还可激活患儿的免疫系统,促使单核-巨噬细胞、T淋巴细胞、中性粒细胞及上皮细胞大量分泌CXCL8,部分CXCL8释放入血,使外周血中CXCL8水平升高,高水平的CXCL8有助于机体防御MP进一步侵入[15],但过量的CXCL8可趋化吸引大量炎症细胞于病灶处聚集浸润,介导肺、气管、支气管上皮细胞产生免疫损伤,使患儿出现发热、咳嗽、胸痛等症状。进一步观察发现,重症患儿外周血CXCL8水平进一步升高,与轻症患儿相比,差异无显著性,提示CXCL8虽然参与MP所致的免疫病理损害,但与免疫损伤的程度没有明显关系。重症患儿外周血中CXCL8滴度较高,MP黏附局部上皮细胞使其分泌更多的CXCL8,它们彼此相互协调,共同趋化吸引单核-巨噬细胞、淋巴细胞至病灶处聚集,引起气道平滑肌收缩,腺体分泌增加,气道反应性增高,诱导强烈的炎症反应和严重的组织损伤[16]。临床上针对这类患儿在传统应用大环内酯类抗生素基础上,联合应用糖皮质激素或/和静注人免疫球蛋白,能抑制过强的免疫反应对组织造成的免疫损伤。
mRNA是反映细胞内基因转录翻译的指标,可进一步了解某基因在特定条件下的调控能力。CXCL8 mRNA是调控转译CXCL8的敏感指标,能直接影响外周血CXCL8的表达水平[17,18]。肺炎支原体缺乏细胞壁,细胞膜中富含胆固醇,其特殊的末端结构(Terminal structure)能促使支原体于呼吸道黏膜上皮细胞表面黏附定植,引起细胞损伤,诱导免疫应答。PBMCs富含多种免疫细胞,在机体抗感染免疫过程中起关键作用。本文研究结果发现,支原体肺炎患儿PBMCs内CXCL8 mRNA水平亦较正常对照组显著升高,提示细胞免疫在由支原体介导的炎症过程中起重要作用,并能在基因转录水平上调表达,趋化吸引大量单核-巨噬细胞、中性粒细胞,促进免疫细胞活化并分泌更多的CXCL8进入外周血[19],形成局限性的炎性浸润,促进吞噬和杀伤支原体。已知支原体肺炎以间质性肺炎和急性毛细支气管炎为主,感染中毒症状轻,但本文发现少数重症患儿表达高水平的CXCL8 mRNA,过度上调的CXCL8 mRNA并不有利于清除入侵的肺炎支原体,反而进一步激活炎性因子信号传导通路,释放更多炎性因子,使肺、支气管等局部炎症进一步加重[20]。
阿奇霉素是第二代大环内酯类抗生素,是在红霉素结构的基础上经重排、扩环、还原和N-甲基化等分子重构而成,具有组织渗透性好的优点[21],巨噬细胞可通过跨膜转运方式促使阿奇霉素在局部病灶细胞内维持较高水平,提高其治疗效果。急性期以红霉素静脉注射7~10 d,使患儿病情得以明显控制,咳嗽症状减轻,肺部炎症逐渐改善,病情得到有效控制,再以阿奇霉素序贯治疗2~3周, 病情逐步由急性期转归为恢复期,此时患儿外周血CXCL8及其mRNA均明显降低,与急性期相比,差异有显著性(P<0.05)。提示阿奇霉素不仅可抑制MP增殖,降低病原体的致炎作用,亦可抑制炎症反应,减轻免疫损伤,并能下调CXCL8 mRNA表达,减少CXCL8的分泌,使免疫损伤逐渐恢复。但部分恢复期的病例与正常对照相比,外周血CXCL8或CXCL8 mRNA水平仍较高,对这些患儿即使临床症状改善,还应继续巩固治疗,预防病情复发。
胸部X线检查对诊断患儿肺和气道病变,评估疾病的严重程度及转归有重要意义[22]。本文研究发现支原体肺炎患儿以轻症病例为主,胸部X线以右肺斑点状和斑片状模糊状阴影多见,急性期患儿常呈现混合性通气功能障碍,即既有限制性通气功能障碍,又有阻塞性通气功能障碍。有趣的是不同年龄组患儿胸部X线表现各异,3岁以下的婴幼儿以斑片状密度增高影病变多见,两肺均可受累;年长患儿以肺段或肺叶实质性浸润病变为主,而且以单侧为主,尤以右下肺和右肺中叶病变多见,边缘模糊,密度较低,此可能与右肺中叶支气管较细长的解剖结构有关。随着进一步治疗,患儿症状改善,病情逐步进入恢复期,但部分患儿因气道高反应性,肺顺应性恢复相对较慢,持续时间较长,应特别加强对气道炎症针对性治疗,增加呼吸训练,促进间质性病变的恢复[23,24]。
综上所述,支原体肺炎是儿童常见的呼吸道疾病,肺炎支原体作为支原体肺炎的病原体,亦是致炎的关键始动因素。CXCL8作为一种促炎因子,参与支原体肺炎的发病过程,并在炎症浸润免疫病理反应过程中起重要作用。支原体肺炎患儿外周血CXCL8及其mRNA表达水平增高,并与病情的严重程度具有一定的相关性,可作为监控病情转归的实验室辅助诊断指标。阿奇霉素可降低患儿血清中CXCL8含量、下调CXCL8 mRNA的表达,逐渐抑制由肺炎支原体介导的免疫损伤。
[1]Dumke R,Schnee C,Pletz MW,etal.Mycoplasma pneumoniae and Chlamydia spp.infection in community-acquired pneumonia,Germany,2011-2012 [J].Emerg Infect Dis,2015,21(3):426-634.
[2]Sun H,Chen Z,Yan Y,etal.Epidemiology and clinical profiles of Mycoplasma pneumoniae infection in hospitalized infants younger than one year [J].Respir Med,2015,109(6):751-757.
[3]Lin CH,Nai PL,Bien MY,etal.Thrombin-induced CCAAT/enhancer-binding protein β activation and IL-8/CXCL8 expression via MEKK1,ERK,and p90 ribosomal S6 kinase 1 in lung epithelial cells [J].J Immunol,2014,192(1):338-348.
[4]中华医学会儿科学分会呼吸学组.儿童社区获得性肺炎管理指南(2013修订)(上)[J].中华儿科杂志,2013,51(10):745-752.
[5]中华医学会儿科学分会呼吸学组.儿童社区获得性肺炎管理指南(2013修订)(下)[J].中华儿科杂志,2013,51(11):856-862.
[6]王健,韩忠燕,周娜.CXCL8及其受体CXCR1、CXCR2在慢性乙肝患者外周血PMNs中的表达[J].中国免疫学杂志,2015,31(3):375-379,383
[7]Hausner M,Schamberger A,Naumann W,etal.Development of protective anti-Mycoplasma pneumoniae antibodies after immunization of guinea pigs with the combination of a P1-P30 chimeric recombinant protein and chitosan [J].Microb Pathog,2013,64:23-32.
[8]Chang HY,Jordan JL,Krause DC.Domain analysis of protein P30 in Mycoplasma pneumoniae cytadherence and gliding motility [J].J Bacteriol,2011,193(7):1726-1733.
[9]Romero-García J,Francisco C,Biarnés X,etal.Structure-function features of a Mycoplasma glycolipid synthase derived from structural data integration,molecular simulations,and mutational analysis [J].PLoS One,2013,8(12):e81990.
[10]Wang M,Wang Y,Yan Y,etal.Clinical and laboratory profiles of refractory Mycoplasma pneumoniae pneumonia in children [J].Int J Infect Dis,2014,29:18-23.
[11]Kobayashi Y,Wada H,Rossios C,etal.A novel macrolide solithromycin exerts superior anti-inflammatory effect via NF-κB inhibition [J].J Pharmacol Exp Ther,2013,345(1):76-84.
[12]Saraya T,Nakata K,Nakagaki K,etal.Identification of a mechanism for lung inflammation caused by Mycoplasma pneumoniae using a novel mouse model [J].Results Immunol,2011,1(1):76-87.
[13]Russo RC,Garcia CC,Teixeira MM,etal.The CXCL8/IL-8 chemokine family and its receptors in inflammatory diseases [J].Expert Rev Clin Immunol,2014,10(5):593-619.
[14]毕慧娟,王健,黄河胜,等.慢性乙肝患者外周血单个核细胞中CXCR1、CXCR2及IL-8 mRNA表达与干扰素治疗关系[J].细胞与分子免疫学杂志,2012,28(4):422-425.
[15]Jornot L,Cordey S,Caruso A,etal.T lymphocytes promote the antiviral and inflammatory responses of airway epithelial cells [J].PLoS One,2011,6(10):e26293.
[16]Liu L,Gao Z,Xia C,etal.Comparative study of trans-oral and trans-tracheal intratracheal instillations in a murine model of acute lung injury [J].Anat Rec(Hoboken),2012,295(9):1513-1519.
[17]Jundi K,Greene CM.Transcription of interleukin-8:how altered regulation can affect cystic fibrosis lung disease [J].Biomolecules,2015,5(3):1386-1398.
[18]Gottipati KR,Bandari SK,Nonnenmann MW,etal.Transcriptional mechanisms and protein kinase signaling mediate organic dust induction of IL-8 expression in lung epithelial and THP-1 cells [J].Am J Physiol Lung Cell Mol Physiol,2015,308(1):L11-L21.
[19]Wang J,Lu Q.Expression of T subsets and mIL-2R in peripheral blood of newborns with hypoxic ischemic encephalopathy [J].World J Pediatr,2008,4(2):140-144.
[20]Tsivkovskii R,Sabet M,Tarazi Z,etal.Levofloxacin reduces inflammatory cytokine levels in human bronchial epithelia cells:implications for aerosol MP-376(levofloxacin solution for inhalation)treatment of chronic pulmonary infections [J].FEMS Immunol Med Microbiol,2011,61(2):141-146.
[21]Curatolo W,Foulds G,Labadie R.Mechanistic study of the azithromycin dosage-form-dependent food effect [J].Pharm Res,2010,27(7):1361-1366.
[22]Tanaka R,Sanada S,Fujimura M,etal.Ventilatory impairment detection based on distribution of respiratory-induced changes in pixel values in dynamic chest radiography:a feasibility study [J].Int J Comput Assist Radiol Surg,2011,6(1):103-110.
[23]舒林华,尚云晓,蔡栩栩,等.肺炎支原体肺炎患儿支气管肺泡灌洗液和血清中肺表面活性蛋白的变化及意义[J].中国当代儿科杂志,2012,14(12):928-932.
[24]马香,丁明杰,赵秀侠,等.不同胸部影像学表现的肺炎支原体肺炎儿童的肺功能变化特征[J].中国当代儿科杂志,2014,16(10):997-1000.
[收稿2015-11-09修回2015-12-01]
(编辑倪鹏)
Expression of CXCL8 and its mRNA in peripheral blood of children with Mycoplasmal pneumonia
BU Xiao-Fang,WANG Jian,NI Ning,TIAN Heng-Zhong,QI Qing-Song,KONG Zhan-Yi.Department of Pediatrics,the Maternal and Child Health-Care Hospital of Huainan,Huainan 232007,China
Objective:To study the expression of CXCL8 in the serum and CXCL8 mRNA in the peripheral blood mononuclear cells(PBMCs) of the children with Mycoplasma pneumoniae pneumonia(MPP) and its clinical significance.Methods: Forty-eight children(severe cases 12,light cases 36) with MPP were recruited from October 2013 to March 2015 in the Maternal and Child Health-Care Hospital of Huainan.The concentration of the CXCL8 in serum and the level of CXCL8 mRNA in the PBMCs were measured by enzyme linked immunosorbent assay(ELISA) and polymerase chain reaction(PCR).Taking GAPDH as the internal reference,the ratio of lgcDNA/lgGAPDH was regarded as the extreme level of CXCL8 mRNA.Results: The serum level of CXCL8 and expression of CXCL8 mRNA in PBMCs in the children with MPP were (298.917±51.860)pg/ml and (1.848±0.525)lgcDNA/lgGAPDH.Compared with the normal control,there were significant differences between the two groups(P<0.05).Further observation showed that the levels of CXCL8 in serum were no significant difference between in light cases and severe illness(P>0.05).However,the expression of CXCL8 mRNA in peripheral blood of the children with severe illness was significantly higher than those in light cases(P<0.05).Intravenous infusion of Erythromycin was provided in the acute phase for seven to ten days,so that the children′s condition could be significantly controlled,and the symptoms of pulmonary inflammation were also relieved.Followed by the use of sequential therapy of Azithromycin for about two to three weeks,the children′s condition were gradually from acute stage to recovery stage.At this time,the CXCL8 and its mRNA levels in peripheral blood of the sick children were all significantly decreased comparing with those in the acute stage(P<0.05).Conclusion: The expression of CXCL8 and its mRNA were increased in the peripheral blood of the sick children with Mycoplasma pneumonia,and also correlated with the severity of the disease.CXCL8 can participate in the pathogenesis of Mycoplasma pneumonia,and has a certain cue effect on the severity and prognosis of the disease.Azithromycin can reduce the content of CXCL8 in serum of the sick children via the pathway of inhibiting the proliferation of Mycoplasma pneumoniae,and down regulate the expression of mRNA,so that the immune injury mediated by Mycoplasma pneumoniae may be gradually inhibited.
Mycoplasma pneumoniae(MP);Mycoplasma pneumoniae pneumonia(MPP);Peripheral blood mononuclear cells(PBMCs);CXCL8;mRNA
10.3969/j.issn.1000-484X.2016.08.025
R375+.2R392.11文献标志码A
1000-484X(2016)08-1195-05
卜小芳(1967年-),女,副主任医师,主要从事儿科呼吸道感染与免疫临床研究,E-mail:13956456688@126.com。
及指导教师:王健(1962年-),男,教授,硕士生导师,主要从事病原感染与免疫研究,E-mail:wangjian8237@sina.com。