坏死性凋亡和p38 MAPK通路的相互作用介导高糖引起的H9c2 心肌细胞损伤
2016-08-29梁伟杰何洁仪陈君余盛龙张稳柱宋明才陈景福冯鉴强廖新学
梁伟杰,何洁仪,陈君,余盛龙,张稳柱,宋明才,陈景福,冯鉴强,廖新学
(1. 广州市番禺区中心医院心血管内科,2. 广州市番禺区心血管疾病研究所,广东 广州 511400; 3. 中山大学附属第一医院黄埔院区心血管内科CCU,广东 广州 510700;4. 中山大学附属第一医院心血管内科,广东 广州 510080)
坏死性凋亡和p38 MAPK通路的相互作用介导高糖引起的H9c2 心肌细胞损伤
梁伟杰1,2,何洁仪1,2,陈君1,2,余盛龙1,2,张稳柱1,2,宋明才1,2,陈景福3,冯鉴强4,廖新学4
(1. 广州市番禺区中心医院心血管内科,2. 广州市番禺区心血管疾病研究所,广东 广州511400; 3. 中山大学附属第一医院黄埔院区心血管内科CCU,广东 广州510700;4. 中山大学附属第一医院心血管内科,广东 广州510080)
doi:10.3969/j.issn.1001-1978.2016.08.021
目的研究坏死性凋亡(necroptosis,Nec)和p38丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路的相互作用在高糖引起H9c2 心肌细胞损伤中的作用。方法应用细胞计数盒检测心肌细胞存活率;双氯荧光素染色荧光显微镜照相法检测细胞内活性氧(reactive oxygen species, ROS)水平;罗丹明 123染色荧光显微镜照相法测定线粒体膜电位(mitochondrial membrane potential, MMP);蛋白质免疫印迹法测定RIP3蛋白(反映Nec的指标)和p38MAPK蛋白的表达水平。结果高糖(35 mmol·L-1葡萄糖,HG)作用H9c2心肌细胞24 h可引起明显的细胞损伤,表现为细胞存活率降低,ROS生成及MMP丢失增多;应用100 μmol·L-1necrostatin-1(Nec-1,Nec特异性抑制剂)和HG共处理心肌细胞24 h或3 μmol·L-1SB203580(p38MAPK抑制剂)预处理心肌细胞60 min,再予HG作用24 h可减轻高糖引起的上述损伤。此外,HG作用心肌细胞1、3、6、9、12、24、36和48 h均能明显增加RIP3蛋白的表达水平,其中24 h时表达水平增加最明显。应用100 μmol·L-1Nec-1共处理或3 μmol·L-1SB203580预处理心肌细胞均能明显地抑制HG对RIP3蛋白表达的上调作用。另一方面,应用100 μmol·L-1Nec-1共处理心肌细胞能阻断HG对磷酸化(p)-p38MAPK表达的上调作用。结论Nec和p38 MAPK通路的相互作用介导高糖引起H9c2 心肌细胞损伤。
坏死性凋亡;p38丝裂原激活蛋白激酶;相互作用;高糖;心肌细胞;损伤
细胞死亡是生命的基本过程,不仅参与生物的发育和自稳平衡,在多种疾病的发生、发展过程中也发挥重要的作用。糖尿病心肌病(diabetic cardiomyopathy, DCM)是糖尿病的重要并发症之一,严重地危害着人类的健康与生命。在DCM发生过程中,心肌细胞死亡起关键性的启动作用。Cai等[1]报道:在糖尿病患者和动物模型中都可观察到心肌细胞死亡。细胞死亡可分为凋亡(apoptosis)、坏死(necrosis)、自噬(autophagy)和坏死性凋亡(necroptosis,Nec)[1-5]。Nec是Degterev等于2005年首次报道的一种细胞死亡方式,广泛参与缺血性心脑血管疾病、肝肾脏器损害、肿瘤及炎症反应等病理生理过程[3,6-8]。在启动Nec过程中,受体相互作用蛋白(receptor interaction protein,RIP)发挥重要的作用。目前,RIP蛋白家族由RIP1~RIP7共7个成员组成,其中RIP1 和RIP3 是参与Nec的重要分子蛋白,两者的活化并形成复合物是启动Nec的关键。多项实验证实,RIP3是调控Nec的特异性蛋白因子,过量表达的RIP3可导致Nec发生,沉默或下调RIP3的表达可不同程度地阻止细胞发生Nec[7,9-10]。有研究报道,在链脲霉素(streptozotocin)诱导的糖尿病大鼠,心肌纤维化、肥厚、炎症的发生伴随着RIP3的大量表达[11],提示Nec可能参与高血糖引起的心肌损伤。另有报道指出:Nec与p38丝裂原激活蛋白激酶(mitogen-activated protein kinase, MAPK)通路的关系非常密切,p38MAPK通路可介导Nec的发生[12-13]。但是,在DCM细胞模型中,Nec能否介导高糖(high glucose, HG)引起的心肌细胞损伤,Nec与p38MAPK之间的关系如何,目前尚未见报道。
为此,本研究通过HG损伤H9c2心肌细胞建立DCM细胞模型[14],旨在探讨:① Nec能否介导HG引起的心肌细胞损伤;② 在HG损伤心肌细胞过程中,Nec和p38MAPK通路之间是否存在相互作用关系。
1 材料与方法
1.1材料抗RIP3抗体、抗p-p38MAPK抗体和抗t-p38MAPK抗体购自Cell Signaling(USA);特级胎牛血清购自Gibco BRL(USA);DMEM培养基由Hyclone公司(USA)供应;罗丹明123(rhodamine 123, Rh 123)和双氯荧光素( 2’,7’-dichlorfluorescein-diacetate,DCFH-DA)、SB203580(p38MAPK通路抑制剂)、necrostatin-1(Nec-1,Nec特异性抑制剂)购自Sigma-Aldrich(USA);SB203580和Nec-1按照产品说明采用二甲基亚砜(DMSO)溶解后、DMEM培养基稀释至目标浓度使用;细胞计数试剂盒8(cell counter kit-8, CCK-8)由Dojindo Lab(Japan)提供;H9c2 心肌细胞取自中山大学实验动物中心。
1.2细胞培养及实验分组H9c2 心肌细胞来源于大鼠胚胎期的心脏组织,置于含5% CO2的37 ℃温箱中,于含10%胎牛血清的DMEM培养基中培养。实验分为6组:(A)对照(control)组:DMEM培养基(5.5 mmol·L-1葡萄糖)处理心肌细胞24 h;(B)高糖(high glucose, HG)组:35 mmol·L-1葡萄糖作用心肌细胞24 h;(C)Nec-1+HG组:100 μmol·L-1Nec-1和35 mmol·L-1葡萄糖共处理心肌细胞24 h;(D)SB203580+HG组:3 μmol·L-1SB203580作用心肌细胞60 min,撤去,PBS洗2次,然后35 mmol·L-1葡萄糖处理心肌细胞24 h;(E)Nec-1组:100 μmol·L-1Nec-1和DMEM培养基共处理心肌细胞24 h;(F) SB203580组:3 μmol·L-1SB203580作用心肌细胞60 min,撤去,PBS洗2次,然后DMEM处理心肌细胞24 h。
1.3CCK-8 测定心肌细胞存活率将H9c2 心肌细胞接种于96孔培养板中,当细胞生长至约80%培养孔面积时,按照分组采取不同的处理后,弃上清, PBS液洗3次,于每孔加入90 μL DMEM和10 μL CCK-8溶液,37 ℃温箱中孵育2.5 h,酶标仪(λ=450 nm)记录各孔的吸光度(A)。取5孔A值的平均数,按以下的公式计算细胞存活率:细胞存活率/%=处理组A /对照组A×100%。实验重复5次。
1.4DCFH-DA染色测定细胞内活性氧(reactive oxygen species, ROS)水平将H9c2 心肌细胞接种于24孔培养板中,当细胞生长至约80%培养孔面积时,按照分组采取不同处理后,PBS液洗3次,加入10 μmol·L-1DCFH-DA染液,37℃温箱中孵育30 min,然后用PBS液洗3次。在荧光显微镜下随机选取5个不重复区摄片,用ImageJ 1.47i软件分析5个视野绿色荧光强度的平均值[平均荧光强度(mean fluorescence intensity,MFI),能间接反映ROS水平,数值越大,表示ROS水平越高],并进行数据统计分析。实验重复5次。
1.5Rh 123染色测定线粒体膜电位(mitochondrial membrane potential, MMP)将H9c2 心肌细胞接种于24孔培养板中,当细胞生长至约80%培养孔面积时,按照分组采取不同处理后,PBS液洗3次,加入10 μg·L-1Rh 123染液,37 ℃温箱中孵育45 min,然后PBS液洗3次。在荧光显微镜下随机选取5个不重复区摄片,细胞核周围绿色的亮点即为摄取了Rh 123的线粒体。Image J 1.47i软件分析5个视野绿色荧光的MFI(其数值大小可反映MMP水平高低),并进行数据统计分析。实验重复5次。
1.6蛋白质免疫印迹法检测RIP3和p38MAPK蛋白的表达水平将H9c2 心肌细胞接种于60 mm培养皿中,培养至约80%满时,按照实验分组采取不同的处理后,去上清液,PBS液洗涤后加入细胞裂解液,4 ℃摇床中作用30 min,14 000×g高速离心10 min,吸取上清液,二喹啉甲酸法进行蛋白定量。总蛋白经十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离后,转移到二氟化树脂膜上。5%脱脂奶粉常温下封闭60 min,随后分别加入抗RIP3、抗t-p38或抗p-p38 抗体(浓度为1 ∶1 000),4 ℃孵育过夜,用预冷的TBST洗3 次,每次5 min,然后与相应的二抗(浓度为1 ∶2 500)室温下孵育1.5 h,再予TBST洗3次,每次5 min。用增强化学发光法使二氟化树脂膜显色,暗室中将显色条带曝光到医用X线片上,凝胶成像系统扫描分析结果。实验重复5次。
2 结果
2.1Nec-1和SB203580抑制高糖引起的心肌细胞毒性Fig 1A显示,35 mmol·L-1葡萄糖(高糖,HG)作用心肌细胞24 h可引起明显的心肌细胞毒性,降低细胞存活率,与正常对照组比较,差异具有统计学意义(P<0.01)。分别应用75、100、200、400、600、800 μmol·L-1Nec-1与HG共处理心肌细胞24 h,均能使细胞存活率升高,与HG组比较,差异有统计学意义(P<0.05),其中100 μmol·L-1Nec-1对细胞毒性的抑制作用最为明显。单纯采用75、100、200、400、600、800 μmol·L-1Nec-1和DMEM分别共处理心肌细胞24 h均不影响细胞存活率(Fig 1B)。根据上述结果,本研究采用Nec-1的作用浓度为100 μmol·L-1。
与Nec-1的作用相类似,在HG作用前,应用3 μmol·L-1SB203580预处理心肌细胞60 min,也可提高细胞存活率,与HG组比较,差异具有统计学意义(P<0.01)。3 μmol·L-1SB203580本身对心肌细胞存活率无明显的影响(Fig 1C)。
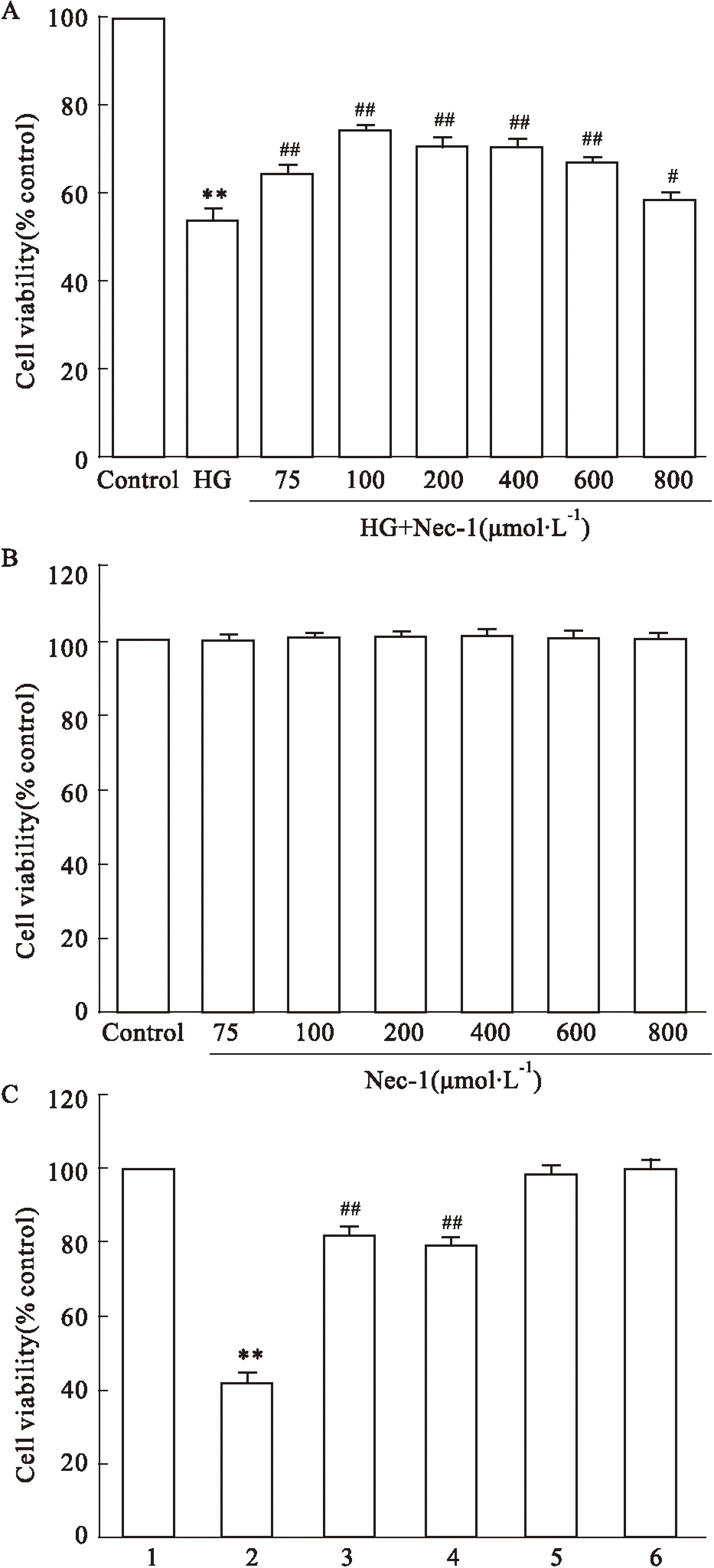
Fig 1 Nec-1 and SB203580 inhibit HG-induced cytotoxicity in H9c2 cardiac cells (n=5)
1: Control; 2: Glucose 35 mmol·L-1; 3: Nec-1 100 μmol·L-1+ Glucose 35mmol·L-1; 4: SB203580 3 μmol·L-1+ Glucose 35mmol·L-1; 5: Nec-1 100 μmol·L-1. 6: SB203580 3 μmol·L-1.**P<0.01vscontrol group;#P<0.05,##P<0.01vsthe HG-treated group.
2.2Nec-1和SB203580抑制高糖引起的心肌细胞ROS堆积Fig 2B显示,采用HG作用H9c2 心肌细胞24 h可使胞内DCFH-DA的MFI升高至(31.4±1.37)%,与正常对照组[MFI值为(11.1±0.81)%,Fig 2A]相比,差异具有统计学意义(P<0.01)。然而,100 μmol·L-1Nec-1和HG共处理心肌细胞24 h,可使MFI降低至(15.7±1.07)%,与HG组比较,两者差异具有统计学意义(P<0.01,Fig 2C)。单纯100 μmol·L-1Nec-1和DMEM共处理心肌细胞24 h对心肌细胞ROS的生成无明显的影响(P>0.05,Fig 2E)。
与Nec-1的作用相类似,在HG作用前,应用3 μmol·L-1SB203580预处理心肌细胞60 min,可使MFI降低至(14.2±0.78)%,与HG组比较,差异具有统计学意义(P<0.01,Fig 2D)。3 μmol·L-1SB203580对心肌细胞ROS的生成无明显的影响(P>0.05,Fig 2F)。
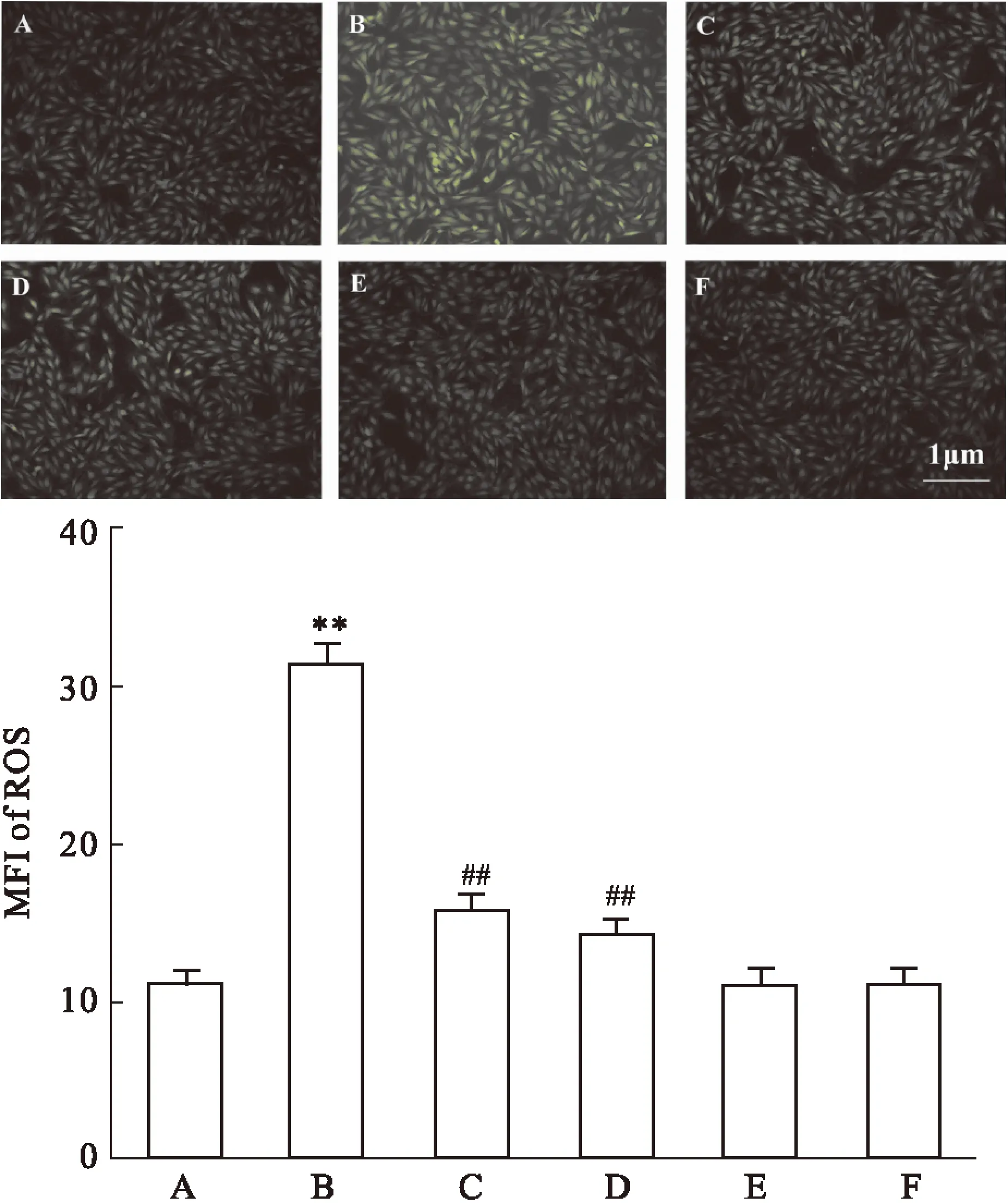
Fig 2 Nec-1 and SB203580 inhibit HG-induced accumulation of intracellular reactive oxygen species (ROS) in H9c2 cardiac cells (n=5)
A: Control; B: Glucose 35 mmol·L-1; C: Nec-1 100 μmol·L-1+ Glucose 35mmol·L-1; D: SB203580 3 μmol·L-1+ Glucose 35mmol·L-1; E: Nec-1 100 μmol·L-1. F: SB203580 3 μmol·L-1.**P<0.01vscontrol group;##P<0.01vsthe HG-treated group.
2.3Nec-1和SB203580抑制高糖引起的心肌细胞MMP丢失Fig 3显示,采用HG作用H9c2 心肌细胞24 h可使胞内Rh 123的MFI从(31.5±1.20)%(正常对照组,Fig 3A)降低至(10.6±0.90)%(Fig 3B),两组差异具有统计学意义(P<0.01)。采用100 μmol·L-1Nec-1和HG共处理心肌细胞24 h,可使MFI升高至(21.8±1.14)%(Fig 3C),与HG组比较,差异具有统计学意义(P<0.01)。单纯Nec-1本身对心肌细胞MMP无明显的影响(P>0.05,Fig 3E)。
与Nec-1的作用相类似,在HG作用前,应用3 μmol·L-1SB203580预处理心肌细胞60 min,可使心肌细胞内Rh 123的MFI升高至(20.5±1.20)%,与HG组比较,两者差异具有统计学意义(P<0.01,Fig 3D)。SB203580本身对心肌细胞MMP无明显的影响(P>0.05,Fig 3F)。
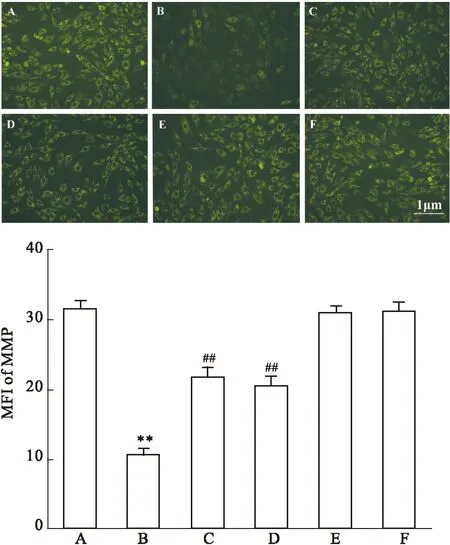
Fig 3 Nec-1 and SB203580 inhibit HG-induced mitochondrial membrane potential (MMP) loss in H9c2 cardiac cells (n=5)
A: Control; B: Glucose 35 mmol·L-1; C: Nec-1 100 μmol·L-1+ Glucose 35mmol·L-1; D: SB203580 3 μmol·L-1+ Glucose 35mmol·L-1; E: Nec-1 100 μmol·L-1. F: SB203580 3 μmol·L-1.**P<0.01vscontrol group;##P<0.01vsthe HG-treated group.
2.4HG促进心肌细胞RIP3蛋白的表达Fig 4显示,HG分别作用H9c2心肌细胞1、3、6、9、12、24、36和48 h均能增加RIP3蛋白的表达,与正常对照组比较,差异均具有统计学意义(P均<0.01),其中HG作用心肌24 h时,RIP3表达增加最明显。
2.5Nec-1和SB203580减弱HG对心肌细胞RIP3蛋白表达的上调作用如前所述,HG可上调心肌细胞RIP3蛋白的表达;在HG作用前,应用100 μmol·L-1Nec-1和HG共处理心肌细胞24 h或应用3 μmol·L-1SB203580预处理60 min后,再予HG作用心肌细胞24 h,RIP3的表达水平明显减少,与HG组对比,差异均具有统计学意义(P均<0.01)。100 μmol·L-1Nec-1或3 μmol·L-1SB203580本身对心肌细胞RIP3蛋白的基础表达无明显的影响(Fig 5)。
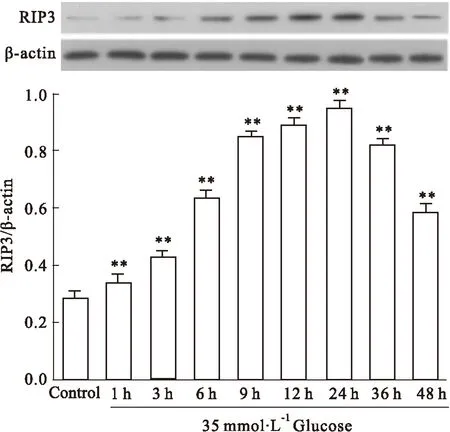
Fig 4 HG promotes expression of RIP3 protein in H9c2 cardiac cells (n=5)
H9c2 cardiac cells were exposed to HG for a 48 h period.**P<0.01vscontrol group.
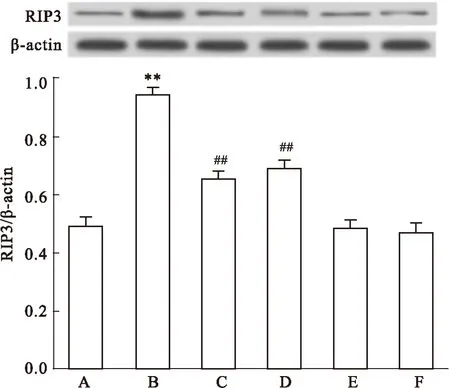
Fig 5 Nec-1 and SB203580 attenuate HG-induced up-regulation of RIP3 expression in H9c2 cardiac cells (n=5)
A: Control; B: Glucose 35 mmol·L-1; C: Nec-1 100 μmol·L-1+ Glucose 35mmol·L-1; D: SB203580 3 μmol·L-1+ Glucose 35mmol·L-1; E: Nec-1 100 μmol·L-1. F: SB203580 3 μmol·L-1.**P<0.01vscontrol group;##P<0.01vsthe HG-treated group.
2.6Nec-1减轻HG对心肌细胞磷酸化p38MAPK表达的上调作用Fig 6显示,应用HG处理心肌细胞24 h可使p-p38MAPK表达水平明显增加,与正常对照组比较,差异具有统计学意义(P<0.01)。应用100 μmol·L-1Nec-1和HG共处理心肌细胞24 h,p-p38MAPK的表达水平明显降低,与HG组比较,差异具有统计学意义(P<0.01)。100 μmol·L-1Nec-1本身对心肌细胞p-p38MAPK的基础表达无明显的影响。
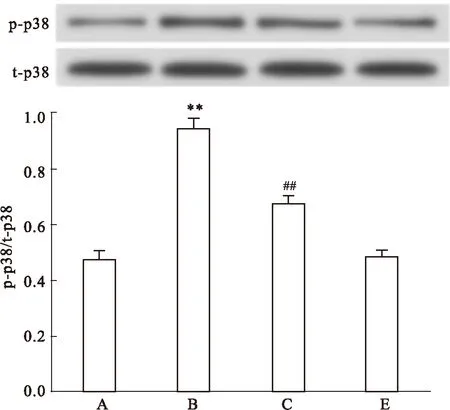
Fig 6 Nec-1 attenuates HG-induced up-regulation of p-p38MAPK expression in H9c2 cardiac cells (n=5)
A: Control; B: Glucose 35 mmol·L-1; C: Nec-1 100 μmol·L-1+ Glucose 35mmol·L-1; E: Nec-1 100 μmol·L-1.**P<0.01vscontrol group;##P<0.01vsthe HG-treated group.
3 讨论
心肌细胞死亡在DCM的发生过程中发挥重要作用[1]。细胞的死亡方式包括apoptosis、necrosis、autophagy和Nec[1-5]。已有实验证实:apoptosis、necrosis和autophagy参与DCM的发生和发展[2,3,15]。然而,Nec是否参与高血糖引起的心肌细胞损伤,目前尚未完全明了。最近,Liu等[11]观察到,糖尿病大鼠在出现左心室重构及舒张功能障碍的同时,伴随有RIP3表达明显增加,提示Nec与糖尿病大鼠心肌损伤有关。但是,他们没有应用抑制Nec的技术与方法进一步探讨Nec在糖尿病心肌损伤中的作用。本实验在观察到HG引起心肌细胞损伤(包括细胞毒性、氧化应激和线粒体损伤)的同时,能明显地上调心肌细胞RIP3蛋白的表达,采用Nec的特异性抑制剂Nec-1共处理心肌细胞不仅能减轻HG引起的心肌细胞损伤,使细胞存活率升高,ROS生成及MMP丢失减少,而且能明显地抑制RIP3表达的上调。上述结果清晰地提示:Nec介导HG引起的心肌细胞毒性、氧化应激和线粒体受损等损伤,这从细胞学水平进一步深化了Liu等[11]的研究结果,为阐明Nec在糖尿病心肌损伤中的作用提供了新颖的实验依据。
重要的是,我们进一步探讨了Nec与p38MAPK通路的关系。p38MAPK通路是MAPK家族的重要成员之一,可被各种刺激(如炎症、缺血缺氧、化学损伤等)激活,参与调控细胞生长、分化、凋亡等病理生理过程[16-17]。本研究和我们之前的研究[14,18]表明,Nec和p38MAPK通路可介导HG引起的H9c2 心肌细胞损伤,然而它们两者之间的关系尚不清楚。在本实验中,Nec的抑制剂Nec-1能明显地抑制HG对p-p38MAPK表达的上调,提示Nec可通过激活p38MAPK通路引起心肌细胞损伤,这与之前其他细胞模型的研究结论相似[12-13];另一方面,p38MAPK通路的抑制剂SB203580能对抗HG引起RIP3表达的上调,提示HG激活的p38MAPK通路可促进Nec的发生。因此,我们的研究证实:在HG损伤心肌细胞模型中,HG可激活p38 MAPK通路和诱导Nec发生,两者之间存在正相互作用,Nec可激活p38MAPK通路,而激活的p38MAPK通路也可促进Nec的发生,两者之间形成一个正反馈回路,在HG引起的心肌细胞毒性、氧化应激和线粒体损伤过程中发挥重要作用。
综上所述,本实验证实,Nec可介导HG诱导的H9c2 心肌细胞损伤,Nec与p38MAPK通路之间的正相互作用可能是HG引起心肌细胞损伤的重要机制之一。
(致谢:本实验在中山大学中山医学院科技楼开展,感谢冯鉴强教授和廖新学教授对本实验设计、文稿书写提出了很多宝贵的意见和建议。)
[1]Cai L, Kang Y J. Cell death and diabetic cardiomyopathy[J].CardiovascToxicol, 2003, 3(3): 219-28.
[2]Nunes T,Bernardazzi C,de Souza H S. Cell death and inflammatory bowel diseases: apoptosis, necrosis, and autophagy in the intestinal epithelium[J].BiomedResInt,2014, 2014: 218493.
[3]Zhou W, Yuan J. Necroptosis in health and diseases[J].SeminCellDevBiol, 2014, 35: 14-23.
[4]李欣志, 刘建勋. 缺血/再灌注过程中心肌细胞自噬研究进展[J]. 中国药理学通报, 2008, 24(6): 704-7.
[4]Li X Z, Liu J X. Role of autophagy in cardiac myocyte during ischemia/reperfusion[J].ChinPharmacolBull, 2008, 24(6): 704-7.
[5]吴振, 吴立军, 田代真一, 等. 紫草素诱导HeLa细胞凋亡经过caspase激活的机制[J].中国药理学通报, 2004, 20(5): 540-4.
[5]Wu Z, Wu L J, Tian D Z Y, et al. Shikonin induce HeLa cell apoptosis via a caspase-dependent mechanism[J].ChinPharmacolBull, 2004, 20(5): 540-4.
[6]Zhao H, Jaffer T, Eguchi S, et al. Role of necroptosis in the pathogenesis of solid organ injury[J].CellDeathDis, 2015, 6: e1975.
[7]Luedde M, Lutz M, Carter N, et al. RIP3, a kinase promoting necroptotic cell death, mediates adverse remodelling after myocardial infarction[J].CardiovascRes, 2014, 103(2): 206-16.
[8]Degterev A, Huang Z, Boyce M, et al. Chemical inhibitor of nonapoptotic cell death with therapeutic potential for ischemic brain injury[J].NatChemBiol, 2005, 1(2): 112-9.
[9]Cho Y S, Challa S, Moquin D, et al. Phosphorylation-driven assembly of the RIP1-RIP3 complex regulates programmed necrosis and virus-induced inflammation[J].Cell, 2009, 137(6): 1112-3.
[10] Degterev A, Zhou W, Maki J L, et al. Assays for necroptosis and activity of RIP kinases[J].MethodsEnzymol, 2014, 545: 1-33.
[11] Liu Y S, Huang Z W, Wang L, et al. Sitagliptin alleviated myocardial remodeling of the left ventricle and improved cardiac diastolic dysfunction in diabetic rats[J].JPharmacolSci, 2015, 127(3): 260-74.
[12] Wang D, Zhao M, Chen G, et al. The histone deacetylase inhibitor vorinostat prevents TNFα-induced necroptosis by regulating multiple signaling pathways[J].Apoptosis, 2013, 18(11): 1348-62.
[13] 贾晓芳, 张勤丽, 牛侨. MAPK信号通路在铝致SH-SY5Y细胞死亡中的作用[J]. 卫生研究, 2014, 43(6): 917-22.
[13] Jia X F, Zhang Q L, Niu Q. MAPK signaling pathways involved in aluminum-induced apoptosis and necroptosis in SH-SY5Y cells[J].JHygRes, 2014, 43(6): 917-22.
[14] Xu W, Wu W, Chen J, et al. Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J].IntJMolMed, 2013, 32(4): 917-25.
[15] Varga Z V, Giricz Z, Liaudet L, et al. Interplay of oxidative, nitrosative/nitrative stress, inflammation, cell death and autophagy in diabetic cardiomyopathy[J].BiochimBiophysActa, 2015, 1852(2): 232-42.
[16] 刘丹, 尹东, 廖章萍, 等. p38MAPK/14-3-3γ通路在LPS预处理对抗心肌细胞缺氧/复氧损伤中的作用[J]. 中国药理学通报, 2012, 28(9): 1239-43.
[16] Liu D, Yin D, Liao Z P, et al. Role of p38MAPK/14-3-3γ signal pathway in LPS preconditioning against cardiomyocytes anoxia/ reoxygenation injury[J].ChinPharmacolBull, 2012, 28(9): 1239-43.
[17] 王超, 张会欣, 邢邯英, 等. 通心络胶囊抑制p38 MAPK磷酸化抑制糖尿病周围神经病变小鼠氧化应激[J]. 中国药理学通报, 2015, 31(5): 726-30.
[17] Wang C, Zhang H X, Xing H Y, et al. Tongxinluo capsule inhibits oxidative stress in diabetic peripheral neuropathy mice by inhibiting the activity of p-p38 MAPK[J].ChinPharmacolBull, 2015, 31(5): 726-30.
[18] 徐文明, 陈景福, 田丽红, 等. 瘦素-p38MAPK通路介导高糖对H9c2心肌细胞的损伤[J]. 中国动脉硬化杂志, 2014, 22(5): 433-7.
[18] Xu W M, Chen J F, Tian L H, et al. Leptin-p38MAPK pathway mediates high glucose-induced injury in H9c2 cardiac cells[J].ChinJArterioscler, 2014, 22(5): 433-7.
Interaction between necroptosis and p38MAPK pathway mediates high glucose-induced injury in H9c2 cardiac cells
LIANG Wei-jie1,2, HE Jie-yi1,2, CHEN Jun1,2, YU Sheng-long1,2,ZHANG Wen-zhu1,2, SONG Ming-cai1,2,CHEN Jing-fu3, FENG Jian-qiang4, LIAO Xin-xue4
(1.DeptofCardiology,CentralHospitalofPanyuDistrict,Guangzhou511400,China; 2.CardiovascularInstituteofPanyuDistrict,Guangzhou511400,China; 3.CardiacCareUnitofDeptofCardiology,HuangpuDivisionoftheFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510700,China; 4.DeptofCardiology,theFirstAffiliatedHospital,SunYat-senUniversity,Guangzhou510080,China)
AimTo investigate the role of the interaction between necroptosis (Nec) and p38 mitogen-activated protein kinase (MAPK) pathway in the high glucose (HG)-induced H9c2 cardiac cells injury. MethodsThe cell viability was measured by cell counter kit-8 assay. The intracellular level of reactive oxygen species (ROS) was tested by DCFH-DA stating followed by photofluorography. Mitochondrial membrane potential (MMP) was detected by Rhodamine 123 staining followed by photofluorography. The expression levels of receptor interaction protein 3 (RIP3, an indicator of Nec) and p38MAPK protein were tested by Western blot assay. ResultsThe treatment of H9c2 cardiac cells with 35 mmol·L-1glucose (high glucose, HG) for 24 h induced considerable injuries, including a decrease in cell viability, increases in ROS generation as well as MMP loss. The co-treatment of the cells with 100 μmol·L-1necrostatin-1(Nec-1,a specific inhibitor of Nec)and HG for 24 h or the pre-treatment of the cells with 3 μmol·L-1SB203580 (an inhibitor of p38MAPK) for 60 min before HG exposure attenuated the above injuries induced by HG. Moreover, the treatment of the cells with HG for 1,3,6,9,12,24,36 and 48 h significantly increased the expression levels of RIP3, peaking at 24 h. The co-treatment of the cells with 100 μmol·L-1Nec-1 or the pre-treatment of the cells with 3 μmol·L-1SB203580 considerably blocked the up-regulation of RIP3 expression induced by HG. On the other hand, the co-treatment of the cells with 100 μmol·L-1Nec-1 alleviated the HG-induced up-regulation of the expression of p-p38MAPK. ConclusionThe interaction between Nec and p38MAPK pathway mediates the HG-induced injury in H9c2 cardiac cells.
necroptosis; p38 mitogen-activated protein kinase; interaction; high glucose; cardiomyocyte; injury
2016-03-15,
2016-04-15
国家自然科学基金资助项目(No 81270296);广东省财政科技项目(No 2014SC107)
梁伟杰(1981-),男,硕士,主治医师,研究方向:心血管介入和心血管疾病的保护机制,Tel: 020-34859342,E-mail:279096515@qq.com;
廖新学(1965-),男,博士,主任医师,博士生导师,研究方向:心血管疾病的损伤与保护机制,通讯作者,Tel: 020-87332628,E-mail:liaoxinx@mail.sysu.edu.cn
A
1001-1978(2016)08-1138-07
R322.11;R329.25;R341;R345.57;R587.1
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.042.html