白杨素对TNF-α诱导慢性暴露TGF-β卵巢癌OVCAR-3细胞系球形成的影响
2016-08-29彭耀金崔迎红孙姝雯曹建国
李 朵,彭耀金,陈 阿,崔迎红,孙姝雯,曹建国
(湖南师范大学医学院,湖南 长沙 410013)
白杨素对TNF-α诱导慢性暴露TGF-β卵巢癌OVCAR-3细胞系球形成的影响
李朵,彭耀金,陈阿,崔迎红,孙姝雯,曹建国
(湖南师范大学医学院,湖南 长沙410013)
doi:10.3969/j.issn.1001-1978.2016.08.020
目的研究白杨素对肿瘤坏死因子-α(TNF-α)诱导慢性暴露转化生长因子-β(TGF-β)卵巢癌OVCAR-3细胞系球形成的影响,并探讨其作用机制是否涉及下调NF-κB(p65)蛋白表达。方法TNF-α(10 μg·L-1)处理TGF-β(5 μg·L-1)预暴露12 d的卵巢癌OVCAR-3细胞24 h,球形成率测定法检测不同浓度(5.0、10.0、20.0 μmol·L-1)白杨素对球形成率的影响;Western blot检测NF-κB(p65)蛋白表达;NF-κB(p65) siRNA转染探讨作用机制。结果TNF-α(10 μg·L-1)联合慢性暴露TGF-β(5 μg·L-1)处理增高OVCAR-3细胞系球形成率。白杨素能有效地拮抗致炎因子诱导卵巢癌细胞自我更新作用,呈剂量依赖性(P<0.05),并伴随着NF-κB(p65)蛋白表达下调。与对照siRNA相比,NF-κB(p65) siRNA转染OVCAR-3细胞NF-κB(p65)蛋白表达下调,并明显增强白杨素抑制球形成作用。结论下调NF-κB(p65)蛋白表达参与白杨素抑制TNF-α(10 μg·L-1)联合慢性暴露TGF-β(5 μg·L-1)处理诱导卵巢癌OVCAR-3细胞系球形成作用。
卵巢癌;白杨素;球形成率;TNF-α;TGF-β;NF-κB(p65)
卵巢癌早期即可在腹腔内种植扩散,因其生长隐秘、迅速,约70%的患者初诊时已属晚期,其死亡率在女性生殖系统恶性肿瘤中居首位,严重威胁着女性的生命健康[1]。据肿瘤干细胞学说,人们推定卵巢癌干细胞可能是卵巢癌发生、转移、侵袭、复发和耐药的根本原因,因此,清除肿瘤干细胞是改善卵巢癌治疗效果的策略之一[2-3]。有研究表明,转化生长因子β(transforming growth factor-β, TGF-β)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)或两者共同诱导获得肿瘤干细胞特性[4-6]。白杨素(chrysin, ChR)作为一种蜂胶中含量最高的天然黄酮类化合物,近期发现它具有抑制肿瘤干细胞自我更新的作用[7-10]。本文主要检测白杨素是否具有逆转TNF-α处理慢性暴露TGF-β诱导人卵巢癌OVCAR-3细胞系球形成作用,并探讨其作用机制是否涉及抑制核因子-κB(nuclear factor-kappa B, NF-κB)活性。
1 材料与方法
1.1受试物与试剂白杨素购自美国Sigma 公司,用二甲基亚砜(dimethyl sulfoxide, DMSO)溶解,实验组培养体系中DMSO 的最高终浓度为不影响细胞生长速率的浓度(0.1%)。鼠抗人NF-κB(p65)抗体购自美国Santa Cruz Biotechnology公司;鼠抗人β-actin单克隆抗体购自美国Sigma-Aldrich公司。NF-κB(p65) siRNA依据GenBank(基因登记号. M61909)设计;NF-κB(p65) siRNA和乱序对照siRNA购自上海Invitrogen公司。NF-κB(p65) siRNA序列为:5’-GCCTTAATAGTAGGGTAAGTT-3’。乱序对照siRNA序列为:5’-UUCUCCGAACGUGUCACGUTT-3’。Lipofectamine RNAiMAX购自美国Invitrogen公司。TGF-β和TNF-α购自北京义翘神州生物技术有限公司。
1.2细胞与球培养人卵巢癌OVCAR-3细胞系细胞购自中国科学院细胞库。按照文献[11-12]所述方法,进行细胞培养和球培养,分别得到单层贴壁生长细胞和非黏附克隆性生长的球(球体直径 ≥ 50.0 μm)细胞。
1.3球形成率测定实验分组设计为Mock组:完全培养基对照组;TGF-β组: TGF-β(5.0 μg·L-1)处理OVCAR-3细胞12 d;TGF-β+TNF-α组:TGF-β(5.0 μg·L-1)处理OVCAR-3细胞12 d,或者在不同浓度白杨素(5、10、20 μmol·L-1)存在或者缺失情况下,TNF-α(10.0 μg·L-1)联合TGF-β(5.0 μg·L-1)处理24 h。分别收集细胞,并以无血清干细胞条件培养基悬浮细胞,调节细胞密度为1×106·L-1,每孔1.0 mL,接种于24孔超低黏附培养板,培养8 d,计数每孔球数目。球形成率计算公式如下:球形成率/% = 每孔肿瘤球均数/每孔接种活细胞总数(1 000个细胞)×100%。
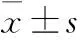
1.5NF-κB p65 siRNA转染按照文献[8]方法,用DMEM培养基悬浮卵巢癌OVCAR-3细胞,并调节细胞密度为5×107·L-1, 每孔2.0 mL,接种于6孔细胞培养板。培养24 h, 细胞达到约50%融合,按照供应商说明书的方法和步骤,用Lipofectamine RNAiMAX试剂将50 nmol·L-1NF-κB(p65) siRNA或乱序对照siRNA(Control siRNA)转染入细胞。转染24 h后进行相应TGF-β(5.0 μg·L-1)、TNF-α(10.0 μg·L-1)、白杨素处理。
2 结果
2.1TNF-α诱导TGF-β慢性暴露卵巢癌OVCAR-3细胞球形成干细胞条件培养基超低黏附板悬浮培养OVCAR-3细胞系细胞8 d,形成非黏附克隆性球。用球形成率测定法对比Mock、TGF-β和TNF-α+TGF-β 3组卵巢癌OVCAR-3细胞系球形成率。结果显示,与Mock组相比,TGF-β能增高卵巢癌OVCAR-3细胞系肿瘤球形成率,且TNF-α能进一步增强TGF-β诱导卵巢癌OVCAR-3细胞系球形成能力作用(Fig 1)。

Fig 1 Influence of inflammatory factor TGF-β and TNF-α on rate of tumor sphere formation of ovarian OVCAR-3 cells
Treatment with TGF-β and TGF-β plus TNF-α increased the rate of tumor sphere formation of ovarian OVCAR-3 cells.*P<0.05vsuntreated OVCAR-3 cells;#P<0.05vsOVCAR-3 cells treated with 5.0 μg·L-1TGF-β alone.
2.2白杨素抑制TNF-α诱导TGF-β慢性暴露卵巢癌OVCAR-3细胞系球形成采用不同浓度(5.0、10.0、20.0 μmol·L-1)白杨素处理TGF-β+TNF-α组OVCAR-3细胞,球形成率测定法检测细胞自我更新能力作用。Fig 2结果显示,不同浓度白杨素以浓度依赖方式抑制TGF-β慢性暴露合并TNF-α处理诱导卵巢癌OVCAR-3细胞系球形成作用(P<0.05)。
2.3白杨素逆转TNF-α联合TGF-β慢性暴露上调卵巢癌OVCAR-3细胞NF-κB(p65)蛋白表达作用与Mock组相比,TGF-β组和TGF-β+TNF-α组卵巢癌OVCAR-3细胞NF-κB(p65)蛋白表达增强(Fig 3A)。结果说明TGF-β和TNF-α联合处理能有效地激活人卵巢癌OVCAR-3细胞NF-κB经典信号传导通路。不同浓度白杨素(5.0、10.0、20.0 μmol·L-1)孵育TGF-β慢性暴露合并TNF-α处理的卵巢癌OVCAR-3细胞,抗NF-κB(p65)抗体进行Western blot分析。结果如Fig 3B所示,白杨素以浓度依赖方式抑制TNF-α处理合并TGF-β慢性暴露增高卵巢癌OVCAR-3细胞NF-κB(p65)蛋白表达水平(P<0.05)。

Fig 2 Effect of chrysin on rate of tumor sphere formation of OVCAR-3 cells induced by inflammatory factor
Chrysin suppressed self-renew of ovarian stem-like cells increased by inflammatory factor in a dose dependent manner.*P<0.05vsOVCAR-3 cells treated without chrysin;#P<0.05vsOVCAR-3 cells treated with 5.0 μmol·L-1chrysin.
2.4NF-κB(p65) siRNA与白杨素合用对致炎因子诱导卵巢癌OVCAR-3细胞NF-κB(p65)蛋白表达和球形成的影响与乱序对照 siRNA转染细胞比较,NF-κB(p65) siRNA转染下调TGF-β和TNF-α联合处理诱导卵巢癌OVCAR-3细胞NF-κB(p65)蛋白表达(Fig 4A)和抑制球形成(Fig 4B)。同时,NF-κB(p65) siRNA转染协作白杨素抑制TNF-α处理合并TGF-β慢性暴露诱导卵巢癌OVCAR-3细胞自我更新和NF-κB(p65)蛋白表达水平增高作用。
3 讨论
致炎因子TGF-β和TNF-α诱导肿瘤细胞上皮间充质转化表型,从而赋予肿瘤干细胞功能和特性[4]。比较肿瘤球形成率大小是评价肿瘤细胞干细胞特性的一个重要指标,肿瘤球形成作用提高表示细胞的自我更新能力增强。本文采用TNF-α联合慢性暴露TGF-β方案处理卵巢癌OVCAR-3细胞,球形成率测定结果说明TGF-β(5.0 μg·L-1)联合慢性暴露TNF-α(10 μg·L-1)处理能有效地增强卵巢癌OVCAR-3细胞系细胞自我更新能力。结果显示,致炎因子促成OVCAR-3细胞系卵巢癌干样细胞表型。

Fig 3 Inhibitory effect of chrysin on expression level of NF-κB(p65) in OVCAR-3 cells increased by inflammatory factor
A: Comparison of the expression level of NF-κB(p65) in OVCAR-3 cells cultured with or without the inflammatory factor.*P<0.05vsuntreated OVCAR-3 cells;#P<0.05vsOVCAR-3 cells treated with 5.0 μg·L-1TGF-β; B: Chrysin significantly reduced the expression level of NF-κB(p65) in OVCAR-3 cells treated with TNF-α and TGF-β in a dose-dependent manner.*P<0.05vsOVCAR-3 cells treated without chrysin.#P<0.05vsOVCAR-3 cells treated with 5.0 μmol·L-1chrysin.

Fig 4 Inhibitory effects of chrysin enhanced by NF-κB (p65) siRNA
A: NF-κB(p65) siRNA enhanced chrysin downregulating NF-κB(p65) expression in OVCAR-3 cells; B: NF-κB(p65) siRNA potentiated inhibitory effect of chrysin on the rate of tumor sphere formation of OVCAR-3 cells.*P<0.05vscontrol siRNA transfected OVCAR-3 cells;#P<0.05vs5.0 μmol·L-1chrysin treated control siRNA transfected OVCAR-3 cells
卵巢癌是女性常见的生殖系统恶性肿瘤,手术治疗、放化疗是目前治疗卵巢癌的主要方法。目前,治疗卵巢癌的有效方案以铂类为基础的化疗方案为主,但是其不良反应大,影响患者治疗效果[13]。近年来,白杨素的抗肿瘤作用越来越受到人们关注,许多研究表明白杨素具有预防和治疗肿瘤作用[7-10]。本研究发现白杨素以剂量依赖方式抑制TNF-α联合慢性暴露TGF-β诱导OVCAR-3细胞系球形成并下调NF-κB(p65)蛋白表达,这些结果说明,白杨素具有抑制致炎因子诱导卵巢癌干样细胞自我更新作用。
NF-κB(p65)在细胞生长分化与凋亡、炎症反应以及肿瘤发生等生物学过程中具有重要作用,它一直是人们关注的药物作用靶点[14-16]。Li等[11]研究报道,TNF-α诱导TGF-β慢性暴露人乳腺上皮细胞和乳腺癌细胞Twist1表达需要NF-κB(p65),表明这个过程涉及激活经典NF-κB信号传导途径。本文结果也证实TNF-α联合慢性暴露TGF-β诱导上调OVCAR-3细胞NF-κB(p65)蛋白表达。为了探索NF-κB(p65)蛋白表达是否参与白杨素抑制致炎因子诱导卵巢癌OVCAR-3细胞系细胞自我更新作用,我们利用NF-κB(p65) siRNA转染技术初步探讨了白杨素逆转慢性暴露TGF-β联合TNF-α诱导卵巢癌OVCAR-3细胞系球形成的作用机制。结果显示,NF-κB(p65) siRNA转染协作白杨素抑制致炎因子诱导卵巢癌OVCAR-3细胞系细胞自我更新作用,提示联合其他相关药物可增强白杨素的抑制作用。这些结果为应用白杨素干预致炎因子诱导OVCAR-3卵巢癌干样细胞表型提供了证据,并阐释了抑制炎症与肿瘤联系的关键性转录因子NF-κB活性为白杨素的作用机制之一。
(致谢:本研究在湖南师范大学药物工程重点实验室完成,感谢所有给予帮助的老师和同学。)
[1]Emons G, Kurzeder C, Schmalfeldt B, et al. Temsirolimus in women with platinum-refractory/resistant ovarian cancer or advanced/recurrent endometrial carcinoma. A phase Ⅱ study of the AGO-study group(AGO-GYN8)[J].GynecolOncol, 2016, 140(3): 450-6.
[2]于风胜, 李艺, 崔恒. 卵巢癌干细胞及卵巢癌治疗[J]. 中国实用妇科与产科杂志, 2014, 30(1): 14-7.
[2]Yu F S, Li Y, Cui H. Ovarian cancer stem cells and treatment of ovarian cancer[J].ChinJPractGynecolObstet, 2014, 30(1): 14-7.
[3]Bar J K, Grelewski P, Lis-Nawara A, et al. The role of cancer stem cells in progressive growth and resistance of ovarian cancer: true or fiction[J]?PostepHigMedDosw, 2015, 69: 1077-86.
[4]Kong F, Zhu Y, Yuan H, et al. FOXM1 regulated by ERK pathway mediates TGF-beta 1-induced EMT in NSCLC[J].OncolRes, 2014, 22(1): 29-37.
[5]Karin M, Greten F R. NF kappa B: Linking inflammation and immunity to cancer development and progression[J].NatRevImmunol, 2005, 5(10): 749-59.
[6]Watabe T, Miyazono K. Roles of TGF-beta family signaling in stem cell renewal and differentiation[J].CellRes, 2009, 19(1): 103-15.
[7]Ren K, Cao X, Liu Z, et al. 8-bromo-5-hydroxy-7-methoxychrysin targeting for inhibition of the properties of liver cancer stem cells by modulation of Twist signaling[J].IntJOncol, 2013, 43(5): 1719-29.
[8]Quan M, Xiao L, Liu Z, et al. 8-bromo-7-methoxychrysin inhibits properties of liver cancer stem cells via downregulation of beta-catenin[J].WorldJGastroenterol, 2013, 19(43): 7680-95.
[9]周亭芳, 李高峰, 李朵, 等. 白杨素增强辐射诱导宫颈癌HeLa细胞系球形成细胞凋亡[J]. 湖南师范大学学报(医学版), 2015, 12(3): 1-3.
[9]Zhou T F, Li G F, Li D, et al. Chrysin enhance radiation-induced apoptosis of sphere-forming cells from cervical cancer Hela cell line[J].JHunanNormUniv(MedSci), 2015, 12(3): 1-3.
[10]曹晓正, 杨小红, 曹建国, 等. 8-溴-7-甲氧基白杨素逆转人宫颈癌SiHa细胞系球形成细胞上皮-间叶样表型转化[J]. 中国药理学通报, 2014, 30(5): 668-71.
[10]Cao X Z, Yang X H, Cao J G, et al. 8-bromo-7-methoxychrysin reverses EMT of the sphere-forming cells derived from cervical cancer SiHa cell line[J].ChinPharmacolBull, 2014, 30(5): 668-71.
[11]Li C, Xia W, Huo L, et al. Epithelial-mesenchymal transition induced by TNF-alpha requires NF-kappa B-mediated transcriptional upregulation of Twist1[J].CancerRes, 2012, 72(5): 1290-300.
[12]Qiu X, Wang Z, Li Y, et al. Characterization of sphere-forming cells with stem-like properties from the small cell lung cancer cell line H446[J].CancerLett, 2012, 323(2): 161-70.
[13]唐敏, 李鸿, 周国梅, 等. 大黄酸调控Rac1/LIMK1/cofilin信号通路抑制卵巢癌细胞运动与侵袭[J]. 中国药理学通报, 2016, 32(3): 366-72.
[13]Tang M, Li H, Zhou G M, et al. Rhein inhibits the movement and invasion of human ovarian carcinoma cells through Rac1/LIMK1/cofilin signaling pathway[J].ChinPharmacolBull, 2016, 32(3): 366-72.
[14]Arora R, Yates C, Gary B D, et al. Panepoxydone targets NF-κB and FOXM1 to inhibit proliferation, induce apoptosis and reverse epithelial to mesenchymal transition in breast cancer[J].PLoSOne, 2014, 9(6): 1-12.
[15]Dolcet X, Llobet D, Pallares J, et al. NF-κB in development and progression of human cancer[J].VirchowsArch, 2005, 446(5): 475-82.
[16]Pateras I, Giaginis C, Tsigris C, et al. NF-kappa B signaling at the crossroads of inflammation and atherogenesis: searching for new therapeutic links[J].ExpertOpinTherTar, 2014, 18(9): 1089-101.
Effect of chrysin on sphere formation of ovarian cancer OVCAR-3 cells induced by TNF-α following chronic exposure to TGF-β
LI Duo, PENG Yao-jin, CHEN A, CUI Ying-hong, SUN Shu-wen, CAO Jian-guo
(MedicalCollege,HunanNormalUniversity,Changsha410013,China)
AimTo investigate the effect of chrysin(ChR) on sphere formation of ovarian cancer OVCAR-3 cell line induced by treatment with tumor necrosis factor-α(TNF-α) following chronic exposure to transforming growth factor-β(TGF-β), and its mechanism underlying whether this action is involved in down-regulation of NF-κB(p65) protein expression.MethodsAfter pre-exposure to TGF-β(5 μg·L-1) for 12 d, OVCAR-3 cells were treated with TNF-α(10 μg·L-1) for 24 h, tumor sphere-forming assay was used to detect the rate of tumor sphere formation of OVCAR-3 cells treated with or without various concentrations of ChR(5.0,10.0 and 20.0 μmol·L-1).The protein expression of NF-κB(p65) was analyzed using Western blot. Transfection with NF-κB(p65) siRNA was used to explore the mechanism by which ChR inhibited self-renew of OVCAR-3 cells.ResultsAfter co-treatment of TNF-α(10 μg·L-1) and chronic exposure to TGF-β(5 μg·L-1), the rate of sphere formation of ovarian cancer OVCAR-3 cells was increased. ChR effectively reduced sphere-forming capacity of ovarian cancer cells induced by inflammatory factor in a dose dependent manner(P<0.05), and the protein expression level of NF-κB(p65) was down-regulated. Compared with the cells transfected with control siRNA, the expression of NF-κB(p65) protein was down-regulated in cells transfected with NF-κB(p65) siRNA, and the NF-κB(p65) siRNA significantly enhanced the inhibitory effect of ChR on the sphere-forming capacity of OVCAR-3 cells.ConclusionsThe inhibitory effects of ChR on sphere-forming capacity of ovarian cancer OVCAR-3 cells induced by co-treatmemt of TNF-α with chronic exposure to TGF-β are involved in down-regulation of NF-κB(p65) protein expression.
ovarian cancer; chrysin; sphere formation; TNF-α; TGF-β; NF-κB(p65)
2016-03-21,
2016-04-20
湖南师范大学青年科学基金资助项目(No 医140666);国家自然科学基金面上项目(No 81172375)
李朵(1988-),女,硕士,实验师,研究方向:抗肿瘤药物药理学,E-mail:liduo1022@163.com;
曹建国(1956-),男,博士,教授,博士生导师,研究方向:抗肿瘤药物药理学,通讯作者,E-mail:caojianguo2005@126.com
A
1001-1978(2016)08-1133-05
R329.24;R394.2;R737.310.22;R977.6;R979.1
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.040.html