内向整流钾通道激动剂对异丙肾诱发心肌肥厚大鼠心律失常的抑制作用及机制研究
2016-08-29陈依春李超红杨明珠王晓露封启龙
陈依春,李超红,杨明珠,王晓露,封启龙
(1.山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,山西 太原 030001;2.新乡医学院第一附属医院,河南省神经病学研究所,河南 卫辉 453000)
内向整流钾通道激动剂对异丙肾诱发心肌肥厚大鼠心律失常的抑制作用及机制研究
陈依春1,李超红2,杨明珠1,王晓露1,封启龙1
(1.山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,山西 太原030001;2.新乡医学院第一附属医院,河南省神经病学研究所,河南 卫辉453000)
doi:10.3969/j.issn.1001-1978.2016.08.019
目的研究内向整流钾通道激动剂扎考必利(zacopride,Zac)对异丙肾上腺素(isoproterenol,ISO)诱发的心肌肥厚大鼠心律失常的抑制作用及其电生理机制。方法① 51只SD大鼠(200~230 g),随机分为对照组、ISO组和ISO+Zac组(n=17)。连续7 d经腹腔注射5 mg·kg-1ISO,建立大鼠心肌肥厚模型;② 利用体表心电图观察Zac对ISO诱发的心肌肥厚大鼠心律失常的效应;③ 应用全细胞膜片钳技术观测Zac对模型组大鼠心肌细胞内向整流钾电流(IK1)、静息电位(RMP)、延迟后除极(DADs)及触发活动(TA)的影响。结果① M型超声心动图显示,与对照组相比,ISO组大鼠左室舒张末期内径(LVEDD)和左室收缩末期内径(LVESD)均明显降低,左室后壁舒张末期厚度(LVPWd)和室间隔舒张末期厚度(IVSd)均增高(P<0.05),提示ISO诱发建立大鼠心肌肥厚模型成功;② 体表心电图显示,ISO组肥厚大鼠88.89%发生室性心律失常(频发室性期前收缩),生理盐水对照组大鼠未观察到心律失常的发生。在连续7 d给予15 μg·kg-1Zac干预后,肥厚大鼠心律失常发生率降至11.11%(P<0.05);③ 与对照组相比,ISO组大鼠RMP由(-71.05±1.27) mV降低至(-69.38±1.21) mV(P<0.05);连续7 d给予15 μg·kg-1Zac后,RMP增加至(-73.86±1.33) mV,较对照组和ISO组均明显增大(P<0.05);④ ISO+Zac组大鼠单个心肌细胞DADs和TA发生率较ISO致心肌肥厚组明显降低,由88.24%降低至11.76%(P<0.05);⑤ 与对照组相比,ISO组大鼠内向整流钾通道电流(IK1)明显降低,在给予Zac(15 μg·kg-1)后IK1明显增加(P<0.05)。结论选择性IK1通道激动剂Zac可明显抑制ISO诱发的心肌肥厚大鼠心律失常的发生,其机制与它通过增强IK1使膜电位负值增大和抑制延迟后除极的效应有关。
心律失常;内向整流钾通道;静息电位;延迟后除极;全细胞膜片钳;心肌肥厚
心肌肥厚是一种主要发生在长期压力负荷过重情况下的代偿性改变,通过心肌总量增加,收缩力加强,使心脏得以维持正常的排血功能,并保持相当的储备力。但肥大心肌需氧增加,冠状动脉供血量相对不足,往往导致严重的心律失常及/或心功能恶化[1]。研究表明[2],心肌肥厚并发心衰患者中有一半出现多种形态的心律失常,并经常由此发生猝死。因此,探索防治心肌肥厚过程中心律失常发生的新途径,具有重要的理论和临床意义。
内向整流钾通道(IK1通道)电流是心肌最主要的背景电流,参与静息电位的维持和动作电位3期终末复极[3-4],并与心肌兴奋性和心律失常的发生密切相关[5-7]。动物实验证明,心衰时IK1的减弱,可导致膜电导降低,使内向的钠钙交换电流引发较强的去极化,从而促使延迟后除极(DADs)和触发活动(TA)的发生率增加[8]。而DADs及其触发的TA与多种心律失常特别是恶性心律失常的发病密切相关,一直是抗心律失常实验研究和临床治疗的靶点[9-10]。因此,适度激活IK1通道[11]是否可以逆转上述心律失常发生的病理过程,即通过增强IK1,使膜电导增加,从而减小静息期诱发DADs发生的内向钠钙交换电流,产生抗心律失常效应。本研究拟应用IK1通道选择性激动剂和心肌肥厚引起心律失常的动物模型验证这一设想。
扎考必利(zacopride,Zac)属苯甲酰胺衍生物,为5-羟色胺3(5-HT3)受体阻断剂和5-羟色胺4(5-HT4)受体激动剂,是Liu等[12]报道的首个IK1通道选择性激动剂,可特异性适度增大IK1,增量不超过40%,她们研究了Zac激活IK1通道的抗心律失常作用,观察到Zac可通过增强大鼠IK1,抑制乌头碱(aconitine)诱发的室性心律失常和延迟后除极(DADs)。但Zac对心肌肥厚诱发的心律失常是否有效,至今未见报道。本研究使用ISO建立心肌肥厚大鼠心律失常的模型,利用体表心电图记录观察了Zac的抗心律失常作用。利用全细胞膜片钳技术,观察Zac对心肌肥厚模型单个心肌细胞的静息电位、DADs及相关离子通道的作用,进一步探讨其抗心律失常的可能机制。
1 材料与方法
1.1材料与仪器
1.1.1实验动物健康SPF级成年Sprague-Dawley(SD)大鼠220~230 g,♂,由中国人民解放军军事医学科学院实验动物中心提供,许可证号:SCK-(军)2014-0013。自由进食,饮水,室温控制在(25±2)℃。
1.1.2药品与试剂异丙肾上腺素(isoproterenol hydrochloride),批号:3A/156653,购买于英国Tocris公司;扎考必利(zacopride hydrochloride),批号:3A/159084,购买于英国Tocris公司;胶原酶P(collagenase P),购买于德国Bochringer Mannhein公司;磷酸肌酸二钠盐(Na2-phosphocreatine)、三磷酸腺苷镁盐(Mg-ATP)、4-氨基吡啶(4-AP)、5′-三磷酸腺苷二钾(K2-ATP)、牛磺酸(taurine)、HEPES、L-谷氨酸(L-Glutamic)、氯化钡(BaCl2)、氯化铯(CsCl)、乙二胺四乙酸(glycol ether diamine tetraacetic acid,EGTA)均购买于美国Sigma公司;NaCl、KCl、NaH2PO4、KH2PO4、MgSO4、CaCl2、KCl、MgCl2均购自Sangon Biotech公司;其余试剂均为国产分析纯产品。
1.1.3溶液配制① 台氏液(mmol·L-1):NaH2PO40.33,NaCl 140,KCl 5.4,MgCl21.0,glucose 10.0,HEPES 5.0,CaCl21.8,使用NaOH调节pH至7.38。② 无钙台氏液:不含CaCl2的台氏液。③ KB液(mmol·L-1):HEPES 10.0,KCl 40.0,Taurine 20.0,KH2PO425.0,EGTA 1.0,glucose 10.0,MgSO43.0,L-谷氨酸50.0,使用KOH调节pH至7.38。④ 酶液(mmol·L-1):无钙台氏液中加入Taurine 20.0 mmol·L-1,Collagenase P 0.07~0.1 g·L-1,使用NaOH调节pH至7.38。⑤ 动作电位(AP)电极内液(mmol·L-1)[13]:Mg-ATP 5.0,HEPES 10.0,磷酸肌酸二钠盐5.0,KCl 140.0,MgCl22.0,使用KOH调节pH至7.20。细胞外液(mmol·L-1):KCl 5.4,glucose 10.0,CaCl22.5,NaCl 134.0,MgCl21.0,HEPES 10.0,使用NaOH调节pH至7.40。⑥ 内向整流钾电流(IK1)电极内液(mmol·L-1):K2-ATP 3.0,KCl 150.0,EGTA 5.0,MgCl21.0,4-AP 5.0,HEPES 5.0,Mg-ATP 1.0,使用KOH调节pH至7.30。细胞外液为台氏液中加入0.5 mmol·L-1CdCl2以阻断L-型钙通道。
1.1.4仪器BL-420F生物机能实验系统:成都泰盟软件有限公司;膜片钳放大器(Axopatch200B):美国Axon Instruments公司;数模转换器(Digidate1440A):美国Axon Instruments公司;微电极拉制仪(PC-10):日本Narishige公司;液压式微操纵器(MHW-103):日本Narishige公司;Langendorff心脏灌流系统:澳大利亚AD Instruments公司;倒置显微镜(1X71):德国Olympus公司。
1.2方法
1.2.1大鼠心肌肥厚模型制备异丙肾上腺素(ISO)诱发大鼠在体心肌肥厚模型制备,取51只健康SD大鼠200~230 g。将其随机分成3组:① 对照组:每日给予0.5 mL的生理盐水(NS)腹腔内注射。② ISO组:每日给予5 mg·kg-1的ISO溶于0.5 mL的NS腹腔内注射,制备大鼠心肌肥厚模型[13-15]。③ ISO+Zac组:每日给予5 mg·kg-1的ISO和15 μg·kg-1的Zac溶于0.5 mL的NS腹腔内注射。以上3组大鼠均连续给药7 d,每天称重1次,根据体重变化调整给药剂量,最后1次给药24 h后开始实验。
1.2.2大鼠超声心动图检查最后1次给药24 h后,各组大鼠用30 mg·kg-1水合氯醛麻醉,仰卧位固定于鼠板上,剃毛暴露胸部。采用美国GE公司的vivid-7超声仪进行大鼠心功能检测。测量的指标主要包括:左心室舒张末期内径(left ventricular end-diastolic dimension,LVEDD)、左心室收缩末期内径(left ventricular end-systolic dimension,LVESD)、左心室后壁舒张末期厚度(left ventricular posterior wall end-diastolic thickness,LVPWd)、室间隔舒张末期厚度(interventricular septum end-diastolic thickness,IVSd)、左心室射血分数(left ventricular ejection fraction,LVEF)、左心室短轴的缩短率(left ventricular fractional shortening,LVFS)。各个指标均取3个连续测量心动周期的平均值。
1.2.3大鼠在体体表心电图记录最后一次给药24 h后,各组大鼠用30 mg·kg-1水合氯醛腹腔内注射麻醉,将肢体导联连接固定好之后,采用BL-420F生物机能实验系统记录大鼠Ⅱ导联心电图,观察1h内室性心律失常的发生率、室性期前收缩(VPB)个数、ST段抬高幅度。ST段测量方法参考Yamamoto等[16]所用方法。
1.2.4大鼠单个心肌细胞的分离各模型组大鼠用40 mg·kg-1戊巴比妥钠腹腔注射麻醉后,断头颈动脉放血,快速开胸取心脏,在提前预冷并以100%氧气充灌的4℃无钙台氏液中仔细修剪,经主动脉逆行插管将心脏悬挂于Langendorff灌流装置上,以100%氧气充灌的无钙台氏液恒压(7.35 kPa)、恒温(37℃)灌流心脏10 min,待心脏充盈后,改为酶液循环灌流15~20 min,待心室变大,变软后剪取左心室肌组织置于KB液中,用眼科剪轻轻剪碎,用尖端圆润的玻璃吸管轻轻吹打3~5 min后,用孔径为150 μm的滤网过滤得到单个细胞,保存于KB液中,室温下静置3 h让其稳定后进行实验。
1.2.5全细胞膜片钳记录吸取1~2滴细胞悬液滴入倒置显微镜的细胞槽(约1 mL)内,静置8~10 min,待细胞充分贴壁后,用台氏液灌流复钙,流速约2 mL·min-1,在高倍镜下选取长杆状、纹理清晰、表面光滑的心肌细胞作为实验对象,将充灌电极内液的玻璃微电极(电阻约2~5 MΩ)轻轻移至细胞表面,施加负压使电极尖端和细胞膜之间形成高阻封接(电阻达GΩ),负压破膜后,进行膜电容补偿和串联电阻补偿,使用Axopatch200B膜片钳放大器、Digidate1440A数模转换器及Pclamp9.0采集、贮存及分析离子电流。
1.2.6模型组大鼠单个心肌细胞延迟后除极记录形成全细胞记录模式后,先观察所记录细胞的静息电位,然后用记录动作电位的细胞外液灌流,用15 ms、3 Hz的连续刺激作为条件刺激,诱发延迟后除极(DADs)。
1.2.7模型组大鼠单个心肌细胞内向整流钾电流记录记录内向整流钾电流(IK1)的细胞外液为台氏液中加入0.5 mmol·L-1CdCl2以阻断ICa-L。钳制电位-40 mV,给予细胞0.5 Hz、500 ms、跃阶10 mV从-120 mV~+20 mV的去极化脉冲刺激激活IK1。膜电流大小使用电流密度(pA/pF)表示。
2 结果
2.1各组大鼠超声心动图检测结果各组大鼠M型超声心动图检查结果显示,与对照组相比,ISO组大鼠LVEDD和LVESD均明显降低(P<0.05),LVPWd和IVSd以及LVEF和LVFS均增高(P<0.05),提示ISO组大鼠室壁增厚,心室腔缩窄,呈现向心性心肌肥厚和收缩功能增强,心肌肥厚模型建立成功。ISO+Zac组大鼠与ISO组大鼠相比,LVEDD和LVESD均增加,但与对照值仍有明显差异(P<0.05);LVPWd、IVSd以及LVEF和LVFS均降低,且接近对照水平(Tab 1、Fig 1)。
2.2Zac可减轻ISO诱发的心肌肥厚大鼠心律失常各组大鼠体表心电图检查显示,对照组大鼠在监测中均未观察到心律失常的发生。ISO组大鼠88.89%发生室性心律失常,100%发生ST段抬高。在给予15 μg·kg-1Zac后,ISO+Zac组大鼠心律失常的发生率降低至11.11% (P<0.05),但与心肌缺血相关的ST段变化未见明显改善,与ISO组大鼠相比无差异(Tab 2、Fig 2)。
Tab 1 Characteristics of echocardiogram in model ±s,n=9)
ISO: isoproterenol; Zac: zacopride; LVEDD: left ventricular end-diastolic dimension; LVESD: left ventricular end-systolic dimension; LVPWd: left ventricular posterior wall end-diastolic thickness; IVSd: interventricular septum end-diastolic thickness; LVEF: left ventricular ejection fraction; LVFS: left ventricular fractional shortening.*P<0.05vscontrol;#P<0.05vsISO.
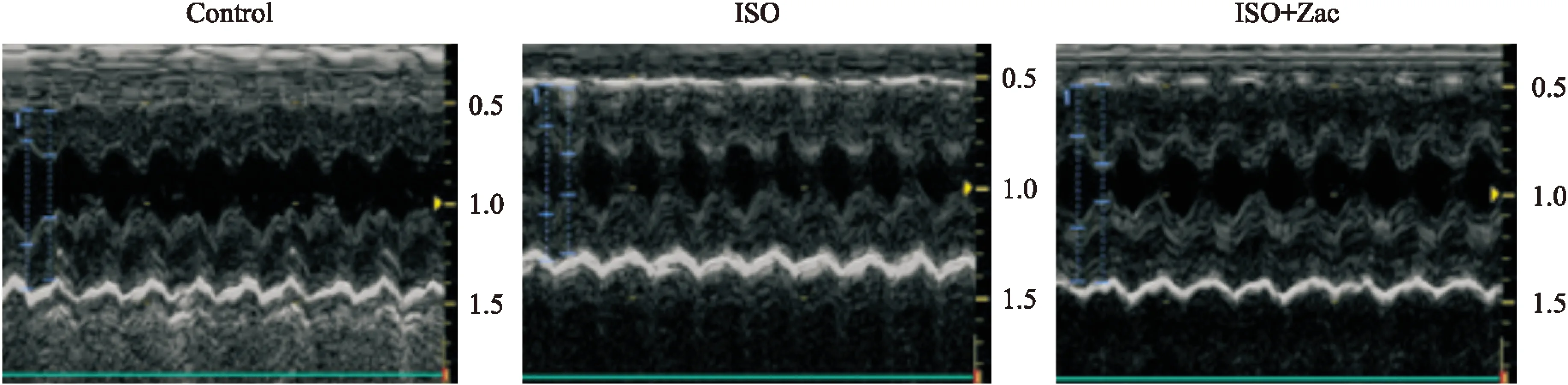
Fig 1 The M-mode echocardiographic images of model rats in different treatment groups
M-mode echocardiographic images showing marked concentric hypertrophy and cardiac dysfunction in ISO-treated rats in contrast to rats in control group.The structure and functional abnormality improved significantly in rats treated with ISO+Zac.
Tab 2Comparison of arrhythmic incidence and ECG ST-segment changes in rats
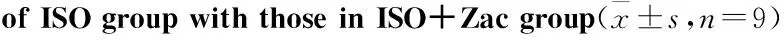

GroupIncidenceofventriculararrhythmia/%IncidenceofST-segmentelevation/%ST-segmentelevation/mVControl000ISO88.89*100*0.224±0.018*ISO+Zac11.11*#100*0.200±0.011*
*P<0.05vscontrol;#P<0.05vsISO
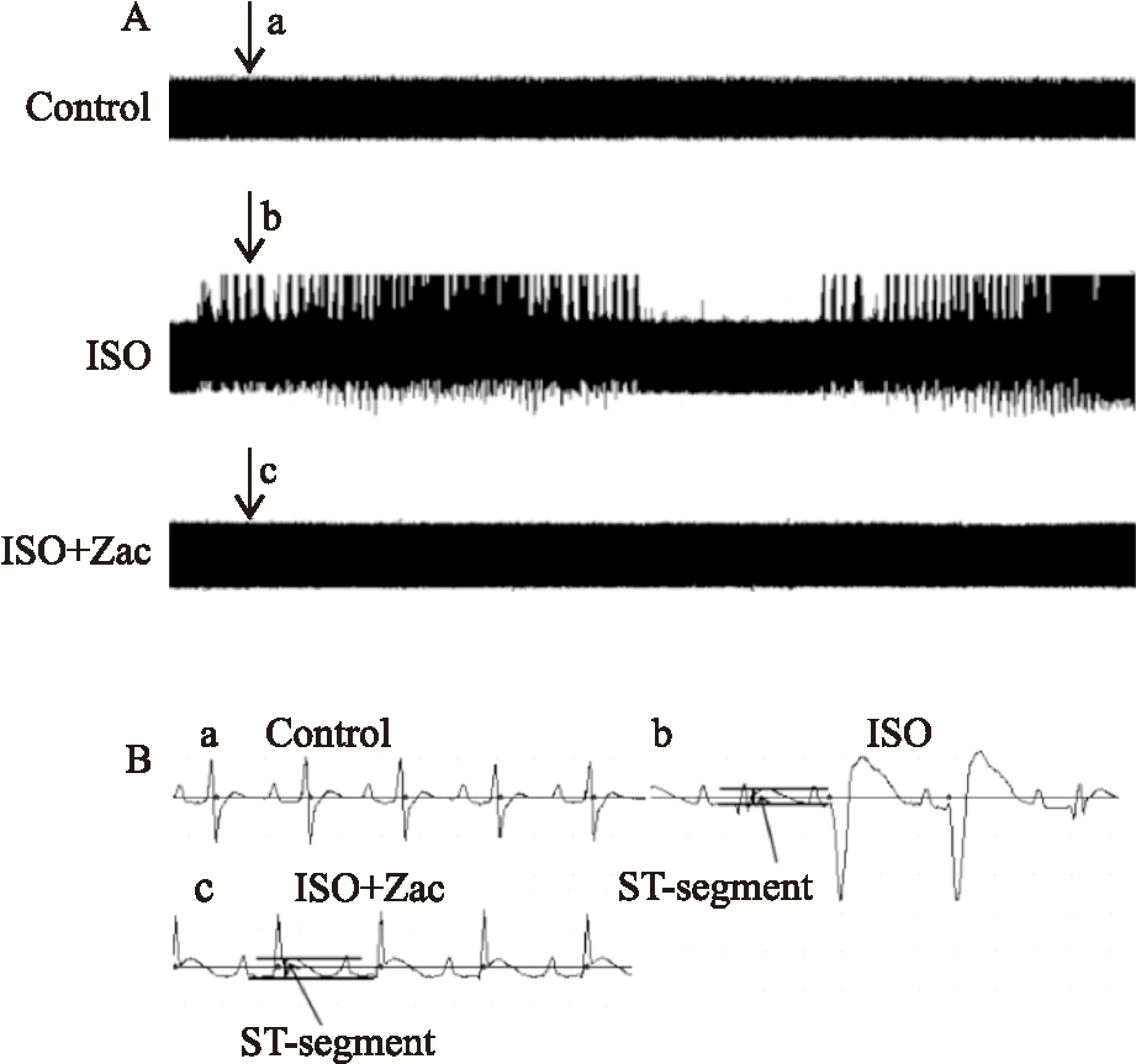
Fig 2 Representative electrocardiogram(II limb lead) showing inhibitory effect of Zac on arrhythmia in isoproterenol-induced myocardial hypertrophic rats
A: Condensed ECG tracings in rats of differently treated groups;B:Representative ECG tracing at different time points;a:normal ECG tracing;b:VPB and ST-segment elevation;c:ST-segment elevation.
2.3Zac可增大心肌细胞静息电位,抑制ISO所致肥厚心肌延迟后除极全细胞膜片钳结果显示,对照组、ISO组、ISO+Zac组单个心肌细胞RMP分别为(-71.05±1.27)、(-69.38±1.21)、(-73.86±1.33) mV。组间比较,ISO组小于对照组,ISO+Zac组分别大于对照组和ISO组(P<0.05),见Fig 3。电流钳模式下,对照组、ISO组和ISO+Zac组大鼠单个心肌细胞DADs发生率分别为0%、88.24%和11.76%。与ISO组相比,ISO+Zac组大鼠单个心肌细胞DADs发生率明显降低(P<0.05)(Fig 4、5)。2.4Zac可增强ISO组大鼠下调的IK1在钳制电位-100 mV和-60 mV时,ISO组心肌细胞IK1电流密度(pA/pF)分别为(-16.62±1.63)和(1.73±0.23),与对照组(-20.36±1.40)和(2.38±0.15)相比明显降低(P<0.05)。在给予15 μg·kg-1Zac后,ISO+Zac组IK1电流密度在-100 mV和-60 mV时分别达到(-26.95±1.12)和(4.04±0.40),均明显高于ISO组和对照组(P<0.05)(Fig 6)。可见Zac可有效消除ISO对IK1的抑制作用,增强心肌细胞IK1。
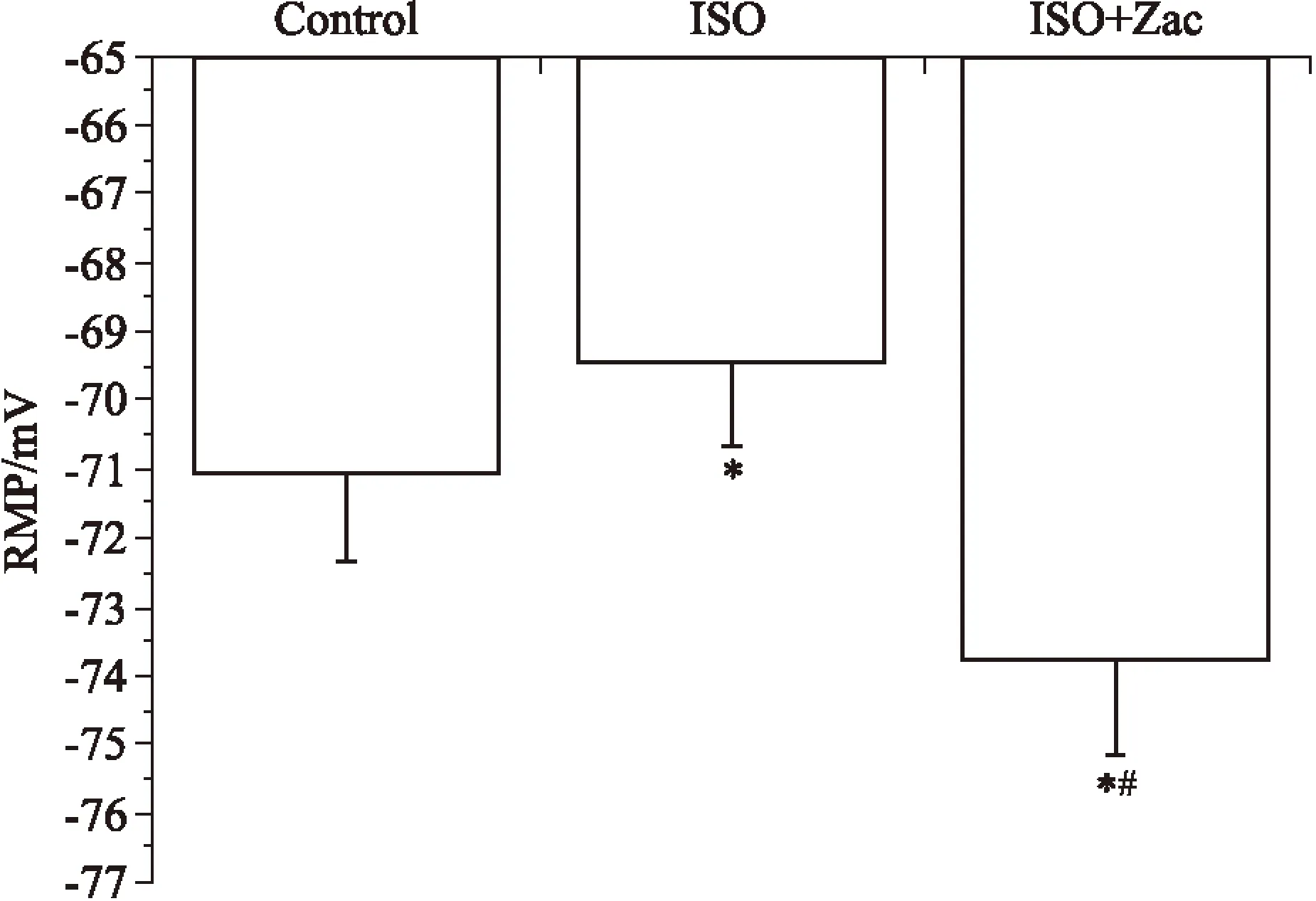
Fig 3 Zac significantly increased resting membrane potential(RMP) in isolated rat ventricular myocytes(n=10)
*P<0.05vscontrol;#P<0.05vsISO.
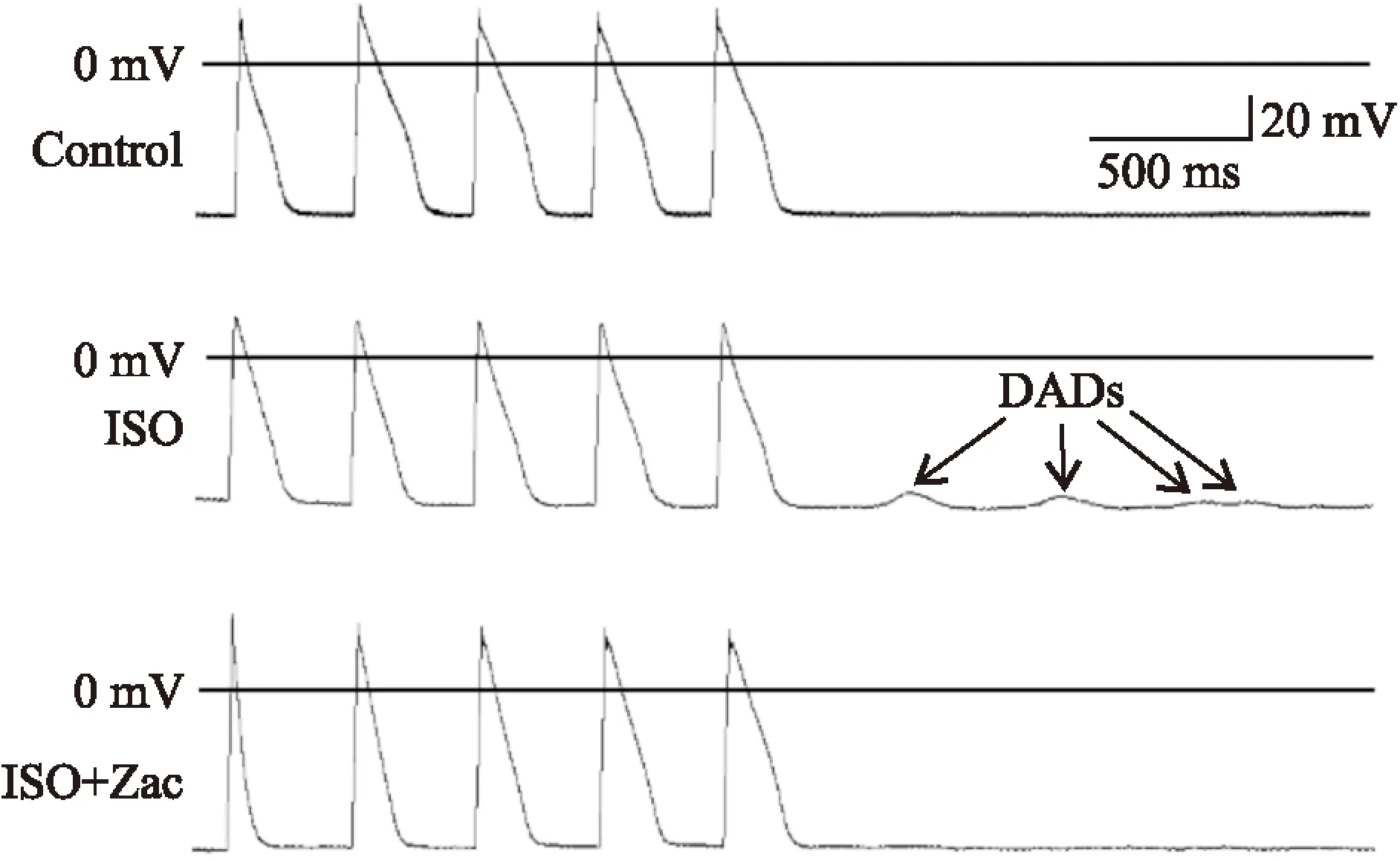
Fig 4 Zac significantly inhibited DADs in isoproterenol-induced myocardial hypertrophic rat cardiomyocytes
DADs: delayed afterdepolarizations.
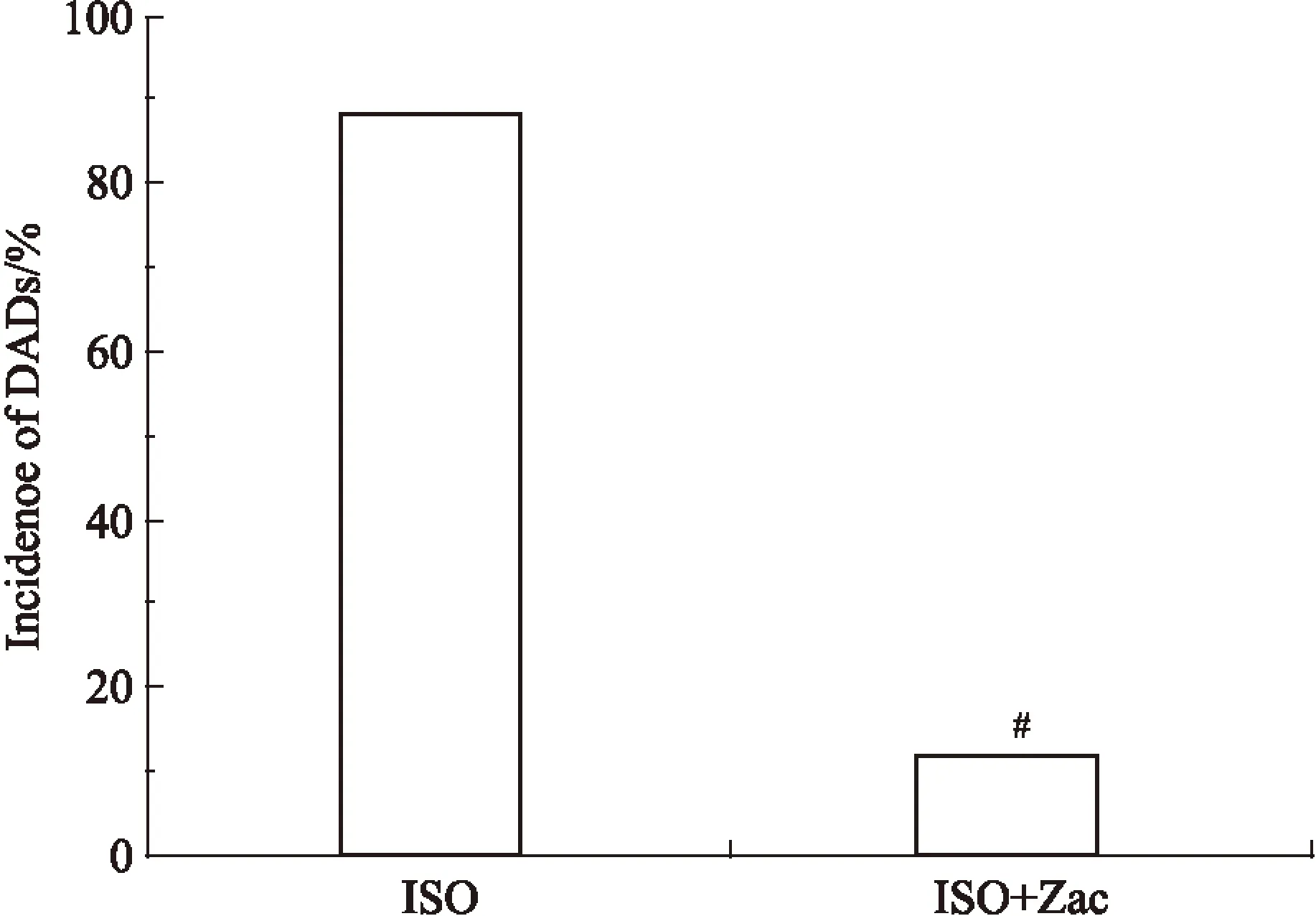
Fig 5 Bar graph showing Zac significantly inhibited incidence of DADs in isolated ventricular myocytes of isoproterenol-induced myocardial hypertrophic rats(n=17)
#P<0.05vsISO.
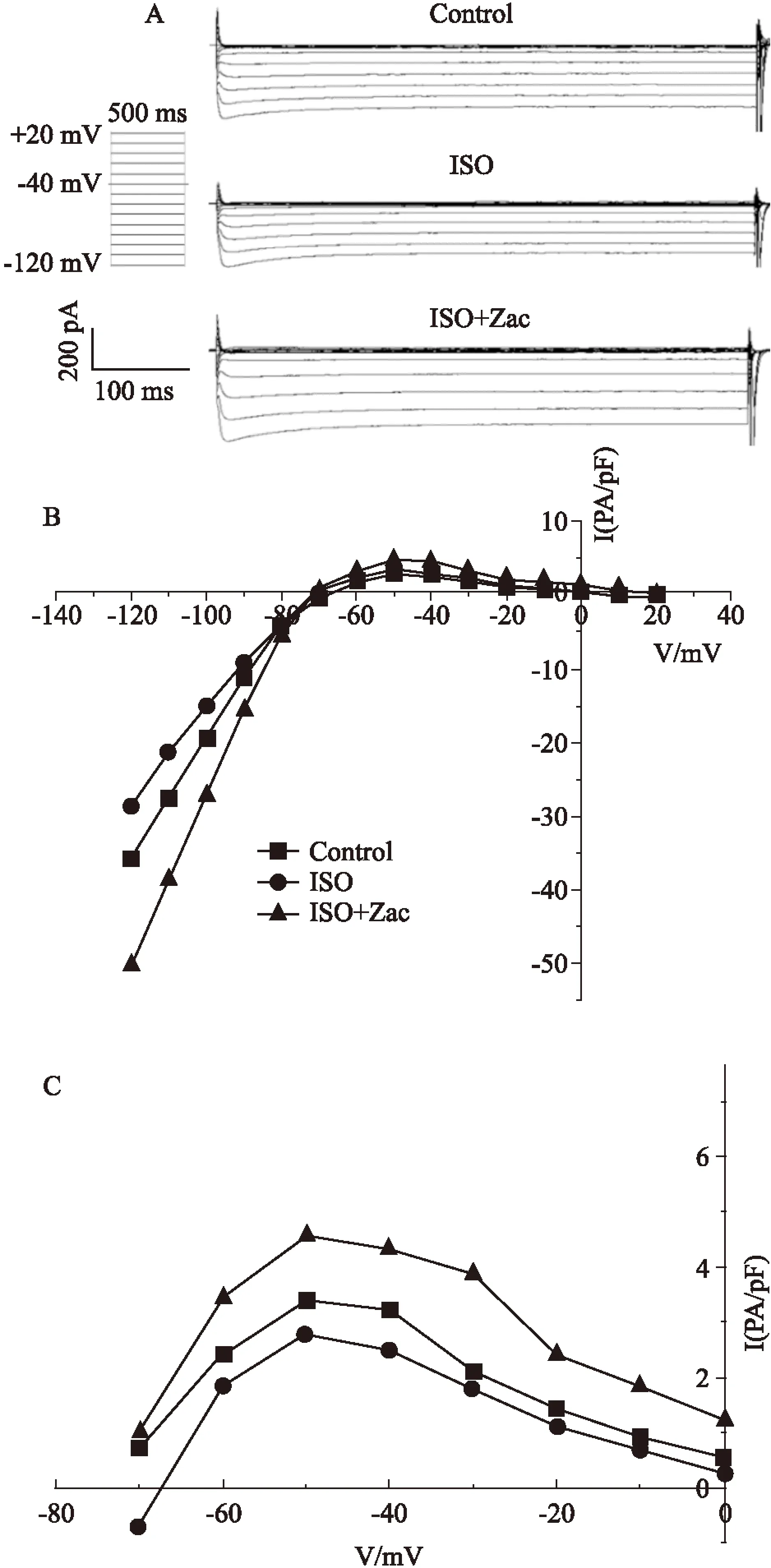
Fig 6 Zac effectively rescued IK1suppression to normal level in ventricular myocytes of isoproterenol-induced hypertrophic rats
A: RepresentativeIK1trace recorded using 500 ms, 10 mV voltage steps from -120 to+20 mV. Holding potential was set as -40 mV;B:Effects of Zac onIK1current-voltage(I-V) relationship in isolated rat ventricular myocytes in control, ISO and ISO+Zac group;C:Expand plots for the outward components ofIK1from B.
3 讨论
心肌肥厚是心脏因长期压力负荷过重而发生心力衰竭过程中的一个代偿性阶段,常伴有心律失常和心功能变化[17]。本研究通过腹腔注射大剂量ISO诱发大鼠心肌肥厚的慢性动物模型,首次观测了Zac对心肌肥厚模型动物电活动的影响。结果表明,Zac可明显降低ISO诱发的心肌肥厚模型动物的心律失常发生率。
我们进一步探讨了Zac抑制模型动物心律失常发生的电生理机制。利用全细胞膜片钳研究证实,Zac可明显增大肥厚心肌细胞的IK1,增大RMP,抑制条件刺激下诱发的DADs,这些效应都是Zac抑制ISO诱发的心肌肥厚模型动物心律失常发生的重要机制。膜电位增大,可降低心肌细胞的兴奋性;增加钠通道的可利用度,提高心肌的传导性;增大心肌静息膜电导,减小膜电流变化引起的膜电位波动,增加膜的电稳定性[11]。这些变化都是与Zac激动IK1,导致膜电位增大相关的[10]。DADs一直被认为是触发性心律失常的重要机制,它的发生与胞内钙超载和内向钠钙交换电流增强相关[8]。心电图ST段代表心室各部分心肌细胞处于去极化状态,ST段抬高表示心肌缺血或损伤[6],本研究中ST段抬高可能是ISO致心肌肥大,心肌代谢和耗氧量增加,从而出现心肌缺血。在研究中发现,Zac并不影响ST段改变,表明它并不干预心肌代谢与供血过程。
我们的研究结果证明了选择性IK1通道激动剂Zac对心肌肥厚模型动物心律失常具有抑制作用,其机制可能与它通过增强IK1、抑制延迟后除极的效应有关。这为适度增强IK1通道是一条有效的抗心律失常途径提供了新的实验依据。
(致谢:本研究在山西医科大学生理学系细胞生理学省部共建教育部重点实验室完成,感谢实验室提供的仪器及技术支持;感谢吴博威教授及赵录英老师对实验技术的指导。)
[1]孟亚鹏, 陶宏凯. 一种快速建立心肌肥厚大鼠模型的制备及指标评价[J].内蒙古中医药, 2011, 4(11): 103-4.
[1]Meng Y P, Tao H K. A rapid preparation of myocardial hypertrophy in rats model and indicators for evaluation[J].InnerMongTraditChinMed, 2011, 4(11): 103-4.
[2]Shah M, Akar F G, Tomaselli G F. Molecular basis of arrhythmias[J].Circulation,2005,112(16): 2517-29.
[3]Hibino H, Inanobe A, Furutani K, et al. Inwardly rectifying potassium channels:their structure, function, and physiological roles[J].PhysiolRev, 2010, 90(1):291-366.
[4]Anumonwo J M, Lopatin A N. Cardiac strong inward rectifier potassium channels[J].MolCellCardiol, 2010, 48(1): 45-54.
[5]刘清华, 吴博威, 张杨, 林媛媛. Zacopride增强心肌内向整流钾电流(IK1)发挥抗心律失常效应[J]. 中国病理生理杂志, 2010, 26(6): 1041-6.
[5]Liu Q H, Wu B W, Zhang Y, Lin Y Y. Zacopride enhances inwardly rectifier potassium current (IK1)to antagonize arrhythmias[J].ChinJPathophysiol, 2010, 26(6): 1041-6.
[6]李超红, 陈依春, 翟旭文, 封启龙. 内向整流钾通道激动剂对大鼠异丙肾诱发心律失常的抑制作用[J]. 中国药理学通报, 2015, 31(8): 1081-5.
[6]Li C H, Chen Y C, Zhai X W, Feng Q L. Inhibitory effect of agonist ofIK1channel on arrhythmia induced by isoproterenol in rats[J].ChinPharmacolBull, 2015, 31(8): 1081-5.
[7]Lopatin A N, Nichols C G. Inward rectifiers in the heart: an update onIK1[J].MolCellCardiol, 2001, 33(4): 625-38.
[8]Pogwizd S M, Schlotthauer K, Li L, et al. Arrhythmogenesis and contractile dysfunction in heart failure: roles of sodium-calcium exchange, inward rectifier potassium current, and residual beta-adrenergic responsiveness[J].CircRes,2001, 88(11): 1159-67.
[9]Masood A, Patriok J T, Mohammad J. Mechanism of clinical tachycardias[J].AMJCardiol, 1988, 61(2): 9-19.
[10]Wit A L, Rosen M R. Afterdepolarizations and triggered activity:distinction from automaticity as an arrhythmogenic mechanism[M]//Fozzard H A, Haber E, Jennings R B, et al.Heartandcardiovascularsystem:scientificfoundations. 2nd ed. New York: Raven Press,1992: 2113-63.
[11]吴博威, 刘清华, 张莉. 心肌内向整流钾通道和心律失常[J]. 生理学报, 2012, 64(6): 751-7.
[11]Wu B W, Liu Q H, Zhang L. Cardiac inwardly rectifying potassium channel and arrhythmias[J].ActaPhysiolSin, 2012, 64(6): 751-7.
[12]Liu Q H, Li X L, Xu Y W, et al. A novel discovery ofIK1channel agonist: zacopride selectively enhancesIK1current and suppresses triggered arrhythmias in the rat[J].CardiovascPharmacol, 2012, 59(1): 37-48.
[13]Meszaros J, Khananshvili D, Hart G. Mechanisms underlying delayed after depolarizations in hypertrophied left ventricular myocytes of rats[J].AmJPhysiolHeartCircPhysiol, 2001, 281(2): H903-14.
[14]Meszaros J. Sodium-pump injury and arrhythmogenic transient depolarizations in catecholamine-induced cardiac hypertrophy[J].EurPharmacol, 1992, 210(3):325-31.
[15]Rona G, Chappel C I, Balazs T, Gaudry R. An infarct-like myocardial lesion and other toxic manifestations produced by isoproterenol in the rat[J].AMAArchPathol,1959,67(4): 443-55.
[16]Yamamoto S, Matsui K, Sasabe M, et al. Effect of SMP-300, a new Na+/H+exchange inhibitor, on myocardial ischemia and experimental angina models in rats[J].JpnJPharmacol, 2000, 84(2): 196-205.
[17]眭荣燕, 王万辉, 连磊凡, 等. 染料木素对ISO致心肌肥厚大鼠的抗氧化及抑制炎症反应作用研究[J]. 中国实验方剂学杂志, 2012, 18(19): 175-8.
[17]Sui R Y, Wang W H, Lian L F,et al. Anti-oxidation and anti-inflammation effect of genistein on myocardial hypertrophy in rats induced by isopropylarterenol[J].ChinJExpTradMedForm, 2012, 18(19): 175-8.
Cardiac arrhythmia suppression byIK1channel agonist in isoproterenol-induced myocardial hypertrophic rats and investigation on its mechanism
CHEN Yi-chun1, LI Chao-hong2, YANG Ming-zhu1, WANG Xiao-lu1, FENG Qi-long1
(1.DeptofPhysiology,ShanxiMedicalUniversity,KeyLaboratoryofCellularPhysiologyofShanxiProvinceandMinistryofEducation,Taiyuan030001,China;2.theFirstAffiliatedHospitalofXinxiangMedicalCollege,HenanInstituteofNeurology,WeihuiHenan453000,China)
AimTo investigate the effect of zacopride(Zac) on cardiac arrhythmia in isoproterenol(ISO)-induced myocardial hypertrophic rats and the underlying electrophysiological mechanisms.Methods① Fifty-one rats were randomly divided into control group(n=17), ISO group(n=17) and ISO+Zac group(n=17). Rat model with cardiac arrhythmia and hypertrophy was established by intraperitoneal ISO(5 mg·kg-1) injection.② ECGs were recorded to observe the effects of Zac on arrhythmia in model rats.③ Whole-cell patch clamp was applied to record inwardly rectifier potassium current(IK1), resting membrane potential(RMP) and amplicated delayed afterdepolarizations(DADs).Results① Echocardiographic examination showed that, left ventricular end-diastolic dimension(LVEDD) and left ventricular end-systolic dimension(LVESD) significantly decreased in rats in ISO group compared with control group, whereas left ventricular posterior wall end-diastolic thickness(LVPWd) and interventricular septum end-diastolic thickness(IVSd) increased(P<0.05), suggesting rat model of isoproterenol-induced myocardial hypertrophy was successfully established.② ECGs showed that 88.89% of rats in ISO group had ventricular premature beats(VPBs), which significantly decreased to 11.11% after the application of Zac (P<0.05).③ Values of RMP decreased from (-71.05±1.27) mV in control group to (-69.38±1.21) mV in ISO group(P<0.05). After Zac administration, RMP significantly increased to (-73.86±1.33) mV compared with control and ISO group(P<0.05).④ DADs and TA incidence significantly decreased from 88.24% in ISO group to 11.76% in ISO+Zac group(P<0.05).⑤ Compared with control group,IK1density was markedly reduced in ISO group, whereas Zac could effectively rescueIK1suppression to normal level.ConclusionsZac, as a selectiveIK1channel agonist, can significantly inhibit cardiac arrhythmia in isoproterenol-induced myocardial hypertrophic rats, which is mainly attributed to increased RMP by enhancingIK1and subsequent suppression of DADs.
cardiac arrhythmia; inward rectifier potassium current; resting membrane potential; delayed afterdepolarizations; whole-cell patch clamp technique; myocardial hypertrophy
2016-03-15,
2016-04-18
国家自然科学基金资助项目(No 30900492);山西省青年科学基金资助项目(No 2009021043-1);山西省高校“131”领军人才工程项目;山西省高等学校优秀青年学术带头人支持项目
陈依春(1990-),女,硕士生,研究方向:心肌电生理,E-mail:15835116973@163.com;
封启龙(1976-),男,博士,教授,硕士生导师,研究方向:心肌电生理,通讯作者,E-mail:fengqilong@163.com
A
1001-1978(2016)08-1127-07
R-332;R322.11;R329.24;R541.702.2; R542.2
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.038.html