孕期炎症刺激对子代小鼠脂质代谢及FAT/CD36表达的影响
2016-08-29秦书刚周见至李晓辉
秦书刚,陈 新,贾 乙,周见至,苏 敏,李晓辉
(第三军医大学药学系药物研究所,重庆 400038)
孕期炎症刺激对子代小鼠脂质代谢及FAT/CD36表达的影响
秦书刚,陈新,贾乙,周见至,苏敏,李晓辉
(第三军医大学药学系药物研究所,重庆400038)
doi:10.3969/j.issn.1001-1978.2016.08.010
目的以FAT/CD36为切入点,研究母体孕期炎症刺激对子代脂质代谢的影响。方法8周龄C57小鼠,♀♂ 2 ∶1合笼配种,d 2 ♀鼠分笼饲养记为在孕0 d,在孕11 d给予孕鼠一次性腹腔注射脂多糖(LPS)(75 μg·kg-1),对照组注射0.2 mL的生理盐水。分别于子鼠4、8、12周取材(♀鼠取肾周脂肪、♂鼠取附睾周围脂肪),对子代小鼠体重、内脏脂肪重量、脂肪组织和细胞中游离脂肪酸(FFA)、甘油三酯(TG)、FAT/CD36表达量进行检测。结果与NS组相比,LPS组小鼠体重、内脏脂肪重量、脂肪系数明显增高,♂鼠附睾脂肪和血液中TG、FFA的表达量明显升高;各周龄♂鼠脂肪组织和诱导的3T3-L1细胞中FAT/CD36明显上调(P<0.05)。结论母体孕期炎症刺激导致子代小鼠脂肪发育异常,游离脂肪酸(FFA)、甘油三酯(TG)、FAT/CD36的表达量明显升高,其机制可能与FAT/CD36对脂质代谢的调节有关。
孕期炎症刺激;FAT/CD36;FFA;TG;脂质代谢紊乱;肥胖
随着社会发展,肥胖以及由于肥胖引起的一系列心脑血管疾病和代谢性疾病,已经成为危害人类健康的重要因素。据美国华盛顿大学卫生统计评估研究报道,当前,全球约70亿人中有21亿人肥胖[1]。肥胖是一种由多种因素引起的以体重、内脏脂肪湿重、脂肪系数增加、脂质代谢紊乱、脂肪细胞体积和数量增多导致体脂占体重的百分比异常和脂肪在不同部位沉积为特点的慢性代谢性疾病[2]。对于肥胖,多数归因于遗传因素和后天不良的生活习惯所致,研究也多数针对常规的饮食诱导或有肥胖先兆的个体进行,但是即使人们普遍地注意健康生活方式,肥胖并没有得到很好的改善。因此,积极研究不同模型、不同因素对肥胖的影响,从不同方面对肥胖机制进行研究至关重要[3]。
流行病学调查研究发现,宫内发育迟缓胎儿和低出生体重儿成年后出现肥胖、胰岛素抵抗及相关代谢综合征的几率是正常儿童的5.75倍,提示胎儿的宫内发育是影响成年后肥胖的独立因素[4]。孕期炎症导致子代肥胖与遗传因素和后天饮食等不良因素导致肥胖之间存在很多相似的特点,比如成年个体都有脂质代谢紊乱、胰岛素抵抗、脂肪发育不良等现象,然而,他们之间的具体机制及其联系还未见报道。本研究拟通过一次性给予孕鼠脂多糖炎症刺激,同时建立肥胖模型和孕期炎症模型,是不同于以往任何单纯的肥胖模型和炎症模型,在此基础上研究子代脂质代谢紊乱和FAT/CD36的表达量对肥胖的影响,以期对肥胖的机制做进一步的研究。
1 材料与方法
1.1仪器与试剂Real-time PCR仪(Eppendorf),NanoDrop超微量分光光度计(Thermo),脂多糖(LPS)(Sigma),总RNA提取试剂盒(DP419)(TIANGEN),总RNA Real-time PCR试剂盒(DRR820A)(TaKaRa),总RNA反转录试剂盒(DRR047A)(TaKaRa),ND-2000微量核酸定量仪(Thermo),FAT/CD36抗体(Nvous),FAT/CD36引物(上海生工),FFA测定试剂盒(南京建成,A042-1),TG测定试剂盒(南京建成,A110-1),3-异丁基-1-甲基黄嘌呤(IBMX)(Sigma),地塞米松(DEX)(Sigma),胰岛素(INS)(Sigma)。
1.2动物分组及模型建立C57小鼠8周龄,♀鼠体质量(20±2) g,♂鼠体质量(25±2) g,合笼。将孕鼠随机分为2组。对照组NS:在孕d 11腹腔注射无菌生理盐水0.2 mL;LPS组:在孕d 11腹腔注射LPS 75 μg·kg-1。
1.3子代小鼠体重、脂肪重量和脂肪系数的测量2组子代小鼠从出生开始(设为d 0)进行体重监测,每2周测量1次体重(g),直到12周,并于4、8、12周分别取样,称取脂肪湿重(g),并计算脂肪系数(脂肪系数=脂肪湿重/体重×100)。
1.4子代♂鼠血液和脂肪组织TG和FFA水平检测子代♂鼠于4、8、12周眼球取血和取♂鼠附睾脂肪组织,通过试剂盒分别检测♂鼠血液和脂肪组织中游离脂肪酸(FFA)、甘油三脂(TG)含量。
1.5子代♂鼠脂肪组织中FAT/CD36含量的检测Real-time PCR法分别检测子代♂鼠附睾脂肪中FAT/CD36 mRNA表达水平,Western blot方法检测子代♂鼠附睾脂肪组织中FAT/CD36蛋白的表达水平。1.6诱导分化3T3-L1细胞中FAT/CD36含量的检测10% DMEM高糖培养基培养3T3-L1细胞至80%融合,加入诱导剂I(10%血清+0.5 mmol·L-1IBMX+0.1 μmol·L-1DEX+0.1 μmol·L-1INS)培养60 h,加入诱导剂II(10%血清+0.1 μmol·L-1INS)培养48 h后,换为正常培养基(10% DMEM高糖培养),4 d以后取细胞进行Real-time PCR和Western blot,分别检测诱导组与空白组FAT/CD36表达水平[5]。
2 结果
2.1母体孕期炎症刺激对子代小鼠脂肪发育的影响如Fig 1所示,与NS组相比,LPS组♀鼠8、12周子代♀鼠体重和♂鼠各周龄体重差异均有显著性(P<0.05)。各周龄子代♀鼠肾周脂肪湿重及8、12周肾周脂肪系数差异均有显著性(P<0.05),见Fig 2。各周龄子代♂鼠附睾脂肪湿重及4、8周附睾脂肪系数差异均有显著性(P<0.05),见Fig 3。

Fig 1 Body weight change of offspring mice at different ±s,n=36)
A:Female weight;B:Male mice body weight.*P<0.05,**P<0.01vscontrol
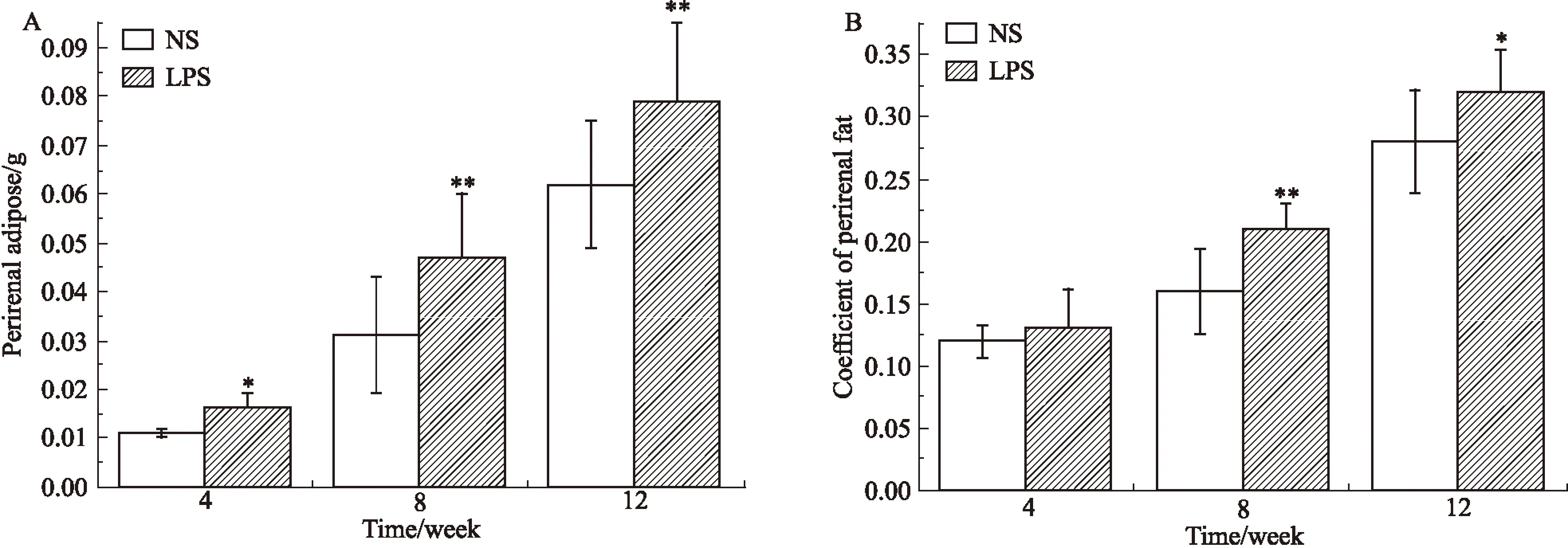
Fig 2 Perirenal fat wet weight(A) and fat coefficient(B) of female offspring mice ±s,n=12)
*P<0.05,**P<0.01vscontrol
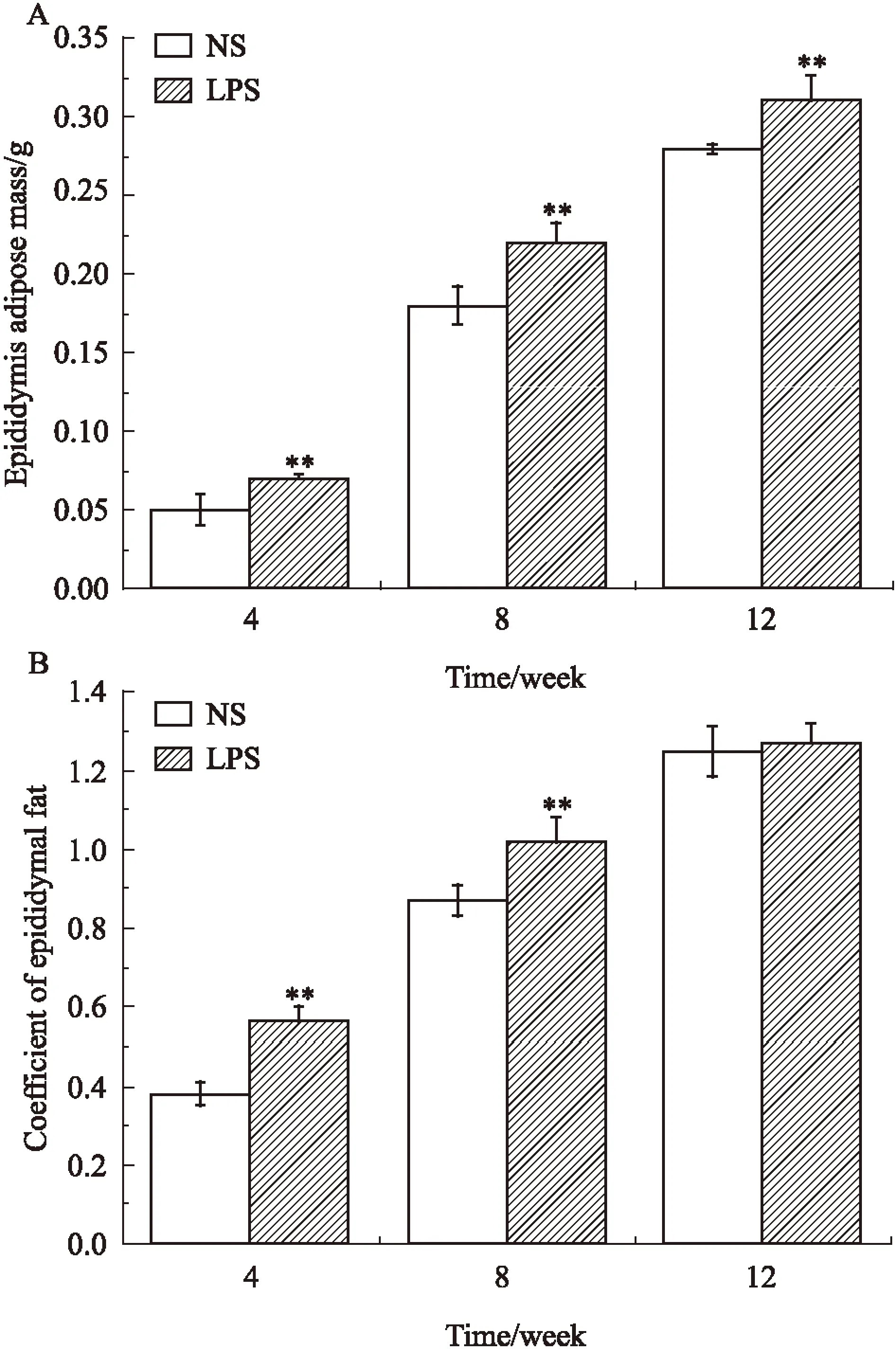
Fig 3 Epididymal fat wet weight(A) and fat coefficient(B) of male offspring ±s,n=12)
**P<0.01vscontrol
2.2母体孕期炎症刺激对子代♂鼠血液FFA和TG含量的影响如Fig 4所示,与NS组相比,LPS组各周龄子代♂鼠血液中的FFA含量及8、12周TG含量差异均有显著性(P<0.05)。
2.3母体孕期炎症刺激对子代♂鼠脂肪组织FFA和TG含量的影响如Fig 5所示,与NS组相比,LPS组各周龄子代♂鼠脂肪组织中的FFA含量及8、12周TG含量差异均有显著性(P<0.05)。
2.4母体孕期炎症刺激对子代♂鼠脂肪组织FAT/CD36的影响如Fig 6、Fig 7所示,与NS组相比,LPS各周龄子代♂鼠脂肪组织中FAT/CD36 mRNA水平和4、8周蛋白水平表达量差异均有显著性(P<0.05)。
2.5诱导分化3T3-L1细胞中FAT/CD36含量的检测如Fig 8、9所示,与正常组相比,诱导的3T3-L1细胞中FAT/CD36 mRNA水平和蛋白水平差异均有显著性(P<0.01)。
3 讨论
孕期炎症刺激以后,子代小鼠出现了以体重增加、内脏脂肪含量增多、脂肪系数增大的脂肪发育不良情况,说明肥胖模型的成功建立。在此基础上,通过对子代小鼠血液和脂肪中FFA和TG含量的测定,我们发现小鼠血液和脂肪组织中的FFA和TG都较对照组高。以FFA和TG代谢异常为主要特点的脂质代谢紊乱是导致肥胖十分重要的因素[5],脂肪主要是通过脂肪动员进行代谢,在脂肪酶的作用下,脂肪主要被分解为TG和FFA供组织利用和供能。FFA和TG在机体内的分布、储存和代谢对肥胖的影响至关重要,由于血液中FFA、TG含量的增加,会导致脂肪酸的过多摄取,脂肪组织中FFA、TG含量也随之升高,脂质积累于组织器官中,最终导致慢性炎症和相关代谢性疾病[6-8]。
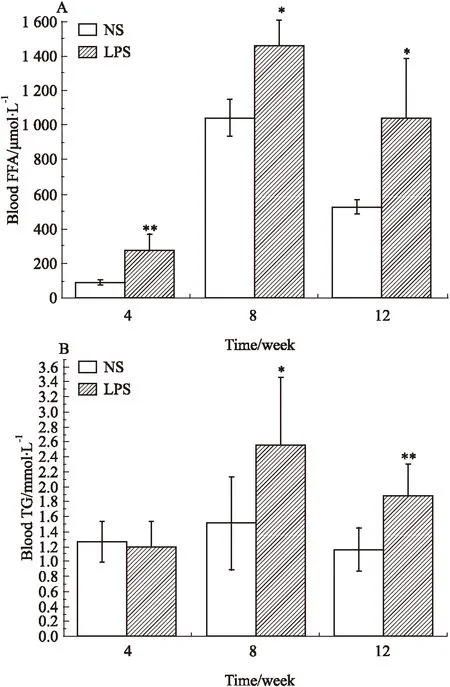
Fig 4 Blood free fatty acid(FFA)(A) and triglycerides
*P<0.05,**P<0.01vscontrol
通过对小鼠脂肪组织中FAT/CD36含量的测定,我们发现,在高FFA、TG含量的脂肪组织中,FAT/CD36的表达量也相对增加。作为B族清道夫受体的一种,FAT/CD36主要位于细胞膜上,在很多组织和细胞中都有表达,其主要作用是转运脂肪酸和参与脂质代谢,介导细胞和组织对脂肪酸进行摄取[9]。在脂肪组织中,血液中FFA和TG在FAT/CD36的参与下进行代谢,其活性和表达量的变化会使得脂肪在不同组织中分布和沉积不同。脂肪的异位沉积和脂质的积累会引起代谢性疾病和慢性炎症性肥胖,所以FAT/CD36表达量对血液和脂肪组织中FFA、TG的分布和代谢都至关重要[10-11]。研究发现,在FAT/CD36缺失的小鼠模型中,脂肪酸的摄取能力无论是对于骨骼肌还是脂肪组织都明显降低[10]。不仅如此,除了参与脂质代谢紊乱,与多种代谢性疾病的发生密切相关,如心血管疾病、动脉粥样硬化、肥胖及糖尿病等[10-12]。因此,FAT/CD36在机体的作用也受到广泛重视,尤其是以FAT/CD36为媒介引起的以FFA、TG各种脂质代谢紊乱和炎症因子之间的相互关系倍受关注[13-14]。在炎症状态下,脂质代谢主要受到3种途径的调节:内质网应激、核因子κB(NF-κB)途径、C- Jun氨基末端激酶通路。FAT/CD36作为其中最为关键的因子之一,通过与促炎因子和抗炎因子之间的相互调节,从而对细胞炎症、脂质代谢和肥胖起到重要作用[15-19]。在诱导分化的3T3-L1细胞中,FAT/CD36含量较正常的细胞也较高,说明FAT/CD36在前脂肪细胞分化为成熟的脂肪细胞的过程中,随着脂肪细胞的积累增多,FAT/CD36的表达量也明显上升,FAT/CD36可能对脂肪细胞的形成、脂质的转运和代谢都至关重要。
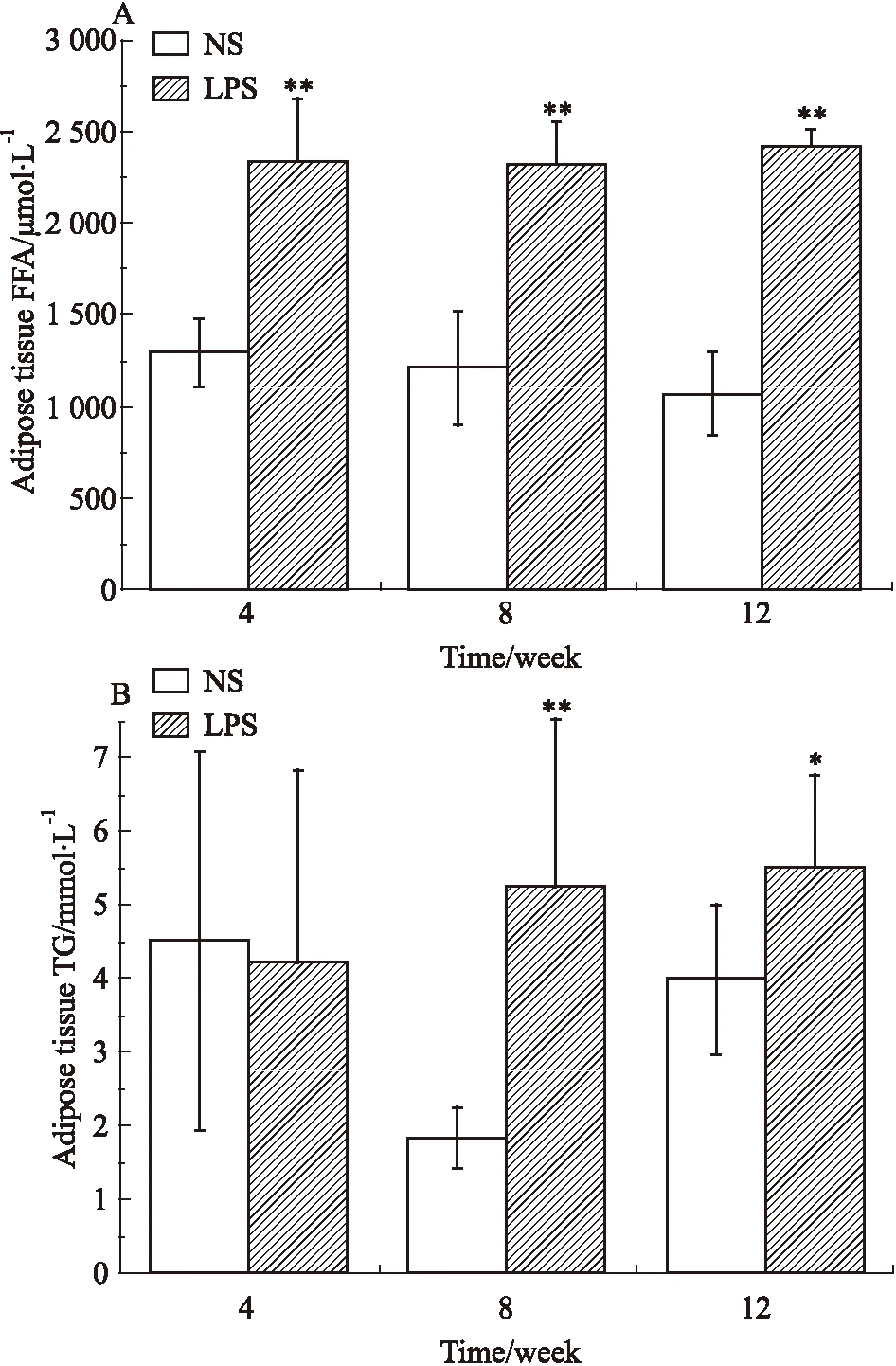
Fig 5 Epididymal fat free fatty acid(FFA)(A) and triglycerides (TG) (B) of male offspring ±s,n=12)
*P<0.05,**P<0.01vscontrol
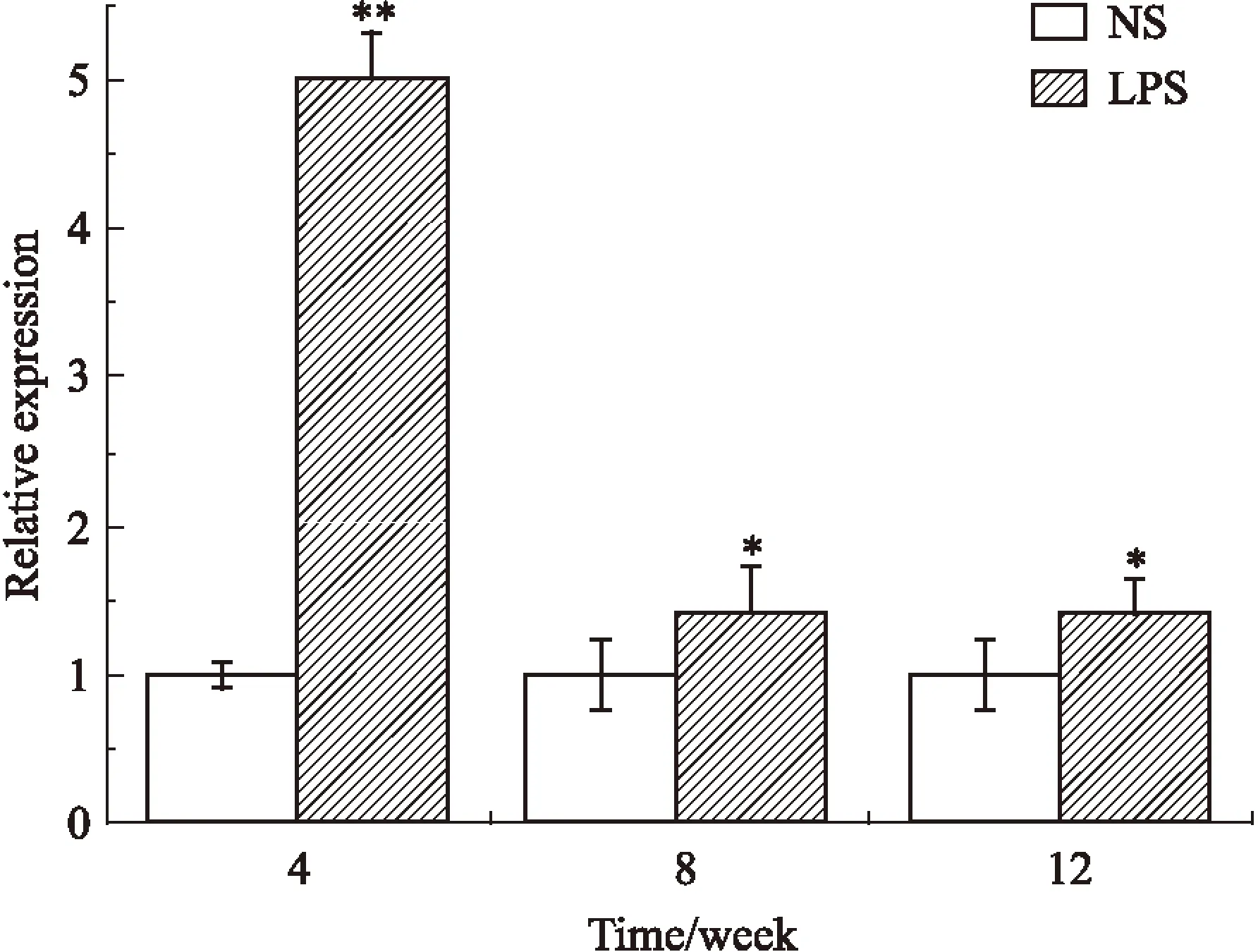
Fig 6 FAT/CD36 mRNA expression of each week male offspring ±s,n=12)
*P<0.05,**P<0.01vscontrol
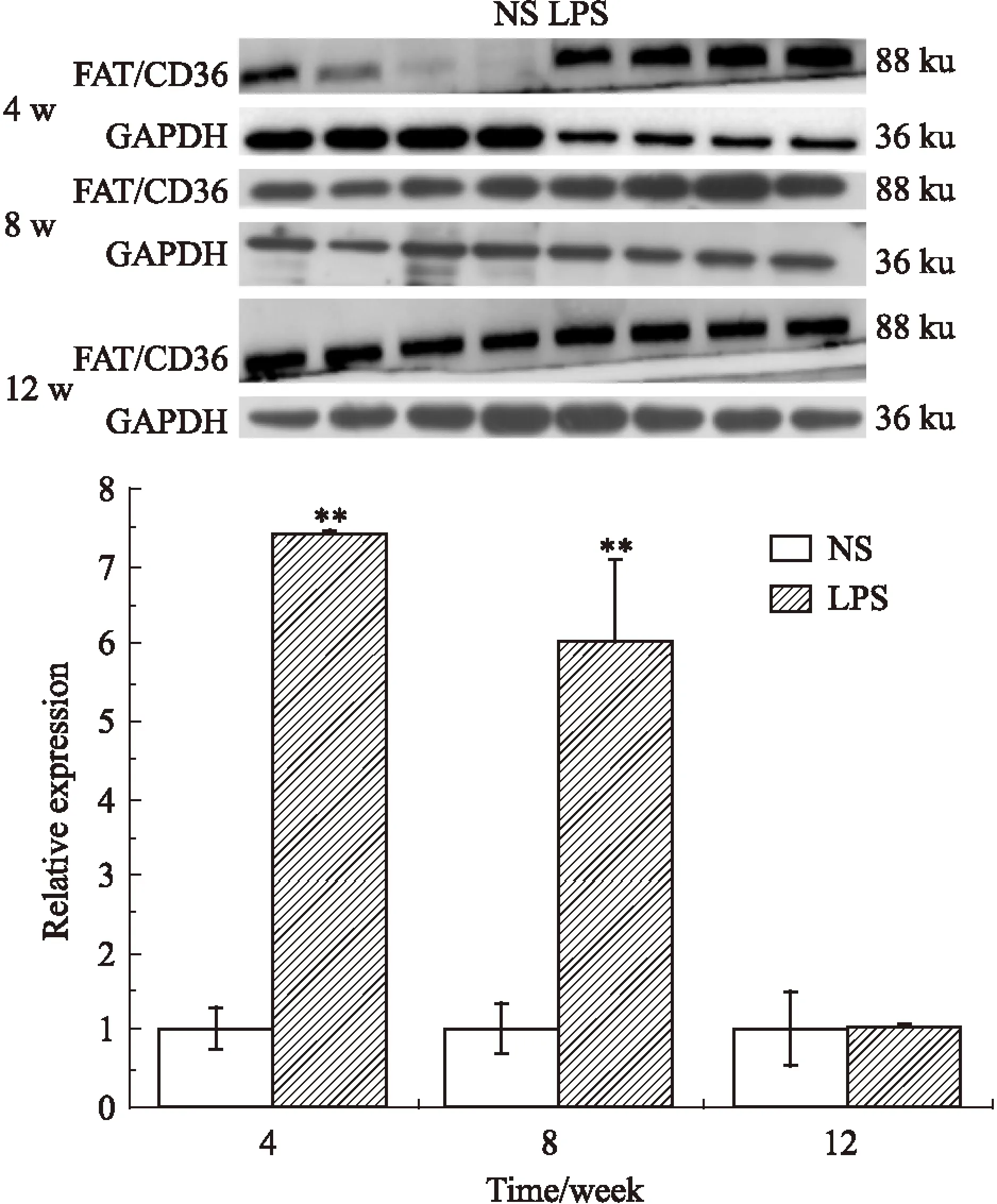
Fig 7 FAT/CD36 protein expression of each week offspring male ±s,n=12)
**P<0.01vscontrol
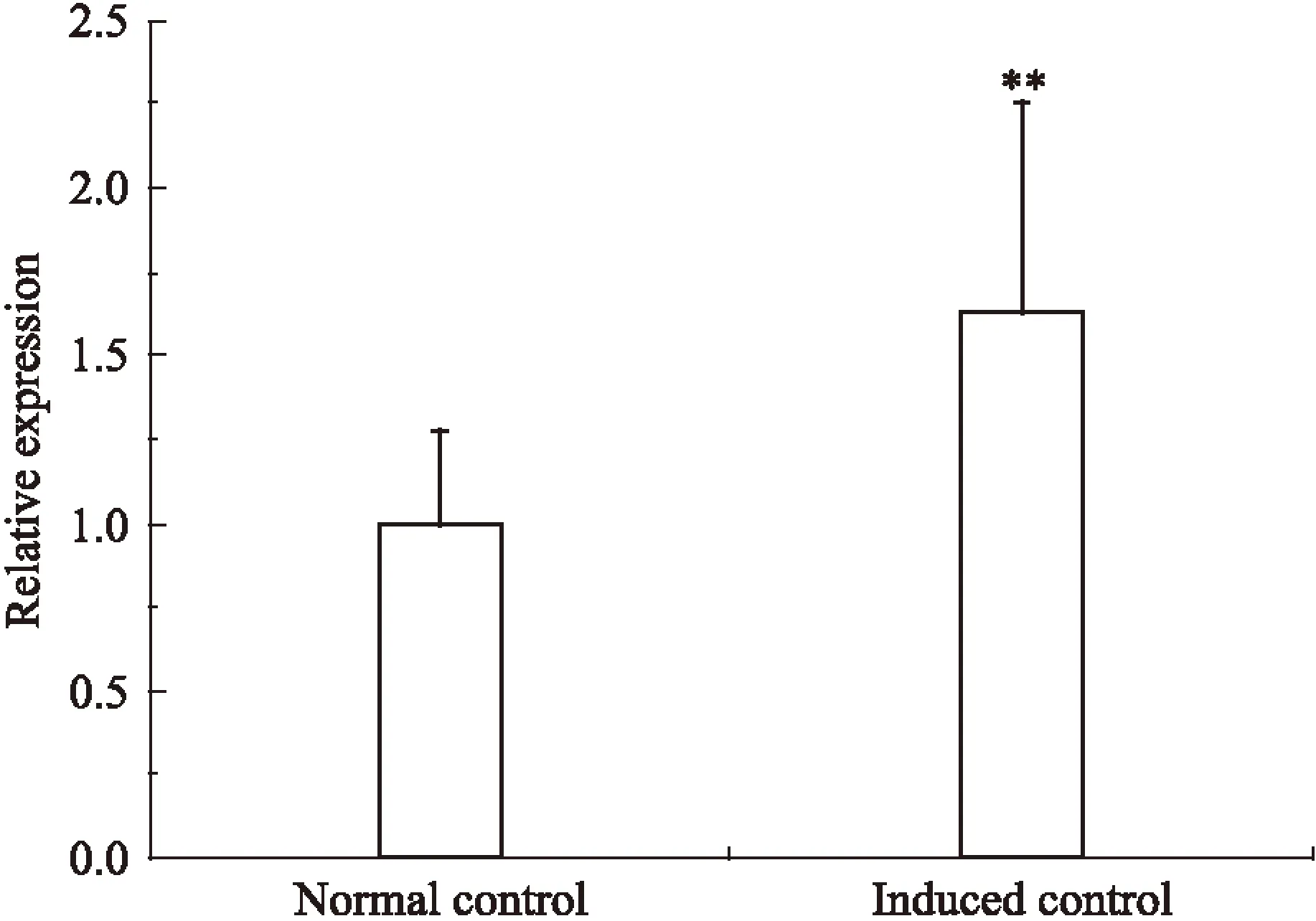
Fig 8 FAT/CD36 mRNA expression of
**P<0.01vscontrol
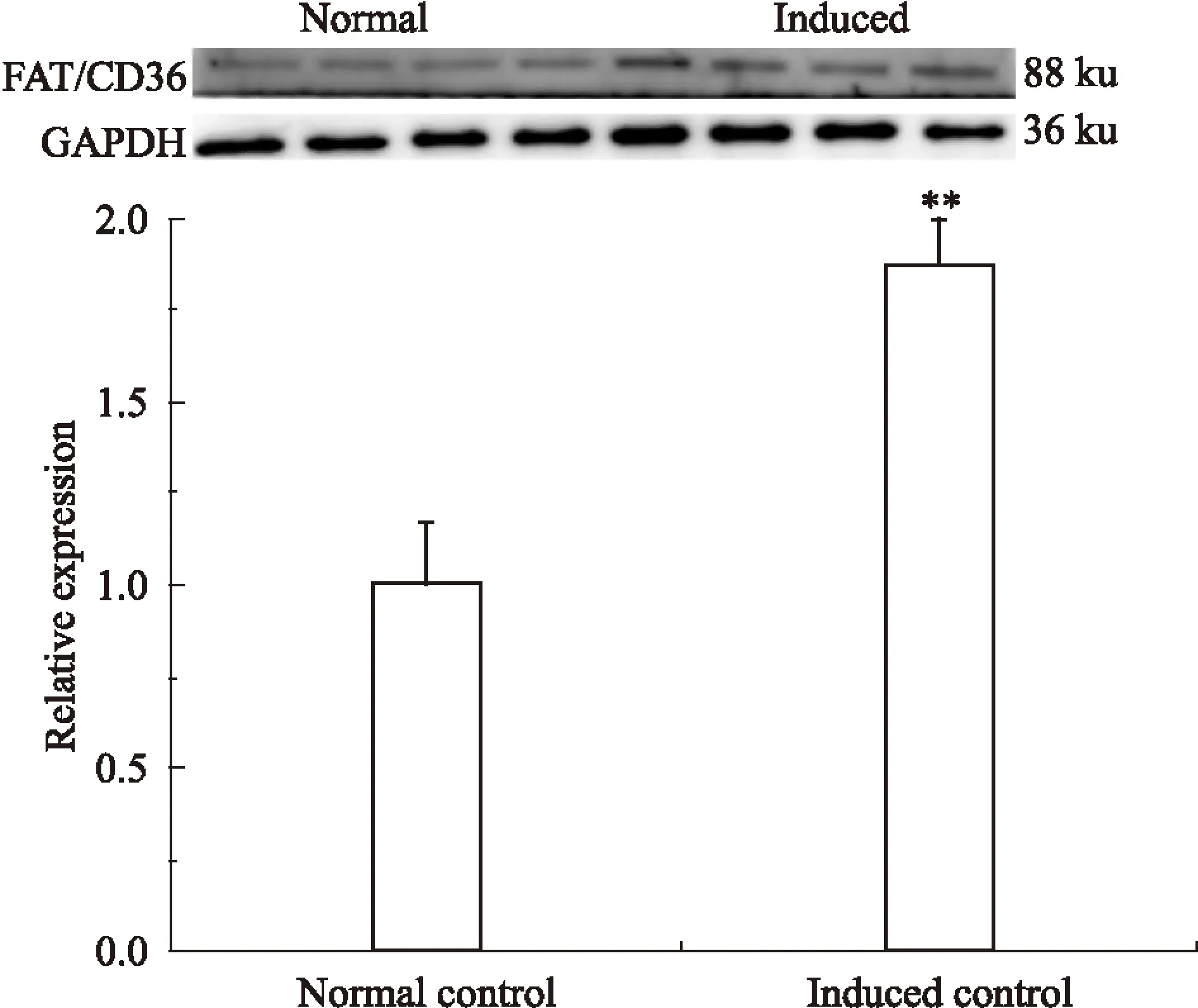
Fig 9 FAT/CD36 protein expression of
**P<0.01vscontrol
本实验选取典型的炎症免疫刺激剂脂多糖(LPS)于母体妊娠中期给予刺激,研究母体孕期炎症刺激对子代小鼠脂肪发育的影响和机制。通过实验我们得出,孕期炎症刺激以后,子代小鼠出现了以体重增加、内脏脂肪含量增多、脂肪系数增大的脂肪发育不良情况。通过血液和脂肪中FFA和TG含量的测定,我们发现小鼠血液和脂肪组织中的FFA和TG都较对照组高。通过对小鼠脂肪组织中FAT/CD36含量的测定我们发现,脂肪组织中FAT/CD36含量也明显增加,这说明在以FFA、TG为主要特征的脂质代谢中,FAT/CD36作为脂肪酸转运酶扮演了十分重要的角色,并且在诱导分化的3T3-L1细胞中,FAT/CD36含量较正常的细胞也较高,说明FAT/CD36在前脂肪细胞分化为成熟的脂肪细胞的过程中,随着脂肪细胞的积累增多,FAT/CD36的表达量也明显上升,FAT/CD36可能对脂肪细胞的形成、脂质的转运和代谢都至关重要,而脂肪的过多积累会引起器官的损害和慢性炎症的发生,最终导致肥胖和相关的代谢疾病。孕期炎症模型不同于以往的任何单纯的肥胖模型和炎症模型,它有效地说明了胎儿宫内炎症可以作为一种独立的因素导致子代小鼠肥胖,没有后天饮食的干预,更贴近于临床,是遗传因素与炎症和肥胖的一个结合点。FAT/CD36 途径可作为一个切入点,为新药开发及临床治疗提供线索。然而母体孕期炎症刺激影响子代脂肪发育的具体机制目前尚不明确,需要进行下一步的研究。
[1]Zhou M, Wang H, Zhu J, et al. Cause-specific mortality for 240 causes in China during 1990-2013:a systematic subnational analysis for the Global Burden of Disease Study 2013[J].Lancet, 2016,387(10015): 251-72.
[2]杨永玉,胡长平. 肥胖与脂肪组织重构[J]. 中国药理学通报, 2016,32(1): 9-13.
[2]Yang Y Y, Hu C P. Obesity and fat tissue reconstruction[J].ChinPharmacolBull, 2016,32(1): 9-13.
[3]田辉,王玉婷,陶莉,等. 一种新型小鼠肥胖模型的建立[J]. 中国药理学通报,2013,29(7):1016-8.
[3]Tian H, Wang Y T, Tao L, et al. A new type of building in mouse models of obesity[J].ChinPharmacolBull, 2013,29(7): 1016-8.
[4]李瑶,辛颖. 宫内发育迟缓大鼠胰腺肝脏骨骼肌中胰岛素受体底物的表达[J]. 中国循证儿科杂志, 2011,6(3): 225-9.
[4]Li Y, Xin Y. Intrauterine growth retardation rats of insulin receptor substrate expression in the liver of skeletal muscle[J].ChinJEvidBasedPediatr, 2011, 6(3): 225-9.
[5]Li S, Bouzar C, Cottet-Rousselle C, et al. Resveratrol inhibits lipogenesis of 3T3-L1 and SGBS cells by inhibition of insulin signaling and mitochondrial mass increase[J].BiochimBiophysActa, 2016,1857(6): 643-52.
[6]张勇, 李之俊. 运动与脂肪动员研究进展[J]. 中国运动医学杂志, 2012, 31(1): 69-75.
[6]Zhang Y,Li Z J. The research progress of movement and fat mobilization[J].ChinJSportsMed, 2012,31(1): 69-75.
[7]Talati M, Hemnes A. Fatty acid metabolism in pulmonary arterial hypertension: role in right ventricular dysfunction and hypertrophy[J].PulmCirc, 2015,5(2): 269-78.
[8]刘芳, 高南南, 杨润梅, 等. 不同品系小鼠肥胖模型比较及C57BL/6J小鼠肥胖机制研[J]. 中国药理学通报, 2013,29(3): 360-5.
[8]Liu F, Gao N N, Yang R M, et al. Comparison of obesity models established in the different strains of mice and the mechanism of obese C57BL/6J mice[J].ChinPharmacolBull, 2013,29(3): 360-5.
[9]金鑫,张会欣,张彦芬,等. 津力达对高脂诱导的胰岛素抵抗ApoE-/-小鼠骨骼肌脂质转运酶类的表达变化[J]. 中国中药杂志, 2015, 40(6):1156-60.
[9]Jin X, Zhang H X, Zhang Y F, et al. Effect of Jinlida on changes in expression of skeletal muscle lipid transport enzymes in fat-induced insulin resistance ApoE-/-mice[J].ChinJChinMaterMed, 2015,40(6): 1156-60.
[10]杨艳丽. 肥胖研究进展[J]. 济宁医学院学报, 2012,35(1): 64-6.
[10]Yang Y L. The research progress of obesity[J].JJiningMedColl, 2012,35(1): 64-6.
[11]Liu L, Mei M, Yang S, et al. Roles of chronic low-grade inflammation in the development of ectopic fat deposition[J].MediatorsInflamm, 2014,20(14): 418185-93.
[12]Buttet M, Poirier H, Traynard V, et al. Deregulated lipid sensing by intestinal CD36 in diet-induced hyperinsulinemic obese mouse model[J].PLoSOne,2016,11(1): 145626.
[13]Goudriaan J R,Dahlmans V,Teusink Bel, et al. CD36 deficiency increases insulin sensitivity in muscle,but induces insulin resistance in the liver in mice[J].LipidRes, 2003,44(12): 2270-7
[14]程梭梭, 袁莉. CD36与脂肪酸代谢和胰岛素抵抗[J]. 国际内分泌代谢杂志, 2010,30(1): 38-42.
[14]Cheng S S, Yuan L. The correlation of CD36 with both fatty acid metabolism and insulin resistance[J].IntJEndocrinolMetab, 2010,30(1): 38-42.
[15]汤绍芳,李红涛, 邱明才. 代谢性炎症与代谢综合征[J]. 医学与哲学, 2009,30(12): 48-50.
[15]Tang S F,Li H T, Qiu M C. Metaflammation and metabolic syndrome[J].MedPhilos, 2009,30(12): 48-50.
[16]Hegarty B D, Cooney G J, Kraegen E W, et al. Increased efficiency of fatty acid uptake contributes to lipid accumulation in skeletal muscle of high fat-fed insulin-resistant rats[J].Diabetes,2002,51(5): 1477-84.
[17]Smith A C, Mullen K L, Junkin K A,et al. Metformin and exercise reduce muscle FAT/CD36 and lipid accumulationand blunt the progression of high-fat diet-induced hyperglycemia[J].AmJPhysiolEndocrinolMetab, 2007, 293(1): E172-81.
[18]陈俊华,张向阳. CD36抗原在动脉粥样硬化发生机制中的作用[J]. 心血管病学进展, 2008,29(5):795-8.
[18]Chen J H, Zhang X Y. CD36 antigen role in the mechanism of atherosclerosis[J].AdvCardiovascDis, 2008, 29(5):795-8.
[19]靳文英,陈红. CD36与动脉粥样硬化[J]. 中国动脉硬化杂志, 2010,18(7): 582-5.
[19]Jin W Y,Chen H. CD36 and atherosclerosis[J].ChinJArterioscler, 2010,18(7): 582-5.
Prenatal exposure to lipopolysaccharide results in lipid metabolism and FAT/CD36 expression in mice offspring
QIN Shu-gang, CHEN Xin, JIA Yi, ZHOU Jian-zhi, SU Min, LI Xiao-hui
(DeptofPharmaceutics,CollegeofPharmacy,theThirdMilitaryMedicalUniversity,Chongqing400038,China)
AimTo explore the effect of prenatal exposure to lipopolysaccharide (LPS) on lipid metabolism in mice offspring from the starting point of FAT/CD36 expression. Methods8-week old C57 mice mated 2 ∶1,then they were caged separately,marked as pregnancy 0 d. The pregnant mice were given single intraperitoneal injection of 75 μg·kg-1LPS, and the control received injections of 0.2 mL saline. The perirenal adipose of female mice and epididymis adipose of male mice were collected in 4 w,8 w,12 w,respectively. The weight of visceral adipose tissue and the free fatty acid(FFA) and triglyceride(TG) of adipose tissue and FAT/CD36 of offspring mice were quantitated.ResultsThe body weight of offspring of LPS group was also significantly higher than that of NS group, and LPS group offspring displayed increased adipose tissue wet weights, the expression of TG and FFA was increased in LPS group compared with NS. Especially, prenatal exposure to inflammatory stimulation resulted in marked increase of FAT/CD36 and abnormal adipocyte development.ConclusionsInflammation induced by prenatal exposure to LPS results in increased body weight, adipose coefficient and FAT/CD36 that might develop into obesity in adult mice. These results are relevant in that anomalous local adipose tissue and FAT/CD36 regulation may be an important mechanism underlying obesity.
prenatal exposure to lipopolysaccharide; FAT/CD36; FFA; TG; lipometabolic disorder; obesity
2016-04-07,
2016-05-11
国家自然科学基金面上项目(No 81473260);重庆市自然科学基金重点项目(No cstc2015jcyjBX0093)
秦书刚(1990-),男,硕士生,研究方向:中心性肥胖,E-mail:18104513839@163.com;
李晓辉(1962-),男,博士,教授,博士生导师,研究方向:抗炎免疫与心血管药理学,通讯作者,E-mail:lpsh008@aliyun.com;
A
1001-1978(2016)08-1080-06
R-332;R364.5;R349.15;R589.2;R977.6
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.020.html
苏敏(1963-),男,博士,副教授,硕士生导师,研究方向:药物新制剂,通讯作者,E-mail:sms888@163.com