果胶阿霉素对大鼠心脏毒性的研究
2016-08-29唐小海冉茂盛张雪梅
彭 琳,唐小海, 严 伟,冉茂盛,张雪梅,,范 菲,
(1.四川师范大学生命科学学院,四川 成都 610101;2.重庆莱美药业股份有限公司, 重庆 401336)
果胶阿霉素对大鼠心脏毒性的研究
彭琳1,2,唐小海1,2, 严伟1,冉茂盛2,张雪梅1,2,范菲1,2
(1.四川师范大学生命科学学院,四川 成都610101;2.重庆莱美药业股份有限公司, 重庆401336)
doi:10.3969/j.issn.1001-1978.2016.08.009
目的考察果胶阿霉素(PAC)对大鼠心脏毒性的影响。方法50只大鼠随机分成5组,每组10只。阿霉素(ADM)组腹腔注射3 mg·kg-1,隔天给药1次,连续给药6次;PAC组分别腹腔注射ADM当量1.5、3、6 mg·kg-1,隔天给药1次,连续给药6次;对照组腹腔注射生理盐水3 mg·kg-1,隔天给药1次,连续给药6次。给药后48 h处死大鼠,检测大鼠超声心动图、心肌酶、心脏组织中氧化应激水平及心脏组织病理学的变化。同时建立S180腹水瘤模型,检测PAC的抗肿瘤作用。结果ADM组大鼠存活率为50%,PAC各组大鼠存活率为100%;PAC能不同程度增加大鼠体重、心脏指数及免疫指数;增加HR、EF、FS,减小LVIDd、LVIDs;降低血清中AST、LDH、CK、CK-MB活性;增加心肌组织中GSH-Px、SOD活性,降低MDA含量;改善病理学变化;PAC能明显降低腹水的生长,延长小鼠生存期。结论PAC能有效改善心脏毒性,提高大鼠存活率,改善免疫能力及心功能,改善心肌酶和氧化应激,减少心肌细胞损伤,而且有明显的抗肿瘤作用。
阿霉素;果胶阿霉素;心脏毒性;超声心动图;心肌酶;氧化应激水平;病理学变化;抗肿瘤活性
阿霉素(ADM)是目前应用最广泛的抗肿瘤药物之一,对各种生长周期的肿瘤均有杀伤效果[1]。但是,ADM在达到抗癌疗效的同时也产生严重的心脏毒性[2-4]。为了减小ADM毒副作用,利用靶向给药系统将药物选择性地释放到特定的组织或细胞,保持靶点药物浓度,减少心脏毒性。果胶是从植物细胞壁提取的物质,是一种生物组织相容性极好的天然高分子物质,在体内性质稳定,不降解,具有来源丰富、安全、无毒等优点,用其作为靶向给药的载体有着非常广阔的应用前景[5]。将小分子果胶与抗癌药物阿霉素通过酰胺键[6]共价结合形成的高分子抗癌前药果胶阿霉素(PAC),其药理作用主要由于EPR效应及肿瘤细胞的吞噬作用,该高分子轭合物在肿瘤细胞大量累积,并通过溶酶体酶的作用使共价键断裂,释放游离阿霉素,进而靶向作用于肿瘤细胞。PAC腹腔给药后,血中游离阿霉素浓度大大降低,且心肌组织中溶酶体数量少于其他组织,因此能达到减少心脏毒性的目的。
1 材料与方法
1.1实验动物与实验材料SD大鼠,♀,体质量280~320 g,(成都达硕实验动物有限公司,合格证号:0016465);KM小鼠,♀,20~22 g,(成都达硕实验动物有限公司,合格证号:0016465);果胶阿霉素(PAC)由实验室合成;注射用盐酸多柔比星(浙江海正药业股份有限公司,批号:H20100406);谷胱甘肽过氧化物酶(GSH-Px)测试盒(南京建成生物工程研究所,批号:20141108)、超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所,批号:20141108)、丙二醛(MDA)测试盒(南京建成生物工程研究所,批号:20141107);可见紫外分光光度计(北京普析通用仪器有限公司,型号:TU-1810);全自动生化分析仪(深圳迈瑞生物医疗电子股份有限公司,型号:BS-480)。
1.2方法
1.2.1大鼠心脏毒性造模50只大鼠随机分成5组,分别为ADM组、PAC低剂量组、PAC中剂量组、PAC高剂量组和对照组。每组给药剂量分别为:ADM腹腔注射3 mg·kg-1,隔天给药1次,连续给药6次,累积剂量为18 mg·kg-1[7];PAC分别腹腔注射ADM当量1.5、3、6 mg·kg-1,隔天给药1次,连续给药6次,累积剂量分别含ADM当量9、18、36 mg·kg-1;对照组给予同体积的生理盐水。
1.2.2超声心动图检测造模完成后48 h,称体重后腹腔注射100 g·L-1水合氯醛麻醉大鼠,将大鼠左胸去毛,固定大鼠四肢,左胸前涂少量耦合剂,将探头置于左胸前,调整深度为2.0~2.5 cm,获得左室短轴各切面,记录乳头肌水平的M型曲线,并进行测量。观测指标包括:左室舒张末期内径(LVIDd)、左室收缩末期内径(LVIDs)、心率(HR)、左室射血分数(EF)、左室短轴缩短率(FS)。
1.2.3大鼠体重变化百分比、心脏指数、存活率检查完超声心动图后处死大鼠,分离大鼠心脏并称重,计算大鼠体重变化百分比、心脏指数,统计大鼠存活率。
大鼠体重变化百分比/%=(最终体重-最初体重)/最初体重×100
心脏指数/%=心脏重量/最终体重×100
存活率/%=存活大鼠数量/起始大鼠数量×100
1.2.4免疫器官脏器系数的测定处死大鼠后,分离大鼠脾脏及胸腺并称重,计算脏器系数。
脾脏系数/%= 脾脏重量/最终体重×100
胸腺系数/%=胸腺重量/最终体重×100
1.2.5心肌酶谱检测[8]采用全自动生化分析仪测定血清中肌酸肌酶(CK)、肌酸激酶同工酶(CK-MB)、天冬氨酸氨基转移酶(AST)以及乳酸脱氢酶(LDH)活性。
1.2.6氧化应激水平检测取心肌组织称重,加入组织重量9倍体积的生理盐水,匀浆,制备100 g·L-1的组织匀浆液。 硫代巴比妥酸法检测MDA含量,硫代二硝基苯甲酸显色法测定GSH-Px活力,黄嘌呤氧化酶法测定SOD活力。
1.2.7病理学检查取心室部分,用体积分数为0.1的中性福尔马林溶液固定,石蜡包埋切片,HE染色,乙醇脱水,透明,封片,镜检观察大鼠心肌组织病理学变化。
1.2.8PAC对S180腹水瘤的抗肿瘤活性100只KM小鼠腹腔接种106个细胞。3 d后,将小鼠随机分为5组,每组各20只:ADM组、PAC低剂量组、PAC中剂量组、PAC高剂量组和对照组,分别按照ADM 2.5 mg·kg-1、PAC 2.5 mg·kg-1、PAC 5 mg·kg-1、PAC 10 mg·kg-1、 对照组(等体积生理盐水)腹腔给药,3 d后重复上述方式再次给药,即累积剂量分别是ADM 5 mg·kg-1、PAC 5 mg·kg-1、PAC 10 mg·kg-1、PAC 20 mg·kg-1。给完药3 d后,各组断颈处死10只小鼠,收取腹水并称重,计算各组小鼠腹水量。每组剩余的10只小鼠继续饲养,观察生存期。
2 结果
2.1超声心动图检测如Tab 1所示,与对照组相比,ADM组HR、EF、FS明显降低(P<0.01),LVIDd、LVIDs明显增加(P<0.01)。与ADM组相比,PAC各剂量组心功能均有明显改善,其中PAC 9 mg·kg-1组HR、EF、FS明显增加(P<0.01),LVIDd、LVIDs明显降低(P<0.01);PAC 18 mg·kg-1组HR、FS明显增加(P<0.01),EF明显增加(P<0.05),LVIDd、LVIDs明显降低(P<0.01);PAC 36 mg·kg-1组FS明显增加(P<0.01),HR明显增加(P<0.05)。
2.2大鼠存活率、体重和脏器指数的变化如Tab 2所示,对照组及PAC各组大鼠全部存活,ADM组大鼠死亡一半。ADM组体重变化百分比、心脏指数、脾脏指数、胸腺指数与对照组相比明显降低(P<0.01)。与ADM组相比,PAC 9 mg·kg-1组与PAC 18 mg·kg-1组的体重变化百分比、心脏指数、脾脏指数、胸腺指数均有明显增高(P<0.01);PAC 36 mg·kg-1组与ADM组相比,心脏指数、胸腺指数明显增高(P<0.01),体重变化百分比明显增高(P<0.05)。
2.3心肌酶含量ADM组大鼠血清中CK、CK-MB、LDH和AST与对照组相比有明显增高(P<0.01)。与ADM组相比,PAC 9 mg·kg-1组CK、CK-MB、LDH、AST明显降低(P<0.01);PAC 18 mg·kg-1与ADM组相比,CK-MB、LDH、AST明显降低(P<0.01),CK明显降低(P<0.05);PAC 36 mg·kg-1组对比ADM组,AST明显降低(P<0.01),CK及LDH明显降低(P<0.05)。见Fig 1。
2.4心肌细胞氧化应激水平对比对照组的GSH-Px、SOD及MDA,ADM组GSH-Px、SOD明显降低,而MDA明显升高(P<0.01)。与ADM组相比,PAC 9 mg·kg-1和PAC 18 mg·kg-1组GSH-Px、SOD明显上升,MDA明显下降(P<0.01);PAC 36 mg·kg-1组与ADM组相比,MDA明显下降(P<0.01),GSH-Px、SOD明显上升(P<0.05)。见Fig 2。
GroupHR/BPMEF%FS%LVIDd/mmLVIDs/mmControl370.00±10.5784.70±4.7949.12±2.2357.30±1.4229.50±2.22ADM18mg·kg-1326.10±16.04##64.40±7.20##32.52±3.91##67.60±2.17##46.40±3.17##PAC9mg·kg-1367.60±7.37**80.40±6.85**47.04±3.66**59.20±2.04**32.30±3.02**PAC18mg·kg-1355.90±11.07**73.50±8.65*43.59±4.70**63.20±1.81**35.90±3.87**PAC36mg·kg-1344.00±15.59*68.30±8.6539.54±5.69**66.20±1.9945.20±2.53
##P<0.01vscontrol;*P<0.05,**P<0.01vsADM
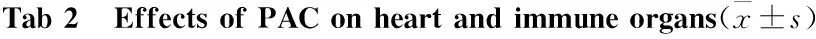
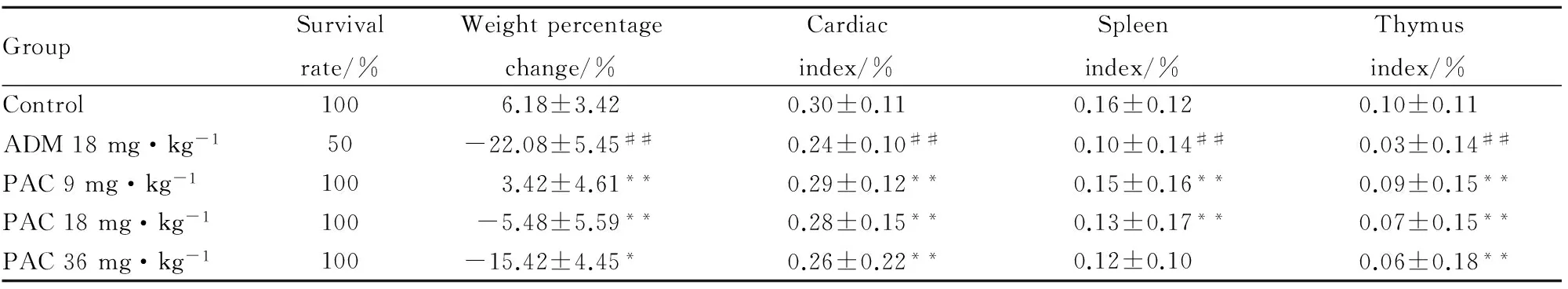
GroupSurvivalrate/%Weightpercentagechange/%Cardiacindex/%Spleenindex/%Thymusindex/%Control1006.18±3.420.30±0.110.16±0.120.10±0.11ADM18mg·kg-150-22.08±5.45##0.24±0.10##0.10±0.14##0.03±0.14##PAC9mg·kg-11003.42±4.61**0.29±0.12**0.15±0.16**0.09±0.15**PAC18mg·kg-1100-5.48±5.59**0.28±0.15**0.13±0.17**0.07±0.15**PAC36mg·kg-1100-15.42±4.45*0.26±0.22**0.12±0.100.06±0.18**
##P<0.01vscontrol;*P<0.05,**P<0.01.vsADM
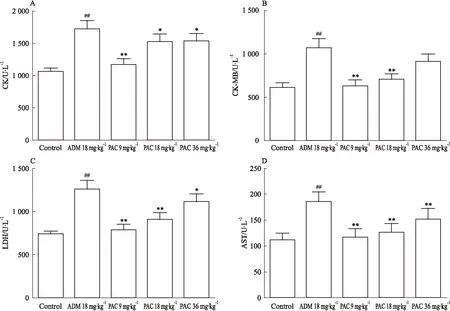
Fig 1 Effect of PAC on serum CK (A),CK-MB (B),LDH(C),AST(D)
##P<0.01vscontrol;*P<0.05,**P<0.01vsADM
2.5病理学变化如Fig 3所示,光镜下观察对照组心外膜完整,未见纤维组织增生;肌层肌纤维无肥大萎缩变细,无肌肉纤维断裂、波浪变性,心肌细胞无水样,空泡、脂肪变性,细胞核居中,结构清晰,肌纤维未见坏死及瘢痕组织形成;未见炎细胞浸润及纤维结缔组织增生,心内膜内皮细胞完好。ADM组心肌细胞局灶性水肿,心肌纤维排列紊乱,间隙增大、变性、部分溶解坏死,间质水肿,毛细血管扩张。PAC组大鼠心肌损伤呈剂量效应,但均比ADM损伤程度低,其中PAC 9 mg·kg-1组组织结构基本正常,PAC 18 mg·kg-1组心肌细胞局灶状水肿,PAC 36 mg·kg-1组心肌细胞局灶状水肿,心肌纤维排列紊乱,间隙增大。
2.6PAC的抗肿瘤作用相比阴性组产生的腹水量(9.82±2.34) g,ADM 5 mg·kg-1组腹水为(0.29±0.37) g(P<0.01),PAC 3个剂量组与阴性对照组相比也能不同程度地抑制腹水的产生,其中PAC 5 mg·kg-1、PAC 10 mg·kg-1、PAC 20 mg·kg-1分别产生腹水(4.36±0.79) g、(0.73±0.46) g、0 g(P<0.01)。各组剩余的10只小鼠中,阴性组小鼠在23 d内全部死亡,ADM组小鼠死亡3只,PAC 5 mg·kg-1、PAC 10 mg·kg-1、PAC 20 mg·kg-1分别死亡5只、2只、0只。见Fig 4。
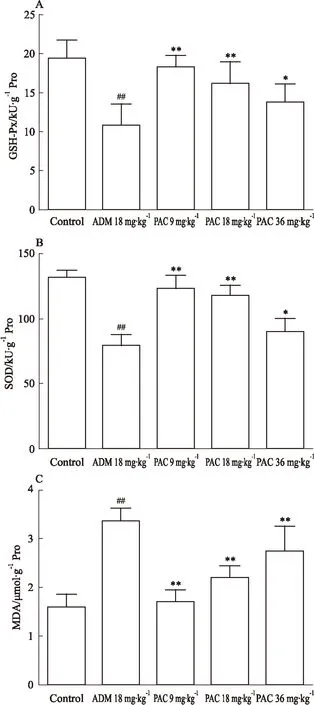
Fig 2 Effects of PAC on GSH-Px (A), SOD (B) and MDA (C)
##P<0.01vscontrol;*P<0.05,**P<0.01vsADM
3 讨论
一般情况下,心肌细胞内存在完整的氧化抗氧化系统,它们的平衡保证了机体的正常运作。由于ADM进入心肌细胞后通过代谢产生大量自由基,消耗机体的抗氧化酶SOD、GSH-Px等, 使抗氧化能力降低,心肌细胞膜系统磷脂中多不饱和脂肪酸逐渐形成脂质自由基,引起脂质过氧化。使膜结构发生改变,并影响膜功能蛋白的位置和构型,破坏膜的完整性,导致心肌细胞损伤[9-13]。PAC腹腔给药后,主要分布于网状巨噬系统器官中,心脏中药物浓度明显降低,同时进入循环系统的药物大大减少,因此能减少药物对心肌的损伤。研究中发现多次腹腔注射高分子靶向药物PAC后,能提高抗氧化酶的活性,清除过量的自由基,减轻过氧化反应产物聚积而导致的脂质过氧化产物的形成,从而降低对大鼠的氧化损伤,保护心肌细胞膜的完整性,降低心脏毒性。同时,由于EPR效应和肿瘤细胞对大分子药物的吞噬作用,使药物在肿瘤细胞大量积累,提高选择性和利用率,使得PAC也能很好地抑制肿瘤细胞的生长,提高小鼠生存期。PAC在减小药物心脏毒性的同时拥有良好的抗肿瘤作用,因此,临床上有望通过增加药物剂量提高其抗肿瘤效果并改善患者生活质量,这使PAC有更深一步深入研究和开发的意义和价值。
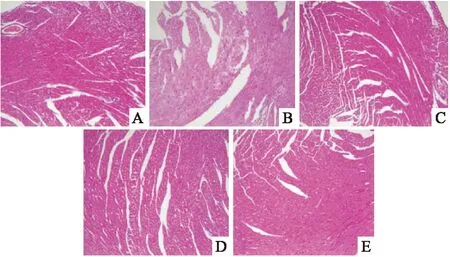
Fig 3 Effect of PAC on cardiac histology in rats
A:Control group;B:ADM 18 mg·kg-1group;C:PAC 9 mg·kg-1group;D:PAC 18 mg·kg-1group;E:PAC 36 mg·kg-1group
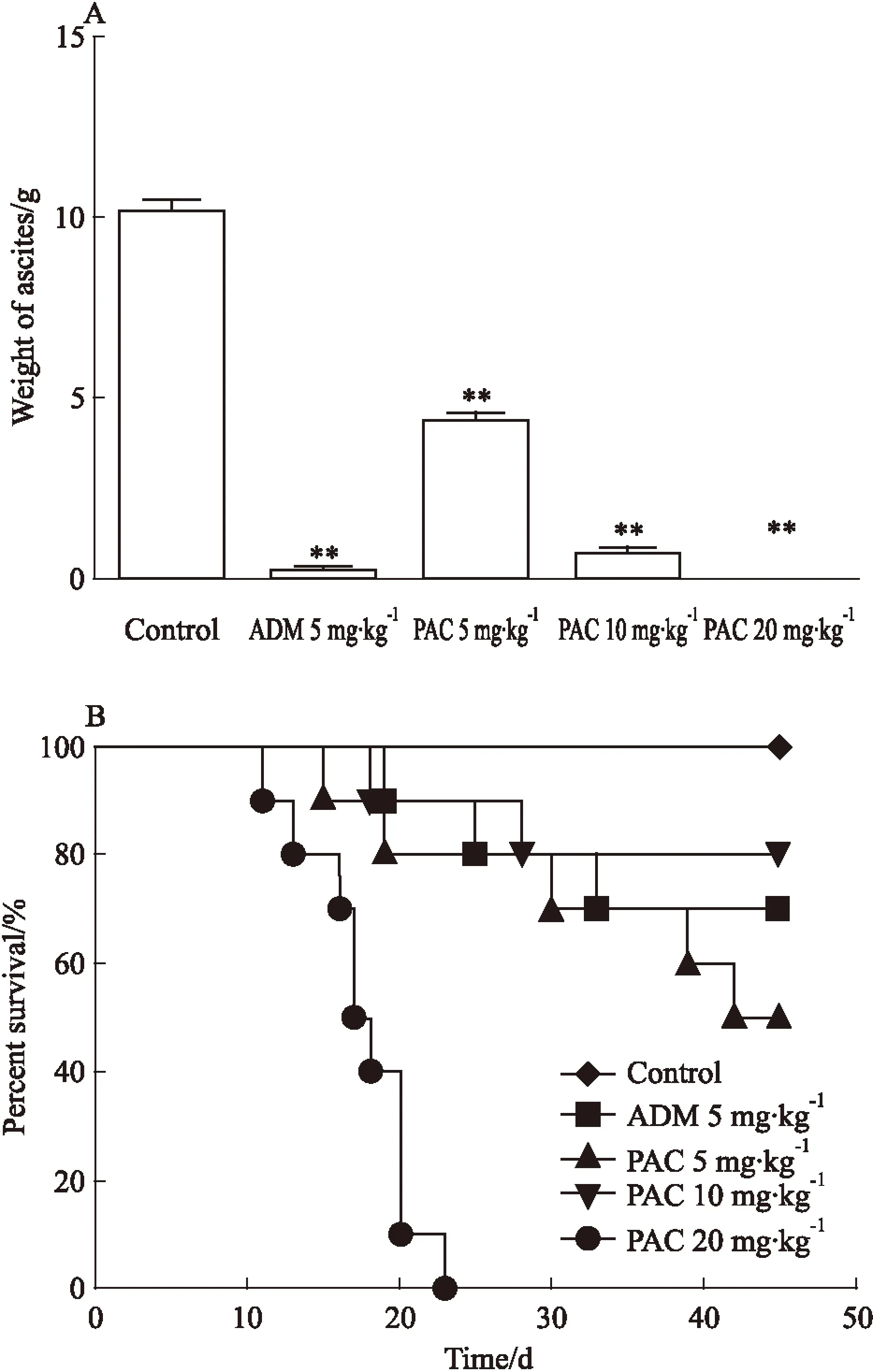
Fig 4 Effects of PAC on S180 ascites (A) and survival period (B) of mice
**P<0.01vscontrol
(致谢:本实验于川大莱美联合实验室完成,在此对本实验做出贡献的所有人员给予诚挚的感谢。)
[1]Desai V G,C Kwekel J,Vijay V,et al. Early biomarkers of doxorubicin-induced heart injury in a mouse model[J].ToxicolApplPharmacol,2014,281(2):221-9.
[2]Guenancia C,Li N,Hachet O,et al.Paradoxically,iron overload does not potentiate doxorubicin-induced cardiotoxicityinvitroin cardiomyocytes andinvivoin mice[J].ToxicolApplPharmacol,2015,284(2):152-62.
[3]Heeba G H,Mahmoud M E.Dual effects of quercetin in doxorubicin-induced nephrotoxicity in rats and its modulation of the cytotoxic activity of doxorubicin on human carcinoma cells[J].EnvironToxicol,2016,31(5):624-36.
[4]Ewer M S, Ewer S M. Cardiotoxicity of anticancer treatments: what the cardiologist needs to know[J].NatRevCardiol,2010,7(10):564-75.
[5]Mohnen D. Pectin structure and biosynthesis[J].CurrOpinPlantBiol,2008,11(3):266-77.
[6]Vetvicka D, Hruby M, Hovorka O,et al. Biological evaluation of polymeric micelles with covalently bound doxorubicin[J].BioconjugChem,2009,20(11):2090-7.
[7]Imbaby S, Ewais M, Essawy S,et al. Cardioprotective effects of curcumin and nebivolol against doxorubicin-induced cardiac toxicity in rats[J].HumExpToxicol,2014,33(8):800-13.
[8]Firdous A P,Kuttan R.Chemoprotective activity of carotenoid meso-zeaxanthin against doxorubicin-induced cardiotoxicity[J].JExpTherOncol,2012,10(2):101-6.
[9]Octavia Y,Tocchetti C G,Gabrielson K L,et al.Doxorubicin-induced cardiomyopathy: from molecular mechanisms to therapeutic strategies[J].JMolCellCardiol,2012, 52(6):1213-25.
[10]夏洪娟,王延鹏,朱伟,等.白藜芦醇通过上调SIRT1抑制阿霉素诱导的H9c2细胞损伤[J].中国药理学通报,2014,30(2):220-4.
[10]Xia H J,Wang Y P,Zhu W,et al.Resveratrol inhibits doxorubicine-induced toxicity of H9c2 cells partly by upregulating expression of SIRT1[J].ChinPharmacolBull,2014,30(2):220-4.
[11]简春燕,郭润民,刘丹铭,等.柚皮苷保护H9c2心肌细胞对抗阿霉素诱导的心肌毒性[J].中国药理学通报,2014,30(2):238-43.
[11]Jiang C Y,Guo R M,Liu D M,et al.Naringin protects H9c2 cells against doxorubicin-induced cardiotoxicity[J].ChinPharmacolBull,2014,30(2):238-43.
[12]Wang F, Li H, Shi H,et al . Pro-apoptotic role of nuclear factor-κB in adriamycin-induced acute myocardial injury in rats[J].MolMedRep,2012,5(2):400-4.
[13]李丽,唐燕霞,欧冰凝,等.表没食子儿茶素没食子酸酯全乙酰化衍生物对柔红霉素致小鼠心脏毒性的影响[J].中国药理学通报,2014,30(3):345-8.
[13]Li L,Tang Y X,Ou B N,et al.Effects of(-)-epigallocatechin-3-gallate peracetylated derivative on daunorubicin-induced cardiotoxicity in mice[J].ChinPharmacolBull,2014,30(3):345-8.
Study of pectin-adriamycin conjugate to cardiac toxicity in rats
PENG Lin1,2, TANG Xiao-hai1,2,YAN Wei1, RAN Mao-sheng2, ZHANG Xue-mei1,2, FAN Fei1,2
(1.CollegeofLifeScience,SichuanNormalUniversity,Chengdu610101,China;2.ChongqingLummyPharmaceuticalCo.Ltd,Chongqing401336,China)
AimTo study the effect of pectin-adriamycin conjugate(PAC) on cardiac toxicity.Methods50 female SD rats were randomly divided into 5 groups with 10 animals in each group. Adriamycin(ADM) group received 3 mg·kg-1, ip, every other day for 6 times.PAC group received ADM equivalent 1.5,3 and 6 mg·kg-1, ip, every other day for 6 times. Control group received normal saline parallel to ADM. Rats were sacrificed and the echocardiogram, cardiac enzymes,the oxidative stress levels in myocardial cells and histopathological changes after 48 h administration were detected. S180 ascites tumor bearing mice models were established to investigate the antitumor activity of PAC.ResultsThe survival rate of ADM group was 50% and that of PAC each group was 100%. PAC could significantly increase body weight,heart index and immune index and increase HR,EF,FS,reduce LVIDd,LVIDs. PAC could also significantly increase the AST, LDH, CK, CK-MB level in serum.GSH-Px and SOD activities of PAC group were significantly increased and MDA contents were reduced, and histopathological changes decreased. PAC could effectively inhibit the growth of tumor cells and extend the survival period of mice.ConclusionPAC induces a significant reduction in cardiotoxicity by increasing survival rate, immune and cardiac function, improving cardiac enzymes,oxidative stress and myocardial cell injury, and also PAC has obvious antitumor effect.
ADM; pectin-adriamycin conjugate(PAC); cardiac toxicity; echocardiogram; cardiac enzymes; the oxidative stress levels; histopathological changes; antitumor activity
2016-03-28,修回稿日期:2016-04-25
国家十二五重大专项(No 2011ZX09102-001)
彭琳(1991-),女,硕士,研究方向:靶向抗肿瘤药物,E-mail:748109074@qq.com;
唐小海(1963-),男,博士,教授,研究方向:抗肿瘤药物,通讯作者,E-mail:pharmmateceo@aliyun.com
A
1001-1978(2016)08-1075-06
R-332;R322.11;R730.53;R979.14
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.018.html