山茱萸环烯醚萜苷类成分对AGEs诱导HUVEC损伤的保护作用
2016-08-29沈红胜许惠琴陆春红戴国英陈玉萍吴云皓
沈红胜,许惠琴,陆春红,戴国英,徐 康,吕 兴,陈玉萍,吴云皓
(1. 南京中医药大学药学院,2.江苏省中药药效与安全性评价重点实验室,江苏 南京 210023)
山茱萸环烯醚萜苷类成分对AGEs诱导HUVEC损伤的保护作用
沈红胜1,2,许惠琴1,2,陆春红1,2,戴国英1,2,徐康1,2,吕兴1,2,陈玉萍1,2,吴云皓1,2
(1. 南京中医药大学药学院,2.江苏省中药药效与安全性评价重点实验室,江苏 南京210023)
doi:10.3969/j.issn.1001-1978.2016.08.007
目的探讨山茱萸环烯醚萜苷类特征成分马钱苷、莫诺苷对糖基化终末产物(AGEs)诱导人脐静脉内皮细胞(HUVEC)损伤的保护作用。方法体外培养HUVEC,用马钱苷、莫诺苷(终浓度分别为100、10、1 μmol·L-1)预孵1 h后,再加入AGEs(200 mg·L-1)刺激,并设氨基胍为阳性对照,孵育24 h后,采用MTT法检测马钱苷、莫诺苷对HUVEC增殖率的影响;采用试剂盒检测细胞上清液中一氧化氮(NO)、内皮素(ET-1)、单核细胞趋化蛋白-1(MCP-1)和血管细胞黏附分子-1(VCAM-1);采用Western blot法检测HUVEC中糖基化终末产物受体(RAGE)、核转录因子(NF-κB)的蛋白表达。结果山茱萸环烯醚萜苷类特征成分马钱苷、莫诺苷能抑制AGEs导致的HUVEC损伤,与空白对照组比较,模型组细胞RAGE、NF-κB蛋白表达上调(P<0.01),ET-1、MCP-1、VCAM-1分泌增加(P<0.01),NO水平降低(P<0.01)。马钱苷、莫诺苷给药组能不同程度地下调RAGE、NF-κB蛋白表达,减少ET-1、MCP-1、VCAM-1分泌,升高NO水平,与模型组比较差异具有显著性(P<0.05~0.01)。结论山茱萸环烯醚萜苷类特征成分马钱苷、莫诺苷对AGEs导致的HUVEC损伤具有明显的保护作用,其作用机制为下调RAGE蛋白表达,抑制RAGE受体相关NF-κB信号通路发挥抗炎作用,从而改善内皮细胞功能。
山茱萸;马钱苷;莫诺苷;糖尿病;AGEs;HUVEC
糖尿病(diabetes mellitus,DM)以高血糖为主要特征,成为继肿瘤、心血管疾病之后第三大严重威胁人类健康的慢性内分泌代谢性疾病[1-2]。研究发现[3-4],在糖尿病发生及糖尿病血管病变过程中,晚期糖基化终末产物(AGEs)起到了关键性的作用。血管内皮细胞(vascular endothelial cell,VEC)是血管的屏障保护层,另外可产生和释放各种活性物质,维持血管正常功能和血液的供应状态。糖尿病血管病变发生最基本的是血管内皮细胞结构和功能的受损,持续的高血糖导致内皮细胞损伤及功能紊乱,增高血管内皮通透性,还可抑制内皮细胞的迁移、增殖[5-6]。
山茱萸环烯醚萜苷类成分能够明显改善糖尿病所致的内皮细胞损伤[7],同时其特征成分马钱苷、莫诺苷能明显抑制糖尿病大鼠肾皮质内皮细胞增生,减轻内皮细胞的肿胀程度,降低内皮细胞间通透性,保护内皮的完整,对糖尿病血管并发症内皮细胞具有明显的保护作用[8]。因此,本实验采用AGEs诱导的人脐静脉内皮细胞(HUVEC)损伤模型,探究山茱萸环烯醚萜苷类特征成分马钱苷、莫诺苷保护内皮细胞的效应机制,为马钱苷、莫诺苷的临床应用提供理论研究基础。
1 材料与方法
1.1实验材料人脐静脉内皮细胞,购自南京凯基生物科技发展有限公司,批号: KG110;马钱苷(loganin,批号: M-010-140730 ) 、莫诺苷(morroniside,批号: M-011-140730),均由成都瑞芬思生物科技有限公司提供(质量分数≥98% ) ; 氨基胍(aminoguanidine),Sigma公司进口分装。RPMI 1640 培养液、胰蛋白酶(Trypsin),美国Gibco公司;胎牛血清(FBS),杭州四季青公司;二甲基亚砜(DMSO)、四甲基偶氮唑蓝(MTT),美国Sigma公司;RIPA裂解液,碧云天生物技术研究所;血管细胞黏附分子-1(VCAM-1)ELISA试剂盒,进口分装,批号:14101201 ;单核细胞趋化蛋白-1(MCP-1)ELISA试剂盒,南京联科生物技术有限公司,批号:E09549-1638;一氧化氮(NO)试剂盒,南京建成生物工程研究所,批号:20140613;内皮素(ET-1)ELISA 试剂盒,进口分装,批号:14101202;RAGE抗体,美国Abcam公司,批号:GR186177-6;NF-κB抗体,美国Abcam公司,批号:GR115355-1。
1.2仪器Synergy HT酶标仪,美国Bio-Tek公司;二氧化碳细胞培养箱,日本SANYO公司;超净工作台,苏州净化设备有限公司;倒置荧光显微镜(Ti型),日本尼康公司。
1.3方法
1.3.1AGEs的制备[9]将牛血清白蛋白(BSA)在0.2 mol·L-1磷酸盐缓冲液(PBS,pH 7.4)中配制成50 g·L-1,同时将葡萄糖在上述液体中配制成0.5 mol·L-1,充分溶解,37℃避光孵育3个月,使其形成AGEs-BSA。同时,平行条件下配制不加入葡萄糖的上述BSA溶液,以制备无糖基化BSA(0-BSA)作为对照。待AGEs形成后,用孔径为分子质量1万的透析袋低温透析24 h,除去未反应的葡萄糖。用0.22 μm滤器过滤除菌后保存于-20℃备用。
1.3.2细胞培养HUVEC采用10%FBS RPMI 1640培养液培养,按1 ∶3比例进行传代培养,每2~3 d换液1次,传代至第5~7代的细胞用于实验。
1.3.3MTT法检测细胞增殖取对数生长期的分化成熟细胞,调整细胞密度至5×107·L-1,接种于96孔板,每孔100 μL,于37℃、5% CO2培养箱中静置培养24 h。当细胞贴壁生长至80%~90%融合状态时,换无FBS RPMI 1640培养液饥饿培养23 h,加入氨基胍、马钱苷、莫诺苷(终浓度分别为100、10、1 μmol·L-1)预孵1 h后,加入终浓度为200 mg·L-1的AGEs刺激,同时设模型组和空白对照组。24 h后,每孔加入5 g·L-1的MTT溶液20 μL,继续孵育4 h,吸弃孔中培养上清液,每孔加入150 μL的DMSO,震荡混匀10 min,酶标仪测定490 nm处各孔的吸光度(A)值,计算细胞存活率。
细胞增殖保护率/%=[(OD给药组-OD模型组)/OD模型组]×100%
1.3.4试剂盒检测细胞上清液中细胞因子的表达取对数生长期的HUVEC,以1×108·L-1密度接种于24孔板内,设4复孔。按“1.3.3”项中方法制备饥饿后的HUVEC,加入氨基胍、马钱苷、莫诺苷(终浓度分别为100、10、1 μmol·L-1)预孵1 h后,加入终浓度为200 mg·L-1的AGEs,同时设模型组及空白对照组。24 h后,分离细胞与上清液,用对应的试剂盒检测细胞上清液中NO、ET、MCP-1、VCAM-1水平。
1.3.5Western blot检测RAGE、NF-κB蛋白表达取对数生长期细胞,以2×108·L-1密度接种于6孔板,按“1.3.3”项中方法制备饥饿后的HUVEC,加入氨基胍、马钱苷、莫诺苷(终浓度为10 μmol·L-1)预孵1 h后,加入终浓度为200 mg·L-1的AGEs,同时设模型组及空白对照组。离心收集细胞,用RIPA裂解液提取细胞总蛋白,并测定蛋白浓度。蛋白样品加入1/4体积的4×蛋白上样缓冲液,沸水煮沸5 min,进行SDS-PAGE凝胶电泳,然后转印至PVDF膜上,按约0.1 mL·cm-2量加入封闭液封闭1 h,一抗4℃过夜。次日PBST漂洗3次,加入辣根过氧化酶标记的二抗,室温孵育2 h,ECL显色。利用Image J软件分析各组灰度值,以β-actin为内参,计算各蛋白的变化。
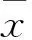
2 结果
2.1马钱苷、莫诺苷对AGEs损伤HUVEC存活率的影响给予AGEs刺激24 h后,与空白对照组比较,模型组细胞OD值明显降低(P<0.01);与模型组比较,氨基胍组在终浓度100、10 μmol·L-1时,马钱苷、莫诺苷在终浓度100、10、1 μmol·L-1时,对AGEs损伤HUVEC具有明显的保护作用(P<0.05~0.01),且呈浓度相关性。见Tab 1。
2.2马钱苷、莫诺苷对AGEs损伤HUVEC后MCP-1、VCAM-1的影响给予AGEs刺激24h后,与空白对照组比较,模型组细胞产生的MCP-1、VCAM-1明显升高(P<0.01);与模型组比较,氨基胍、莫诺苷、马钱苷(终浓度为100、10、1 μmol·L-1)对AGEs损伤HUVEC细胞产生的MCP-1、VCAM-1具有明显的抑制作用(P<0.05~0.01)。见Tab 2。
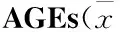
Tab 1 Effect of loganin and morroniside on cell viability of HUVEC induced by ±s,n=6)
##P<0.01vsvehicle;*P<0.05,**P<0.01vsmodel

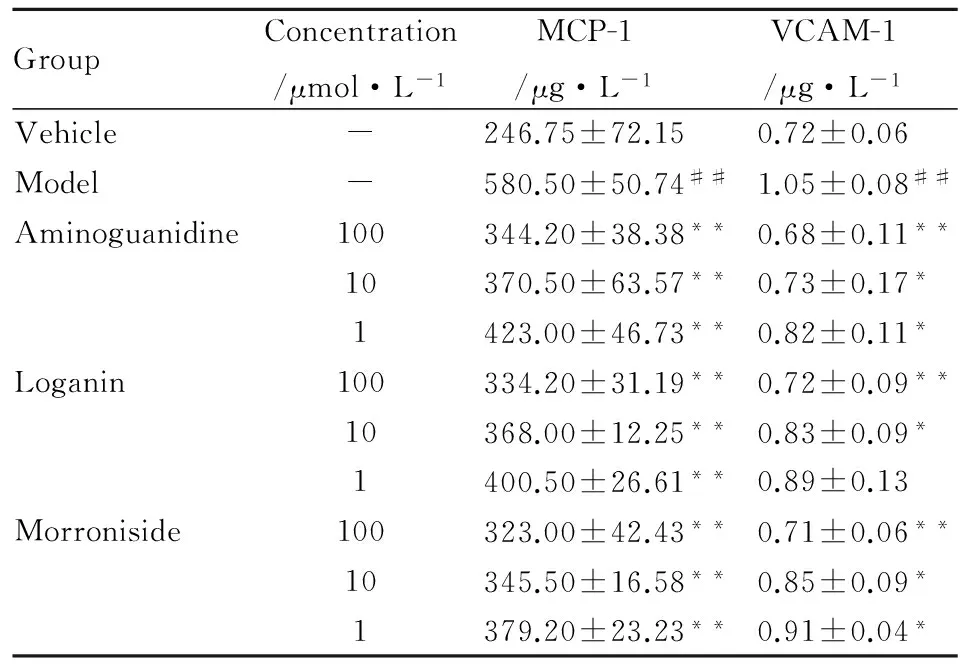
GroupConcentration/μmol·L-1MCP-1/μg·L-1VCAM-1/μg·L-1Vehicle-246.75±72.150.72±0.06Model-580.50±50.74##1.05±0.08##Aminoguanidine100344.20±38.38**0.68±0.11**10370.50±63.57**0.73±0.17*1423.00±46.73**0.82±0.11*Loganin100334.20±31.19**0.72±0.09**10368.00±12.25**0.83±0.09*1400.50±26.61**0.89±0.13Morroniside100323.00±42.43**0.71±0.06**10345.50±16.58**0.85±0.09*1379.20±23.23**0.91±0.04*
##P<0.01vsvehicle;*P<0.05,**P<0.01vsmodel
2.3马钱苷、莫诺苷对AGEs损伤HUVEC后NO、ET-1的影响给予AGEs刺激24 h后,与空白对照组比较,模型组细胞产生的NO明显降低(P<0.01), ET-1明显升高(P<0.01);与模型组比较,氨基胍、马钱苷、莫诺苷(终浓度为100、10、1 μmol·L-1)对AGEs损伤HUVEC细胞产生的NO具有明显的促进作用(P<0.01);氨基胍(终浓度为100、10、1 μmol·L-1)、马钱苷(终浓度为100、10 μmol·L-1)、莫诺苷(终浓度为100 μmol·L-1)对AGEs损伤HUVEC细胞产生的ET-1具有明显的抑制作用(P<0.05~0.01)。见Tab 3。
2.4马钱苷、莫诺苷对AGEs损伤HUVEC的RAGE、NF-κB蛋白表达的影响给予AGEs刺激24 h后,与空白对照组比较,模型组RAGE、NF-κB蛋白表达明显增加(P<0.01);与模型组比较,氨基胍、马钱苷、莫诺苷组(终浓度为10 μmol·L-1)的RAGE、NF-κB蛋白表达明显下调(P<0.05~0.01)。见Fig 1、Fig 2。
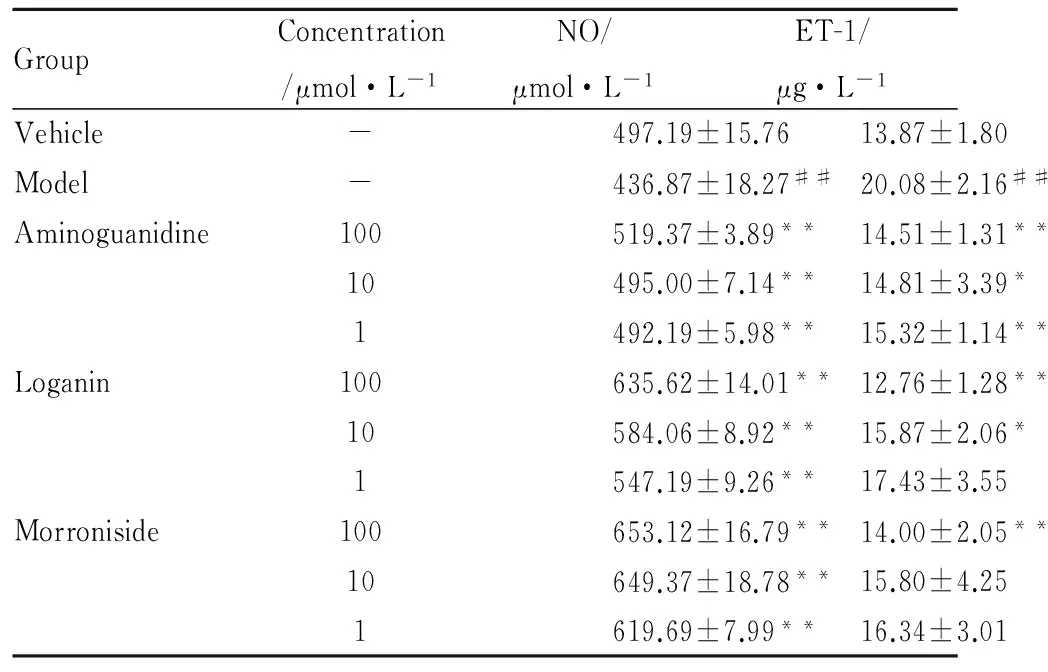
GroupConcentration/μmol·L-1NO/μmol·L-1ET-1/μg·L-1Vehicle-497.19±15.7613.87±1.80Model-436.87±18.27##20.08±2.16##Aminoguanidine100519.37±3.89**14.51±1.31**10495.00±7.14**14.81±3.39*1492.19±5.98**15.32±1.14**Loganin100635.62±14.01**12.76±1.28**10584.06±8.92**15.87±2.06*1547.19±9.26**17.43±3.55Morroniside100653.12±16.79**14.00±2.05**10649.37±18.78**15.80±4.251619.69±7.99**16.34±3.01
##P<0.01vsvehicle;*P<0.05,**P<0.01vsmodel
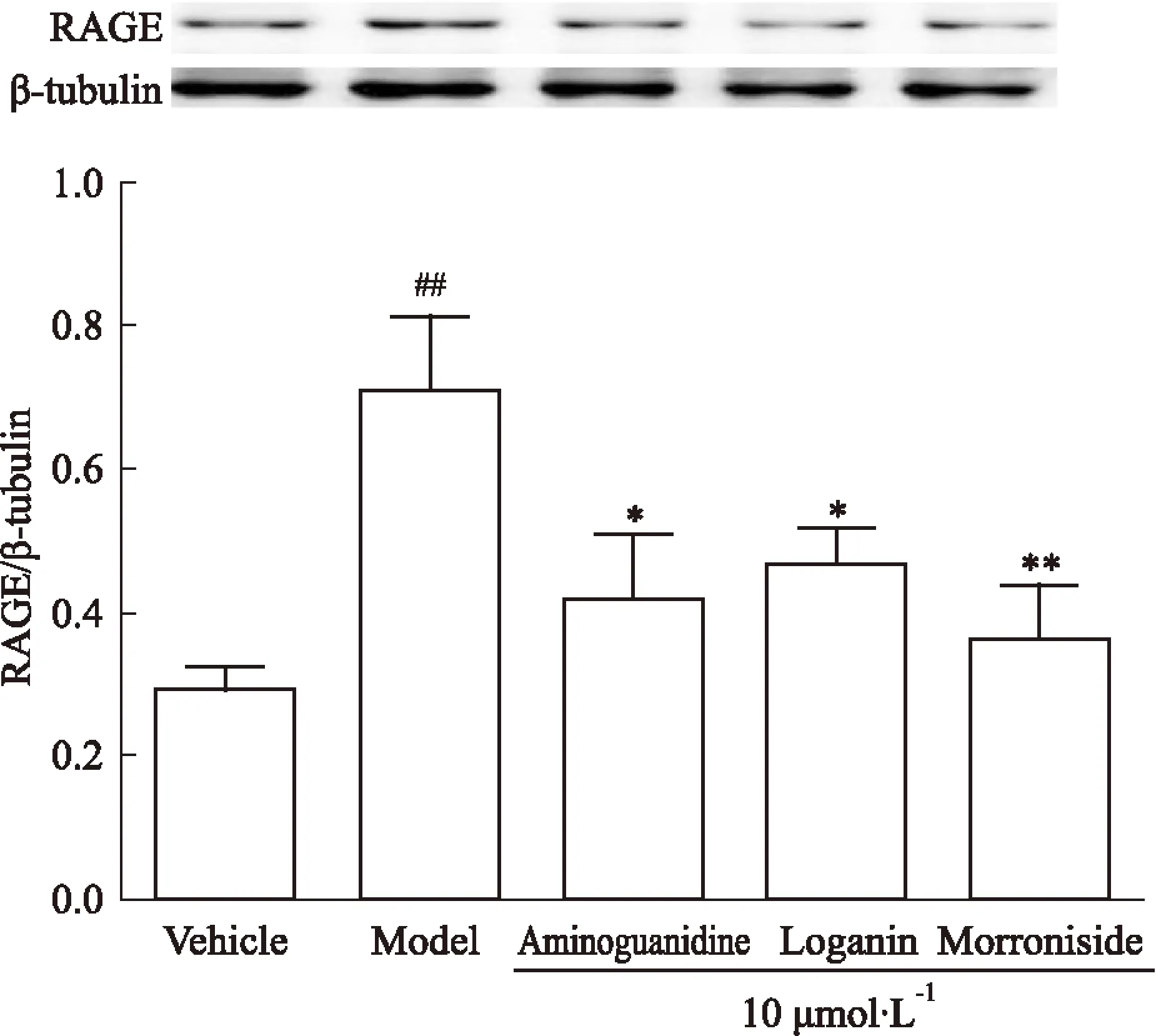
Fig 1 Effect of loganin and morroniside
##P<0.01vsvehicle;*P<0.05,**P<0.01vsmodel
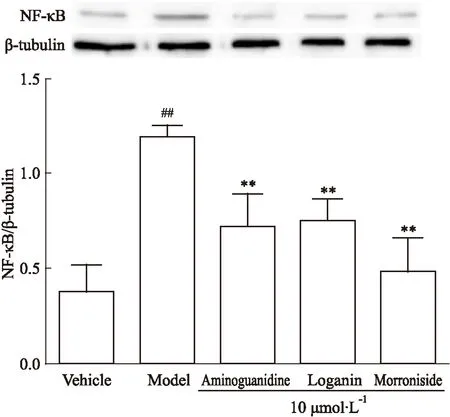
Fig 2 Effect of loganin and morroniside
##P<0.01vsvehicle;**P<0.01vsmodel
3 讨论
血管内皮细胞作为一种机体内的重要修复细胞,其主要功能有愈合创面、参与炎症反应、分泌细胞外基质、生长因子等[10]。研究表明[11],血管内皮功能紊乱是糖尿病血管并发症的关键性环节。AGEs是非酶糖基化反应的终末产物,糖尿病条件下AGEs形成速率加快并大量累积,因此,糖基终末化产物受体(RAGE)与AGEs结合增多及活性增强,诱导NF-κB的活化,并由胞质转移到胞核中,启动多种靶基因的转录[12],影响MCP-1、VCAM-1等表达,进而引起内皮细胞炎症反应的发生。另外,还可影响NO/ET 的平衡[13],改变内皮细胞功能,引起细胞膜通透性的变化。NF-κB激活后又作为一种正反馈,促进AGEs与RAGE的结合。
越来越多的证据表明,炎症反应是引起糖尿病血管病变的重要因素之一。MCP-1是趋化因子超家族CC亚群的成员之一,具有诱导、激活单核巨噬细胞的作用。正常情况下,HUVEC等多种机体细胞分泌少量MCP-1,在机体内保持平衡,维持正常生理功能。但在糖尿病条件时,多种因素诱导内皮细胞趋化因子表达增强,MCP-1分泌增多[14]。 MCP-1还可促进HUVEC表达VCAM-1,后者可介导HUVEC和白细胞黏附紧密,并相互作用、相互激活,促进黏附分子、趋化因子、细胞因子大量表达,扩大炎症反应[15]。因此,MCP-1和VCAM-1介导的单核细胞迁移和对内皮细胞的黏附是诱发血管内炎性反应的关键步骤,是衡量病变过程中炎性反应程度的特征指标。NO和内皮素(ET-1)是一对调节血管舒张收缩功能的活性物质,ET-1的升高及NO的降低,可引起血管收缩、微循环障碍,从而导致血管内皮依赖性舒张功能减退。NO是内源性血管舒张因子,因此血管内NO降低,是糖尿病血管病变的发病机制之一。ET-1是一种具有强烈收缩血管作用的活性多肽,它是由血管内皮细胞分泌的所知作用最强、最持久的缩血管多肽物质,在内皮损伤时,ET-1的合成与释放明显增加,故被认为是血管内皮功能损伤的分子标志物之一[16]。研究表明,NO与ET-1的动态平衡对于内皮功能的调节至关重要。因此,NO 与ET-1含量变化是反映内皮细胞功能改变的重要指标之一。
本实验通过AGEs直接刺激HUVEC 24h,研究马钱苷、莫诺苷对AGEs损伤HUVEC的保护作用,并探讨其作用机制。结果表明,马钱苷、莫诺苷可减轻AGEs诱导的HUVEC损伤,并促进HUVEC的增殖,且随着浓度的升高而增强;同时,马钱苷、莫诺苷可明显下调HUVEC中RAGE蛋白的表达,提示马钱苷、莫诺苷保护HUVEC损伤可能与降低RAGE表达有关。NF-κB为介导炎症反应的启动因子,马钱苷、莫诺苷可有效抑制NF-κB的表达,减少MCP-1和VCAM-1的分泌,抑制炎性反应。另外,马钱苷、莫诺苷可恢复NO和ET-1间的动态平衡,改善内皮细胞功能。综上所述,马钱苷、莫诺苷对AGEs诱导的HUVEC损伤具有保护作用,其机制可能为下调RAGE蛋白表达,抑制RAGE受体相关NF-κB信号通路发挥抗炎作用,从而改善内皮细胞功能。
[1]乔爱敏,李乐,刘青.晚期糖基化终产物及其受体RAGE在糖尿病血管并发症中的作用机制[J].中国临床药理学与治疗学,2014,19(11):1306-11.
[1]Qiao A M,Li L,Liu Q.Mechanism of action of advanced glycation end products and their receptors RAGE contribute to the development of diabetic vascular complications[J].ChinJClinPharmacolTher,2014,19(11):1306-11.
[2]魏聪.糖尿病大血管病变的研究进展[J].上海交通大学学报(医学版),2010,30(10):1292-6.
[2]Wei C.Advance in research of macroangiopathy in diabetes[J].JShanghaiJiaotongUniv(MedSci),2010,30(10):1292-6.
[3]Stitt A W,Jenkins A J,Cooper M E.Advanced glycation end products and diabetic complications[J].ExpertOpinInvestigDrugs,2005,18(3):1-14.
[4]Stirban A,Gawlowski T,Roden M.Vascular effects of advanced glycation end products:clinical effects and molecular mechanisms[J].MolMetab,2014,3(2):94-108.
[5]杜冠华.血管内皮细胞损伤机制及保护药物的研究[J].基础医学与临床,2004,24(3):258-63.
[5]Du G H.Mechanism of endothelial cell injury and the drugs protection of endothelial cell against injury[J].BasicMedSciClin,2004,24(3):258-63.
[6]Changwon P,Tae Min K,Malik A B.Transcriptional regulation of endothelial cell and vascular development[J].CircRes,2013,112(10):1380-400.
[7]许惠琴,农伟虎,刘成鼎,等.山茱萸最佳配伍组分对高糖致ECV304细胞氧化损伤的保护作用[J].中国药理学通报,2011,27(8):1077-80.
[7]Xu H Q,Nong W H,Liu C D,et al.The effect of the best compatibility of compents in Fruetus Corni of protecting the oxidative damage of vascular endothelial cells cultured in high glouse medium[J].ChinPharmacolBull,2011,27(8):1077-80.
[8]吕兴,许惠琴,刘斌,等.莫诺苷对晚期糖基化终末产物加重链脲佐菌素诱导糖尿病肾病保护作用及其机制[J].中草药,2014,45(21):3109-16.
[8]Lyu X,Xu H Q,Liu B,et al.Protection of morroniside on STZ-induced diabetic nephropathy aggravated by AGEs in mice and its mechanism[J].ChinTraditHerbalDrugs,2014,45(21):3109-16.
[9]吴云皓,陈玉萍,吕兴,等.马钱苷对糖基化终末产物诱导足细胞损伤的保护作用[J].中国药理学通报,2016,32(3):332-6.
[9]Wu Y H,Chen Y P,Lyu X,et al.Protective effect of loganin on podocyte injury inducing by advanced glycation end products[J].ChinPharmacolBull,2016,32(3):332-6.
[10]Arnold F,West D C. Angiogenesis in wound healing[J].PharmacolTher,1991,52(3):407-22.
[11]Tang X,Luo Y X,Chen H Z,et al.Mitochondria,endothelial cell function,and vascular diseases[J].FrontPhysiol,2014,5:175.
[12]Wang C Y,Xie J W,Xu Y,et al.Trientine reduces BACE1 activity and mitigates amyloidosis via the AGE/RAGE/NF-κB pathway in a transgenic mouse model of Alzheimer’s disease[J].AntioxidRedoxSignal,2013,19(17):2024-39.
[13]陆春红,许惠琴,刘凯,等.生地环烯醚萜苷类成分对AGEs损伤HUVEC的保护作用[J].南京中医药大学学报,2015,31(1):55-9.
[13]Lu C H,Xu H Q,Liu K,et al.Protective effects of habitat iridoid glycosides of Radix Rehmanniae on HUVEC injuried by AGEs[J].JNanjingUnivChinMed,2015,31(1):55-9.
[14]Fornoni A,Ijaz A, Tejada T,Lenz O. Role of inflammation in diabetic nephropathy[J].CurrDiabetesRev,2008,4(1):10-7.
[15]李军,王国荣,王燕,等. 二苯乙烯苷对同型半胱氨酸诱导的人脐静脉内皮细胞MCP-1、ICAM-1和VCAM-1表达的影响[J]. 中国动脉硬化杂志, 2012, 20(10):890-4.
[15]Li J,Wang G R,Wang Y,et al.Effects of tetrahydroxysilbene glucoside on MCP-1,ICAM-1 and VCAM-1 expression induced by homocysteine in HUVEC[J].ChinJArterioscler,2012, 20(10):890-4.
[16]周慧,李玲.2型糖尿病血管病变与内皮功能改变关系的研究[J].心血管康复医学杂志,2003,12(4):315-6.
[16]Zhou H,Li L.Correlation between vessels lesion and endothelium cell functions of vessel in diabetic patients[J].ChinJCardiovascRehabMed,2003,12(4):315-6.
Protective effect of loganin and morroniside on HUVEC injury induced by advanced glycation end products
SHEN Hong-sheng1,2, XU Hui-qin1,2, LU Chun-hong1,2,DAI Guo-ying1,2,XU Kang1,2, LYU Xing1,2, CHEN Yu-ping1,2, WU Yun-hao1,2
(1.CollegeofPharmacy,NanjingUniversityofChineseMedicine,2.JiangsuKeyLaboratoryforPharmacologyandSafetyEvaluationofChineseMateriaMedica,Nanjing210023,China)
AimTo observe the protective mechanism of loganinand morroniside(active components inCornusofficinalis) on HUVEC injury induced by advanced glycation end products(AGEs).MethodsHUVECs were culturedinvitroand divided into control group, model group(AGEs group), loganin group, morroniside group and aminoguanidine group(set as positive control). After being incubated with loganin and morroniside(final concentrations were 100,10,1 μmol·L-1) for 1 h, HUVECs were stimulated by AGEs of 200 mg·L-1for 24 h. Then, the cell viability was measured by using MTT method. The supernatant was extracted and the levels of NO,ET-1,MCP-1,VCAM-1 were measured by the corresponding kits. Receptors of advanced glycation end products(RAGE) and NF-κB in HUVEC were detected by Western blot.ResultsLoganin and morroniside could inhibit HUVEC injury induced by AGEs. In model group,the contents of ET-1,MCP-1,VCAM-1 increased(P<0.01),the content of NO decreased(P<0.01) and the expression of RAGE and NF-κB increased(P<0.01); however,loganin and morronside could reduce the ET-1,MCP-1,VCAM-1contents,increase the NO content and down-regulate the expression of RAGE and NF-κB to different extents.ConclusionLoganin and morroniside could ameliorate HUVEC injury, and its mechanism may be related to inhibit inflammation,the improvement of endothelial cell function, and the decrease of the expression of RAGE.
CornusofficinalisSieb. et Zucc.; loganin; morroniside; diabetes mellitus; AGEs; HUVEC
2016-04-07,
2016-05-10
国家自然科学基金资助项目(No 81374029, 81073111);江苏高校优势学科建设工程资助项目(No nzyzyxjp1006)
沈红胜(1992-),男,硕士生,研究方向:内分泌药理学,E-mail: 1375358145@qq.com;
许惠琴(1961-),女,博士,教授,博士生导师,研究方向:内分泌药理学,通讯作者,E-mail: hqxu309@sina.com
A
1001-1978(2016)08-1063-05
R284.1;R322.123;R329.24;R587.1;R977.6
网络出版时间:2016-7-19 10:43网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160719.1043.014.html
◇论著◇