小麦胚中不同形态多胺含量的变化及其与耐旱性的关系
2016-08-27杜红阳刘骨挺杨青华刘怀攀
杜红阳刘骨挺杨青华刘怀攀,*
1周口师范学院生命科学与农学学院 / 植物遗传与分子育种重点实验室, 河南周口 466001;2河南农业大学农学院 / 河南粮食作物协同创新中心, 河南郑州 450002;3中国农业大学生物学院, 北京 100193
小麦胚中不同形态多胺含量的变化及其与耐旱性的关系
杜红阳1,2刘骨挺3杨青华2刘怀攀1,2,*
1周口师范学院生命科学与农学学院 / 植物遗传与分子育种重点实验室, 河南周口 466001;2河南农业大学农学院 / 河南粮食作物协同创新中心, 河南郑州 450002;3中国农业大学生物学院, 北京 100193
为解析发育籽粒胚中不同种类和不同形态多胺在小麦耐旱机制中的作用, 以强抗旱性的洛麦22和弱抗旱性的豫麦48为材料, 于小麦花后第10天施以根际自然干旱、喷施外源多胺及其合成抑制剂处理, 研究不同类型多胺含量变化及其与品种耐旱相关生理指标和产量相关性状的关系。干旱胁迫处理10天内, 2个品种籽粒胚中游离态腐胺(Put)、亚精胺(Spd)和精胺(Spm)以及酸可溶性共价结合态多胺(ASCC-PA)含量均上升, 尤其是豫麦48的游离态 Put一直表现为急剧升高趋势。干旱处理前期两品种籽粒中游离态Spd和Spm的上升幅度没有明显差异, 处理后期洛麦22中Spd和Spm的上升幅度明显大于豫麦48; 两品种胚中的酸不溶性共价结合态腐胺(AISCC-Put)含量前期均较低,到后期洛麦22的AISCC-Put含量上升明显。外源Spd和Spm处理后, 不仅显著提升了干旱胁迫后期豫麦48胚的游离态 Spd和Spm的含量, 并且提高了旗叶相对含水量和籽粒相对干物质增长速率, 降低了旗叶相对质膜透性, 抗旱性得到改善。MGBG处理强烈抑制了洛麦22胚中游离态Put向Spd和Spm转化, 也明显降低小麦的抗旱性。外施菲咯啉显著抑制了干旱胁迫所诱导的 AISCC-Put增加, 同时也降低了小麦对干旱胁迫的抗性。上述结果暗示花后胚中游离态Put向游离态Spd、Spm和AISCC-Put的顺利转化可以提高小麦抗干旱能力。
干旱胁迫; 小麦籽粒胚; 多胺
小麦是世界主要粮食作物, 近年来干旱胁迫是小麦生产中最重要限制因素之一。我国华北地区和黄淮流域是冬小麦的主产区, 小麦生长季内干旱灾害频频发生, 特别在灌浆期, 经常遭遇干热风和土壤干旱逆境, 严重影响小麦灌浆, 导致产量和品质下降。因此, 抗旱机制是小麦遗传和生理研究需解答的重要科学问题, 是抗旱育种和高产栽培技术体系的理论基础。
多胺(PA)是植物体内一种重要的植物生长调节剂, 常见的主要有腐胺(Put)、亚精胺(Spd)和精胺(Spm), 在植物体内主要以游离态(free)、酸可溶性共价结合态(acid soluble covalently conjugated, ASCC)和酸不溶性共价结合态(acid insoluble covalently conjugated, AISCC) 3种状态存在。Put在S-腺苷蛋氨酸脱羧酶作用下, 生成 Spd和 Spm, 该酶可被甲基乙二醛-双(鸟嘌呤腙) (MGBG)强烈抑制。多胺与羟基肉桂酸和肉桂素等小分子物质, 在酰基转移酶的作用下共价结合后形成ASCC-PA。作为一种次生代谢物质, ASCC-PA与植物抗病能力有关, 特别参与植物抵御外界浸染的过敏反应。多胺与蛋白质和木质素等生物大分子共价结合则形成 AISCC-PA,也称为bound polyamine[1]。AISCC-PA参与对细胞蛋白质结构和酶活性的稳定, 转谷酰胺酶具有催化多胺与蛋白质共价合成功能, 而菲咯啉(O-Phen)是该酶的专一性抑制剂[2]。这 3种不同形态的多胺不仅参与植物正常的生长发育过程[3-5], 而且与植物抗逆性密切相关[6-9]。在水稻上, 籽粒中内源多胺含量的多少与籽粒充实与粒重呈显著正相关, 在花后第3天喷施外源多胺能提高内源 Spd和 Spm的含量,同时胚乳细胞数、谷粒充实率和千粒重增加, 而外源抑制剂MGBG处理则抵消了这种效应, 说明Spd 和Spm对籽粒灌浆充实和粒重有密切关系[10-11], 并且灌浆期稻米中多胺的含量与稻米的品质也有密切关系[12]。在小麦上, 水分亏缺条件下, Spd和Spm与籽粒灌浆呈正相关[13], 但不同种类多胺的效应有差别, Spd和Spm能显著提高千粒重和籽粒灌浆速率,而Put对其影响不大[14]。目前, 探讨游离态多胺与作物籽粒灌浆关系的研究报道较多, 而较少涉及干旱胁迫条件下胚中不同形态多胺的生理调控功能, 尤其在小麦上。本课题组前期研究发现, 正在发育的小麦胚细胞膜上的结合态多胺促进了干旱胁迫下细胞质膜 H+-ATPase活性的升高, 提高了小麦的抗旱性[15]。胚中不同形态多胺含量的变化是否与抗旱性有关, 尚需深入研究。本研究利用前期筛选出来的2个抗旱性差异显著的小麦品种为试验材料[15], 在灌浆期进行根际土壤干旱处理, 分析小麦胚发育中不同种类和不同形态多胺含量的动态变化与抗干旱能力的关系, 并通过施用外源多胺和多胺抑制剂加以验证, 为深入解析多胺的抗旱机制提供理论依据。
1 材料与方法
1.1 试验材料及种植条件
选用抗旱性不同的2个小麦品种, 其中洛麦22为抗旱品种, 豫麦 48为干旱敏感品种。2011年至2014年连续3年在河南周口师范学院试验园区进行盆栽试验, 盆底直径35 cm, 上部直径40 cm, 高50 cm。盆土为沙壤土, 并施用(NH4)2SO41.0 g kg-1、P2O50.8 g kg-1和K2O 0.6 g kg-1改良土壤, 土壤经风干后过筛。
小麦种子经0.1% (w/v) HgCl2溶液表面消毒10 min, 自来水冲洗干净后, 浸种24 h, 在25℃恒温箱中催芽。选取露白约 3 mm的萌动种子, 每盆播种50粒, 经过低温春化后, 每盆保留30株长势良好一致的幼苗, 每株仅留 1个有效分蘖茎, 然后移至温室中。最初生长温度为25℃(昼)/15℃(夜), 空气湿度为70%, 正常供水; 之后, 随着小麦的生长发育, 逐步根据大田小麦的正常生长条件调整温室培养温度和湿度。温室采用自然光照, 阴雨天用强度 600 μmol m-2s-1日光灯光照。
1.2 试验处理
从小麦开花授粉第10天开始进行6种处理, 每处理30盆, 3次重复。(1)正常供水对照, 用TEN60水势仪(南京思欧仪器设备有限公司)监测土壤水势,使之介于-0.02 MPa至-0.03 MPa之间; (2)干旱胁迫,采用土壤自然干旱, 水势保持在-0.10 MPa至-0.12 MPa之间, 超过阈值时适当补水; (3)干旱胁迫+喷施Spd; (4)干旱胁迫+喷施 Spm; (5)干旱胁迫+喷施MGBG; (6)干旱胁迫+喷施O-Phen。对各处理叶片和穗喷施等量液体, 喷施量为每盆 20 mL, 每天 6:00 和18:00各喷一次, 喷10天, Spd、Spm、MGBG和O-Phen的浓度均为1 mmol L-1, 对照喷清水。于处理后第0、第2、第4、第6、第8和第10天的6:00取旗叶和穗中部籽粒, 每次取每处理长势一致 30株。3个重复的平均值为当年测定数据。
1.3 小麦旗叶生理指标、籽粒增长速率和千粒重的测定方法
按 Du等[15]描述的方法测定旗叶相对含水量和相对质膜透性。
取穗中部籽粒 200粒, 烘干后称重。为了消除品种差异, 以籽粒相对干物质增长速率来表示籽粒的增长速率。相对干物质增长速率(%) = 处理的干物质增长速率/对照的干物质增长速率 × 100; 干物质增长速率(%) = (第n天的籽粒干重 - 第0天的籽粒干重)/第0天的籽粒干重 × 100。
小麦成熟后, 取每处理30个长势一致穗, 计数1000粒称重。
1.4 小麦胚中多胺组分及含量的测定方法
取穗中部籽粒, 用解剖刀在解剖镜下小心剥出完整胚, 按照 Kiriakos等[16]的方法, 稍作修改测定多胺含量。取0.2 g小麦鲜胚放入研钵, 加预冷的5%高氯酸2 mL匀浆, 4℃提取1 h。
测定游离态多胺时, 将提取液12 000 × g离心30 min; 上清液经苯甲酰化后加乙醚真空干燥, 再用甲醇溶解, 然后用0.45 μm滤膜过滤, 取5 μL进样。采用同样方法制Put、Spd和Spm标样。用Waters 2695高效液相色谱仪(HPLC)检测Put、Spd和Spm含量。洗脱液为 64% (v/v)甲醇, 设流速为 0.7 mL min-1, 柱温为25±1℃。254 nm波长下测定多胺浓度,单位为nmol g-1FW。
测定 ASCC-PA和 AISCC-PA含量时, 提取液15 000×g离心20 min, 取上清液2 mL检测ASCCPA, 取2 mL NaOH (1 mol L-1)悬浮沉淀(AISCC-PA存在于沉淀中)。将上述2 mL的沉淀悬浮液和上清液再各加入2 mL浓盐酸(12 mol L-1), 转入医用安培瓶中, 用酒精喷灯把玻璃瓶口熔化, 拉丝封口, 然后放入烘箱中, 在高温(110℃)条件下水解一昼夜,放凉后取出瓶, 敲掉瓶口, 把内容物倒进漏斗滤纸过滤, 以除去碳化材料, 用小瓷钵接收过滤液, 然后在通风橱内, 把小瓷钵放在 70℃的水浴锅中, 将盐酸蒸发, 再加入1 mL高氯酸(5%), 吸取0.5 mL溶解液, 按照上述测定游离态多胺方法苯甲酰化后,用Waters 2695 HPLC测定结合态多胺含量, 单位为nmol g-1FW。
1.5 统计分析
用 Microsoft Excel 2007整理数据并制图, 用SPSS10.0软件中Duncan’s多重比较检验法进行差异显著性分析。
2 结果与分析
2.1 小麦旗叶相对含水量、相对质膜透性、籽粒相对干重增长速率和千粒重的变化
干旱胁迫下, 两小麦品种的旗叶相对含水量(图1-A, B)、籽粒相对干物质增长速率(图1-C, D)和千粒重(表1)下降, 但是洛麦22的下降幅度小于豫麦48,特别是干旱胁迫后期, 豫麦48的降幅明显大于洛麦22, 其千粒重的降幅也明显大于洛麦22。2个品种的旗叶相对质膜透性(图1-E, F)的动态变化与上述的旗叶相对含水量、籽粒相对干物质增长速率和千粒重的变化相反。这些结果验证了洛麦22的抗旱性强于豫麦48。外源Spd和Spm处理, 则显著抑制了干旱胁迫下旗叶相对含水量、籽粒相对干物质增长速率和千粒重的下降以及相对质膜透性的上升, 说明外源Spd 和Spm明显促进了豫麦48的抗干旱胁迫能力, 外源Spd和Spm对洛麦22的这些抗旱性指标影响不大。抑制剂MGBG和O-Phen显著促进了洛麦22在干旱胁迫下旗叶相对含水量、籽粒相对干物质增长速率和千粒重的下降以及相对质膜透性的上升, 表明这2种抑制剂均明显降低了洛麦22的抗旱性。
2.2 小麦发育胚中游离态多胺的含量变化
干旱胁迫诱导两小麦品种发育胚中的 3种游离态多胺含量上升, 品种间存在差异。豫麦48的游离态Put上升幅度大于洛麦22, 特别是干旱胁迫后期,豫麦48的游离态Put一直处于较高水平, 而洛麦22的游离态Put前期水平较高, 后期显著下降(图2-A,B)。干旱胁迫前期两品种的游离态Spd和Spm含量都表现为升高, 且品种间无明显差异, 但胁迫后期,洛麦22的游离态Spd和Spm上升幅度远大于豫麦48; 外源Spd和Spm处理后明显促进了两品种游离态Spd和Spm的上升(图2-C, D, E, F), 特别是豫麦48。MGBG则显著促进了洛麦22在胁迫后期内源游离态Put的上升(图2-A), 并明显抑制其后期内源游离态Spd和Spm (图2-C, E)的上升。
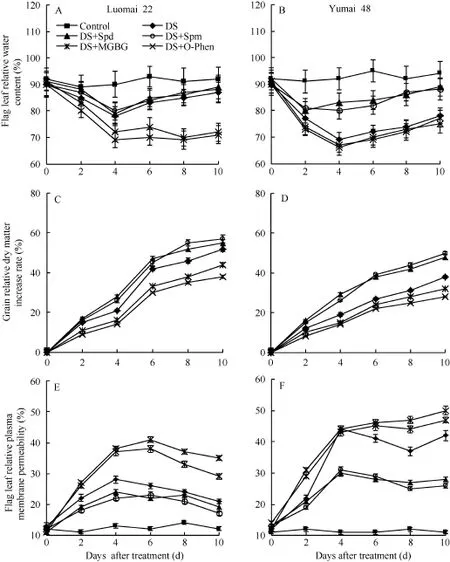
图1 不同处理对小麦旗叶相对含水量(A, B)、籽粒相对干物质增长速率(C, D)和旗叶相对质膜透性(E, F)的影响Fig. 1 Effects of different treatments on relative water content of flag leaf (A, B), relative increased rate of grain dry weight (C, D),and relative plasma membrane permeability of flag leaf (E, F) in wheat

表1 不同处理对洛麦22和豫麦48千粒重的影响Table 1 Effect of different treatments on 1000-grain weight (g)
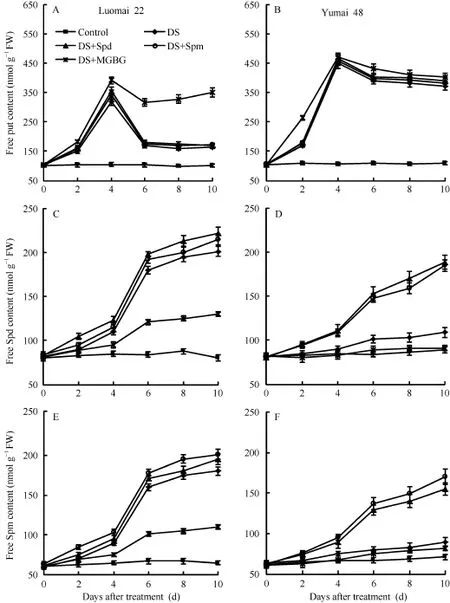
图2 不同处理对小麦发育胚游离态多胺含量的影响Fig. 2 Effect of different treatments on contents of free polyamines in developing wheat embryos
2.3 小麦发育胚中ASCC-PA的含量变化
干旱胁迫下, 两品种发育胚中的 ASCC-Put、ASCC-Spd和ASCC-Spm都上升。ASCC-Put在干旱胁迫前期呈上升趋势, 到后期稳定在一个较高的水平上, 品种间无明显差异(图 3-A); 随着胁迫时间的延长, 两品种发育胚中的 ASCC-Spd和ASCC-Spm含量都有所上升, 但升高幅度无规律性(图3-B, C)。
2.4 小麦发育胚中AISCC-PA的含量变化
干旱胁迫后, 小麦发育胚中的 AISCC-Spd和AISCC-Spm 含量随胁迫时间延长呈持续上升趋势,明显高于对照, 且两品种表现一致(图4-C, D, E, F);而 AISCC-Put含量变化在品种间差异明显, 抗旱性品种洛麦22在处理后第4天AISCC-Put含量急剧升高, 上升幅度明显大于干旱敏感性品种豫麦48 (图4-A, B)。干旱胁迫同时用O-Phen处理, 则显著抑制了干旱所诱导的 AISCC-Put水平升高, 特别是洛麦22。
3 讨论
3.1 干旱胁迫与小麦发育胚中游离态多胺的关系
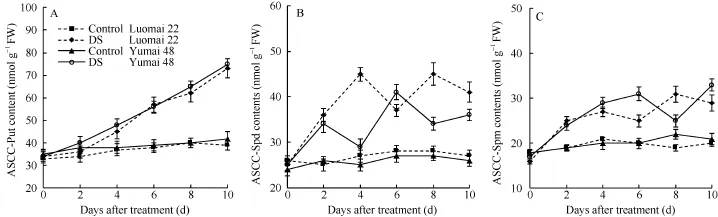
图3 干旱胁迫(DS)对小麦发育胚中酸可溶性共价结合态(ASCC)多胺含量的影响Fig. 3 Effects of drought stress (DS) on the levels of acid soluble covalently conjugated polyamines (ASCC-PA) in developing wheat embryos
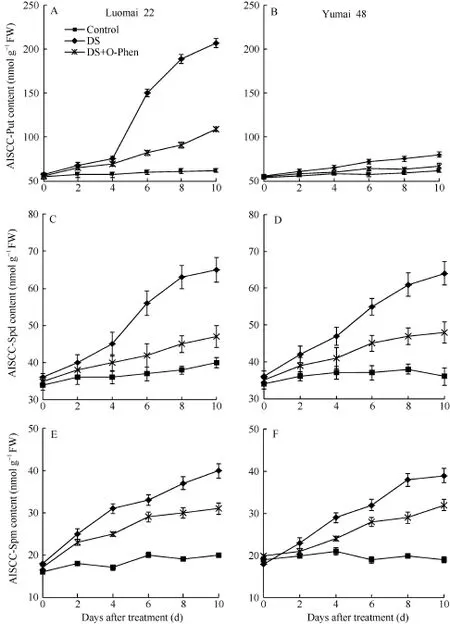
图4 干旱胁迫(DS)和O-Phen对小麦发育胚中酸不溶性共价结合态(AISCC)多胺含量的影响Fig. 4 Effects of drought stress (DS) and O-Phen on acid insoluble covalently conjugated polyamines (AISCC-PA) level in developing wheat embryos
多胺参与植物的抗逆胁迫反应[17], 而植物中游离态多胺的功能目前尚存争议, 特别是在逆境胁迫下, 游离态 Put的升高对植物提高抗旱性的意义是争论的焦点。多数研究认为, 逆境条件下游离态Put水平升高对植物是一种伤害反应, 水稻盐胁迫[18]、大田花生喷施 Put[19]和燕麦转精氨酸脱羧酶[20]等研究结果都证实游离态Put对植物的伤害; 然而, 也有学者认为逆境胁迫下游离态 Put升高是植物的一种适应性反应[21-22]。本研究结果显示, 抗旱性差异明显的两品种在干旱胁迫前期的游离态 Put水平都急剧上升(图2-A, B), 且品种间没有显著差异, 而在后期抗旱性品种洛麦 22有较高水平的游离态 Spd和Spm (图2-C, E)。为了验证高水平的游离态Spd和Spm是否由游离态Put转化而来, 采用了游离态Put向游离态Spd和Spm转化参与酶的抑制剂MGBG,发现MGBG在抑制洛麦22胚中游离态Put向游离态Spd和Spm转化(图2-A, C, E)的同时, 也显著降低了该品种的抗旱能力(图 1和表1)。外施Spd和Spm后, 在提高豫麦48胚中游离态Spd和Spm水平(图2-D, F)的同时, 也显著提高该品种的抗旱性(图1和表1)。结合前人研究有关胁迫下游离态Put升高意义的争论, 以及大量文献所报道的游离态 Spd和Spm在干旱胁迫下含量上升是植物的一种积极保护效应[7,23-24], 我们认为, 小麦抗旱性高低与干旱胁迫前期游离态 Put升高无关, 而取决于前期升高的游离态Put能否在后期转化为游离态Spd和Spm。
在干旱胁迫下, 为什么是游离态 Spd和 Spm,而不是游离态 Put发挥作用呢?可能重要归因于它们在生理 pH范围内所呈现的多聚阳离子特性[25]。在干旱胁迫下, 由于游离态Spd和Spm比游离态Put携带更多的阳离子, 所以更容易与细胞内的呈阴离子状态的酸性蛋白质和生物膜磷脂非共价结合, 从而保护这些生物大分子在胁迫条件下不被破坏, 维持构象和功能的稳定。我们的前期研究也表明, 胚中游离态多胺非共价结合在细胞质膜上的酸性蛋白质或者生物膜磷脂上, 提高干旱胁迫下的质膜H+-ATPase活性[15]。H+-ATPase通过维持跨质膜的质子浓度梯度, 实现细胞内外正常的物质运输, 提高抗旱性和籽粒产量。
3.2 干旱胁迫与小麦发育胚中ASCC-PA的关系
有人认为植物体内ASCC-PA是游离态PA的临时储存库[26-27]。多数研究表明, 这种形态多胺与植物生殖器官发育关系密切[28-29]。对于这种形态的多胺与逆境胁迫关系的研究虽然也有所报道, 但是多集中在低温胁迫[27]和抗病能力方面[30-31]。就目前掌握的文献, 尚未见 ASCC-PA与干旱胁迫关系的报道。本研究观测了干旱胁迫下发育胚中ASCC-PA的动态变化, 发现ASCC-PA与干旱胁迫似乎没有直接关系, 因为该种形态的3种多胺ASCC-Put、ASCCSpd和 ASCC-Spm虽然在胁迫时都上升, 但是它们的动态变化缺乏规律性, 且品种间也没有表现出明显差异(图3)。作为临时储存库, 无论抗性强或者弱的品种都具备这样的临时储存能力, 而是否能把储存库里的 ASCC-PA顺利提取出来就要看不同品种的抗性大小了。
3.3 干旱胁迫和O-Phen与小麦发育胚中AISCCPA关系
有关 AISCC-PA与逆境胁迫关系的研究也并不多见, 赵福庚等[32]通过大麦幼苗耐盐试验, Kong等[33]利用白杉愈伤组织研究, 先后报道了游离态 Put向AISCC-Put的转化提高了植物抗逆性。本研究在小麦灌浆期干旱胁迫下试验, 取得了一致的结果, 暗示游离态Put向AISCC-Put的转化有利于提高小麦对干旱胁迫的抗性。本试验胁迫后期, 抗旱性品种洛麦 22胚中 AISCC-Put的水平显著升高(图 4-A),而干旱敏感性品种豫麦 48的升幅不明显(图 4-B);用抑制剂O-Phen处理后验证了这一结果, O-Phen显著抑制干旱诱导的洛麦22胚中AISCC-Put水平升高(图4-A), 同时也明显降低了洛麦22的耐旱性(图 1和表1)。AISCC-Spd (图4-C, D)和AISCC-Spm (图4-E, F)的水平都随着胁迫时间延长比对照有所升高,但两品种的升高幅度没有明显的差异, 暗示这 2种形态的多胺与小麦的抗旱性关系不大。
4 结论
干旱胁迫下, 抗旱性不同的2个小麦品种在胁迫前期, 发育胚中的游离态 Put水平急剧上升, 而AISCC-Put含量较低, 在后期抗旱性强的品种洛麦22有较高水平的游离态Spd和Spm以及AISCC-Put,而干旱敏感性品种豫麦48仍然维持较高游离态 Put和较低的 AISCC-Put。这些结果暗示灌浆期小麦干旱胁迫下, 胚中升高的游离态Put转化为游离态Spd 和Spm以及AISCC-Put有利于提高其抗旱性。
References
[1] Elisabeth T, Martin-Tanguy J. Floral induction and floral development of strawberry. Plant Growth Regul, 1995, 17: 157-165
[2] Icekson I, Apelbaum A. Evidence for transglutaminase activity inplant tissue. Plant Physiol, 1987, 84: 972-974
[3] Vondrakova Z, Eliasova K, Vagner M. Exogenous putrescine affects endogenous polyamine levels and the development of Picea abies somatic embryos. Plant Growth Regul, 2015, 75:405-414
[4] Ben Mohamed H, Vadel A M, Geuns J M C, Khemira H. Effects of hydrogen cyanamide on antioxidant enzymes activity, proline and polyamine contents during bud dormancy release in superior seedless grapevine buds. Acta Physiol Plant, 2012, 34: 429-437
[5] Cao D D, Hu J, Zhu S J, Hu W M, Knapp A. Relationship between changes in endogenous polyamines and seed quality during development of sh2sweet corn (Zea mays L.) seed. Sci Hort, 2010, 123: 301-307
[6] Legocka J, Sobieszczuk-Nowicka E. Sorbitol and NaCl stresses affect free, microsome-associated and thylakoid-associated polyamine content in Zea mays and Phaseolus vulgaris. Acta Physiol Plant, 2012, 34: 1145-1151
[7] Li Z, Zhou H, Peng Y, Zhang X Q, Ma X, Huang L K, Yan Y H . Exogenously applied spermidine improves drought tolerance in creeping bentgrass associated with changes in antioxidant defense,endogenous polyamines and phytohormones. Plant Growth Regul,2015, 76: 71-82
[8] 杨建昌, 张亚洁, 张建华, 王志琴, 朱庆森. 水分胁迫下水稻剑叶中多胺含量的变化及其与抗旱性的关系. 作物学报, 2004,30: 1069-1075
Yang J C, Zhang Y J, Zhang J H, Wang Z Q, Zhu Q S. Changes in contents of polyamines in the flag leaf and their relationship with drought-resistance of rice cultivars under water deficiency stress. Acta Agron Sin, 2004, 30: 1069-1075 (in Chinese with English abstract)
[9] Yin Z P, Li S, Ren J, Song X S. Role of spermidine and spermine in alleviation of drought-induced oxidative stress and photosynthetic inhibition in Chinese dwarf cherry (Cerasus humilis) seedlings. Plant Growth Regul, 2014, 74: 209-218
[10] 杨建昌, 朱庆森, 王志琴, 曹显祖. 水稻籽粒中内源多胺含量及其与籽粒充实和粒重的关系. 作物学报, 1997, 23: 385-392
Yang J C, Zhu Q S, Wang Z Q, Cao X Z. Polyamines in rice grains and their relations with grain plumpness and grain weight. Acta Agron Sin, 1997, 23: 385-392 (in Chinese with English abstract)
[11] 谈桂露, 张耗, 付景, 王志琴, 刘立军, 杨建昌. 超级稻花后强、弱势粒多胺浓度变化及其与籽粒灌浆的关系. 作物学报,2009, 35: 2225-2233
Tan G L, Zhang H, Fu J, Wang Z Q, Liu L J, Yang J C. Post-anthesis changes in concentrations of polyamines in superior and inferior spikelet and their relation with grain filling of super rice. Acta Agron Sin, 2009, 35: 2225-2333 (in Chinese with English abstract)
[12] 王志琴, 张耗, 王学明, 张自常, 杨建昌. 水稻籽粒多胺的浓度与米质的关系. 作物学报, 2007, 33: 1922-1927
Wang Z Q, Zhang H, Wang X M, Zhang Z C, Yang J C. Relationship between concentrations of polyamine in filling grains and rice quality. Acta Agron Sin, 2007, 33: 1922-1927 (in Chinese with English abstract)
[13] Yang W B, Yin Y P, Li Y, Cai T, Ni Y L, Peng D L, Wang Z L. Interactions between polyamines and ethylene during grain filling in wheat grown under water deficit conditions. Plant Growth Regul, 2014, 72: 189-201
[14] 刘杨, 温晓霞, 顾丹丹, 郭强, 曾爱, 李长江, 廖允成. 多胺对冬小麦籽粒灌浆的影响及其生理机制. 作物学报, 2013, 39:712-719
Liu Y, Wen X X, Gu D D, Guo Q, Zeng A, Li C J, Liao Y C. Effect of polyamine on grain filling of winter wheat and its physiological mechanism. Acta Agron Sin, 2013, 39: 712-719 (in Chinese with English abstract)
[15] Du H Y, Zhou X G, Yang Q H, Liu H P, Ronald K. Changes in H+-ATPase activity and conjugated polyamine contents in plasma membrane purified from developing wheat embryos under short-time drought stress. Plant Growth Regul, 2015, 75: 1-10
[16] Kiriakos K, Maria D, Christakis H, Kalliopi A, Roubelakis A. A narrow-pore HPLC method for the identification and quantitation of free, conjugated, and bound polyamines. Anal Biochem, 1993,214: 484-489
[17] Gupta K, Dey A, Gupta B. Plant polyamines in abiotic stress responses. Acta Physiol Plant, 2013, 35: 2015-2036
[18] 李子银, 张劲松, 陈受宜. 水稻盐胁迫应答基因的克隆、表达及染色体定位. 中国科学: C辑, 1999, 29: 561-570
Li Z Y, Zhang J S, Chen S Y. Cloning and expression of response genes of rice to salt tress and its chromosomal location. Sci China: Ser C, 1999, 29: 561-570 (in Chinese)
[19] 王晓云, 李向东, 邹琦. 外源多胺、多胺合成前体及抑制剂对花生连体叶片衰老的影响. 中国农业科学, 2000, 33(3): 30-35
Wang X Y, Li X D, Zou Q. Effect of polyamines on senescence of attached peanut leaves. Sci Agric Sin, 2000, 33(3): 30-35 (in Chinese with English abstract)
[20] Masgrau C, Altablella T, Farras R, Flores D, Thompson A J, Besford R T, Tiburcio A F. Inducible over-expression of oat arginine decarboxylase in transgenic tobacco plants. Plant J, 1997, 11:465-473
[21] Szigeti Z, Lehoczki E. A review of physiological and biochemical aspects of resistance to atrazine and paraquat in Hungarian weeds. Pest Manag Sci, 2003, 59: 451-458
[22] Goicoechea N, Szalai G, Antolin M C, Sanchez-Diaz M, Paldi E. Influence of arbuscular mycorrhizae and rhizobium on free polyamines and proline levels in water-stressed alfalfa. J Plant Physiol, 1998, 153: 706-711
[23] Kubis J. Exogenous spermidine differentially alters activities of some scavenging system enzymes, H2O2and superoxide radical levels in water-stressed cucumber leaves. J Plant Physiol, 2008,165: 397-406
[24] Yamaguchi K, Takahashi Y, Berberich T, Imai A, Takahashi T,Michael A. A protective role for the polyamine spermine against drought stress in Arabidopsis. Biochem Biophys Res Commun,2007, 352: 486-490
[25] Sood S, Nagar P K. The effect of polyamines on leaf senescence in two diverse rose species. Plant Growth Regul, 2003, 39: 155-160
[26] Bais H P, Sudha G S, Rarishankar G A. Putrescine and silver nitrate influences shoot multiplication, in vitro flowering and endogenous titers of polyamines in Cichorium intybus L. cv. Lucknow local. J Plant Growth Regul, 2000, 19: 238-248
[27] Romero H M, Norato R J, Posada C. Changes in polyamine content are related to low temperature resistance in potato plants.Acta Biol Colomb, 1999, 4: 27-47
[28] Shinozaki S, Ogata T, Horiuchi S. Endogenous polyamines in the pericarp and seed of the grape berry during development and ripening. Sci Hort, 2000, 83: 33-41
[29] Scaramagli S, Biondi S, Leone A, Grillo S, Torrigiani P. Acclimation to low-water potential in potato cell suspension cultures leads to changes in putressine metabolism. Plant Physiol Biochem, 2000, 38: 345-351
[30] Musetti R, Scaramagli S, Vighi C, Pressacco L, Torrigiani P,Favali M A. The involvement of polyamines in phytoplasma-infected periwinkle (Catharanthus roseus L.) plants. Plant Biosyst, 1999, 133: 37-45
[31] Rabiti A L, Betti L, Bortolotti G, Marini F, Canova A, Bagni N, Torrigiani P. Shout-term polyamine response in TMV-inoculated hypersensitive and susceptible tobacco plants. New Phytol, 1998,139: 549-553
[32] 赵福庚, 孙诚, 刘友良, 章文华. 盐胁迫下大麦根系多胺代谢与其耐盐性的关系. 植物学报, 2003, 45: 295-300
Zhao F G, Sun C, Liu Y L, Zhang W H. Relationship between polyamine metabolism in roots and salt tolerance of barley seedlings. Acta Bot Sin, 2003, 45: 295-300 (in Chinese with English abstract)
[33] Kong L, Attree S M, Fowke L C. Effects of polyethylene glycol and methylglyoxal bis (guanylhydrazone) on endogenous polyamine levels and osmotic embryo maturation in white spruce. Plant Sci, 1998, 133: 211-220
Dynamics in Contents of Different Types of Polyamine in Wheat Embryos and Its Relationship with Resistance to Drought Stress
DU Hong-Yang1,2, LIU Gu-Ting3, YANG Qing-Hua2, and LIU Huai-Pan1,2,*1College of Life Science and Agronomy / Key Laboratory of Plant Genetics and Molecular Breeding, Zhoukou Normal University, Zhoukou Henan 466001, China;2Agronomy College / The Collaborative Innovation Center of Henan Grain Crops, Henan Agricultural University, Zhengzhou Henan 450002, China;3College of Biological Science, China Agricultural University, Beijing 100193, China
This study aimed at understanding the functions of different kinds of polyamine in developing embryos of wheat under drought stress. The drought resistant variety “Luomai 22” and the drought-sensitive variety “Yumai 48” were treated for 10 days with drought stress (DS) and DS plus exogenous polyamines (Spd and Spm) and inhibitors (MGBG and O-Phen) on the 10th day after anthesis. In both varieties, the levels of free Put, Spd, and Spm and the content of acid soluble covalently conjugated polyamines (ASCC-PA) increased under DS treatment, particularly, the free Put content in Yumai 48 increased rapidly and continuously during 10 days after treatment. The increased magnitude of free Spd and Spm contents in Luomai 22 embryos was similar to that in Yumai 48 embryos at the early stage of DS, but significantly larger than that in Yumai 48 embryos at later stage of DS. The content of acid insoluble covalently conjugated Put (AISCC-Put) was low in both varieties at early stage of DS, however, increased obviously in Luomai 22 at later stage of DS, with a significantly higher level in Luomai 22 than in Yumai 48. Application of exogenous Spd or Spm resulted in significantly increased free Spd and Spm contents in Yumai 48 at later DS stage; simultaneously, the relative water content of flag leaf and the relative dry matter increase rate of grain increased and the relative plasmamembrane permeability of flag leaf decreased, indicating improved drought resistance in Yumai 48. Polyamine inhibitors showed negative effects on drought resistance, in which MGBG had a strong inhibition on the conversion from free Put to free Spd or Spm in embryos of Luomai 22 and O-Phen depressed AISCC-Put induction by drought stress. These results suggest that drought tolerance of wheat might be improved by the easy conversion from free Put to free Spd, Spm, or AISCC-Put after flowering.
Drought stress; Wheat grain embryo; Polyamines
10.3724/SP.J.1006.2016.01224
本研究由国家自然科学基金项目(31271627), 周口师范学院高层次人才科研启动经费(ZKNU2015109), 国家公益性行业(农业)科研专项(201203077)资助。
This study was supported by the National Natural Science Foundation of China (31271627), the Start-up Fund for High-level Scholars of Zhoukou Normal University (ZKNU2015109), and the China Special Fund for Agro-Scientific Research in the Public Interest (201203077).
*
(Corresponding author): 刘怀攀, E-mail: liuhuaipan2013@126.com, Tel: 0394-8178138
联系方式: E-mail: duhongyang2005@126.com
Received(
): 2015-12-03; Accepted(接受日期): 2016-05-09; Published online(网络出版日期): 2016-05-23.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160523.0852.006.html
