MTT试验检测EV71 2A蛋白对宿主细胞损伤作用
2016-08-25张文强马英伟庄志超白永娟王志玉温红玲
乔 乔,李 静,张文强,马英伟,庄志超,白永娟,赵 丽,王志玉,温红玲
MTT试验检测EV71 2A蛋白对宿主细胞损伤作用
乔乔1,李静1,张文强2,马英伟1,庄志超1,白永娟1,赵丽1,王志玉1,温红玲1
目的在Vero细胞、RD细胞和U87细胞3种细胞系中,研究EV71的2A蛋白对宿主细胞增殖能力的影响及对细胞的损伤作用,揭示2A蛋白在EV71的致病机制中所起的作用。方法将野毒株EV71 SDLY 107株(强毒株)、EV71 SDLY 1株(弱毒株)和嵌合毒株EV71 SDLY 107-2A-1感染Vero细胞、RD细胞、U87细胞后,利用MTT试验测定3种细胞在感染病毒后不同时间点的存活情况,绘制细胞生长曲线,比较细胞增殖程度,并利用单因素方差分析法分析3种细胞在感染不同病毒48 h后的存活率;结果EV71 SDLY 107株感染Vero细胞和RD细胞后细胞增殖程度和存活率均低于EV71 SDLY 1株(t=41.64,P<0.001;t=33.28,P<0.001);EV71 SDLY 107-2A-1嵌合株感染Vero细胞和RD细胞后,细胞增殖程度和存活率均高于亲本病毒EV71 SDLY 107株,低于EV71 SDLY 1株(t=17.97,P<0.001;t=42.09,P<0.01); EV71 SDLY 107-2A-1株感染U87细胞后细胞存活率低于EV71 SDLY 1株(t=8.85,P<0.001),但与EV71 SDLY 107株感染后细胞存活率无统计学差异(t=0.74,P=0.603);不同细胞感染同株病毒48 h后,U87细胞存活率均为最低,Vero细胞存活率均为最高。结论EV71强毒株的2A蛋白对细胞产生的损伤作用大于弱毒株的2A蛋白,提示2A蛋白在EV71对宿主细胞的作用中发挥功能。
EV71;2A蛋白;细胞增殖;存活率
肠道病毒71型(Enterovirus71, EV71)是小RNA病毒科肠道病毒属成员,可引起重症手足口病,常伴有神经系统并发症[1-4],其基因组是一条单股正链RNA,只有一个开放阅读框架(ORF)。非结构蛋白2A(2Apro)是由150个氨基酸组成的半胱氨酸水解蛋白酶,可水解前体蛋白P1与P2之间的肽键[5],并切割3CD产生3C′和3D′蛋白[6-7]。EV71 2Apro具有转录激活性质[8],并可通过分解eIF4G和PARP诱导宿主细胞凋亡[9-11]。目前研究均说明2A蛋白在EV71的复制过程及毒力作用中可能具有重要意义,但尚有许多问题有待阐明。
本研究利用反向遗传操作构建了EV71的2A嵌合病毒,在3种不同的细胞系中分别感染EV71的强毒株、弱毒株和嵌合毒株,检测不同毒株对细胞的损伤作用和对细胞的增殖能力影响,旨在探讨强弱毒株2A蛋白对EV71细胞损伤的差异和对细胞增殖能力影响,为进一步研究2A蛋白的功能和作用机制提供研究基础。
1 材料和方法
1.1细胞和病毒非洲绿猴肾细胞(Vero细胞)和人脑星形胶质母细胞瘤细胞(U87细胞)为本室保存,横纹肌肉瘤细胞(RD细胞)为山东省疾病预防控制中心惠赠。EV71 SDLY 107野毒株为本室分离自1例HFMD 合并脑炎的死亡患儿咽拭子标本,EV71 SDLY 1株为本室分离自1例单纯HFMD患儿粪便标本,病毒分离所用细胞为RD细胞[12]。嵌合体病毒SDLY 107-2A-1株为在SDLY 107全长cDNA感染性克隆基础上将2A蛋白置换为弱毒株SDLY 1株的2A片段构建而成,为本室构建鉴定并保存[13]。
1.2主要仪器与试剂MTT(北京Solarbio公司)、PBS(北京Solarbio公司)、二甲基亚砜(DMSO,北京Solarbio公司),DMEM( 美国Hyclone公司),0.25%胰酶(北京中科迈晨科技有限公司),胎牛血清(天津灏洋生物制品科技有限责任公司),酶标仪(美国BioTek公司)。
1.3病毒培养与收集将EV71 SDLY 107株、EV71 SDLY 1株、EV71 SDLY 107-2A-1株病毒分别接种于RD细胞中,置于37 ℃ 5% CO2条件下培养至约90%细胞病变时,置于-40 ℃反复冻融3次后,10 000 r/min离心10 min,取上清分装后于-80 ℃保存,并测定病毒滴度[2]。
1.4MTT试验配制MTT使用液(5 mg/mL):将250 mg的MTT粉末用1×PBS溶解并定容至50 mL,分装于1.5 mL离心管中,避光保存于-20 ℃备用。在37 ℃ 5% CO2条件下,用含8%胎牛血清的DMEM在96孔板中分别培养Vero细胞、RD细胞和U87细胞,待细胞生长至70%~90%良好单层时,接种这4种病毒(MOI=0.001),同时设置调零孔(培养液、MTT、DMSO),对照孔(细胞、培养液、MTT、DMSO),每个样品和对照均设3个平行样。在细胞感染病毒0 h、12 h、24 h、36 h和48 h后,吸弃上清,每孔加入90 μL含1%胎牛血清的DMEM和10 μL的5 mg/mL MTT溶液后,置于37 ℃ 5% CO2条件下培养4 h后,吸弃上清,每孔再加入110 μL的DMSO,置于37 ℃ 10 min至紫色结晶完全溶解后,利用酶标仪在490 nm处测其吸光度值(A值),绘制感染病毒后不同细胞的生长曲线,比较细胞存活率的差异。在细胞感染病毒48 h后,重复3次上述实验,按公式(实验组A值-调零孔A值)/(对照组A值-调零孔A值)计算出细胞存活率,利用单因素方差分析法进行统计学分析。
1.5统计学方法利用SPSS16.0软件进行统计学分析,不同处理组间比较采用单因素方差分析法(one-way ANOVA),若方差齐再利用LSD法进行两两比较。检验水准α=0.05,P<0.05有统计学意义。
2 结 果
2.1病毒感染后细胞的生长曲线EV71 SDLY 107株、EV71 SDLY 1株、EV71 SDLY 107-2A-1株病毒接种Vero细胞、RD细胞和U87细胞,培养24 h后,均可观察到明显的细胞病变效应(CPE),在0 h~48 h内每隔12 h分别检测吸光度值(A值),并绘制细胞生长曲线。由细胞生长曲线可知,在Vero细胞和RD细胞中(图1A、1B),EV71 SDLY 107-2A-1株感染后0~48 h内细胞增殖程度高于EV71 SDLY 107株,但低于EV71 SDLY 1株,感染组细胞增殖程度均低于对照组;在U87细胞中(图1C),EV71 SDLY 107株、EV71 SDLY 1株及EV71 SDLY 107-2A-1株感染后细胞生长曲线无明显差异,感染组细胞增殖程度均低于对照组。

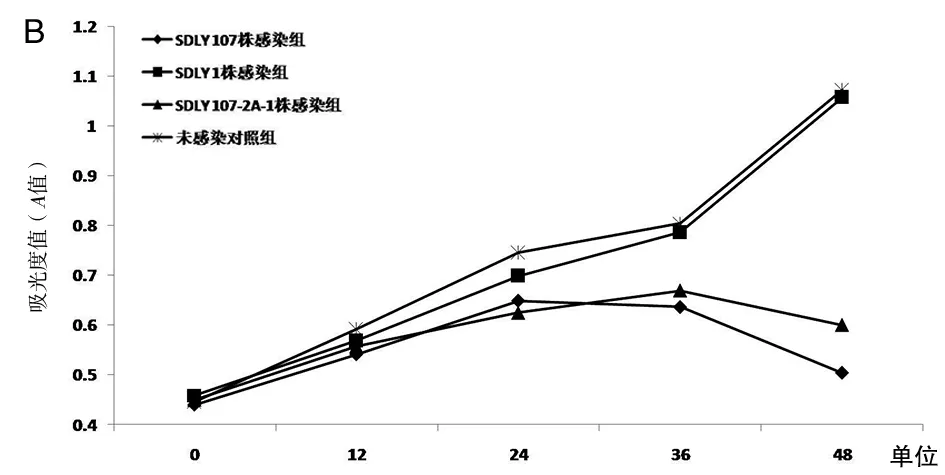
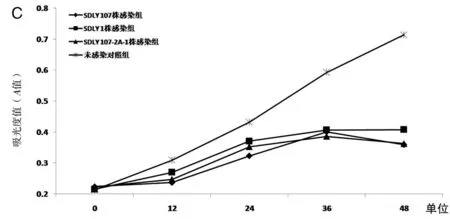
A.Vero细胞;B.RD细胞;C.U87细胞A. Vero cells; B. RD cells; C. U87 cells图1 细胞生长曲线Fig.1 Cell growth curves
2.2不同病毒感染同种细胞对细胞存活率的影响分析Vero细胞、RD细胞和U87细胞分别感染3株病毒48 h后,MTT实验检测细胞存活率,重复3次实验,利用单因素方差分析可知,在Vero和RD细胞中(图2A、2B),EV71 SDLY 107-2A-1嵌合株感染后48 h的细胞存活率高于强毒株EV71 SDLY 107株(t=15.54,P<0.09;t=4.96,P<0.001),低于弱毒株EV71 SDLY 1株(t=17.97,P<0.001;t=42.09,P<0.001),差异有统计学意义;而在U87细胞中(图2C),EV71 SDLY 107-2A-1嵌合株与强毒株EV71 SDLY 107株感染后的细胞存活率无统计学差异(P=0.74,P=0.603),但EV71 SDLY 107-2A-1株(t=8.85,P<0.001)与EV71 SDLY 107株(t=8.96,P<0.001)感染后细胞存活率都低于EV71 SDLY 1株,差异有统计学意义。
2.3同株病毒感染不同细胞对细胞存活率的影响分析细胞感染3株EV71病毒后,U87细胞存活率均为最低,Vero细胞存活率均为最高;EV71 SDLY 107株感染3种细胞48 h后,细胞存活率均低于50%;EV71 SDLY 1株感染U87细胞后细胞存活率显著低于Vero细胞(t=20.48,P<0.001)和RD细胞(t=15.58,P<0.001),差异有统计学意义;EV71 SDLY 107-2A-1嵌合株感染细胞48 h后,Vero细胞存活率高于RD细胞,且RD细胞存活率高于U87细胞(t=7.11,P<0.001),差异有统计学意义。
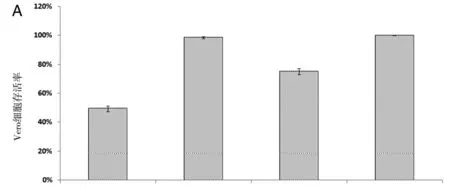
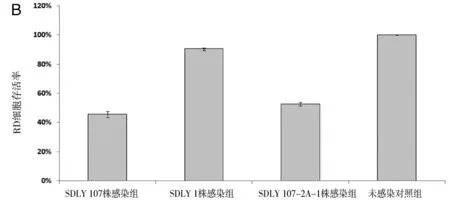

A. Vero细胞存活率;B. RD细胞存活率;C. U87细胞存活率A. Survival rates of Vero cells; B. Survival rates of RD cells; C. Survival rates of U87 cells.图2 不同病毒感染同种细胞48h的细胞存活率Fig.2 Survival rates of cells at 48 h post-infection by different virus
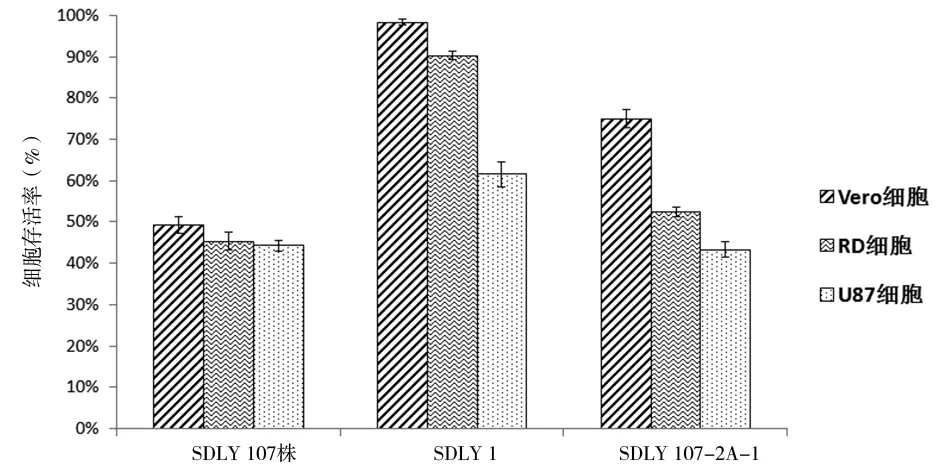
图3 同株病毒感染不同细胞48 h后的细胞存活率Fig.3 Survival rate of different cells at 48 h post-infection by the same virus
3 讨 论
本实验室的前期研究表明,强毒株EV71 SDLY 107株和弱毒株EV71 SDLY 1株在RD细胞中的复制能力和对细胞感染力存在明显差别,但机制不明。我们对EV71 SDLY 107株和EV71 SDLY 1株的蛋白序列进行比对,发现2株病毒在2A蛋白上的64、68和75位氨基酸不同,由于2A蛋白具有转录活性和酶活性,推测2A蛋白上氨基酸位点的区别可能是引起EV71 SDLY 107株和EV71 SDLY 1株的复制差异和感染性差异不同的原因,也有可能是影响EV71毒力表型的重要原因之一。我们利用反向遗传技术对强毒株EV71 SDLY 107株和弱毒株EV71 SDLY 1株的2A蛋白进行了置换,成功构建了EV71嵌合体病毒的感染性克隆,并成功拯救出EV71 SDLY 107-2A-1嵌合株[13],为我们在全病毒水平上检测EV71 2A蛋白的功能提供了研究基础。
本研究利用MTT试验对病毒致细胞增殖抑制的作用进行了研究,结果表明,EV71 SDLY 107株对Vero细胞和RD细胞的损伤作用明显高于EV71 SDLY 1株,但在U87细胞中这2株病毒致细胞损伤作用差异较小,这可能是由于EV71对神经胶质瘤细胞过于敏感,不同毒力表型的毒株对U87细胞的损伤作用都很强,并不能通过MTT试验检测出来,这也从另一个角度说明了EV71对神经系统的致病性,但是实验中所用的EV71 SDLY 1分离株并未在临床上表现出明显的神经症状,这可能是由于EV71的神经毒力机制是由多个因素共同决定的。EV71不同毒株都对U87细胞高度敏感,因此U87细胞可以作为研究EV71毒力的细胞系。此外,分别比较3株病毒感染不同细胞系后可得出,Vero细胞的存活率最高,U87细胞的存活率最低,RD细胞存活率介于二者之间,这可能是由于EV71具有嗜神经性,因此对于U87细胞的损伤作用最强,这可能与细胞上的受体分布有关,在U87细胞上存在某种特异性病毒受体,更有利于EV71对细胞的感染。由此可以推断,2A蛋白在2株亲本毒株致细胞损伤作用差异中发挥了一定的作用。除此之外,EV71 SDLY 107株和EV71 SDLY 1株的2A蛋白有3个氨基酸位点的差异,这对我们利用定点突变技术进一步研究2A蛋白上的潜在的神经毒性关键氨基酸位点具有重要意义。
本研究利用反向遗传技术,在全病毒水平上对EV71 2A蛋白在不同毒株和不同细胞系中致细胞损伤作用进行了研究,这为RNA病毒的结构蛋白及非结构蛋白的研究开辟了新途径。在EV71全病毒水平上进行的蛋白功能研究比在体外表达蛋白进行功能研究更加具有说服力和实际意义,在此基础上,还可以通过建立动物模型进一步研究2A蛋白在病毒复制能力和毒力中起到的作用,为EV71致病机制的研究及抗病毒药物和疫苗的研制奠定了研究基础。
[1] Zhang Y, Tan XJ, Wang HY, et al. An outbreak of hand, foot, and mouth disease associated with subgenotype C4 of human enterovirus 71 in Shandong, China [J]. J Clin Virol, 2009, 44(4): 262-267. DOI: 10.1016/j.jcv.2009.02.002
[2] Mao LX, Wu B, Bao WX, et al. Epidemiology of hand, foot, and mouth disease and genotype characterization of Enterovirus 71 in Jiangsu, China [J]. J Clin Virol, 2010, 49(2): 100-104. DOI: 10.1016/j.jcv.2010.07.009
[3] McMinn PC. An overview of the evolution of enterovirus 71 and its clinical and public health significance[J]. FEMS Microbiol Rev, 2002, 26(1): 91-107. DOI: 10.1111/j.1574-6976.2002.tb00601.x
[4] Chen KT, Chang HL, Wang ST, et al. Epidemiologic features of hand-foot-mouth disease and herpangina caused by enterovirus 71 in Taiwan, 1998-2005[J]. Pediatrics, 2007, 120(2): e244-e252.
[5] Hsu YY, Liu YN, Wang W, et al.Invivodynamics of enterovirus protease revealed by fluorescence resonance emission transfer (FRET) based on a novel FRET pair [J]. Biochem Biophys Res Commun, 2007, 353(4): 939-945. DOI: 10.1016/j.bbrc.2006.12.145
[6] Ventoso I, Carrasco L. A poliovirus 2A(pro) mutant unable to cleave 3CD shows inefficient viral protein synthesis and transactivation defects [J]. J Virol, 1995, 69(10): 6280-6288.
[7] Hellen CU, Lee CK, Wimmer E. Determinants of substrate recognition by poliovirus 2A proteinase[J]. J Virol, 1992, 66(6): 3330-3338.
[8] Yang CH, Li HC, Jiang JG. Enterovirus type 71 2A protease functions as a transcriptional activator in yeast[J]. J Biomed Sci, 2010, 17(35): 65. DOI: 10.1186/1423-0127-17-65
[9] Kuo RL, Kung SH. Infection with enterovirus 71 or expression of its 2A protease induces apoptotic cell death [J]. J Gen Virol, 2002, 83(6): 1367-1376. DOI: 10.1002/hbm.10155
[10] Hsu YY, Liu YN. Visualizing and quantifying the differential cleavages of the eukaryotic translation initiation factors eIF4GI and eIF4GII in the enterovirus-infected cell[J]. Biotechnol and Bioeng, 2009, 104(6): 1142-1152. DOI: 10.1127/0935-1221/2009/0021-1847
[11] Kempf BJ, Barton DJ. Poliovirus 2A(Pro) increases viral mRNA and polysome stability coordinately in time with cleavage of eIF4G[J]. J Virol, 2008, 82(12): 5847-5859.
[12] Wen HL, Si LY, Yuan XJ, et al. Complete genome sequencing and analysis of six enterovirus 71 strains with different clinical phenotypes[J]. Virol J, 2013, 10(4): 115. DOI: 10.1186/1743-422X-10-115
[13] Qiao Q, Li J, Sun CX, et al. Construction and identification of a chimeric cDNA infectious clone of enterovirus 71 strain[J]. Chin J Microbiol Immunol, 2015, 35(2): 87-93. (in Chinese)
乔乔,李静,孙成玺,等.肠道病毒 71 型嵌合体病毒感染性克隆的构建与鉴定[J].中华微生物学和免疫学杂志, 2015, 35(2): 87-93.
Host cell injuries caused by 2Aproof EV71 detected by MTT assay
QIAO Qiao1, LI Jing1, ZHANG Wen-qiang2, MA Ying-wei1, ZHUANG Zhi-chao1,BAI Yong-juan1, ZHAO Li1, WANG Zhi-yu1, WEN Hong-ling1
(1.DepartmentofVirology,SchoolofPublicHealth,ShandongUniversity,Jinan250012,China2.ShandongCenterforDiseaseControlandPrevention,Jinan250014,China)
We studied host cell proliferations and injuries caused by 2Aproof EV71 in Vero cells, RD cells and U87 cells and to reveal the role of 2Aproin EV71 pathogenic mechanism. Vero cells, RD cells and U87 cells were infected by wild strains EV71 SDLY 107 (EV71 fatal strain), EV71 SDLY 1 (EV71 mild strain) and chimeric strain EV71 SDLY 107-2A-1, the survival of three cell lines at different time post infected by viruses were detected used by MTT assay, the cell growth curves were drew to compare cell proliferation and the survival rates of three cell lines at 48 hours post infected by different viruses were analyzed by ANOVA. Results showed that cell proliferations and survival rates of Vero cells and RD cells infected by EV71 SDLY 107 were lower than EV71 SDLY 1 (t=41.64,P<0.001;t=33.28,P<0.001). The proliferations and survival rates of Vero cells and RD cells post-infected by EV71 SDLY 107-2A-1 were higher than that in EV71 SDLY 107 and lower than that in EV71 SDLY 1 (t=17.97,P<0.001;t=42.09,P<0.001). The survival rate of U87 cells infected by EV71 SDLY 107-2A-1 was lower than that in EV71 SDLY 1 (t=8.85,P<0.001) and no different than that in EV71 SDLY 107 (t=0.74,P=0.603). U87 cells had the lowest survival rate and Vero cells had the highest survival rate at 48 h post infected by the same virus strain. The 2Aproof virulent strain caused more severe cell injury than 2Aproof attenuated virus, which reveals 2Aproplays a role in the effect of EV71 on host cells.
EV71; 2Apro; cell proliferation; survival rate
Supported by the National Natural Science Foundation of China (No. 81371833) and the Medical and Health Science and Technology Development Plan of Shandong Province (No. 2013WS0211)
Wen Hong-ling, Email: wenhongling@sdu.edu.cn
温红玲,Email: wenhongling@sdu.edu.cn
1.山东大学公共卫生学院病毒学研究室,实验畸形学教育部重点实验室,济南250012;2. 山东省疾病预防控制中心,济南250014
R373.2
A
1002-2694(2016)06-0525-04
2015-10-08;
2016-03-28
DOI:10.3969/j.issn.1002-2694.2016.06.004
国家自然科学基金面上项目(No.81371833)和山东省医药卫生科技发展计划(No.2013WS0211)联合资助
