利用不确定度评定对改进后水产品中喹乙醇的检测方法进行确证研究
2016-08-24张惠峰闫先春
张惠峰,闫先春,甄 昕
(长春市水产品质量安全检测中心,吉林 长春 130033)
利用不确定度评定对改进后水产品中喹乙醇的检测方法进行确证研究
张惠峰,闫先春,甄昕
(长春市水产品质量安全检测中心,吉林 长春 130033)
建立了水产品中喹乙醇测定的改进方法。改进了前处理方式,样品用热水提取后,经硅藻土和正己烷净化,并对色谱条件进行优化,从而提高检测效率。结果表明,改进后的方法高效简易、灵敏准确,在4个不同基质样品的2个加标水平下的平均回收率为77.2%~87.0%,相对标准偏差为0.4%~6.3%,检出限10 μg/kg,定量限30 μg/kg 。建立了不确定度评定数学模型,通过计算和分析测量过程中各不确定度,对方法和测试条件进行确证。测量系统相对不确定度小于8%,主要受测量过程的随机效应、标准曲线拟合、回收率等因素影响。该方法高效便捷、准确可靠、快速且节约成本,适用于水产品中喹乙醇的检测。此外,本研究对利用不确定度评定进行检测方法确证有十分重要的指导意义。
喹乙醇;不确定度;水产品;检测;确证
喹乙醇(Olaquindox,OLA)又名喹酰胺醇、快育灵、倍育诺等,属喹喔啉类抑菌促生长剂[1-2],被广泛应用于水产品养殖业[3-6]。因喹乙醇具有光敏毒性[7]、致突变和致癌作用[8-12],国家已明令禁止在水产养殖中使用喹乙醇[13]。目前国内外对水产品中喹乙醇的检测主要采用高效液相色谱法、高效液相串联质谱法等。水产品中喹乙醇残留量检测行业标准[14]实际回收率极低[15]。于慧娟、艾晓辉等[16-17]采用热水提取后去净化后高效液相色谱法测定喹乙醇,操作简单,但检出限高。田强兵[18-20]等采用有机溶剂提取净化浓缩后高效液相色谱法测定喹乙醇,操作复杂,所需耗材昂贵。曾静等[21-22]采用高效液相串联质谱法测定喹乙醇,方法检出限低,但所用仪器设备昂贵,适应范围受限。本研究的检测方法,与原国家颁布的行业标准方法相比,操作较简便,使用的有机试剂较少,方法检出限低,准确度较高,样品回收率可达85%左右。本方法不仅降低了检测成本,还缩短了检测时间,可广泛适用于水产品中喹乙醇的定量检测分析。
测量不确定度对于方法的确认、检测过程重点因素质控、能力验证、检验结论意见解释等都有着十分重要的意义,因此在水产品安全检测等各领域越来越受到重视[23-26],但尚未有利用不确定度评定对新检测方法进行确证的报道。本文依据不确定度评定的基本方法、程序[27-30],建立了本方法的测量不确定度数学模型,首次利用不确定度评定对检测新方法进行了确证,并通过对各不确定度分量的计算分析,确定该测量系统是否满足需要,以及测量系统所需要的环境、仪器、试剂等因素是否具有所需要的统计特性,进一步发现显著影响因素,从而不断改进方法以提高检测质量,以期为指导利用不确定度评定进行方法确证和证实及日常检测工作的不确定度评定和结果质量控制提供参考。
1 材料与方法
1.1材料与试剂
喹乙醇标准品(纯度99%):德国Dr.Ehrenstorfer公司;硅藻土(Celite545):美国Sigma-Aldrich公司;甲醇(色谱纯):美国Fisher公司;试验用水均符合GB/T 6682一级水的要求,其余试剂均为国产分析纯。水产品样品:购于长春东北亚物流有限公司。
1.2 仪器与设备
Agilent 1200高效液相色谱仪(配紫外检测器和自动进样器):美国Agilent公司;TDL-40B台式离心机:上海安亭科学仪器厂;TE212-L电子天平:德国 Sartorius公司;Research plus可调量程移液器:德国Eppendorf公司;XS205分析天平:瑞士Mettler公司。
1.3试验方法
1.3.1 标准溶液的配制
标准储备液:精密称取喹乙醇标准品10.0 mg,用少量水溶解。用甲醇定容于100 mL棕色容量瓶中,质量浓度为100 μg/mL,避光冷藏保存。标准使用液,现配现用。
1.3.2 样品提取
称取试样10 g(精确到0.01 g)置于50 mL离心管中,加入硅藻土1 g,准确加入10 mL水,涡旋振荡2 min,60℃恒温水浴振荡提取15 min,全程注意避光,以4 000 r/min离心5 min,将上清液倒入另一个50 mL离心管中,再向残留物中加入10 mL水,同上操作,合并上清液,混匀。
1.3.3净化
取2 mL提取液于5 mL离心管中,加入正己烷2 mL,漩涡振荡2 min,静置分层。弃去正己烷相,再加入正己烷2 mL,重复上述操作。取水相层,经0.45 μm微孔滤膜过滤后,供液相色谱测定。
1.3.4 色谱条件
色谱柱:Agilent C18柱(ZORBAX Eclipse XDB 150 mm×4.6 mm,5 μm);流动相:甲醇-水(15∶85 ,V/V);流速:1.0 mL/min;检测波长:380 nm;柱温:35℃;进样量:20 μL。
2 结果与分析
2.1 喹乙醇色谱图
按色谱条件进行分析,喹乙醇与干扰物质完全分离,峰形良好。喹乙醇标准色谱图见图1。
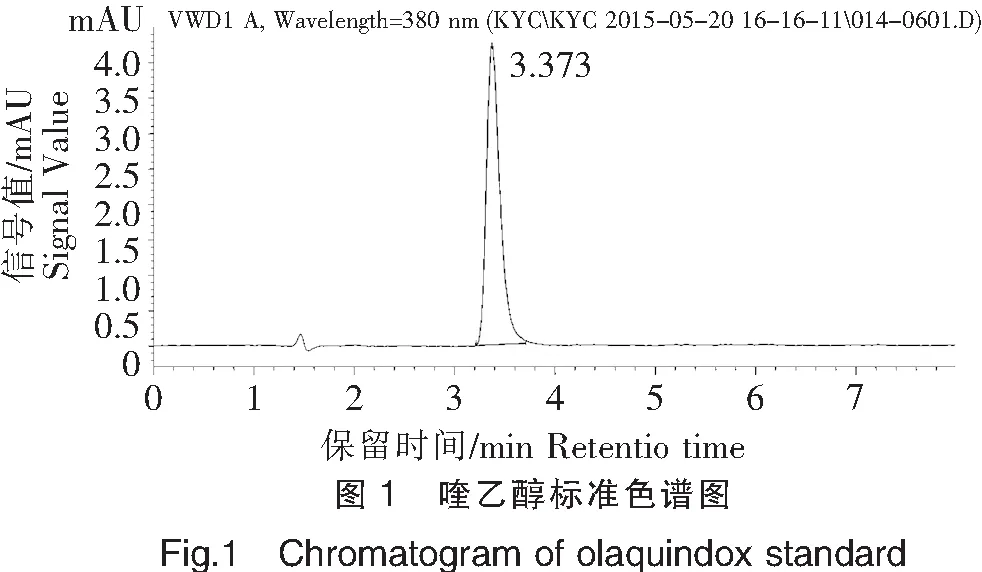
2.2 提取净化与上机检测
依据喹乙醇微溶于热水、难溶于冷水、不溶于一般有机溶剂及对热稳定在70~90℃经30 min无变化的特性,采用热水做提取剂,60℃振荡提取15 min。提取过程中加入硅藻土,能均匀分散基质且有效去除提取液中的很多杂质。处理后的提取液经正己烷脱脂,经微孔滤膜过滤后可直接上机。使用ZORBAX Eclipse XDB 150 mm×4.6 mm色谱柱,优化色谱条件,减少了色谱测定时间。喹乙醇见光分解速度很快,试验全过程需要避光。该方法操作简便,有效缩短了试验时间,从而避免喹乙醇在检测过程中见光分解,提高了回收率,满足水产品中残留检测的要求。
2.3 不确定度评定数学模型建立及来源分析
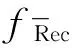
不确定度的来源主要包括曲线校准过程(标储液定容、标液稀释、最小二乘法曲线拟合)、样品质量、试样定容、仪器测试、测试过程随机效应及平均回收率校正结果引入的不确定度等。本研究依据相对标准不确定度小于0.006时可忽略不计的原则(结果保留2位有效数字,故扩展不确定度最小为1μg/kg。另考虑数据修约,当扩展不确定度小于0.50μg/kg时可视为0μg/kg,故当测试结果在38~45μg/kg时,相对标准不确定度小于0.006时可忽略不计),通过对各不确定度分量的计算,分析测量系统所需要的环境、仪器、试剂等因素的测试要求。2.4 曲线校准引入的不确定度评定和线性范围、检出限的确证
2.4.1曲线校准引入的相对标准不确定度u(cal)rel
u(cal)rel主要来源于标准储备液制备、标准溶液稀释过程及曲线拟合。
1)标储溶液配制引入的相对不确定度uVsrel及标准物质确证
原始标准物质引入的不确定度为B类评定:据标准物质(纯度99%)证书给出的扩展不确定度Up=0.01,包含因子k=2,得up=Up/k=0.005,即标准物质的相对不确定度uprel=up/p=0.005 1。故由原始标准物质引入的不确定度可忽略不计,所用标准物质满足方法要求。依据相对标准不确定度小于0.006时可忽略不计的原则,计算得,原始标准物质纯度大于83%时,所引入相对标准不确定度均可忽略。
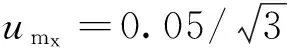
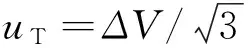
标储溶液配制相对不确定度合成为uVsrel==0.006 1。若标储溶液配制时使用B级容量瓶定容引入相对标准不确定度为0.001 2,对最终结果影响不大。如温度变化范围为9℃时,标储定容时因温度引入的相对标准不确定度为0.006 2,故在检测过程中控制温度范围为12~28℃较为适宜。
2)标准溶液稀释引入的相对标准不确定度uVWrel
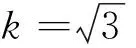
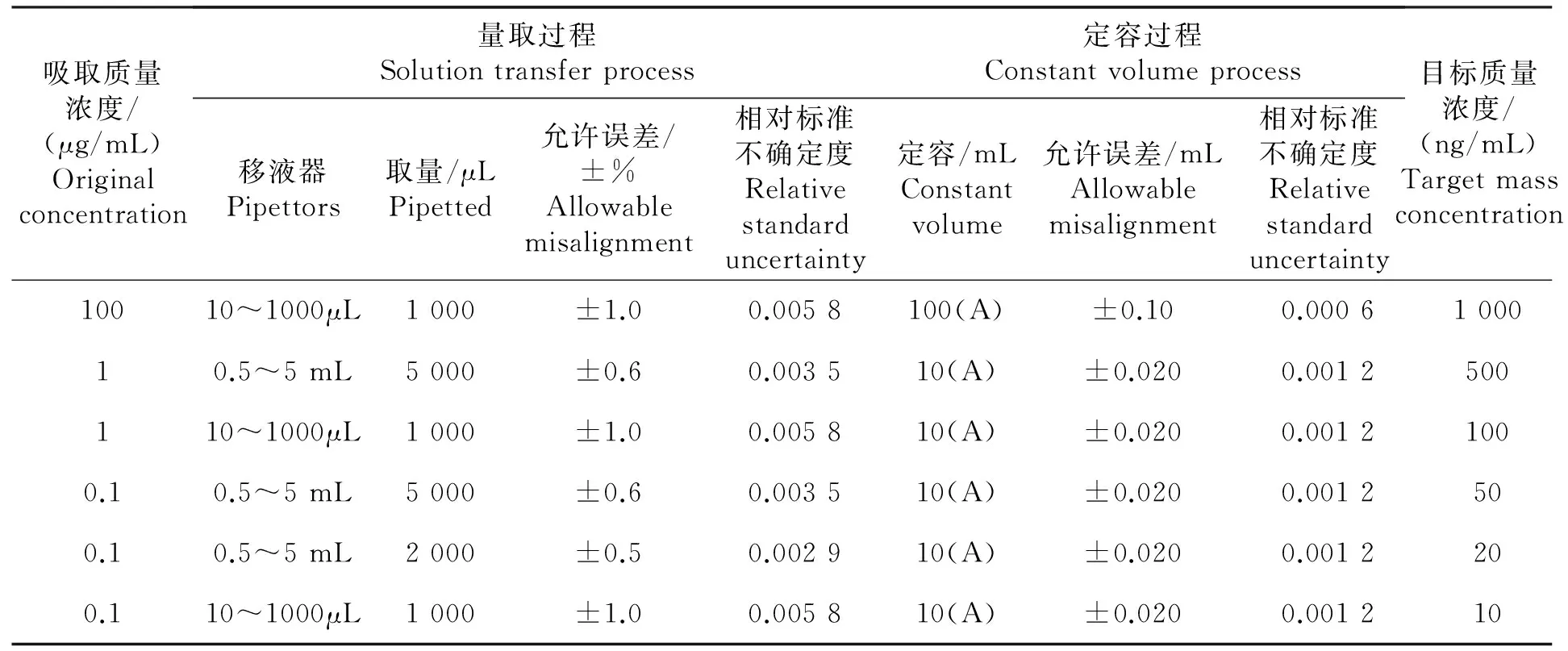
表1 量器校准引入的不确定度
注:所使用定容容量瓶均为A级。
Note:Volumetric flasks used were A-levels.
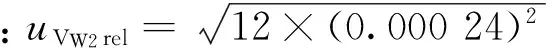
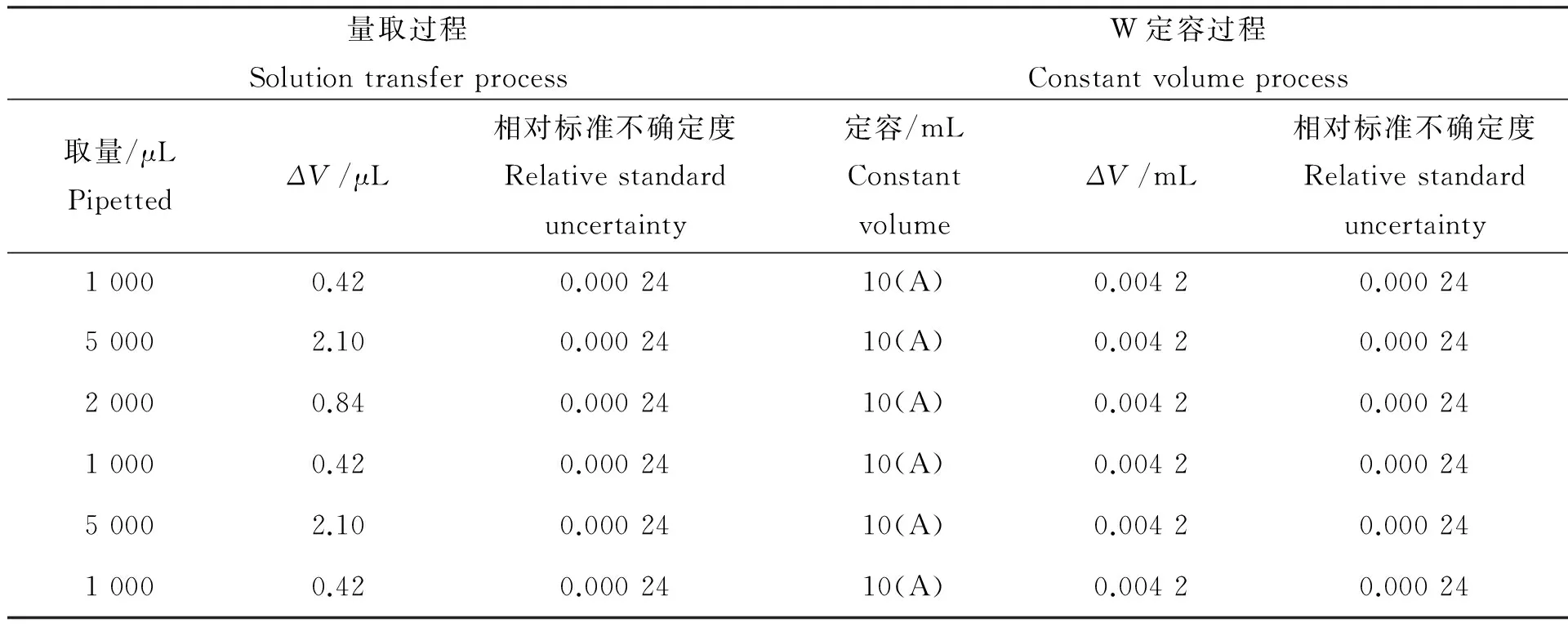
表2 环境温度变化引入的不确定度
3)标准工作曲线拟合引入的相对标准不确定度u(xpred)rel
配制喹乙醇的5个不同质量浓度标准溶液(5、10、50、100、500 ng/mL),采用最小二乘法拟合相应的峰面积A。线性回归方程为Y=0.051 252 9X+0.018 933 6(Y=bX+a,a为截距,b为斜率),方程的线性相关系数为,r=0.999 99,详见表3。

表3 喹乙醇标准曲线测定结果
用最小二乘法拟合的标准工作曲线引入的相对不确定度为A类评定,计算公式见式(2)。
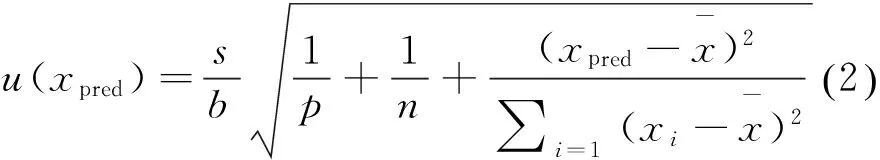
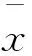
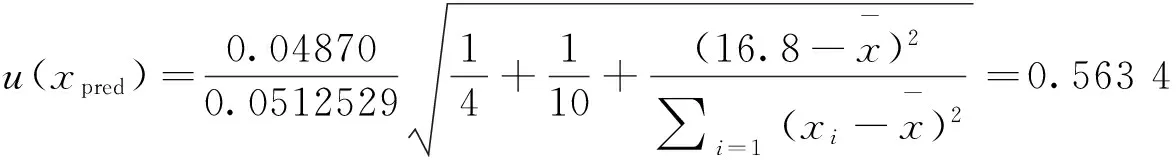
4)曲线校准过程引入的相对标准不确定度合成
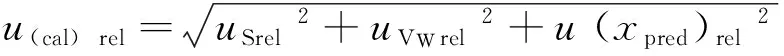
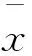
2.4.2 线性范围确证
利用相关系数法对该回归方程的线性进行检验:查相关系数检验表得r =0.917,因为r=0.999 99>0.917= r(0.01,n=6),且残余标准误差小于0.05(s=0.048 70),故该曲线各点拟合较好,线性相关关系特别显著。
2.4.3 方法检出限确证
根据高若梅[34]等对分析方法的检出限和测定下限的研究,通过对5 ng/mL标准溶液测定21次,获得目标峰与4.500~6.500 min信号的平均信噪比的S/N=2.9,按称样量10.00 g,经换算(式1)得方法检出限为10μg/kg,结合平均回收率统计得本方法的定量限为30 μg/kg 。
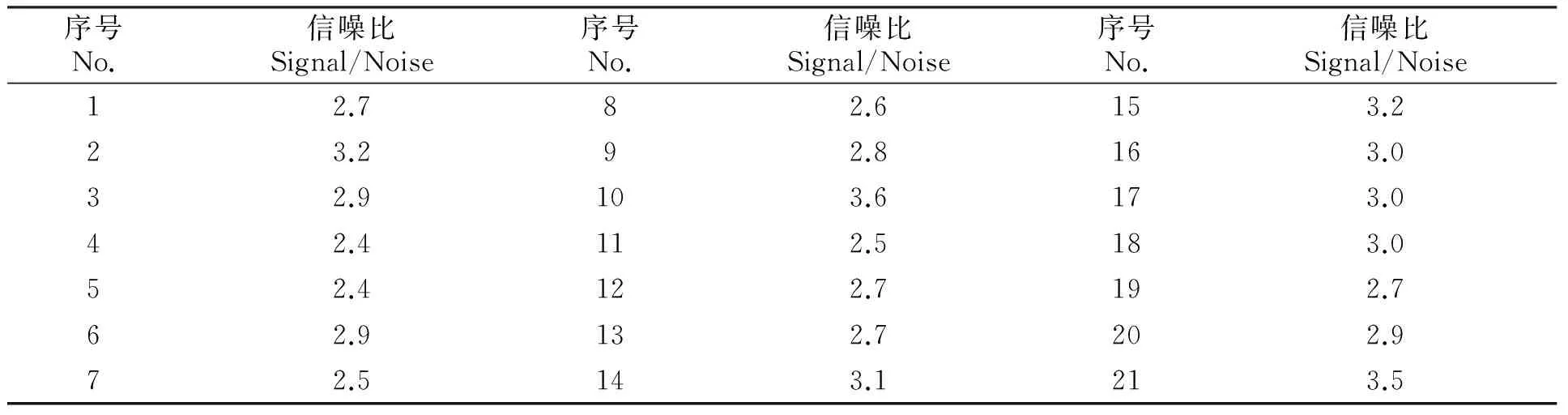
表4 信噪比
2.5样品质量引入的相对标准不确定度umrel
使用赛多利斯TE212-L电子天平(Ⅲ级天平,最大允许误差为±0.05 g),称量10.00 g样品。按照均匀分布计算得um=0.0289g,相对标准不确定度为umrel=0.0029,为B类评定。由样品称量引入的相对不确定度远小于0.006,可忽略不计。
2.6 测试过程随机效应导致的不确定度和回收率、精密度确证

表 5 样品试验结果
2.6.2 方法回收率和精密度
分别称取大黄鱼(Larimichthyscrocea)、鲤鱼(Cyprinuscarpio)、草鱼(Ctenopharyngodonidellus)、鲫鱼(Carassiusauratus)阴性样品各2份于离心管中,加标进行方法的精密度和回收率测定,结果见表6。 本方法在2个不同添加水平的平均回收率为82.7%,对应的平均相对标准偏差为4.7%。精密度和回收率均满足水产品中喹乙醇的测定要求。采用本方法对长春市流通市场及产地水产品的69份样品进行了测定,均未检出喹乙醇。
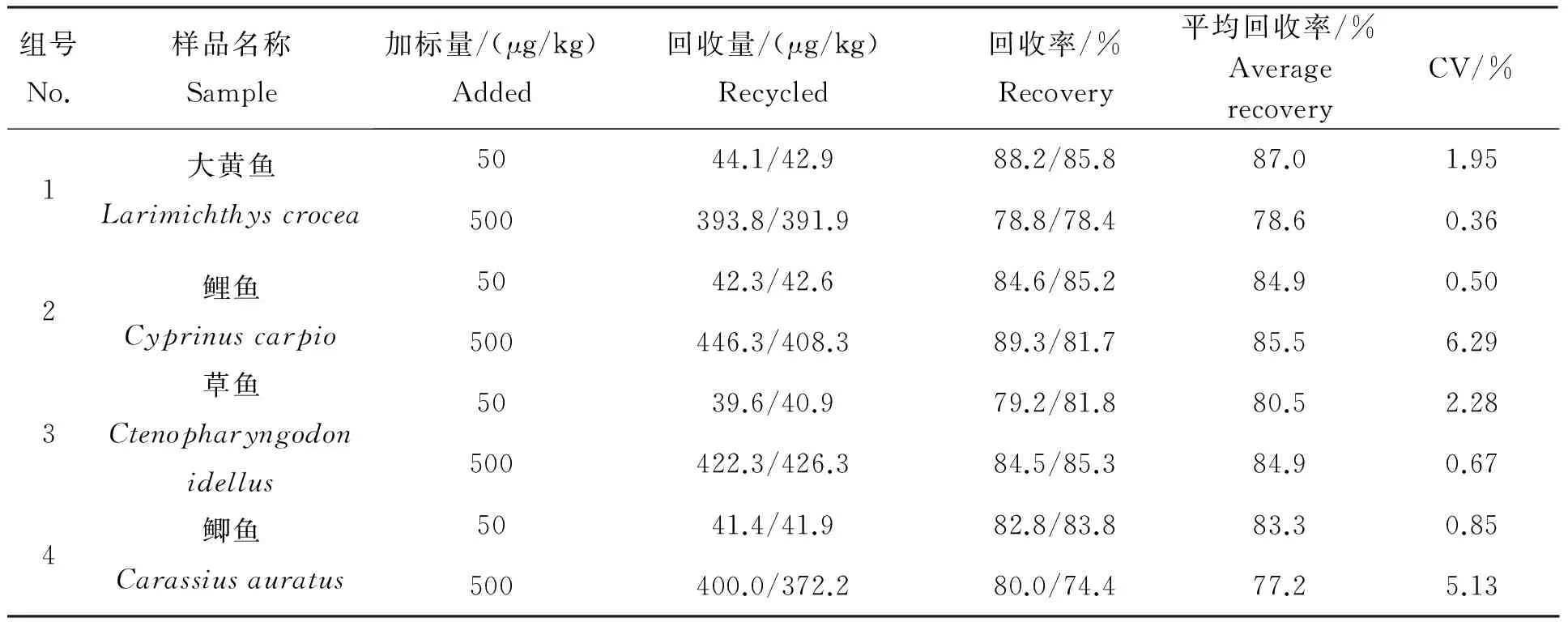
表 6 回收率和精密度试验结果
根据美国ASTMCS94制定的测试性能指标评价法评价本方法的精密度。据相关质量控制规范[35-36]及标准方法要求,查CV≤15%,则经计算r=0.124 1,Lsd=0.039 02,得TPIr=0.89,则当0.7 TPIr=Lsd/Sr (3) 2.8 由定容体积引起的相对标准不确定度uVrel 样品使用10 mL移液器加入20 mL水定容,计算过程同uVWrel。20℃时10 mL移液器容量允许误差为±0.6%,由环境温度变化引起溶剂体积改变极其微小,故不考虑。则由定容体积引起的相对不确定度合成为uVrel=0.004 9。该相对不确定度小于0.006,可忽略不计。 2.9由液相色谱仪引入的不确定度uuvwrel 由液相色谱仪引入的不确定度为B类评定:查仪器检定证书得整机定量重复性RSD6%=0.12,得uuvwrel=0.001 2。该部分引入的相对不确定度远小于0.006,在不确定度评定时可忽略不计。 2.10 合成不确定度及扩展 2.11测量结果报告 2.12各影响因素的不确定结果 各影响因素的不确定结果见表7。 表 7 各影响因素的不确定度结果 1)改进方法以水为提取剂,经硅藻土和正己烷净化后用反相高效液相色谱法测定水产品中喹乙醇,节省部分检测时间和有机试剂,高效便捷、安全环保。经验证,方法的线性范围、检出限、精密度、加标回收率等均满足水产品中喹乙醇的测定要求,检测结果准确可靠。 2)该方法不确定度评定模型的建立,对于不确定度评定和质量控制工作具有十分重要的指导意义。在评估过程中,对测量系统所需要的环境、仪器、试剂等因素的统计特性进行了分析,发现测量过程的随机效应、标准曲线拟合、样品回收率等因素对测量系统有显着的影响。日常进行不确定度评定时,可根据情况不考虑稀释标液时的温度、样品质量称量、定容体积及液相色谱仪等引入的不确定度。 3)通过对各不确定度分量的评估,进一步确证该测量系统的测定要求。因此建议在实际操作过程中全程注意避光,试验应使用纯度较高的喹乙醇标准物质(至少应大于83%);称量标准物质时应使用检定等级为I级的分析天平;溶液制备过程中应使用精度较高的A级器皿进行溶液的移取和定容;在检测过程中控制温度范围为12~28℃较为适宜;应增加平行样品的测定次数并根据预估值选择适当的工作曲线线性范围。 4)根据t检验判断平均回收率与1.0有显著性差异,检测结果必须经过修正;此外应不断熟悉样品处理过程以提高检测结果的准确性和可靠性且增加平行样的测定次数,尽量选择适当的工作曲线线性范围。 [1]Williams B J,Shively J E.In vitro antitreponemal activities of carbadox,virginiamycin,olaquindox,and tylosin as indices of their effectiveness for preventing swine dysentery[J].Veterinary Medicine and small Animal Clinician,1978,73:349-354. [2]Barber R S,Braude R,Hosking Z D,et al.Olaquindox as performance-promoting feed additive for growing pigs[J].Animal Feed Science and Technology,1979,4(2):117-123. [3]李敏,黄永强,李本旺,等.喹乙醇在渔业中应用的研究进展[J].水产科技,2010,(4):4-7. [4]谢麟.喹乙醇的安全性毒理学评价与合理应用[J].兽药与饲料添加剂,1999,2:25-27. [5]杨先乐,胡鲲,邱军强,等.喹乙醇在鱼体内蓄积及其对鱼类的影响[J].水生生物学报,2005,29(1):281-283. [6]郭霞,丁义,孙振中,等.水产品中喹乙醇及其主要代谢物残留的研究进展[J].中国动物检疫,2012,29(10):69-72. [7]De Vries H,Bojarski J,Donker A A,et al.Photochemical reactions of quindoxin,olaquindox,carbadox and cyadox with protein,indicating properties[J].Toxicology,1990,63(1):85-95. [8]Yoshimura H,Nakamura M ,Koeda T,et al.Mutagenicities of carbadox and olaquindox-Growth promoters for pigs[J].Mutation Research/genetic Toxicology,1981,90(1):49-55. [9]WHO.Evaluation of certain veterinary drug residues in food[S].WHO Technical Report Series 799,Geneva,1990:45-50. [10]WHO.Toxicological evaluation of certain veterinary drug residues in food[S].WHO FoodAdditive Series 27,Geneva,1991:141-173. [11]Hao L H,Chen Q,Xiao X L.Molecular mechanism of mutagenesis induced by olaquindox using a shuttle vector pSP189/mammalian cell system[J].Mutation Research,2006,599:21-25. [12]宋春美,侯玉泽,刘宣兵,等 .喹乙醇的危害及检测方法研究进展[J].河南农业科学 ,2009,12:13-17. [13]农业部发布动物性食品中兽药最高残留限量[J].中国兽药杂志,2003,37(3):5-11. [14]中华人民共和国农业部.SC/T 3019—2004 水产品中喹乙醇残留量的测定液相色谱法[S].北京:中国标准出版社,2004. [15]谢小华,周德山,宋向明,等.高效液相色谱法测定水产品中喹乙醇残留量[J].理化检验(化学分册),2011,47(1):102-103. [16]于慧娟,毕士川,黄冬梅,等 .高效液相色谱法测定水产品中喹乙醇的残留量[J].分析科学学报,2004,20(3):281-283. [17]艾晓辉,刘长征,文华 .鱼组织中喹乙醇残留量高效液相色谱检测方法研究[J].湖北农学院学报,2003,23(4):266-270. [18]田强兵,任惠丽,李锋刚,等 .固相萃取-高效液相色谱法测定水产品中喹乙醇[J].分析试验室,2015,34(3):356-358. [19]梅景良,吴聪明,程林丽,等 .HPLC法同步检测鲤鱼、对虾中喹乙醇与MQCA残留[J].海洋科学,2011,35(11):41-47. [20]吴宁鹏,王丽景,李慧素,等 .五种兽药中非法添加喹乙醇和乙酰甲喹的HPLC-PDA检测方法的建立[J].中国兽药杂志,2014,48(12):43-49. [21]曾静,朱宽正,王鹏,等.高效液相色谱-串联质谱法测定水产品中的喹乙醇[J].中国食品卫生杂志,2006,18(5):423-425. [22]钟仕花,郑雯,许远泉,等.超高效液相色谱-串联质谱法快速确证水产品中喹乙醇残留量[J].中国渔业质量与标准,2014,4(3):29-33. [23]刘学光,郑怀东,蔺翠翠,等 .液相色谱法测定草鱼中喹乙醇残留量的不确定度分析[J].农业与技术 ,2013,33(2):233-235. [24]张惠峰,綦天华.高效液相色谱法测定水产品中甲基睾酮残留量的不确定度评定[J].食品科学,2015,36(18):199-203. [25]郑怀东,刘学光,关丽,等.气相色谱法测定河蟹中多氯联苯残留量的不确定度分析[J].食品科学,2011,32(16):334-337. [26]刘海山,陈笑梅,李蕾蕾,等.液相色谱串联质谱法测定水产品中硝基呋喃类代谢物的不确定度评定[J].分析试验室,2009,28(增刊1):187-191. [27]国家质量监督检验检疫总局.JJF 1059—2012 测量不确定度评定与表示[S].北京:中国标准出版社,2012. [28]中国合格评定国家认可委员会.CNAS-GL05 测量不确定度要求的实施指南[S].北京:中国计量出版社社,2011. [29]中国合格评定国家认可委员会.CNAS-GL06 化学分析中不确定度的评估指南[S].北京:中国计量出版社社,2006. [30]国家质量监督检验检疫总局.JJF 1135—2005 化学分析测量不确定度评定[S].北京:中国计量出版社,2005. [31]国家质量监督检验检疫总局.JJG 1036—2008 电子天平检定规程[S].北京:中国计量出版社,2008. [32]国家质量监督检验检疫总局.JJG 196—2006 常用玻璃量器检定规程[S].北京:中国计量出版社,2006. [33]国家质量监督检验检疫总局.JJG 646—2006 移液器检定规程[S].北京:中国计量出版社,2006. [34]高若梅,刘鸿皋.检出限概念问题讨论-IUPAC及其它检出限定义的综合探讨和实验论证[J].分析化学,1993,(10):1332-1336. [35]中华人民共和国农业部.NY/T 1896-2010兽药残留实验室质量控制规范[S].北京:中国标准出版社,2010. [36]国家质量监督检验检疫总局.GB/T 27404 2008 实验室质量控制规范 食品理化检测[S].北京:中国标准出版社,2008. Evaluation of uncertainty was used to verify a new improved detection method on Olaquindox in aquatic products ZHANG Huifeng,YAN Xianchun,ZHEN Xin (Changchun Inspection Center for Aquatic Products Safety and Quality,Changchun 130033,China) An improved method was established for the detection of Olaquindox in aquatic products.An improved pre-treatment method was used in this study.The samples were extracted with hot water and separated by diatomite and n-Hexane,and the chromatographic parameters were optimized,so detection efficiency was raised significantly.The results showed that the average recoveries at two different samples and four different spiked levels was 77.2%~87.0%,the relative standard deviation of 0.4%~6.3%,the detection limit 10 μg/kg,the limit of quantification 30 μg/kg.A mathematical model of uncertainty evaluation was established.Reliability and test conditions were verified by uncertainty analysis and calculation.Relative uncertainty of this method was less than 8%,which was affected by random effect and calibration curve and recovery.This method is not only simple,sensitive and accurate,but also rapid and cost savings,so it is very suitable for the determination of Olaquindox in aquatic products.This study that uncertainty evaluation is used to verify the detection method is very important. Olaquindox;uncertainty;aquatic products;detection;verify 2016-05-27 长春市水产品质量安全风险评估专项(2014-1485). 张惠峰(1982-),女,助理研究员,硕士,主要从事水产品质量安全及水环境研究. E-mail:xiaoqiutong@126.com TS A 1006-5601(2016)03-0244-10 张惠峰,闫先春,甄昕.利用不确定度评定对改进后水产品中喹乙醇的检测方法进行确证研究[J].渔业研究,2016,38(3):244-253.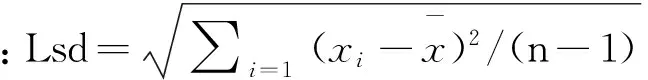
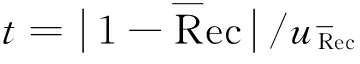
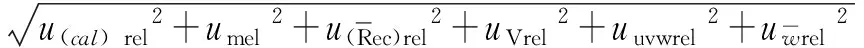
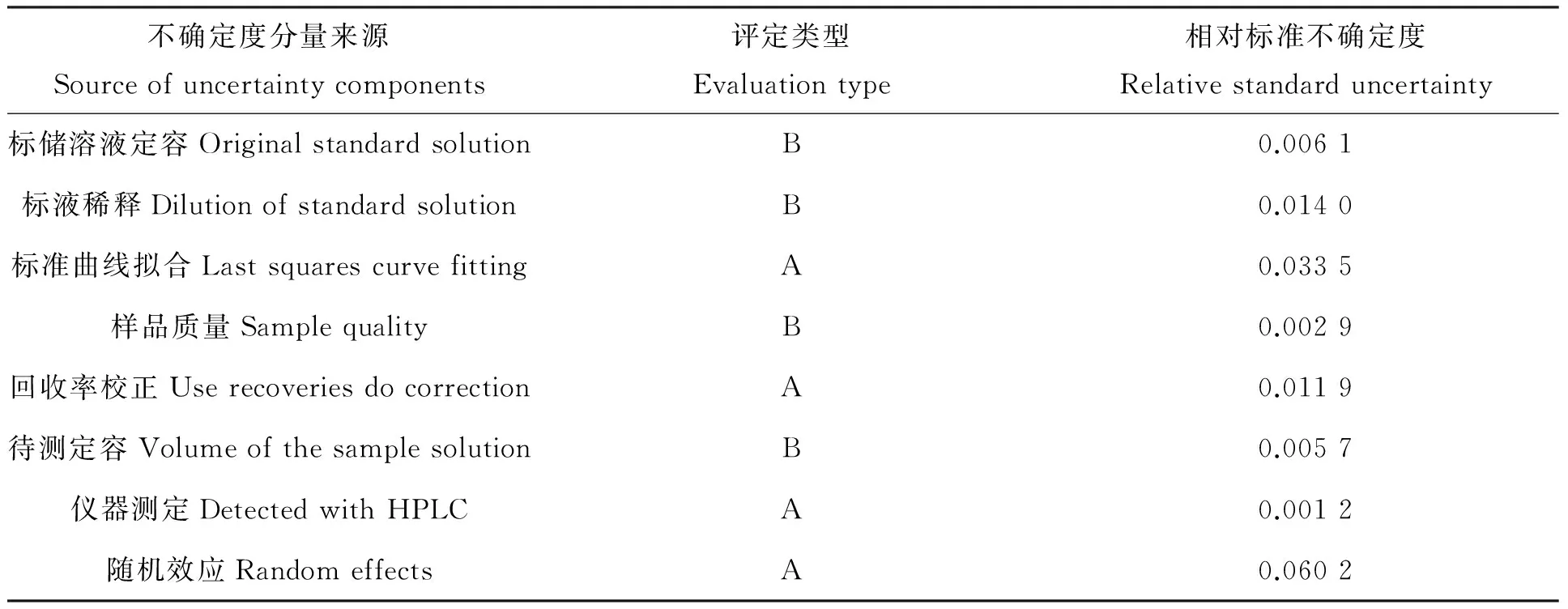
3 结论
