小麦生长素响应因子TaARF6转基因烟草植株分子鉴定
2016-08-24智一鸣刘晓曼
智一鸣, 陈 芳, 刘晓曼, 肖 凯
(河北农业大学农学院,河北保定 071001)
小麦生长素响应因子TaARF6转基因烟草植株分子鉴定
智一鸣, 陈 芳, 刘晓曼, 肖 凯*
(河北农业大学农学院,河北保定 071001)
【目的】生长素响应因子(ARF)在介导生长素信号传递和调控下游生长素响应基因的表达中发挥着重要功能。本文旨在以在富集丰磷特异表达基因的小麦根系cDNA差减文库中鉴定的1个ARF类别的家族成员TaARF6为基础,对该基因cDNA序列、分子特征、不同供磷水平下该基因在根、叶中表达模式及遗传转化TaARF6对丰磷和缺磷条件下植株形态的影响进行较全面研究,阐明该小麦生长素响应因子基因介导不同供磷水平下对植株生长特性的影响。【方法】采用生物信息学工具预测TaARF6编码蛋白特征; 采用溶液培养法培养丰、缺磷处理小麦幼苗,采用半定量RT-PCR技术鉴定TaARF6在丰、缺磷处理下的表达特征。采用DNA重组技术构建将TaARF6编码阅读框融合至表达载体中的表达质粒,利用农杆菌介导的遗传转化法建立超表达TaARF6转基因烟草植株。采用琼脂培养和溶液培养法,培养丰、缺磷不同供磷水平下野生型植株和转基因烟草植株,进而利用常规分析方法鉴定不同磷水平下植株长势、根系和茎叶生物量和植株根叶形态及性状。【结果】1)TaARF6编码生长素响应因子(ARF)型转录因子,编码蛋白中含有ARF家族成员具有的保守结构域。该基因在氨基酸水平上与源于短柄草BdARF6和源于水稻的OsARF6具有高度同源特征。表达分析表明,TaARF6在根、叶中均呈典型低磷下表达下调、复磷后表达再度回升模式,表明该基因表达受到外界供磷水平的调节。2)遗传转化结果表明,在正常生长和低磷逆境下,与野生型植株相比,转基因烟草株系幼苗和植株形态明显增大。3)丰、缺磷不同供磷水平下,与未转化的野生型(WT)对照植株相比,转基因系(Line3 和Line5)植株幼苗和植株根系、茎叶和单株鲜、干重均较野生型显著增加。此外,与WT相比,转基因系植株根系数量增多、主侧根长度、根体积、叶面积和根冠比增加。【结论】TaARF6编码典型的生长素响应因子,其编码蛋白具有生长素响应因子特有结构域。TaARF6对环境中的低磷胁迫逆境能产生明显应答。上调表达TaARF6基因,具有增加植株根、叶鲜、干重和改善根叶及植株形态的生物学功能。本研究表明,通过对植株体内生长素响应基因的转录调控,TaARF6在介导植株不同供磷水平下的根叶形态建成和干物质累积过程中发挥着重要作用。
小麦(Triticum aestivumL.); 生长素响应因子; 分子特征; 遗传转化; 根叶生长
genetictransformation;rootandleafgrowth
生长素是植物生长发育的重要激素类物质,生长素信号与植株顶端优势、根系侧根发生、维管组织分化等密切相关[1-2]。在分子水平上,部分特定转录因子被生长素活化后,进入细胞核启动下游生长素应答基因发生特异性表达。目前证实,与生长素信号转导相关的转录因子,可归属于早期应答和晚期响应两个类别。其中,早期应答生长素信号的转录因子基因,通过活化已编码蛋白或改变自身表达水平,快速激活下游生长素应答基因; 晚期响应转录因子基因则表现为对生长素呈长期响应的特点,能在较长时间内调控下游基因转录,维持生长素持续生理效应[3]。
生长素响应因子(auxinresponsefactor,ARF)基因在植株体内以家族形式存在,是植物种属中参与生长素信号传递的重要转录因子。研究表明,与生长素(AUX/IAA)活化蛋白互作、以钝化形式存在的ARFs,感受生长素信号后,因互作蛋白被泛素连接酶降解而转化为活化状态。活化后的ARFs进一步聚合成同源二聚体,与生长素信号早期应答基因启动子中生长素响应元件AuxRE(基序TGTCTC)特异互作,启动下游生长素响应基因转录[4-5]。在蛋白特征上,ARF转录因子通常在N-末端含有保守DNA结合域(DNA-bindingdomain,DBD),在蛋白中部含有转录激活区(AD)或抑制区(RD),在C-末端含有与Aux/IAAs结合蛋白类似的二聚体化保守域[6-7]。
近年来,在拟南芥和水稻中分别鉴定了23和25个归属于ARF转录因子的基因家族成员[8-9]。此外,不少学者对拟南芥和水稻ARF家族成员的表达特征和生物学功能进行了研究[10-14]。但迄今有关小麦种属中ARF家族成员鉴定、分子特征分析和功能研究尚少见报道。作者通过对前期构建的富集丰磷特异表达基因的根系cDAN差减文库测序和序列比对分析,发现了1个与短柄草ARF家族成员BdARF6高度同源的表达序列标签(EST)。本文以该EST为基础,对该EST对应基因(TaARF6)的分子特征、在丰、缺磷不同供磷水平下表达模式及该基因遗传转化对植株形态特征的影响进行了研究。旨在从ARF调控下游基因转录角度,深化对小麦应答生长素机理的认识,为今后小麦遗传改良提供理论依据。
1 材料与方法
1.1TaARF6序列的获得
笔者前期以小麦品种石新828为材料,构建了富集丰磷特异表达基因的根系cDNA差减抑制杂交(SSH)文库。通过对文库中部分克隆测序及序列比对分析,获得1个与短柄草生长素响应因子类转录因子基因BdARF6(B. distachyon,登录号XM_003575314)高度同源的表达序列标签(EST)。基于生长素响应因子在调控植株生长发育及逆境下细胞分裂中发挥着重要功能,作者对该EST对应基因在NCBI的GenBank中进行查找,获得了与该EST对应的全长cDNA(登录号AK334329)。经文献检索,有关该小麦基因分子特征和生物学功能尚未报道,本文将其命名为TaARF6。
1.2TaARF6的分子特征及与植物种属同源蛋白的多重比对分析
采用DNAStar软件,鉴定TaARF6编码氨基酸序列、编码蛋白分子量和等电点。以TaARF6蛋白序列为基础进行BLATx分析,获得该蛋白保守域及短柄草中同源蛋白BdARF6和水稻同源蛋白OsARF6序列。采用DNAStar软件中MegAlign多重比对工具,进行TaARF6与上述蛋白序列比对分析。1.3TaARF6在不同供磷水平下表达分析
参照Sun等[15]的方法,采用MS营养液培养小麦(cv.石新828)幼苗至三叶期。然后,将幼苗由正常生长[Pi1.2mol/L(正常含磷)]转移至将磷(Pi)降低至0.012mol/L的MS营养液中进行低磷胁迫处理。在处理后6、12和24h,收获根、叶样本,以处理前(0h)根、叶作对照,研究TaARF6在正常生长和低磷胁迫下的表达特征。此外,另将部分低磷处理24h后的幼苗再度转移至含有正常含磷量(Pi1.2mol/L)的MS营养液中进行恢复生长,在恢复后6、12和24h后收获根、叶样本,用于研究TaARF6对恢复正常供磷后的响应特征。
采用TRIzol试剂盒提取样本总RNA,用M-MLV反转录酶进行反转录获得cDNA产物。采用半定量RT-PCR,鉴定TaARF6在不同供磷水平下的表达特征,用于扩增供试基因的特异引物为5′-TCAACCGACTGCAGCGTTCGT(正向)和5′-TTAGAGGCCCTACATCAACAGC(反向)。以小麦组成型表达基因tubulin对TaARF6表达产物进行均一化,扩增tubulin引物为5′-GTTTGAGACCTTCAACACCCC(正向)和5′-GTGGCCATCTCTTGCTCGAAGTC(反向)。PCR扩增参照Guo等的方法[16]进行。1.4TaARF6表达载体构建及烟草遗传转化
以TaARF6cDNA克隆质粒为模板,扩增该基因编码阅读框,引物为5′-GTAGATCTGATGAATCTCTCGCCGTCCG(正向,引入BglII限制性切点)和5′-TTTGGTCACCTTCACGAACGCTGCAG(反向,引入BstEII切点),扩增产物用NcoI和BstEII双酶切后融合至双元表达载体pCAMBIA3301中。参照Sun等[15]的方法,采用农杆菌介导法遗传转化烟草(cv.Wisconsin38),获得超表达TaARF6转基因烟草植株。以获得的T1转基因系为材料,用TRIzol提取正常水培幼苗根系总RNA,利用M-MLV反转录酶进行反转录,以获得的反转录产物cDNA为模板,采用半定量RT-PCR技术,鉴定各转基因系中TaARF6的表达水平,其中,采用的引物为5′-GATGAATCTCTCGCCGTCCG(正向)和5′-TTCACGAACGCTGCAG(反向),以烟草组成型表达延伸因子1a(elongationfactor1a)基因NtEF1a(登录号D63396)作为检测各供试转基因系中TaARF6的内标,扩增该内标基因正向引物为5′-GCTCCCACTTCAGGATGTGTA,反向引物为5′-ACACGACCAACAGGGACAGT。
1.5正常生长及低磷处理后转基因烟草的根叶鲜、干重及形态测定
将获得的7个遗传转化TaARF6的烟草株系在生长室内繁殖至T3代,以2个具有较高TaARF6表达的转基因株系(Line3和Line5)和野生型(WT)植株为材料,在含有正常供磷(Pi1.2mol/L)和低磷(Pi0.05mol/L)琼脂培养基上斜面培养幼苗,研究不同供磷水平下转基因株系幼苗根叶鲜、干重及根系数量、 根长、 叶面积、 根冠比。在丰、缺磷条件下, 各供试材料幼苗的培养时间分别为10和15d。此外,采用含有上述丰、缺磷含量的MS营养液水培各供试材料植株,研究不同供磷水平下成株期根叶鲜、干重,根系体积,叶面积和根冠比特征。在丰、缺磷条件下各供试材料植株培养的时间分别为3和4周。溶液培养期间,每3d更换一次营养液,微型气泵供气。
处理完成后,对正常培养和低磷处理后幼苗和植株进行形态观察并照相记录。采用常规法测定幼苗和植株根叶鲜、干重,通过对根叶鲜、干重分别求和获得单株鲜、干重,通过将根系干重与茎叶干重比值计算根冠比。此外,查数10株幼苗根数,获得琼脂培养条件下单株根数,用直尺量取各条根长求和后得到幼苗根长。用叶面积仪测定5株叶面积,求和获得单株叶面积值。采用排水法测定溶液培养植株根系体积,测定样本为5株。同样采用叶面积仪测定上述植株的单株叶面积。上述各性状测定均进行3次重复。
1.6数据处理
采用统计学分析软件SAS(SPSS13.0),对不同处理野生型及转基因植株根系、茎叶和单株鲜、干重、根数、根长、根体积、根冠比和叶面积进行显著性测定和标准差分析。
2 结果与分析
2.1TaARF6的分子特征
TaARF6cDNA全长为3655bp,开放阅读框2328bp,编码775 个氨基酸(aa)。该基因编码蛋白分子量为85.58kD,等电点(pI)为6.20。在N-端aa1至aa125区间,含有1个DNA结合区; 在aa129至aa235区间,含有1个保守B3_DNA区; 在aa258至aa347区间,含有1个保守生长素响应区。上述特征表明,TaARF6是小麦生长素响应因子(ARF)家族中的重要成员。
通过BLAST工具进行同源查找,获得了与TaARF6高度同源源于短柄草的ARF成员BdARF6和源于水稻的ARF成员OsARF6。多重比对分析表明,在氨基酸水平上,TaARF6与BdARF6和OsARF6具有较高同源性(一致性分别为87.4%和81.5%)(图1)。表明TaARF6在植株体内可能执行与OsARF6与BdARF6类似的生物学功能。
2.2TaARF6在不同供磷水平下的表达特征
采用半定量RT-PCR技术,检测了小麦根、叶中TaARF6在不同供磷水平下的表达特征。结果表明,TaARF6在根、叶中的表达特征相似,表现为在正常生长(0h)条件下,该基因在根、叶中均呈较高水平表达; 低磷处理后,该基因表达下调,呈随着低磷处理时间延长其表达水平也随之不断降低的特征; 将低磷处理24h后植株再度转入至正常供磷水平进行恢复生长后,该基因在根、叶中的表达再度上调,且随恢复进程表达水平不断增高(图2)。表明TaARF6通过对环境中磷(Pi)水平产生明显应答,在介导植株应答环境中供磷水平中可能发挥着重要作用。

图1 TaARF6与短柄草BdARF6及水稻OsARF6的多重比对结果Fig.1 The alignment results among TaARF6, BdARF6 and OsARF6

图2 TaARF6在不同供磷水平下的表达模式Fig. 2 The expression patterns of TaARF6 under various Pi-supply conditions
[注(Note): 0h代表低磷处理前正常供磷水平0hrepresentsthenormalPlevelbeforethePi-deficienttreatment; 6h、12h和24h表示低磷处理后时间6h, 12hand24hstandforthetimepointsafterthePi-deficienttreatment;R6h、R12h和R24h表示低磷处理24h再度恢复至正常供磷后的时间R6h,R12handR24hstandforthetimepointsunderarecoveryPitreatmentaftera24hofPi-deficienttreatment.]
2.3遗传转化TaARF6转基因烟草植株分子鉴定
采用DNA重组技术,构建了将TaARF6编码阅读框融合至双元表达载体pCAMBIA3301中的表达质粒,其表达框示意图如图3A所示。采用农杆菌介导烟草叶圆盘转化法,建立了遗传转化TaARF6的转基因烟草植株。对各转基因系中TaARF6的表达水平分析表明,在7个转基因系中,TaARF6的表达程度不同,以转基因系4较高,转基因系3、5、2和6次之,转基因系1和7较低(图3B)。此外,在野生型(WT)植株中也检测到TaARF6同源片段(图3B),表明烟草中存在着TaARF6同源基因。
2.4过表达TaARF6转基因烟草在两种磷处理下的形态特征
采用不同含磷水平(正常供磷,Pi1.2mol/L和低磷处理,Pi0.05mol/L)琼脂斜面培养转基因系Line3和Line5及野生型(WT)植株,各转基因系和WT在不同供磷处理后的幼苗形态如图4A所示。结果表明,在正常供磷水平和低磷处理条件下,与WT相比,转基因系Line3和Line5的幼苗长势均明显增强,根系和茎叶形态呈不同程度增大特征。采用与上述相同含磷水平的丰磷和低磷MS营养液对上述转基因系及WT进行溶液培养处理,各供试材料植株根、叶形态特征结果与上述琼脂培养幼苗的结果相似(图4B)。
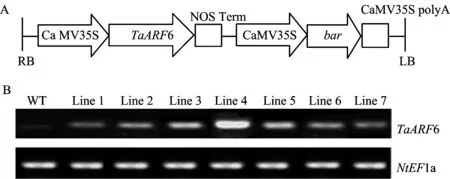
图3 融合TaARF6表达框示意图及烟草转基因系中TaARF6表达水平鉴定Fig.3 The diagram of expression cassette integrated TaARF6 and the TaARF6 expression levels in the transgenic tobacco plants
[注(Note):A-融合TaARF6表达框示意图DiagramoftheexpressioncassetteintegratedTaARF6;B-烟草转基因系中TaARF6表达水平ExpressionlevelsofTaARF6inthetobaccotransgeniclines.WT为野生型WTstandsforthewildtype;Line1至Line7为遗传转化TaARF6的烟草转基因系Line1toLine7meanthetransgeniclinesintegratedTaARF6.]
2.5过表达TaARF6转基因烟草在两种磷处理下的根叶干重、根系形态、叶面积和根冠比
对不同磷水平下琼脂培养和溶液水培TaARF6转基因系(Line3和Line5)及WT根系、茎叶和单株干重进行了测定。结果表明,与前已述及的植株形态相似,在两种供磷水平下,与WT相比,转基因系Line3和Line5的根系、茎叶和单株鲜、干重均显著增加(图5、 图6)。上述结果表明,遗传转化TaARF6具有促进植株各器官生长和增加植株鲜、干重功能。转基因系植株在低磷逆境下较对照植株表现出明显改善的植株形态和较高根叶鲜、干重,表明TaARF6具有增强植株抵御低磷逆境的能力。这可能与其增强植株应答生长素能力和由此诱导生长素响应基因表达进而促进细胞分裂有关。
进一步对正常生长和低磷处理下琼脂培养和溶液水培的TaARF6转基因系和WT根系形态和单株叶面积进行了测定。结果显示,在琼脂培养条件下,与WT相比,转基因系Line3和Line5在不同磷水平下的幼苗根数、根长、叶面积和根冠比均显著增加。

图4 过表达TaARF6转基基烟草和野生型植株在正常生长及低磷处理下的植株形态特征Fig.4 The phenotypic features in plants of overexpressing TaARF6 and wild type under the conditions of normal growth and Pi deprivation
[注(Note):A-琼脂培养Culturedbyagarmedium;B-溶液培养Culturedbyhydroponicsolution.A中,正常培养下幼苗培养时间为10d,低磷处理下幼苗培养时间为15dInA,theculturetimeswere10dand15dunderthenormalconditionandPi-deprivation,respectively.B中,正常培养下幼苗培养时间为3周,低磷处理下幼苗培养时间为4周InB,theculturetimeswerethreeweeksandfourweeksunderthenormalconditionandPi-deprivation,respectively.WT为野生型WTstandsforthewildtype;Line3和Line5为遗传转化TaARF6的烟草转基因系Line3andLine5meanthetransgeniclinesintegratedTaARF6.]
同样,在溶液培养条件下,转基因系Line3和Line5的根体积、叶面积和根冠比在两种磷水平下也均较对照(WT)显著增加(表1)。上述结果与遗传转化TaARF6具有显著提高不同磷水平下幼苗和植株根叶鲜、干重的结果相一致。
3 讨论
生长素响应因子(ARF)是生长素信号早期应答成员,在介导植株对生长素的早期应答中发挥重要生物学功能。研究表明, 在响应生长素的三种重要顺式调控元件TGA保守元件(AACGAC)、生长素响应保守盒AuxRR(GGTCCAT)和生长素响应元件AuxRE(TGTCTC)中,ARFs能与AuxRE特异性互作,启动下游生长素响应基因表达[4-5, 17-18]。本研究对小麦TaARF6的研究表明,该基因编码蛋白含有植物种属中ARF家族成员通常含有的保守元件,如保守DNA互作区及生长素响应区。因此,TaARF6编码蛋白在介导生长素信号转导中可能行使着重要功能。
前人对植物种属ARF家族基因的表达分析发现,该家族中多数成员呈组成型表达特征,在多种组织和器官中均有表达[8, 19]。但该家族部分成员也呈典型的组织及器官特异性表达特征。如位于拟南芥第一对染色体上的ARF基因,呈胚性细胞和发育籽粒特异表达[8]。近年来研究还发现,部分ARF家族成员作为特定小分子RNA(microRNAs)作用靶基因,其表达在较大程度上受到与其作用microRNAs的转录后调控,其转录本因miRNAs表达水平改变而发生相应变化[20-21]。例如,对拟南芥miR160的作用靶基因研究发现,该小分子RNA作用靶基因中含有3个ARF家族成员,分别为ARF10、ARF16和ARF17[20]。上述ARF基因在转录后水平上受到miR160的调节后,进一步参与植株形态及生长素部分响应基因的调控[20]。本研究对TaARF6的表达研究发现,正常生长条件下,该基因在根叶中均有较高转录本丰度,低磷处理下,该基因表达水平下调; 将低磷逆境恢复正常供磷水平后,该基因表达水平再度回升。表明TaARF6的表达受到环境中磷(Pi)供应水平的调控。本课题组前期研究发现,TaARF6是小麦microRNA家族成员TaMIR167作用靶基因之一,而TaMIR167表达受到低磷逆境的诱导[21]。因此,TaARF6在表达水平上对环境中供磷水平的应答,可能是与其作用小分子RNA家族成员TaMIR167对低磷逆境上调应答后,进一步对该靶基因进行转录后的调控所致。因此,TaARF6可能与TaMIR167构成特定的小分子/靶基因作用模块,参与植株对低磷逆境的响应过程。
ARFs成员广泛参与植株生长发育的调节。研究表明,拟南芥AtARF3的突变体植株,下胚轴对生长素诱导的蓝光响应变为迟钝,在生长特征上表现为对生长素响应不敏感的特点[10],AtARF5与维管束和胚轴性建成有关[11],AtARF2参与生长素诱导的幼苗下胚轴弯曲过程[12],AtARF8则对生长素调控的幼苗下胚轴伸长和细胞内生长素的内稳态产生重要影响[13]。对水稻ARF家族成员OsARF1的表达进行干涉后,植株生长变为缓慢,活力变差,叶片呈卷曲性改变,育性降低[14]。本研究对遗传转化TaARF6的烟草植株研究发现,在正常生长和低磷胁迫条件下,与野生型植株相比,转基因植株的长势和植株形态得到明显改善,表现为根系数量、主侧根长度、根体积、叶面积、根冠比以及根系、茎叶和单株鲜、干重显著增加。因此,TaARF6具有增强不同供磷水平下植株生长的能力,这可能与增强TaARF6表达后,植株体内生长素响应基因表达水平上调、 进而促进植物组织细胞的分裂有关。本研究发现,TaARF6能显著改善植株在低磷逆境下生长、根系形态建成及干物质累积,表明该基因在介导植株抵御低磷逆境中发挥着重要作用。因此,该基因在小麦抵御低磷能力鉴定和评价及创制新型耐低磷种质中可能具有重要实践价值。有关TaARF6调控的下游基因及调节不同供磷水平下植株生长的分子机理有待进一步探讨。

图5 琼脂培养下正常和低磷处理转基因株系和野生型植株的鲜、 干重Fig.5 Fresh and dry weights of the TaARF6-overexpressing and wild type plants under the conditions of normal growth and Pi deprivation cultured by agar medium
[注(Note): 正常培养下幼苗培养时间为10d,低磷处理下幼苗培养时间为15dTheculturetimeswere10dand15dunderthenormalconditionandPi-deprivation,respectively. 正常培养和低磷处理结果的显著性测定分析分别进行ThestatisticalsignificanceanalysisofdataobtainedunderthenormalgrowthconditionandthePi-deficientconditionwasseparatelyperformed. *表示同一供磷水平下与野生型对照的差异达到0.05显著性水平Standsfortobesignificantdifferencewithcontrol(wildtype)atthe0.05statisticallevelunderthesamePi-supplycondition.]

图6 溶液培养下正常生长和低磷处理TaARF6转基因株系和野生型植株的鲜、 干重Fig.6 Fresh and dry weights of the TaARF6-overexpressing and wild type plants under the conditions of normal growth and Pi deprivation cultured by hydroponic solution
[注(Note): 正常培养下幼苗培养时间为3周,低磷处理下幼苗培养时间为4周TheculturetimeswerethreeweeksandfourweeksunderthenormalconditionandPi-deprivation,respectively. 正常培养和低磷处理结果的显著性测定分析分别进行ThestatisticalsignificanceanalysisofdataobtainedunderthenormalgrowthconditionandthePi-deficientconditionwasseparatelyperformed. *表示同一供磷水平下与野生型对照的差异达到0.05显著性水平Standsfortobesignificantdifferencewithcontrol(wildtype)atthe0.05statisticallevelunderthesamePi-supplycondition.]

[1]XingH,PudakeRN,GuoG, et al.Genome-wideidentificationandexpressionprofilingofauxinresponsefactor(ARF)genefamilyinmaize[J].BMCGenomics, 2011, 12: 178.
[2]DaviesPJ.Theplanthormones:theirnature,occurrenceandfunctions[A].DaviesPJ.PlantHormones:physiology,biochemistryandmolecularbiology[M].Dordrecht,TheNetherlands:KluwerAcademicPublishers, 1995.
[3]AbelS,TheologisA.Earlygenesandauxinaction[J].PlantPhysiology, 1996, 111: 9-17.
[4]UlmasovT,LiuZB,HagenG,GuilfoyleTJ.Compositestructureofauxinresponseelements[J].PlantCell, 1995, 7: 1611-1623.
[5]SakaiT,TakahashiY,NagataT.Analysisofthepromoteroftheauxin-induciblegene,parC,ofTobacco[J].PlantCellPhysiology, 1996, 37: 906-913.
[6]UlmasovT,MurfettJ,HagenG,GuilfoyleTJ.Aux/IAAproteinsrepressexpressionofreportergenescontainingnaturalandhighlyactivesyntheticauxinresponseelements[J].PlantCell, 1997, 9: 1963-1971.
[7]UlmasovT,HagenG,GuilfoyleTJ.DimerizationandDNAbin-
dingofauxinresponsefactors[J].PlantJournal, 1999, 19: 309-319.
[8]OkushimaY,OvervoordePJ,ArimaK, et al.FunctionalgenomicanalysisoftheAUXINRESPONSEFACTORgenefamilymembersinArabidopsisthaliana:uniqueandoverlappingfunctionsofARF7andARF19 [J].PlantCell, 2005, 17: 444-463.
[9]WangD,PeiK,FuY, et al.Genome-wideanalysisoftheauxinresponsefactors(ARF)genefamilyinrice(Oryza sativa) [J].Gene, 2007, 394: 13-24.
[10]WatahikiMK,YamamotoKT.Themassugu1mutationofArabi-
dopsisidentifiedwithfailureofauxin-inducedgrowthcurvatureofhypocotylsconfersauxininsensitivitytohypocotylandleaf[J].PlantPhysiology, 1997, 115: 419-426.
[11]HardtkeCS,BerlethT.TheArabidopsisgeneMONOPTEROUSencodesatranscriptionfactormediatingembryoaxisformationandvasculardevelopment[J].TheEMBOJournal, 1998, 17: 1405-1411.
[12]EllisCM,NagpalP,YoungJC, et al.AUXINRESPONSEFACTOR1andAUXINRESPONSEFACTOR2regulatesenescenceandfloralorganabscissioninArabidopsis thaliana [J].Development, 2005, 132: 4563-4574.
[13]GoetzM,Vivian-SmithA,JohnsonSD,KoltunowAM.AUXINRESPONSEFACTOR8isanegativeregulatoroffruitinitiationinArabidopsis[J].PlantCell, 2006, 18: 1873-1886.
[14]AttiaKA,AbdelkhalikAF,AmmarMHet al.AntisensephenotypesrevealafunctionalexpressionofOsARF1,anauxinresponsefactor,intransgenicrice[J].CurrentIssuesinMolecularBiology, 2009, 11: 129-134.
[15]SunZ,DingC,LiX,XiaoK.MolecularcharacterizationandexpressionanalysisofTaZFP15,aC2H2-typezincfingertranscriptionfactorgeneinwheat(Triticum aestivum L.)[J].JournalofIntegrativeAgriculture, 2012, 11: 31-42.
[16]GuoC,ZhaoX,LiuX,et al.FunctionofwheatphosphatetransportergeneTaPHT2; 1inPitranslocationandplantgrowthregulationunderrepleteandlimitedPisupplyconditions[J].Planta, 2013, 237(4): 1163-1178.
[17]NagaoRT,GoekjianVH,HongJC,KeyJL.Identificationofprotein-bindingDNAsequencesinanauxin-regulatedgeneofsoybean[J].PlantMolecularBiology, 1993, 21: 1147-1162.
[18]PastugliaM,RobyD,DumasC,CockJM.RapidinductionbywoundingandbacterialinfectionofanSgenefamilyreceptor-likekinasegeneinBrassica oleracea[J].PlantCell, 1997, 9: 49-60.
[19]HagenG,GuilfoyleT.Auxin-responsivegeneexpression:genes,promotersandregulatoryfactors[J].PlantMolecularBiology, 2002, 49: 373-385.
[20]MalloryAC,BartelDP,BartelB.MicroRNA-directedregulat-
ionofArabidopsisAUXINRESPONSEFACTOR17isessentialforproperdevelopmentandmodulatesexpressionofearlyauxinresponsegenes[J].PlantCell, 2005, 17: 1360-1375.
[21]ZhaoX,LiuX,GuoC, et al.IdentificationandcharacterizationofmicroRNAsfromwheat(Triticum aestivumL.)underphosphorusdeprivation[J].JournalofPlantBiochemistryandBiotechnology, 2013, 22(1): 113-123.
Regulationeffectsofanauxinresponsegeneinwheat(TaARF6)inmediatingplantgrowthunderconditionsofnormalgrowthandPideprivation
ZHIYi-ming,CHENFang,LIUXiao-man,XIAOKai*
(College of Agronomy, Agricultural University of Hebei, Baoding, Hebei 071001, China)
【Objectives】Auxinresponsefactors(ARFs)playacriticalroleinmediatingtransductionofauxinsignalingandregulatingexpressionofdownstreamauxin-responsivegenes.Inthisstudy,anARFtypetranscriptionfactorgenereferredtoTaARF6identifiedinarootsuppressionsubtractivecDNAlibrarythatenrichesthedifferentiallyexpressedgenesunderPisufficiencyasthebasiswasusedtoinvestigatemolecularcharacterizationofTaARF6anditsexpressionpatternsundervariousPi-supplyconditions,aswellasitsfunctionsinregulatingplantphenotypes.TheobjectiveofthisstudywasaimedtoelucidatebiologicalrolesofTaARF6inmediatingplantgrowthfeaturesundertheconditionsofPisufficiencyandPideficiency. 【Methods】TheproteincharacterizationofTaARF6waspredictedbythebioinformatics’tools.Theseedlingsofwheat(cv.Shixin828)wereculturedunderthesufficient-anddeficient-PiconditionsbyahydroponicapproachandusedtoinvestigatetheexpressionpatternsofTaARF6basedonsemi-quantitativeRT-PCR.ADNArecombinanttechniquewasadoptedtoconstructtheexpressioncassetteintegratingtheTaARF6openreadingframe.ThetransgenictobaccoplantsoverexpressingTaARF6weregeneratedbasedonagenetictransformationapproachmediatedbyAgobacterium-tumefaciensusingtheleafdiscsasexplants.Basedontheculturemethodsofagarmediumandhydroponicsolution,theseedlingsandplantsofthetransgenicLine3andLine5aswellaswildtype(WT)wereculturedtodeterminethegrowthfeaturesandtoassaythefreshanddryweightsofrootsandabovegroundtissuesundertheconditionsofPisufficiencyandPideficiency.【Results】 1) TaARF6encodesatranscriptionfactorcategoriedintoauxinresponsefactorfamilyandsharestheconserveddomainsofARFproteinsinplants,suchastheDNAbindingdomainandtheauxinresponsedomain.ItsharesahighidentitytoBdARF6andOsARF6,twoARFfamilymembersinB. distachyonandrice,respectively,attheaminoacidlevel.TheexpressionanalysisrevealsthatTaARF6issignificantlydown-regulatedbyPideprivationinrootsandleaves,anditsexpressionintheabovetissuesisrestoredbyarecoverytreatmentinitiatedbyretransferringthePi-deprivedplantstonormal-Picondition. 2)Comparedwiththewildtype,thetobaccoseedlingsandplantsoverexpressingTaARF6areimprovedunderbothPisufficiencyandPideficiencyconditions. 3)Comparedwiththewildtype,thefreshanddryweightsinroots,stemsandleaves,andinthewholeplantofthetobaccoseedlingsandplantswithoverexpressionofTaARF6areincreasedundertheconditionsofbothnormalgrowthandPideprivation,andthelateralrootnumbers,lengthsoftheprimaryandlateralroots,rootvolume,leafareasandtheratiosofrootweighttoabovegroundtissueweightarealsoincreased.【Conclusions】OurresultsinthisstudyconfirmthatTaARF6encodesatypicalauxinresponsefactor,anditsencodedproteincontainsdistinctdomainsgenerallysituatedinARFs. TaARF6issignificantlyresponsivetoexternalPilevels.OverexpressionofTaARF6canimproveplantgrowthfeatures,freshanddryweightsundertheconditionsofnormalgrowthandPideprivation.Together,ourinvestigationinthisstudysuggeststhatTaARF6playscriticalrolesinmediatingplantgrowthanddrymassproductionundervariousPi-supplyconditions,whichispossiblyfinishedthroughitstranscriptionalregulatingexpressionofthedownstreamauxin-responsivegenes.
wheat(Triticum aestivumL.);auxinresponsefactor(ARF);molecularcharacterization;
2014-11-13接受日期: 2015-01-15网络出版日期: 2015-07-17
国家自然科学基金(31201674); 河北省自然科学基金(C2013204146)资助。
智一鸣(1988—),女,河北高邑人,硕士研究生,主要从事作物营养生理和分子生物学研究。E-mail:zhiyiming2011@163.com
E-mail:xiaokai@hebau.edu.cn
S512.1.01;Q954.78
A
1008-505X(2016)01-0085-09
