不同种植密度下丛枝菌根真菌对玉米磷吸收的影响
2016-08-24张晓飞姚国庆朱文东肖京京
张晓飞, 李 伟, 杨 珊, 姚国庆, 朱文东, 肖京京,郑 婷, 曹 宁*, 冯 固
(1吉林大学植物科学学院,吉林长春 130062;2生物多样性与有机农业北京市重点实验室,中国农业大学资源与环境学院,北京 100193)
不同种植密度下丛枝菌根真菌对玉米磷吸收的影响
张晓飞1, 李 伟1, 杨 珊1, 姚国庆1, 朱文东1, 肖京京1,郑 婷1, 曹 宁1*, 冯 固2
(1吉林大学植物科学学院,吉林长春 130062;2生物多样性与有机农业北京市重点实验室,中国农业大学资源与环境学院,北京 100193)
【目的】利用土著丛枝菌根真菌(arbuscularmycorrhizalfungi,AM真菌)与作物形成互惠互利的共生关系提高作物对土壤磷的利用效率是解决农业生产中磷供需矛盾的主要途径之一,本研究在大田玉米不同种植密度条件下,研究AM真菌对玉米根系的侵染及磷吸收作用,为揭示集约化玉米高效获取磷的机理提供理论依据。【方法】以大田作物玉米的两种种植密度(5×104plants/hm2和9×104plants/hm2)体系为研究对象,在田间原位埋设PVC管装置,通过测定菌丝生长室中的菌丝密度和有效磷耗竭来确定不同种植密度体系条件下AM真菌对玉米磷吸收的作用。【结果】相对于低密度种植群体,高密度群体显著降低了玉米拔节期土壤有效磷的耗竭量,同时增加了玉米地上部的磷含量,即磷吸收效率,增幅达20%; 在玉米拔节期,增加种植密度使根际的根外菌丝生物量(菌丝密度)降低了4%,而非根际土壤中的根外菌丝生物量(菌丝密度)增加了37%; 高密度玉米种植密度群体中AM真菌的根外菌丝对土壤有效磷耗竭的贡献增加了22%。【结论】集约化玉米生产中土著AM真菌依然帮助植株从土壤中吸收有效磷; 高密度体系下玉米对磷的吸收更加依赖于AM真菌。高密度种植增加AM真菌对玉米的侵染、 根外菌丝量和对土壤有效磷的吸收。
玉米; 有效磷; 丛枝菌根真菌; 种植密度
磷是不可再生资源,我国是世界上磷肥最大的消费国[1],但磷肥的当季利用率很低,导致了土壤磷的累积,既造成磷资源的浪费又严重威胁环境质量[2-3]。因此,提高土壤磷高效吸收利用的根际过程成为植物营养学的研究热点之一。
根际微生物能够溶解和矿化土壤中的难溶性无机态或有机态的磷酸盐[4],进而提高作物对磷素的吸收利用[5]。其中,丛枝菌根真菌(arbuscularmycorrhizalfungi,以下简称为AM真菌)可与作物根系建立共生关系[6],接种AM真菌可以显著改善玉米的养分吸收状况,提高根系活力和吸收能力,促进玉米根系生长,提高玉米根内生长素含量,使玉米增产[7-9]。
种植密度决定着农田的群体大小和作物产量,对作物根系的形态特征有显著的影响[10]。高密度玉米(密度大于7×104plants/hm2)生产模式在我国东北主产区普遍推广,可显著提高玉米单产。高密度栽培也显著改变了地下根系的群体特征,使根密度和根系总生物量增加[10]。然而,根系形态特性的改变是否影响AM真菌的侵染以及其对玉米磷营养是否有贡献等方面的研究报道甚少。本试验选取两个玉米种植密度体系,探讨了不同种植密度条件下玉米根际过程差异及田间原位条件下根际AM真菌侵染及对土壤磷吸收的影响,为揭示集约化玉米高效获取磷的机理提供理论依据。
1 材料与方法
1.1试验地概况

1.2试验设计
供试土壤为黑土,有效磷含量35.04mg/kg。使用前土壤经高压蒸汽灭菌处理(压力101.3kPa,温度135℃,灭菌2h)。玉米品种为郑单958。种植密度分别为5×104plant/hm2(50K)和9×104plant/hm2(90K)。小区面积为84m2。
原位条件下根际AM真菌变化情况采用田间埋放PVC管装置的方法进行研究。
PVC管装置: 所用PVC管装置的规格为直径10cm,长度6.5cm,PVC管两端各有1cm缓冲区。任意一端用孔径为30μm的尼龙网封住,然后用灭菌的土壤填装,每个装置约500g土壤,填装完成后,再将PVC管的另一端也用孔径为30μm的尼龙网封住,以阻止玉米根系进入PVC管装置,但不影响土壤中AM真菌菌丝的进入。
田间埋设PVC管装置: 玉米出苗后30d后,生长至拔节期(7月6日)时,在两个试验小区中,随机各选取一株长势一致的玉米植株,在其一侧(行间)距地上部基部15cm处挖深度为25cm坑,埋设PVC管装置。在玉米乳熟期(9月1日)收获PVC管装置。埋设PVC管装置如图1所示。
1.3样品采集

在玉米乳熟期,将埋设在田间的PVC管装置收获,舍弃PVC管装置两端的1cm缓冲区,收集装置内土壤并风干。一部分用作菌丝密度的测定,另一部分经粉碎过1mm筛后用于土壤Olsen-P含量的测定。
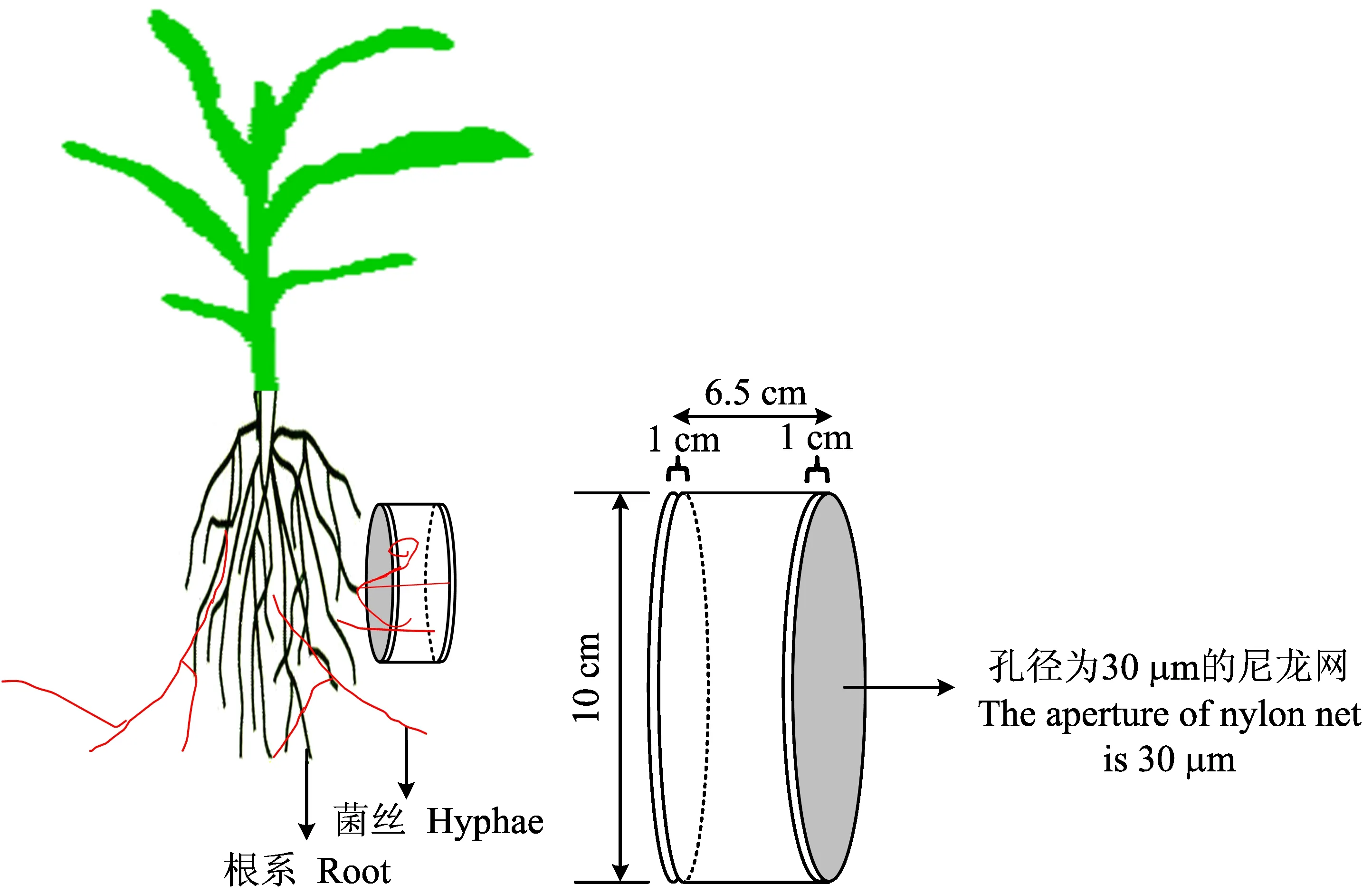
图1 PVC管装置及田间处理示意图Fig.1 The schematic diagram of the PVC device and treatments in field
1.4测定项目和方法
土壤Olsen-P含量用0.5mol/LNaHCO3浸提,钼锑抗比色法测定[12]。在本试验条件下,填装在PVC管装置的供试土壤的Olsen-P含量为35.04mg/kg,作为PVC管装置中土壤Olsen-P含量的初始值。乳熟期收获PVC管装置后测定其土壤Olsen-P含量。PVC管装置中土壤Olsen-P含量的耗竭量用该装置中初始土壤Olsen-P含量与收获后土壤Olsen-P含量之差表示。
菌丝密度的测定采用Jakobsen等[13]的真空泵微孔滤膜抽滤方法。
根系侵染率的测定: 取鲜根系,切成1cm左右的根段,依次经过透明、 酸化、 染色、 脱色,然后选取30条根段,制片,镜检。根据根段中菌根侵染强度(0、 <10%、 <50%、 >50%、 >90%)和丛枝丰度(0、 <50%、 >50%)的标准,定义每一条根段,然后通过“MYCOCALC”软件,计算出M%和A%等参数[14]。M%表示整个根系中AM真菌结构形成的强度,A%表示在整个根系中丛枝结构形成的丰度。
1.5数据处理
试验数据均采用Excel进行整理,Sigmaplot软件作图; 用SPSS统计软件进行方差分析,LSD法检验差异显著性。
2 结果与分析
2.1种植密度对玉米拔节期土壤Olsen-P含量及菌丝密度的影响
非根际土壤Olsen-P含量与根际土壤Olsen-P含量的差值作为Olsen-P含量耗竭量(用△Olsen-P含量表示)。在拔节期,高密度种植体系对土壤Olsen-P含量的耗竭量显著高于低密度处理(表1)。
菌丝密度在一定程度上表征AM真菌的生物量,土壤中AM真菌根外菌丝体的量预示着AM真菌的侵染效应[15]。由表1可以看出,种植密度和生育期对根际和非根际土壤中菌丝密度没有显著影响。
2.2种植密度对不同生育时期的地上部生物量和磷含量的影响
有研究表明,玉米干物质在拔节期以前积累很少,主要在大喇叭口期和吐丝期之后[16]。由图2A可知,高密度种植的玉米吐丝期地上部生物量比拔节期高214%,低密度种植吐丝期的地上部生物量比拔节期高了321%(图2A)。种植密度亦影响玉米产量,低密度种植的产量比高密度高33%(图2A)。
由图2B可知,高密度群体的地上部磷含量吐丝期比拔节期高145%,低密度群体的地上部磷含量吐丝期比拔节期高214%。拔节期高密度群体的地上部磷含量比低密度群体高55%,吐丝期高密度群体的地上部磷含量比低密度群体高20%。
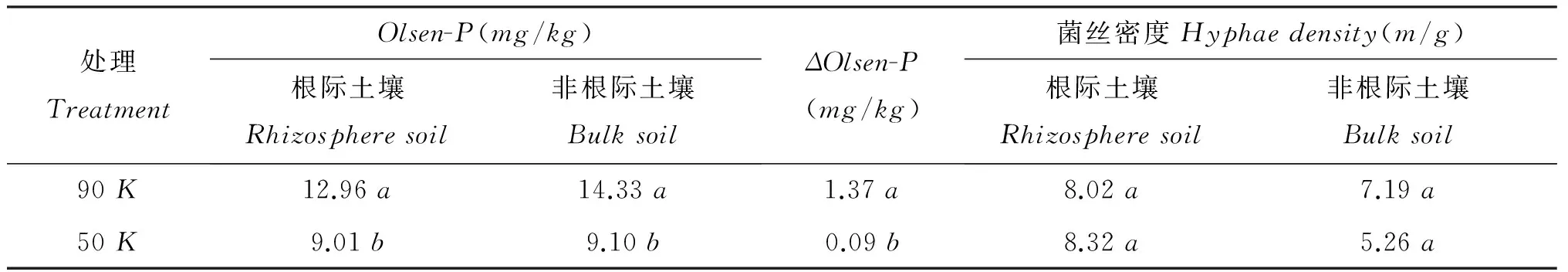
表1 不同种植密度下Olsen-P含量和菌丝密度(拔节期)Table 1 Olsen-P concentration and hyphae length density in different planting density at the V6 stage
注(Note): 同列数据后不同字母表示不同种植密度间差异达5%显著水平Valuesfollowedbydifferentlettersinacolumnaresignificantbetweendifferentdensitiesatthe5%level.
2.3种植密度对不同生育时期根系侵染率的影响

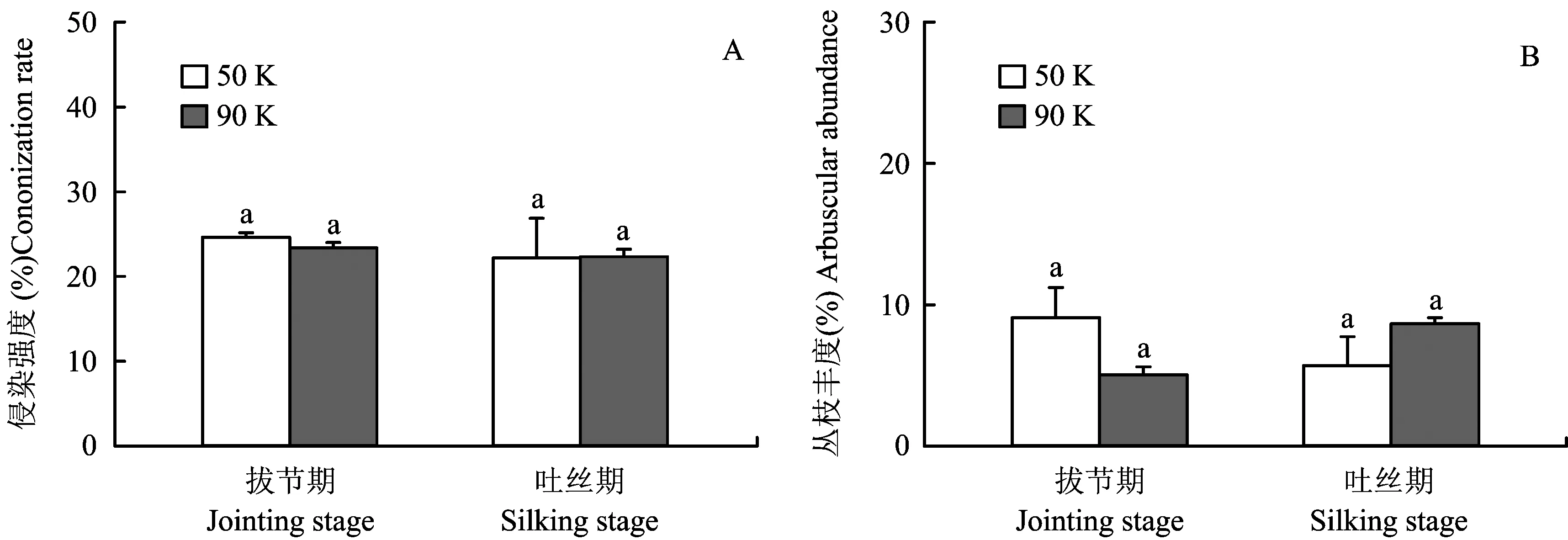
图3 种植密度对根系侵染强度(A)和丛枝丰度(B)的影响Fig.3 Effect of the planting density on the mycorrhizal colonization rate (A) and arbuscular abundance of maize roots (B)
2.4种植密度对AM真菌根外菌丝量及土壤Olsen-P耗竭的影响
菌丝密度表征AM真菌根外菌丝量[15]。安装PVC管装置的目的是定量测定原位条件下玉米根周围定殖的根外菌丝量的变化及其对土壤Olsen-P的吸收。从图4中可以看出,种植密度显著影响AM真菌根外菌丝量的生长。高密度和低密度种植体系下每克土壤根外菌丝长度分别为20.32m和14.61m,高密度群体的根外菌丝密度比低密度群体高39%,差异显著。PVC管装置中土壤Olsen-P的耗竭体现菌丝对土壤磷的吸收量。由图4可知,高密度和低密度种植体系下的Olsen-P耗竭量分别为21.4mg/kg和17.5mg/kg,高密度群体下的AM真菌耗竭Olsen-P量比低密度群体耗竭量高22%。

图4 种植密度对AM真菌菌丝密度和Olsen-P耗竭的影响Fig.4 Effects of the planting density on hyphae length density of AM fungi and olsen-P depletion
[ 注(Note): 柱上不同字母表示不同密度之间差异达5%显著水平Differentlettersabovethebarsindicatesignificantlydifferentbetweendifferentdensitiesatthe5%level.]
3 讨论
3.1种植密度对根际有效磷浓度的影响
玉米对土壤磷的获取主要依赖于根系截获和磷酸根在土壤中的扩散两种方式,因此根长、 根毛和根外菌丝的数量与磷的吸收存在密切的关系。种植密度和生育时期对春玉米的根体积、 根表面积和根长等形态特征都有一定的影响[17]。与低密度相比,随着种植密度增加至9×104plants/hm2时,在蜡熟期高密度种植下根系密度显著减低[18]。然而,根密度的变化与土壤有效磷的利用缺乏定量分析。本研究结果表明,在拔节期,高密度群体对土壤Olsen-P含量的耗竭(ΔOlsen-P含量)显著高于低密度群体的(表1),这说明尽管低密度群体的单株根系所占的生长空间比较大,但是单位土壤体积内的根长密度较高密度群体低,实际接触吸收磷的根表面积较小,因此根系对土壤有效磷的耗竭量小于高密度群体。同时,高密度群体玉米地上部生物量和含磷量也显著大于低密度群体(图2),这也加剧了高密度群体根系对土壤有效磷的耗竭。但低密度群体的产量比高密度群体高,这可能是由于: 第一、 高密度群体密度过大,养分总消耗量大,生长后期养分供应不足; 第二、 增加种植密度,田间玉米群体较大,引起倒伏减产。值得注意的是,在拔节期两种种植密度群体的菌根侵染率和丛枝丰度分别达到24%和8%左右(图3),在玉米根系周围的AM真菌菌丝密度达到8m/g左右(表1)。玉米是菌根依赖性强的植物,AM真菌根外菌丝能够穿过根际磷的亏缺区域从而吸收到植物根系或根毛无法吸收到的磷[19]。盆栽控制试验证明AM真菌的侵染能显著增加玉米对土壤磷的吸收利用[20-21]。大量研究表明,适宜供磷强度下AM真菌能更快、 更有效地增加植物从土壤中获取磷[21-22]。石灰性土壤上玉米的适宜供磷强度为10mg/kg[23-24],而本试验地的土壤速效磷为12mg/kg左右,属于菌根真菌发挥作用的最佳范围。因此,上述结果表明在高产的玉米生产体系中存在着大量的土著AM真菌群落,它们对高密度群体玉米对磷的吸收也发挥了一定的作用。
3.2种植密度对AM真菌贡献率的影响
田间埋设PVC管装置研究原位AM真菌的变化,其结果显示,在乳熟期种植密度显著影响AM真菌根外菌丝在菌丝室中的生长; 与低密度相比,高密度种植下显著增加了PVC管中的根外菌丝量,增量为5.71m/g,与此同时,菌丝室中速效磷含量比初始值大幅度减少(图4)。已往很多研究者认为AM真菌在高投入的作物生产体系中没有作用,这种结论大都是基于田间条件下接种菌根菌剂没有显著接种效应的试验而得出的。然而本研究结果表明,在农田中存在着大量的土著AM真菌。无论是高密度还是低密度玉米种植群体中,土著AM真菌在拔节期和吐丝期对玉米均有较高的侵染率,并且对玉米高效获取磷具有显著贡献。因此,土著AM真菌的这些作用在集约化玉米生产的养分管理中应加以考虑。
本研究初步揭示了田间土著AM真菌根外菌丝量的变化及其对土壤有效磷的吸收,但是仍无法定量确定根外菌丝吸收的有效磷占玉米吸收总磷的比例,这些问题均有待进一步研究。
[1]曹宁, 陈新平, 张福锁, 等. 从土壤肥力变化预测中国未来磷肥需求[J]. 土壤学报, 2007, 44(3): 536-543.
CaoN,ChenXP,ZhangFS, et al.PredictionofphosphatefertilizerdemandinChinabasedonchangeinsoilphosphatefertility[J].ActaPedologicaSinica, 2007, 44(3): 536-543.
[2]陈磊, 王盛锋, 刘荣乐, 等. 不同磷供应水平下小麦根系形态及根际过程的变化特征[J]. 植物营养与肥料学报, 2012, 18(2): 324-331.
ChenL,WangSF,LiuRL, et al.Changesofrootmorphologyandrhizosphereprocessesofwheatunderdifferentphosphatesupply[J].PlantNutritionandFertilizerScience, 2012, 18(2): 324-331.
[3]CheraghiM,LorestaniB,MerrikhpourH, et al.Heavymetalriskassessmentforpotatoesgrowninoverusedphosphate-fertilizedsoil[J].EnvironmentalMonitoringandAssessment, 2013, 185(2): 1825-1831.
[4]RodríguezH,FragaR.Phosphatesolubilizingbacteriaandtheirroleinplantgrowthpromotion[J].BiotechnologyAdvances, 1999, 17(4-5): 319-339.
[5]OliveiraCA,AlvesVMC,MarrielIE, et al.Phosphatesolubi-
lizingmicroorganismsisolatedfromrhizosphereofmaizecultivatedinanoxisoloftheBrazilianCerradoBiome[J].SoilBiologyandBiochemistry, 2009, 41(9): 1782-1787.
[6]冯固, 张福锁, 李晓林, 等. 丛枝菌根真菌在农业生产中的作用与调控[J]. 土壤学报, 2010, 47(5): 995-1004.
FengG,ZhangFS,LiXL, et al.Functionsofarbuscularmycorrhizalfungiinagricultureandtheirmanipulation[J].ActaPedologicaSinica, 2010, 47(5): 995-1004.
[7]JeffriesP,GianinazziS,PerottoS, et al.Thecontributionofarbuscularmycorrhizalfungiinsustainablemaintenanceofplanthealthandsoilfertility[J].BiologyandFertilityofSoils, 2003, 37(1): 1-16.
[8]ZhouGH,WenJJ,CaiDJ, et al.Southernriceblack-streakeddwarfvirus:AnewproposedFijivirusspeciesinthefamilyReoviridae[J].ChineseScienceBulletin, 2008, 53(23): 1-9.
[9]黄京华, 刘青, 李晓辉. 等. 丛枝菌根真菌诱导玉米根系形态变化及其机理[J]. 玉米科学, 2013, 21(3): 131-135, 139.
HuangJ,LiuQ,LiXH, et al.Mechanismofmaizerootmorphologychangeinducedbyarbuscularmycorrhizalfungi[J].JournalofMaizeSciences, 2013, 21(3): 131-135, 139.
[10]李洪. 不同密度处理下玉米单株根系体积的动态变化[J]. 山西农业科学, 2010, 38(9): 20-22.
LiH.Thedynamicchangeofmaizerootsbulkunderdifferentdensitytreatments[J].JournalofShanxiAgriculturalSciences, 2010, 38(9): 20-22.
[11]长春市郊区农业区划办公室. 长春市郊区土壤志[M]. 长春: 长春市郊区农业区划办公室, 1985. 2-5.
AgriculturalRegionalPlanningOfficeofChangchunSuburbs.SoilchroniclesinChangchunsuburbs[M].Changchun:AgriculturalRegionalPlanningOfficeofChangchunSuburbs, 1985. 2-5.
[12]鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
LuRK.Analyticalmethodforsoilandagriculturalchemistry[M].Beijing:ChinaAgriculturalScienceandTechnologyPress, 2000.
[13]JakobsenI,AbbotLK,RobosenAD.Externalhyphaeofvesic-
ular-arbuscularmycorrhizalfungiassociatedwithTrifolium subterraneumL. 1.SpreadofhyphaeandphosphorusinflowintoRoot[J].NewPhytologist, 1992, 120(3): 371-380.
[14]冯海艳, 冯固, 王敬国, 等.植物磷营养状况对丛枝菌根真菌生长及代谢活性的调控[J]. 菌物系统, 2003, 22(4): 589-598.
FengHY,FengG,WangJG, et al.RegulationofPstatusinhostplantonalkallnephosohatase(ALP)activityinintraradicalhyphaeanddevelopmentofextraradicalhyphaeofAMfungi[J].Mycorrhiza, 2003, 22(4): 589-598.
[15]GrahamJH,LindermanRG,MengeJA.Developmentofexte-
malhyphaebydifferentisolatesofmycorrhizal Glomusspp.inrelationtorootcolonizationandgrowthofTroyercitrange[J].NewPhytologist, 1982, 91(2): 183-189.
[16]杨国虎, 李新, 王承莲, 罗湘宁. 种植密度影响玉米产量及部分产量相关性状的研究[J]. 西北农业学报, 2006, 15(5): 57-60, 64.
YangGH,LiX,WangCL,LuoXN.Studyoneffectofplantdensitiesontheyieldandtherelatedcharactersofmaizehybrids[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2006, 15(5): 57-60, 64.
[17]寇太记, 郭金瑞, 宋振伟, 等. 不同种植密度下东北春玉米根系特征及其干物质积累的差异比较[J]. 玉米科学, 2013, 21(1): 51-56.
KouTJ,GuoJR,SongZW, et al.DifferentialcomparisonofrootmorphologyandmatteraccumulationofspringmaizeunderdifferentplantdensitiesinNortheastChina[J].JournalofMaizeSciences, 2013, 21(1): 51-56.
[18]刘镜波, 王小林, 张岁岐, 等. 有机肥与种植密度对旱作玉米根系生长及功能的影响[J]. 水土保持通报, 2011, 31(6): 32-36, 41
LiuJB,WangXL,ZhangSQ, et al.Effectoforganicfertilizerandplantingdensityonrootgrowthandfunctionofmaizeindryland[J].BulletinofSoilandWaterConservation, 2011, 31(6): 32-36, 41.
[19]SandersFE,TinklerPB,BlackRLB, et al.Thedevelopmentofendomycorrhizalrootsystems.I.Spreadofinfectionandgrowthpromotingeffectwithfourspeciesofvesiculararbuscularmycorrhizae[J].NewPhytologist, 1977, 78(2): 257-268.
[20]DrewEA,MurrayRS,SmithSE, et al.Beyondtherhizosphe-
re:growthandfunctionofarbuscularmycorrhizalexternalhyphaeinsandsofvaryingporesizes[J].PlantandSoil, 2003, 251(1): 105-114.
[21]SmithSE,ReadDJ.Mycorrhizalsymbiosis[M].SanDiego:AcademicPress, 1997.
[22]DoddJC,DougallTA,ClappJP, et al.TheroleofarbuscularmycorrhizalfungiinplantcommunityestablishimentatSamphireHoe,Kent,UK-thereclamationplatformcreatedduringthebuildingofthechanneltunnelbetweenFranceandtheUK[J].BiodiversityandConservation, 2002, 11(1): 39-58.
[23]DengY,ChenKR,TengW, et al.Istheinherentpotentialofmaizerootsefficientforsoilphosphorusacquisition? [J].PlosOne, 2014, 9(3): 1-9.
[24]褚群. 菌根途径对玉米磷吸收的贡献[D]. 北京: 中国农业大学博士学位论文, 2013.
ChuQ.ThecontributionofmycorrihizalpathwaytoPuptakeefficiencyofmaize(Zea maysL.) [D].Beijing:PhDdissertationofChinaAgriculturalUniversity, 2013.
EffectofarbuscularmycorrhizalfungionPuptakeofmaize(ZeamaysL.)underdifferentgrowingdensity
ZHANGXiao-fei1,LIWei1,YANGShan1,YAOGuo-qing1,ZHUWen-dong1,XIAOJing-jing1,ZHENGTing1,CAONing1*,FENGGu2
(1 College of Plant Sciences, Jilin University, Changchun 130062, China;2 Beijing Key Laboratory of Biodiversity and Organic Farming/China Agricultural University, Beijing 100193, China)
【Objectives】ImprovingsoilPutilizationefficiencyforcropbyusingarbuscularmycorrhizalsymbiosisisoneofeffectivewaystosolvecontradictionbetweensupplyanddemandofphosphorusresourceinthecropproduction.However,studiesonmycorrhizalcolonizationandphosphorusuptakeofmaizewithdifferentgrowingdensityinfieldhavebeenlessconcerned.【Methods】Afieldexperimentwasconductedwithtwoplantingdensities(5×104plants/hm2and9×104plants/hm2)ofmaize(Zea maysL.).PVCpipeswereinsertedaroundmaizeroots,andphosphorusdepletionandhyphaelengthdensityofsoilinthePVCcompartmentweredeterminedtotesteffectsofarbuscularmycorrhizalfungionphosphorusuptakeofmaize. 【Results】AttheV6stage,theOlsen-Pdepletionwassignificantlyreducedwhentheplantingdensitywasincreased,whiletheincrementoftheshootPcontent(Pabsorptionefficiency)wasupto20%.Withtheincreaseoftheplantingdensity,theextraradicalhyphaelengthdensityintherhizospherewasdecreasedby4%attheV6stage,whilethehyphaedensityinthebulksoilwasincreasedby37%.ThecontributionofextraradicalhyphaetoOlsen-Pdepletionwassignificantlyincreasedby22%underthehigherplantingdensitycondition.【Conclusions】TheseresultsindicatedthatPuptakeofmaizewasdependentonAMsymbiosiswhentheplantingdensitywasincreased,becauseofthemycorrhizalcolonization,extraradicalhyphaedensityandPuptakeweresignificantlyenhanced,comparingtothelowplantingdensity.Keywords:maize;Olsen-P;arbuscularmycorrhizalfungi;plantingdensity
2014-07-01接受日期: 2014-12-19网络出版日期: 2015-05-13
国家自然科学基金(31101606); 教育部博士点基金(20120008130001)资助。
张晓飞(1990—),女,河南林州人,硕士研究生,主要从事磷养分高效利用研究。E-mail:zimeng19900202@163.com
E-mail:caoningjn@163.com
S154.38+1;S513.01
A
1008-505X(2016)01-0263-06
