上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠的神经保护作用*
2016-08-24李夏春彭敏峰高丽华楼正青柳秀平
李夏春, 彭敏峰, 高丽华, 楼正青, 柳秀平△
(1三峡大学医学院病理生理教研室,湖北宜昌443002;2杭州市中医院检验科,浙江杭州310007)
上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠的神经保护作用*
李夏春1, 彭敏峰2, 高丽华2, 楼正青2, 柳秀平2△
(1三峡大学医学院病理生理教研室,湖北宜昌443002;2杭州市中医院检验科,浙江杭州310007)
目的:探讨上调星形胶质细胞中蛋白磷酸酶2A(protein phosphatase 2A,PP2A)对APP/PS1双转基因小鼠的神经保护作用。方法:构建带胶质细胞原纤维酸性蛋白启动子的eGFP-wtPP2A慢病毒,特异性上调星形胶质细胞中的PP2A。将实验小鼠随机分为野生对照+慢病毒空载体组(Con组)、APP/PS1双转基因小鼠+慢病毒空载体组(APP/PS1组)和APP/PS1双转基因小鼠+慢病毒感染组(PP2A组),各组小鼠经侧脑室注射慢病毒4周后,采用脑片免疫荧光检测β-淀粉样蛋白(β-amyloid protein,Aβ)的水平,通过Golgi染色观察树突棘密度和形态学变化,电镜检测突触后致密物(postsynaptic density,PSD)的厚度,Morris水迷宫定位航行实验检测感染慢病毒后对学习和记忆的影响。结果:上调星形胶质细胞中PP2A降低APP/PS1双转基因小鼠Aβ的水平,增加树突棘密度、有突触功能的蘑菇状树突棘比例和PSD厚度,缩短寻找平台逃避潜伏期。结论:上调星形胶质细胞中PP2A改善APP/PS1双转基因小鼠AD样Aβ聚集的病理改变,具有重塑突触结构与功能和改善学习记忆能力的作用。
蛋白磷酸酶2A;星形胶质细胞;APP/PS1双转基因小鼠;神经保护作用
星形胶质细胞在阿尔茨海默病(Alzheimer disease,AD)病人大脑中的老年斑周围聚集,是AD脑中早期的病理改变之一。星形胶质细胞作为中枢神经系统中含量最丰富的细胞在AD的发病过程中起十分重要的作用,它既可产生β-淀粉样蛋白(β-amyloid protein,Aβ),也能对细胞外的Aβ进行内吞,进而清除Aβ[1]。多数研究认为反应性星形胶质细胞参与了AD的炎症过程,促进AD神经退行性改变。但也有研究发现抑制AD转基因小鼠模型中星形胶质细胞的激活,Aβ沉积反而增多[2]。因此从星形胶质细胞对Aβ的清除途径探索治疗AD的措施,是阻止或者延缓AD病理过程发展潜在的有效措施。蛋白磷酸酶2A(protein phosphatase 2A,PP2A)是脑内最重要的丝氨酸/苏氨酸蛋白磷酸酶,主要调节细胞周期和细胞分化。AD脑中PP2A活性明显下降,PP2A活性下降可以损伤神经元轴突结构的建立和功能的维持[3]。作者前期结果发现在细胞水平上调PP2A促进星形胶质细胞的迁移[4],但在整体水平PP2A对星形胶质的作用尚未见报道。
为探讨在整体水平上调星形胶质细胞中的PP2A是否通过激活星形胶质细胞对AD的Aβ沉积病理改变有改善作用,本研究选择6月龄APP/PS1双转基因小鼠这一常用的AD动物模型,侧脑室注射构建的带胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein,GFAP)启动子的eGFP-wtPP2A慢病毒后特异性上调了星形胶质细胞中的PP2A,结果发现上调星形胶质细胞PP2A可激活星形胶质细胞,促进其迁移到老年斑周围发挥清除Aβ的作用,并显著改善APP/PS1双转基因小鼠AD样Aβ聚集的病理改变,重塑突触结构与功能和改善学习记忆能力。
材料和方法
1 动物
B6C3-Tg(携带人APPswe/PSEN1Δ9)双转基因AD模型小鼠购自中国医学科学院医学实验动物研究所,合格证号为S(XK京)2013-0002。取6月龄雌性APP/PS1转基因小鼠35只与同月龄的相同遗传背景的非转基因C57BL/6小鼠25只,共60只,常规分笼喂养于光照/黑暗为12 h/12 h的恒温环境,自由摄食和饮水。实验遵循浙江中医药大学使用相关伦理要求。
2 主要试剂和病毒构建
识别Aβ的兔源性多克隆抗体(是连接到KLH上的DAEFRHDSGYEVHH合成肽,相当于人Aβ1-14氨基酸)购自Abcam。带GFAP启动子、表达绿色荧光蛋白的PP2A过表达(eGFP-wtPP2A)慢病毒由上海纽恩生物公司提供。
3 主要方法
3.1 慢病毒侧脑室注射 小鼠经腹腔注射10%水合氯醛(400 mg/kg)麻醉后固定于立体定位仪上。颅顶备皮消毒后,切开头顶皮肤,暴露前囟。微量注射器针尖定位:前后位:距前囟-0.4 mm;左右位:中线旁开1.0 mm;背腹位:距颅骨表面2.3 mm。以颅骨钻钻孔,将10 μL微量注射器针头经针孔准确插入侧脑室停留5 min,缓慢注入4 μL慢病毒约1 μL/ min,注射完毕后停留5 min,缓慢退出微量注射器,迅速用骨蜡封闭针孔,严格消毒后缝合手术切口。小鼠置于加温平板上待其完全苏醒后,放回笼中饲养。
3.2 免疫荧光组织化学检测 石蜡切片自冰箱取出,60℃烤片30 min;二甲苯脱蜡15 min 2次,经无水乙醇5 min 2次,梯度乙醇水化,PBS洗5 min;加入山羊血清封闭40 min,加入用 I抗稀释液(3% BSA)适当稀释的Aβ抗体(1∶100),4℃孵育2夜; 第3天取出切片,PBS洗3次,加入抗兔的荧光II抗,室温孵育1 h,PBS洗3次;加入50%甘油-PBS封片液封片,710共聚焦显微镜(Zeiss)下观察摄像。
3.3 Golgi染色 灌注固定,取脑,用新鲜媒染液避光浸泡3 d,每日更换媒染液。1.5%硝酸银水溶液充分置换媒染液,摇晃清洗3次,直至置换的液体颜色清亮,之后置暗处镀银3 d,每日更换新的硝酸银水溶液。脑块采用30%蔗糖脱水,冰冻切片机切片,厚度为35 pm,切片立即用95%乙醇和无水乙醇脱水10 min,二甲苯透明5 min后,采用中性塑胶封片。每只小鼠留含海马的24张切片以备照相统计分析。
3.4 电镜观察 将小鼠麻醉并灌注生理盐水,随后快速滴注4℃1%戊二醛多聚甲酸灌注液。大脑取出,并放置在2.5%戊二醛多聚甲酸灌注液后固定12 h,4℃。取出CA3区,在100 mmol/L含1%的锇酸浸泡固定30 min,然后乙醇脱水,随后入Epon812包埋剂中。接下来使用德国超薄切片机(Leica)超薄切片,醋酸双氧铀、枸橼酸铅双重染色分别10 min。用透射电子显微镜荷兰(FEI Tecnai G2 12型)透射电子显微镜观察并拍照,利用Image-Pro Plus软件分析突触后致密物的厚度。
3.5 水迷宫 实验过程中保持环境安静,空间参照物品位置不变,以排除外界干扰。各组进行水迷宫测试。整个实验共计7 d,每只小鼠每天在4个象限各训练1次,连续6 d,每次游泳时限为120 s。潜伏期指大鼠从放入水池到找到隐藏平台所用的时间。若超过120 s未找到平台者停止记录,将潜伏期记录为120 s,由测试者引导其上平台休息30 s后进行下一次训练。若找到平台也在平台上巩固记忆5 s。第7天测试,记录其潜伏期作为衡量大鼠学习和测试成绩的指标。
4 统计学处理
采用SPSS 12.0统计软件进行统计分析,计量资料用均数±标准差(mean±SD)表示;采用Image-Pro Plus软件统计突触数目,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结果
1 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠Aβ的影响
免疫荧光结果显示:APP/PS1组与Con组相比,其皮层神经元间Aβ水平显著升高;与APP/PS1组相比,PP2A组中星形胶质细胞PP2A过表达引起皮层神经元间和胶质细胞内Aβ水平显著降低,见图1。这说明上调星形胶质细胞中PP2A减轻了APP/ PS1双转基因小鼠AD样Aβ聚集的病理改变。

Figure 1.Up-regulation of astrocyte protein phosphatase 2A(PP2A)reduced Aβ levels in APP/PS1 transgenic mice.图1 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠Aβ的影响
2 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠树突棘的影响
高尔基染色的切片树突棘照片显示:APP/PS1组与Con组相比树突棘密度显著降低,蘑菇状树突棘占比显著减少;与APP/PS1组相比,PP2A组树突棘密度和蘑菇状树突棘占比明显升高(P<0.05),见图2。结果说明上调星形胶质细胞中PP2A增加APP/PS1双转基因小鼠树突棘密度和有突触功能的蘑菇状树突棘比例。
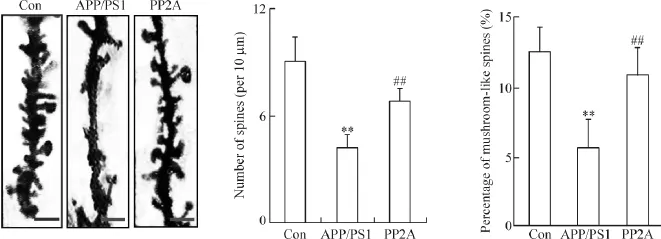
Figure 2.Up-regulation of astrocyte PP2A attenuated synaptic morphology impairment in APP/PS1 transgenic mice.The representative images for morphology of dendritic spine in hippocampal CA3 region visualized by Golgi staining were shown.The scale bars =5 μm.Mean±SD.n=16~19.**P<0.01 vs Con group;##P<0.01 vs APP/PS1 group.图2 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠树突棘的影响
3 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠突触的改变
海马CA3区具有囊泡聚集和突触后致密物(postsynaptic density,PSD)的典型突触结构的突触透射电镜照片显示:APP/PS1组与Con组相比,其PSD厚度显著变薄;与APP/PS1组相比,AVV-PP2A组PSD表观厚度有明显增厚,Image-Pro Plus软件量化分析,结果显示差异有统计学意义,见图3。结果说明上调星形胶质细胞中PP2A增加APP/PS1双转基因小鼠PSD厚度。
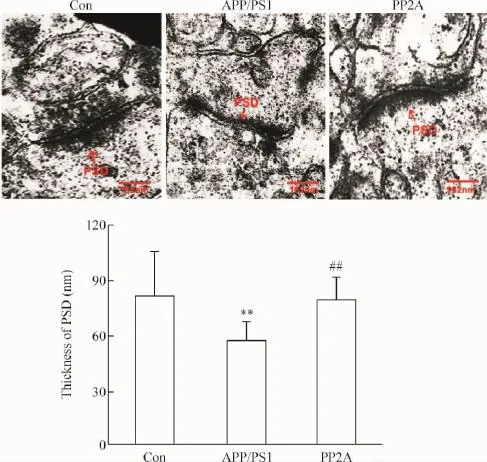
Figure 3.Up-regulation of astrocyte PP2A attenuated synaptic plasticity deficits morphologically in APP/PS1 transgenic mice.The typical micrographs of synapses in hippocampal CA3 were shown,and the red arrows indicated the postsynaptic density (PSD).The scale bars=162 nm.Mean±SD.n=22~25.**P<0.01 vs Con group;##P<0.01 vs APP/PS1 group.图3 上调APP/PS1转基因鼠中星形胶质细胞PP2A对突触的影响
4 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠学习和记忆能力的影响
Morris水迷宫测试结果表明,7月龄的Con小鼠反应比较迅速,入水后能快速找到平台,随着训练次数增加,寻找平台的潜伏期时间显著缩短;而APP/ PS1双转基因组小鼠反应迟钝,寻找平台潜伏期明显延长。而PP2A组潜伏期相比APP/PS1组明显缩短,见图4。实验说明:上调星形胶质细胞中PP2A可缩短APP/PS1双转基因小鼠寻找平台逃避潜伏期,改善其学习和记忆能力。
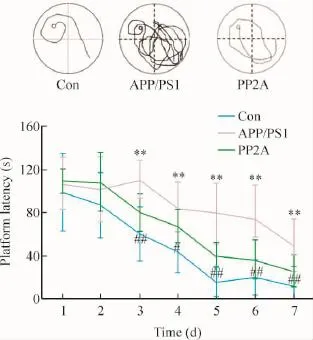
Figure 4.Up-regulation of astrocyte PP2A attenuated cognitive impairment in APP/PS1 transgenic mice.Mean±SD.n=15.**P<0.01 vs Con group;#P<0.05,##P<0.01 vs APP/PS1 group.图4 上调星形胶质细胞中PP2A对APP/PS1双转基因小鼠学习和记忆能力的影响
讨论
AD已经成为严重威胁老龄特别是高龄人群的常见疾病[5]。AD是一种以进行性认知障碍和记忆功能损害为主的中枢神经系统退行性疾病,主要病理特征是老年斑和神经原纤维缠结。淀粉样前体蛋白代谢异常或者清除障碍导致的胞外Aβ沉积增加是AD患者细胞外广泛老年斑产生的主要机制,也是导致其学习记忆能力下降的重要原因[6],因此减少不溶Aβ的产生成为研究和治疗 AD的主要靶点。作为中枢神经系统中含量最丰富的细胞,星形胶质细胞在AD的发病进程中起着重要的调控作用。在神经系统受到损伤时,星形胶质细胞即被激活呈现所谓的“反应性”形态,即胞体肥大,突起多而粗壮,称为反应性星形胶质细胞。反应性星形胶质细胞被认为参与了淀粉样斑块的组成[7],其突起包绕在淀粉样斑块的周围,有些突起甚至可以伸入其内部[8]。运用载脂蛋白E的治疗方法可以直接加速Aβ的清除,并逆转由Aβ聚集而引起的记忆缺陷[9];星形胶质细胞被激活后,载脂蛋白E的抑制剂可以作为一种安全的AD治疗手段[10];增强星形胶质细胞内溶酶体蛋白水解酶的表达可加速Aβ的清除[11]。细胞迁移是一个高度复杂的时空过程,生命中的多种正常和病理过程都涉及到细胞迁移,无论在大脑神经元发育还是神经退行性变时均存在星形胶质细胞的迁移。研究资料提示,可以通过激活星形胶质细胞促进星形胶质细胞的迁移,发挥其清除Aβ的作用,以延缓AD的病理过程进展并使其向保护神经元的方向发展。
PP2A是脑内最重要的的丝氨酸/苏氨酸蛋白磷酸酯酶之一,是AD发病中重要的磷酸酯酶。PP2A 在AD的发病机制中具有重要的作用,在AD脑中其活性明显下降,PP2A可以去磷酸化AD中过度磷酸化的tau蛋白[12]。PP2A主要调节细胞周期和细胞分化,且发现PP2A调节亚基Bβ可以通过p38促分裂原活化蛋白激酶信号通路促进人皮肤基底细胞癌A431细胞的迁移[13],上调PP2A调节亚基alpha4可以刺激细胞的扩张和迁移[14]。PP2A参与了基质细胞衍生因子1/CXC趋化因子12介导的CD34+细胞的迁移和黏附[15]。而我们在前期AD转基因鼠老年斑周围PP2A免疫着色增强,星形胶质细胞内PP2A被激活,位于反应性星形胶质细胞的末端部位。在细胞水平上调PP2A促进星形胶质细胞的迁移[1],说明上调PP2A是星形胶质细胞的激动剂,可以促进星形胶质细胞的迁移。本实验中AD模型APP/PS1转基因鼠中侧脑室注射构建带GFAP启动子的dsRedwtPP2A的慢病毒后,明显减轻APP/PS1双转基因小鼠中Aβ水平,提示在整体水平上调APP/PS1转基因鼠星形胶质细胞中的PP2A,对APP/PS1转基因鼠病理改变有所改善。Aβ主要对AD认知功能损害起作用,而其主要损害目标是脑突触和突触相关信号通路,损害其突触可塑性和学习记忆。越来越多的证据表明脑突触功能障碍在AD疾病进展机制中占有重要地位,且突触的数量和功能发生改变可引起突触可塑性的改变,进而影响学习记忆能力,与疾病认知功能障碍明显相关。学习记忆过程常与树突棘的形成、脱落、扩张和萎缩等形态以及数目和组成相关。高尔基染色可以观察到树突棘分为细长型、矮胖型、伪足型、蘑菇型和杯型5种形态,其中蘑菇型为成熟型树突棘,具有突触功能,与学习记忆的关系最为密切,其占总的树突棘比例越高,学习记忆能力越强。本研究发现上调APP/PS1转基因鼠星形胶质细胞中的PP2A能显著增加树突棘的数目,其蘑菇状树突棘所占总树突棘的比例也明显升高。PSD指在电镜下突触后膜胞质面聚集的一层圆盘状均匀而致密的物质,见于中枢神经系统所有轴树突棘突触的突触后膜上,由许多与信号转导相关的蛋白质组装而成。本研究发现CA3区神经元突触后致密物显著增厚,改善了APP/PS1转基因鼠突触微观结构。进一步的水迷宫实验结果也发现上调星形胶质细胞中PP2A显著改善APP/PS1双突变转基因鼠的学习和记忆能力。在整体水平上调星形胶质细胞中PP2A,促进其迁移到老年斑块周围,并发挥清除Aβ和促进突触重塑的具体作用机制尚需进一步的研究。
综上所诉,上调星形胶质细胞中PP2A对APP/ PS1双突变所致Aβ沉积的病理改变及神经突触受损有显著减轻作用,其机制可能与其降低Aβ的水平及其所致的突触受损并重塑突触结构和功能有关。因此,星形胶质细胞有望作为一种新型的靶点来治疗阿尔茨海默病。
[1] Wyss-Coray T,Loike JD,Brionne TC,et al.Adult mouse astrocytes degrade amyloid-beta in vitro and in situ[J].Nat Med,2003,9(4):453-457.
[2] Kraft AW,Hu X,Yoon H,et al.Attenuating astrocyte activation accelerates plaque pathogenesis in APP/PS1 mice[J].FASEB J,2013,27(1):187-198.
[3] Zhu LQ,Zheng HY,Peng CX,et al.Protein phosphatase 2A facilitates axonogenesis by dephosphorylating CRMP2 [J].J Neurosci,2010,30(10):3839-3848.
[4] Liu XP,Zheng HY,Qu M,et al.Upregulation of astrocytes protein phosphatase-2A stimulates astrocytes migration via inhibiting p38 MAPK in tg2576 mice[J].Glia,2012,60(9):1279-1288.
[5] Haapasalo A,Pikkarainen M,Soininen H.Alzheimer’s disease:a report from the 7th Kuopio Alzheimer symposium[J].Neurodegener Dis Manag,2015,5(5):379-382.
[6] 王 锋,韩 柏,郭建红,等.脑内Aβ沉积与AD模型大鼠学习记忆能力关系的研究[J].中国病理生理杂志,2010,26(3):584-586.
[7] Giaume C,Kirchhoff F,Matute C,et al.Glia:the fulcrum of brain diseases[J].Cell Death Differ,2007,14 (7):1324-1335.
[8] Wang DD,Bordey A.The astrocyte odyssey[J].Prog Neurobiol,2008,86(4):342-367.
[9] Cramer PE,Cirrito JR,Wesson DW,at al.ApoE-directed therapeuticsrapidly clear beta-amyloid and reverse deficits in AD mouse models[J].Science,2012,335 (6075):1503-1506.
[10]Ahmed RR,Holler CJ,Webb RL,at al.BACE1 and BACE2 enzymatic activities in Alzheimer’s disease[J].J Neurochem,2010,112(4):1045-1053.
[11]Bahr BA,Wisniewski ML,Butler D.Positive lysosomal modulation as a unique strategy to treat age-related protein accumulation diseases[J].Rejuvenation Res,2012,15 (2):189-197.
[12]Gong CX,Shaikh S,Wang JZ,et al.Phosphatase activity toward abnormally phosphorylated tau:decrease in Alzheimer disease brain[J].J Neurochem,1995,65(2):732-738.
[13]Nakada N,Kuroda K,Kawahara E.Protein phosphatase 2A regulatory subunit Bbeta promotes MAP kinase-mediated migration of A431 cells[J].Cell Physiol Biochem,2005,15(1-4):19-28.
[14]Kong M,Bui TV,Ditsworth D,et al.The PP2A-associated protein alpha4 plays a critical role in the regulation of cell spreading and migration[J].J Biol Chem,2007,282 (40):29712-29720.
[15]Basu S,Ray NT,Atkinson SJ,at al.Protein phosphatase 2A plays an important role in stromal cell-derived factor-1/ CXC chemokine ligand 12-mediated migration and adhesion of CD34+cells[J].J Immunol,2007,179(5): 3075-3085.
(责任编辑:林白霜,罗 森)
Neuroprotective effect of astrocyte protein phosphatase 2A up-regulation on APP/PS1 double transgenic mice
LI Xia-chun1,PENG Min-feng2,GAO Li-hua2,LOU Zheng-qing2,LIU Xiu-ping2
(1Department of Pathophysiology,Medical School of Three Gorges University,Yichang 443002,China;2Department of Clinical Laboratory,Hangzhou Hospital of Traditional Chinese Medicine,Hangzhou 310007,China.E-mail:470299188@ qq.com)
AIM:To investigate the protective effects of astrocyte protein phosphatase 2A(PP2A)up-regulation on APP/PS1 double transgenic mice.METHODS:An eGFP-wtPP2A lentivirus with glial fiber acidic protein promoter was constructed to specifically increase PP2A expression in the astrocytes.The mice were divided into wild-type mice+ vector virus group(Con),APP/PS1 transgenic mice+vector virus group(APP/PS1)and APP/PS1 transgenic mice+ eGFP-wtPP2A lentivirus group(PP2A)by lateral ventricular injection of the lentivirus.Four weeks after injection of the virus,the immunofluorescence of brain slices were used to detect the level of β-amyloid protein(Aβ).Golgi staining was used to detect the changes of dendritic spine density and morphology.Electron microscopy was applied to detect the thickness of postsynaptic density(PSD).The Morris water maze test was applied to examine the learning and memory abilities of the mice.RESULTS:Up-regulation of PP2A in the astrocytes attenuated Aβ level increasing in APP/PS1 group.Up-regulation of PP2A in the astrocytes significantly attenuated both decreases in the dendritic spine density and the percentage of mushroom-like dendritic spines in the hippocampal CA3 region of APP/PS1 mice.Up-regulation of PP2A in the astrocytes significantly attenuated the reduced thickness of PSD in APP/PS1 group.Up-regulation of PP2A in the astrocytes attenuated the escape latency extending in APP/PS1 group.CONCLUSION:Up-regulation of PP2A in the astrocytes reduces AD-like pathological changes,and attenuates synaptic impairment,synaptic plasticity deficits and cognitive impairment in the APP/PS1 double transgenic mice.
Protein phosphatase 2A;Astrocytes;APP/PS1 double transgenic mice;Neuroprotective effect
R749.16;R363.2
A
10.3969/j.issn.1000-4718.2016.07.006
1000-4718(2016)07-1189-06
2016-01-21
2016-02-19
国家自然科学基金资助项目(No.31300932)
△Tel:0571-85827825;E-mail:470299188@qq.com
