ATP敏感性钾通道的开放通过抑制TLR4/NF-κB通路对抗高糖引起的H9c2心肌细胞损伤和炎症*
2016-08-24梁伟杰陈美姬何洁仪黄惠敏余盛龙陈景福宋明才廖新学
梁伟杰, 陈美姬, 何洁仪, 黄惠敏, 余盛龙, 陈 君, 陈景福, 宋明才, 廖新学
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东广州511400;中山大学附属第一医院黄埔院区3儿科,4心血管内科CCU,广东广州510700;5中山大学附属第一医院心血管内科,广东广州510080)
ATP敏感性钾通道的开放通过抑制TLR4/NF-κB通路对抗高糖引起的H9c2心肌细胞损伤和炎症*
梁伟杰1,2, 陈美姬3, 何洁仪1,2, 黄惠敏1,2, 余盛龙1,2, 陈 君1,2, 陈景福4, 宋明才1,2, 廖新学5△
(1广州市番禺区中心医院心血管内科,2广州市番禺区心血管疾病研究所,广东广州511400;中山大学附属第一医院黄埔院区3儿科,4心血管内科CCU,广东广州510700;5中山大学附属第一医院心血管内科,广东广州510080)
目的:探讨开放ATP敏感性钾通道(KATP通道)能否抑制Toll样受体4(TLR4)/核因子-κB(NF-κB)通路对抗高糖(HG)引起的H9c2心肌细胞损伤和炎症。方法:应用Western blot测定TLR4和NF-κB p65的蛋白水平;应用ELISA法检测细胞培养液中白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α)的水平;采用细胞计数试剂盒8(CCK-8)测定心肌细胞存活率;罗丹明123染色荧光显微镜照相法测定线粒体膜电位(MMP);双氯荧光素染色荧光显微镜照相法测定细胞内活性氧簇(ROS)水平;Hoechst 33258核染色荧光显微镜照相法检测凋亡细胞数量。结果:H9c2心肌细胞经HG(35 mmol/L葡萄糖)处理24 h,胞内TLR4和磷酸化NF-κB p65(p-NF-κB p65)的蛋白水平明显增加,100 μmol/L KATP通道开放剂二氮嗪(DZ)预处理30 min可抑制HG对TLR4和p-NF-κB p65蛋白水平的上调作用;此外,30 μmol/L TAK-242(TLR4抑制剂)和HG共处理心肌细胞24 h也可减轻HG对p-NF-κB p65的上调作用。另一方面,100 μmol/L DZ预处理有明确的心肌保护作用,可抑制HG引起的细胞毒性、炎症反应、线粒体损伤、氧化应激和细胞凋亡,使细胞存活率升高,并减少IL-1β和TNF-α分泌水平、MMP丢失、ROS生成及凋亡细胞数量;而30 μmol/L TAK-242或100 μmol/L PDTC(NF-κB抑制剂)共处理心肌细胞24 h也可发挥和DZ相类似的作用,能抑制HG引起的上述损伤和炎症反应。结论:开放KATP通道可通过抑制TLR4/NF-κB通路对抗HG引起的H9c2肌细胞损伤和炎症。
ATP敏感性钾通道;Toll样受体4;核因子-κB;高糖;心肌细胞;损伤;炎症
众所周知,高血糖是糖尿病的一个重要指征,其所诱导的炎症反应在糖尿病相关并发症如视网膜病变、神经病变、冠心病和糖尿病心肌病(diabetic cardiomyopathy,DCM)等的发生和发展中发挥重要的作用[1-3]。在 DCM的炎症反应过程中,Toll样受体(Toll-like receptors,TLRs)起关键性的调控作用[4]。TLR4是第1个被发现的TLRs,在心肌细胞中有大量的表达[5]。TLR4与相应的配体结合后,可协同激活控制各种基因表达的核因子-κB(nuclear factor κB,NF-κB),调节其下游的炎症因子如白细胞介素(interleukin,IL)-1β、IL-2、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等的基因表达和转录,从而引起炎症的发生[5]。有研究报道,高血糖可促进TLR4的大量表达并诱导心肌细胞炎症发生[6],但抑制TLR4/NF-κB通路的活性能否拮抗高血糖引起的心肌细胞炎症和损伤作用,该研究小组并没有作进一步的探讨。因此,进一步明确这个问题具有重要的意义。
ATP敏感性钾通道(ATP-sensitive K+channels,KATP通道)于1983年被Noma[7]在心肌细胞中发现,是一种受细胞内ATP浓度调控的内向整流钾通道。研究表明,开放KATP通道对心肌有保护作用[8-9]。最近,我们实验证实,开放KATP通道可对抗高糖引起的H9c2心肌细胞损伤[10]。有研究指出,激活KATP通道可通过抑制TLR4的活动减轻炎症反应从而保护神经细胞[11]。但是,激活KATP通道能否通过抑制TLR4及其下游的NF-κB通路,从而保护心肌细胞对抗高糖引起的损伤和炎症,目前尚未见报道。
为此,本研究在高糖损伤H9c2心肌细胞建立的DCM细胞模型[12]中探讨TLR4/NF-κB通路在高糖引起心肌细胞损伤和炎症中的作用,观察开放KATP通道能否抑制TLR4/NF-κB信号通路对抗高糖引起的心肌细胞损伤和炎症。
材料和方法
1 材料
NF-κB抑制剂二硫代氨基甲酸吡咯烷(pyrrolidine dithiocarbamate,PDTC)、罗丹明123(rhodamine 123,Rh123)、Hoechst 33258和双氯荧光素(2',7'-dichlorfluorescein diacetate,DCFH-DA)由 Sigma-Aldrich供应;KATP通道开放剂二氮嗪(diazoxide,DZ)购自Cayman;细胞计数试剂盒8(Cell Counting Kit-8,CCK-8)购自Dojindo;抗TLR4抗体购自Abcam;抗p-NF-κB p65和抗NF-κB p65抗体购于Cell Signaling;TAK-242(TLR4抑制剂)购自InvivoGen;特级胎牛血清(fetal bovine serum,FBS)购自Gibco;DMEM培养基(其葡萄糖浓度为5.5 mmol/L)由HyClone供应;IL-1β和TNF-α ELISA试剂盒由武汉华美生物工程有限公司提供。H9c2心肌细胞来源于胚胎期大鼠心脏组织的亚克隆细胞系,由中山大学实验动物中心细胞库供应。
2 方法
2.1 细胞培养 H9c2心肌细胞置于含10%FBS 的DMEM培养基中,于5%CO2、37℃的条件下传代培养,待细胞生长至约80%的融合状态可用于实验。
2.2 实验分组 实验分为8组:正常对照(control) 组:单纯采用DMEM培养基作用心肌细胞24 h;高糖(high glucose,HG)损伤组:用含有高浓度葡萄糖(35 mmol/L)的DMEM培养基作用心肌细胞24 h;DZ+ HG组:100 μmol/L DZ预处理心肌细胞30 min,PBS液洗2次后,用含高浓度葡萄糖的DMEM培养基作用24 h;TAK-242+HG组:30 μmol/L TAK-242和含高浓度葡萄糖的DMEM培养基共处理心肌细胞24h;PDTC+HG组:100 μmol/L PDTC和含高浓度葡萄糖的DMEM培养基共处理心肌细胞24 h;DZ组:100 μmol/L DZ预处理心肌细胞30 min,PBS液洗2次后,用 DMEM培养基作用 24 h;TAK-242组:30 μmol/L TAK-242与DMEM培养基共处理心肌细胞24 h;PDTC组:100 μmol/L PDTC与DMEM培养基共处理心肌细胞24 h。
2.3 Western blot检测TLR4和NF-κB p65的蛋白水平 在60 mm培养皿中种植H9c2心肌细胞,待细胞生长至大约80%的融合度时,根据分组给予相应处理后,加入细胞裂解液,4℃摇床上处理30 min,12 000 r/min高速离心10 min,以二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白质含量。等量的蛋白经10% 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后,转移至PVDF膜上,5%脱脂奶粉封闭1 h,加入I抗,即兔抗鼠TLR4、NF-κB p65、p-NF-κB p65或β-actin(浓度均为1∶1 000),4℃作用过夜后加入浓度为1∶2 500的II抗稀释液,室温下孵育1.5 h。用增强化学发光法使PVDF膜显色,暗室中将显色条带曝光到医用X线片上,凝胶成像扫描系统分析结果。实验重复5次。
2.4 双抗体夹心ABC-ELISA法检测细胞培养液中IL-1β和TNF-α的水平 于96孔板中种植H9c2心肌细胞,待细胞融合度达到大约80%时,按照分组给予不同的处理后,收集培养基作待测标本。ELISA操作流程根据试剂盒说明书进行,在终止显色反应后,用酶标仪测定各孔450 nm处吸光度(A)值。取5孔A值的平均数,根据以下公式计算IL-1β和TNF-α的诱导释放率(%):处理组A/对照组A×100%。实验重复5次。
2.5 CCK-8法测定心肌细胞存活率 于96孔板中种植H9c2心肌细胞,待细胞融合度达到约80%时,按照设定的分组分别处理后,于每孔中加入DMEM 90 μL和CCK-8溶液10 μL,培养箱内孵育2.5 h,酶标仪上读取450 nm处的A值。细胞存活率按照以下公式计算:细胞存活率(%)=处理组A/对照组A ×100%。实验重复5次。
(2)在搅拌站控制室内,应逐一打印记录沥青和各种矿物用料的用量和两者的拌合温度,并定期检查核验搅拌站的计量和温度测量;不能使用无材料用量和温度自动记录装置的拌和机。
2.6 Rh123染色荧光显微镜照相法检测线粒体膜电位(mitochondrial membrane potential,MMP) 用24孔板培养H9c2心肌细胞,当细胞融合度为80%左右时,按照分组给予相应的处理后,加入稀释的Rh 123缓冲液,细胞培养箱中孵育45 min,荧光显微镜下随机照片记录5个高倍镜视野,应用图像分析软件(ImageJ 1.47i)计算出绿色荧光强度的平均值,即平均荧光强度(mean fluorescent intensity,MFI),再对每组数据进行统计分析。实验重复5次。
2.7 DCFH-DA染色荧光显微镜照相法测定胞内ROS水平 用24孔板培养H9c2心肌细胞,待细胞融合度达到约80%时,按照分组给予相应处理后,加入DCFH-DA染液(浓度为10 μmol/L),细胞培养箱中孵育30 min,荧光显微镜下随机照片记录5个高倍镜视野,应用ImageJ 1.47i软件计算出绿色荧光的MFI,再对每组数据进行统计分析。实验重复5次。
2.8 Hoechst 33258核染色荧光显微镜照相法测定凋亡细胞数量 用24孔板培养H9c2肌细胞,待细胞生长至约80%的融合度时,按照分组给予相应处理后,4%的多聚甲醛作用10 min,加入 Hoechst 33258染料缓冲液(浓度为5 mg/L),细胞培养箱中孵育30 min,荧光显微镜下可观察到:正常心肌细胞呈弥散均匀的低密度荧光,凋亡细胞则表现为细胞核呈致密的固缩形态或颗粒荧光,随机照片记录5个高倍镜视野,应用ImageJ 1.47i软件计算出蓝色荧光的MFI,再对各组进行数据分析统计。实验重复5次。
3 统计学处理
应用SPSS 17.0软件进行统计数据处理和分析,计量资料采用均数±标准误(mean±SEM)表示,单因素方差分析(one-way ANOVA)用于多个样本均数间的比较,SNK-q检验用于多个样本均数间的两两比较,以P<0.05为差异有统计学显著性。
结果
1 DZ抑制HG对心肌细胞TLR4和磷酸化NF-κB p65蛋白水平的上调作用
图1显示,HG处理H9c2心肌细胞24 h,可引起TLR4和p-NF-κB p65的蛋白水平明显上升,与HG损伤组比较,差异有统计学显著性(P<0.01)。应用100 μmol/L KATP通道开放剂DZ预处理心肌细胞30 min,可明显降低TLR4和p-NF-κB p65的蛋白水平,与HG组分别比较,差异均有统计学显著性(P<0.01)。DZ本身对心肌细胞的TLR4和p-NF-κB p65蛋白水平无明显影响。
2 TAK-242减轻HG对磷酸化NF-κB p65蛋白水平的上调作用
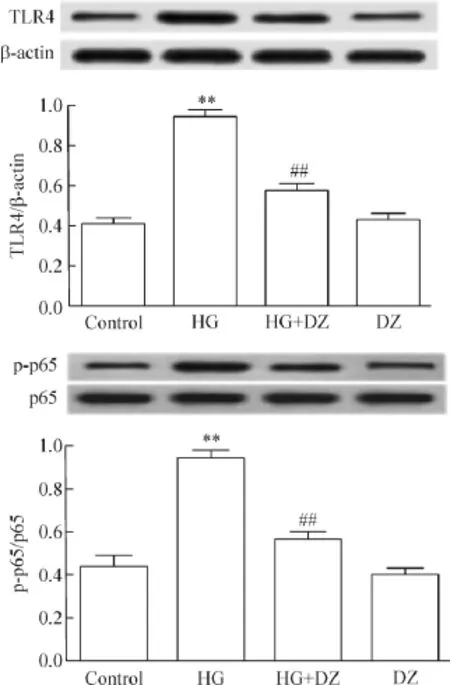
Figure 1.Diazoxide(DZ,a KATPchannel opener)attenuated the high glucose(35 mmol/L glucose,HG)-induced upregulation of TLR4 and p-NF-κB p65 in the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图1 DZ(KATP通道开放剂)抑制HG对心肌细胞TLR4和磷酸化NF-κB p65蛋白水平的上调作用
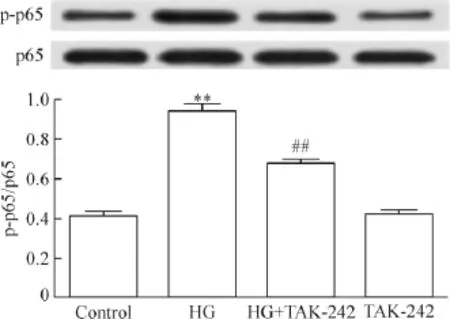
Figure 2.TAK-242(an inhibitor of TLR4)attenuated the HG-induced up-regulation of p-NF-κB p65 protein level in the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图2 TAK-242(TLR4抑制剂)减弱HG对磷酸化NF-κB p65蛋白水平的上调作用
3 DZ、TAK-242和PDTC抑制HG诱导的心肌细胞炎症因子分泌
如图3所示,HG处理心肌细胞24 h可诱导出明显的炎症反应,表现为IL-1β和TNF-α的分泌水平明显增高,与control组比较,差异有统计学显著性(P<0.01)。应用100 μmol/L DZ预处理心肌细胞30 min可使IL-1β和TNF-α的分泌水平明显降低,与HG组比较,差异均有统计学显著性(P<0.01)。
与DZ抑制炎症因子分泌的作用相类似,30 μmol/L TAK-242或100 μmol/L PDTC(NF-κB抑制剂)和HG共处理心肌细胞24 h也能拮抗HG对炎症因子分泌的促进作用,使IL-1β和TNF-α的分泌水平降低,与HG组分别比较,差异均有统计学显著性(P<0.01)。100 μmol/L DZ、30 μmol/L TAK-242或100 μmol/L PDTC本身不影响细胞炎症因子的基础分泌水平。

Figure 3.DZ(a KATPchannel opener),TAK-242(an inhibitor of TLR4)and PDTC(an inhibitor of NF-κB)attenuated the HG-induced secretion of inflammatory cytokines in the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图3 DZ(KATP通道开放剂)、TAK-242(TLR4抑制剂)和PDTC(NF-κB抑制剂)抑制HG诱导的心肌细胞分泌炎症细胞因子
4 DZ、TAK-242和PDTC抑制HG引起的心肌细胞毒性
图4显示,HG作用心肌细胞24 h可使细胞存活率降低至(39.7±2.60)%,提示HG可产生明显的心肌细胞毒性。应用100 μmol/L DZ预处理心肌细胞能明显地抑制HG引起的心肌细胞毒性,升高细胞存活率,与HG组比较,差异有统计学显著性(P<0.01)。100 μmol/L DZ本身对心肌细胞存活率无显著影响。
与DZ的作用相类似,30 μmol/L TAK-242或100 μmol/L PDTC和HG共处理心肌细胞24 h均能明显地抑制HG引起的心肌细胞毒性,使细胞存活率升高,与HG组比较,差异均有统计学显著性(P<0.01)。TAK-242或PDTC本身对心肌细胞的存活率无明显的影响。
5 DZ、TAK-242和PDTC抑制HG引起的心肌细胞MMP丢失
图5所示,HG可使心肌细胞内Rh123的MFI从(30.5±1.27)%降低至(9.6±0.90)%(P<0.01)。采用100 μmol/L DZ预处理心肌细胞30 min可明显减少MMP的丢失,使MFI升高至(20.9±1.00)%,与HG组比较,差异有统计学显著性(P<0.01)。100 μmol/L DZ本身不影响心肌细胞MMP水平。

Figure 4.DZ(a KATPchannel opener),TAK-242(an inhibitor of TLR4)and PDTC(an inhibitor of NF-κB)inhibited the HG-induced cytotoxicity in the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图4 DZ(KATP通道开放剂)、TAK-242(TLR4抑制剂)和PDTC(NF-κB抑制剂)减轻HG引起的心肌细胞毒性

Figure 5.DZ(a KATPchannel opener),TAK-242(an inhibitor of TLR4)and PDTC(an inhibitor of NF-κB)inhibited the HG-induced loss of mitochondrial membrane potential(MMP)in the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图5 DZ(KATP通道开放剂)、TAK-242(TLR4抑制剂)和PDTC(NF-κB抑制剂)抑制高糖引起的心肌细胞MMP丢失
与DZ的线粒体保护作用相类似,应用30 μmol/ L TAK-242或100 μmol/L PDTC和HG共处理心肌细胞24 h也能对抗HG引起的心肌细胞MMP丢失作用,使MFI分别增加至(21.2±0.87)%(HG+ TAK-242组)和(21.7±1.10)%(HG+PDTC组)。分别单独应用30 μmol/L TAK-242或100 μmol/L PDTC处理心肌细胞24 h对细胞的MMP无明显影响,见图5。
6 DZ、TAK-242和PDTC抑制HG引起的心肌细胞氧化应激反应
采用HG作用心肌细胞24 h可使细胞内的DCFH-DA的MFI明显增强,与control组比较,差异有统计学显著性(P<0.01)。应用100 μmol/L DZ预处理心肌细胞30 min可减少细胞内ROS的堆积,MFI从(30.9±1.02)%(HG组)降低至(17.8± 0.60)%,两者比较差异有统计学显著性(P<0.01)。单独应用100 μmol/L DZ预处理心肌细胞对ROS生成无明显影响。
与DZ的抗氧化作用相类似,应用30 μmol/L TAK-242或100 μmol/L PDTC和HG共处理心肌细胞24 h,均能抑制HG引起的细胞内ROS堆积,使MFI分别升高至(17.3±0.76)%(HG+TAK-242 组)和(17.8±1.07)%(HG+PDTC组)。分别单独应用30 μmol/L TAK-242或100 μmol/L PDTC处理心肌细胞24 h对ROS的生成无明显的影响,见图6。

Figure 6.DZ(a KATPchannel opener),TAK-242(an inhibitor of TLR4)and PDTC(an inhibitor of NF-κB)attenuated the HG-induced accumulation of intracellular reactive oxygen species(ROS)in H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图6 DZ(KATP通道开放剂)、TAK-242(TLR4抑制剂)和PDTC(NF-κB抑制剂)减轻HG引起的心肌细胞氧化应激反应
7 DZ、TAK-242和PDTC抑制HG引起的致心肌细胞凋亡作用
HG状态可导致心肌细胞凋亡,经Hoechst 33258核染色后,在荧光显微镜下可观察到呈现典型凋亡特征的细胞数量明显增多,与control组比较,差异有统计学显著性(P<0.01)。然而,100 μmol/L DZ预处理H9c2心肌细胞30 min能显著地减少凋亡细胞的数量,与HG组比较差异有统计学显著性(P<0.01)。DZ本身对心肌细胞凋亡无明显的影响。
与DZ的抗凋亡作用相似,30 μmol/L TAK-242 或100 μmol/L PDTC和HG共处理心肌细胞24 h也能明显减少凋亡细胞的数量,与HG处理组分别比较,差异均有统计学显著性(P<0.01)。TAK-242或PDTC本身对细胞凋亡无明显影响,见图7。
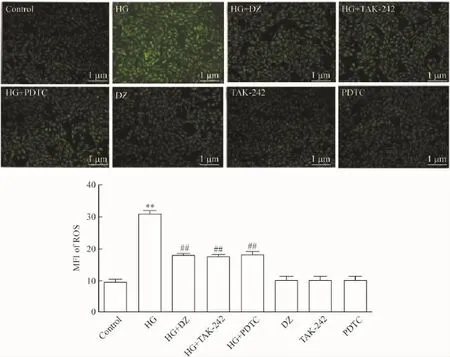
Figure 7.DZ(a KATPchannel opener),TAK-242(an inhibitor of TLR4)and PDTC(an inhibitor of NF-κB)reduced the HG-induced apoptosis of the H9c2 cardiac cells.Mean±SEM.n=5.**P<0.01 vs control group;##P<0.01 vs HG group.图7 DZ(KATP通道开放剂)、TAK-242(TLR4抑制剂)和PDTC(NF-κB抑制剂)抑制高糖诱导的心肌细胞凋亡
讨论
本研究在应用HG损伤H9c2肌细胞建立的DCM细胞模型中再次证实,HG可引起心肌细胞的多种损伤,表现为细胞存活率降低(细胞毒性作用),MMP丢失(线粒体损伤)、ROS生成(氧化应激)、凋亡细胞数量(致凋亡作用)和炎症因子(IL-1β和TNF-α)分泌增多,这与我们之前的报道[10,12-14]相一致。此外,与近年的报道相近似[5-6,13-14],本实验还观察到HG可明显增加心肌细胞TLR4和p-NF-κB p65的蛋白水平,应用TLR4的抑制剂可减弱HG对p-NF-κB p65的上调作用,提示:TLR4位于NF-κB通路的上游,HG可激活TLR4/NF-κB信号通路。TLR4 是TLRs家族中的重要成员,可激活NF-κB通路、调控炎症因子(如IL-1、IL-6、IL-1β和TNF-α等)的分泌[5],参与多器官脏器的炎症损伤。在本研究中我们分别观察了TLR4的抑制剂TAK-242和NF-κB通路的抑制剂PDTC对HG引起心肌细胞损伤和炎症的影响。结果表明,TAK-242和PDTC均能显著减轻HG对心肌细胞的多种损伤及炎症反应,使细胞存活率升高,MMP丢失、ROS生成、凋亡细胞数量和炎症因子(IL-1β和TNF-α)分泌减少。以上结果清晰地提示TLR4/NF-κB信号通路介导HG引起的心肌细胞损伤及炎症。这从细胞学水平进一步深化了de Laat等[6]的研究结果(仅观察HG可上调心肌TLR4表达水平,没有进一步用拮抗剂探讨TLR4/NF-κB通路在HG诱导的心肌损伤和炎症中的作用),为深入阐明炎症通路在高糖引起心肌损伤中的作用机制提供了新颖的实验依据。
重要的是,我们还探讨了KATP通道与TLR4/NF-κB信号通路的关系。研究表明:KATP通道大量存在于心血管组织中,发挥重要的生理和病理生理作用[15]。心肌细胞KATP通道能够偶联细胞能量代谢和兴奋性,在应对各种病理生理应激时,KATP通道的开放能缩短动作电位,降低心肌细胞能量消耗,增加应激的耐受性,从而保护心肌。最近我们证实,开放KATP通道可对抗高血糖引起的 H9c2心肌细胞损伤[10],但其心肌保护机制尚未完全明确。Zhao等[11]研究证实,激活KATP通道可通过抑制TLR4的活动减轻神经细胞的炎症反应;Kawamura等[16]指出,开放KATP通道可抑制冠状动脉旁路搭桥手术患者NF-κB通路的激活。由此可见,KATP通道与TLR4 和NF-κB通路的关系非常密切。但开放KATP通道能否通过调控TLR4/NF-κB通路从而保护心肌细胞对抗高糖引起的损伤和炎症,目前尚未见报道。为此,我们首先观察了KATP通道开放剂DZ对HG促进TLR4和NF-κB p65表达的影响。结果显示DZ能明显抑制HG对TLR4和p-NF-κB p65的上调作用。此外,应用DZ预处理及分别应用TLR4和NF-κB的抑制剂共处理心肌细胞均能产生类似的心肌保护效应,减轻HG诱导的炎症反应、细胞毒性、氧化应激、线粒体损伤及致细胞凋亡作用。这些结果有力地证明,开放KATP通道可通过抑制TLR4/NF-κB信号通路对抗HG引起的心肌细胞损伤和炎症,这可能是KATP通道心肌保护的重要机制之一。
综上所述,本研究证实,TLR4/NF-κB通路介导HG引起的心肌细胞损伤和炎症;开放KATP通道可通过抑制TLR4/NF-κB通路对抗高糖引起的心肌细胞损伤和炎症。
[1] Fang Q,Wang J,Wang L,et al.Attenuation of inflammatory response by a novel chalcone protects kidney and heart from hyperglycemia-induced injuries in type 1 diabetic mice[J].Toxicol Appl Pharmacol,2015,288(2): 179-191.
[2] Rajesh M,Bátkai S,Kechrid M,et al.Cannabinoid 1 receptor promotes cardiac dysfunction,oxidative stress,inflammation,and fibrosis in diabetic cardiomyopathy[J].Diabetes,2012,61(3):716-727.
[3] Pan Y,Wang Y,Zhao Y,et al.Inhibition of JNK phosphorylation by a novel curcumin analog prevents high glucose-induced inflammation and apoptosis in cardiomyocytes and the development of diabetic cardiomyopathy[J].Diabetes,2014,63(10):3497-3511.
[4] Fuentes-Antrás J,Ioan AM,Tuón J,et al.Activation of Toll-like receptors and inflammasome complexes in the diabetic cardiomyopathy-associated inflammation[J].Int J Endocrinol,2014,2014:847827.
[5] Dasu MR,Devaraj S,Park S,et al.Increased Toll-like receptor(TLR)activation and TLR ligands in recently diagnosed type 2 diabetic subjects[J].Diabetes Care,2010,33(4):861-868.
[6] de Laat MA,Gruntmeir KJ,Pollitt CC,et al.Hyperinsulinemia down-regulates TLR4 expression in the mammalian heart[J].Front Endocrinol(Lausanne),2014,5:120.
[7] Noma A.ATP-regulated K+channels in cardiac muscle [J].Nature,1983,305(5930):147-148.
[8] Eisen A,Fisman EZ,Rubenfire M,et al.Ischemic preconditioning:nearly two decades of research.A comprehensive review[J].Atherosclerosis,2004,172(2):201-210.
[9] Sierra A,Zhu Z,Sapay N,et al.Regulation of cardiac ATP-sensitive potassium channel surface expression by calcium/calmodulin-dependent protein kinase II[J].J Biol Chem,2013,288(3):1568-1581.
[10]梁伟杰,陈景福,张稳柱,等.ATP敏感性钾通道在硫化氢抑制高糖引起的心肌细胞损伤中的作用[J].中国病理生理杂志,2015,31(5):785-790.
[11]Zhao AP,Dong YF,Liu W,et al.Nicorandil inhibits inflammasome activation and Toll-like receptor-4 signal transduction to protect against oxygen-glucose deprivationinduced inflammation in BV-2 cells[J].CNS Neurosci Ther,2014,20(2):147-153.
[12]Xu W,Wu W,Chen J,et al.Exogenous hydrogen sulfide protects H9c2 cardiac cells against high glucose-induced injury by inhibiting the activities of the p38 MAPK and ERK1/2 pathways[J].Int J Mol Med,2013,32(4): 917-925.
[13]梁伟杰,陈景福,宋明才,等.血管紧张素-(1-7)/Mas受体轴通过调控NF-κB通路保护心肌细胞对抗高糖诱导的损伤[J].中国病理生理杂志,2015,31(2):267-273.
[14] Xu W,Chen J,Lin J,et al.Exogenous H2S protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting the activation of the NF-κB and IL-1β pathways[J].Int J Mol Med,2015,35(1):177-186.
[15]Tinker A,Aziz Q,Thomas A.The role of ATP-sensitive potassium channels in cellular function and protection in the cardiovascular system[J].Br J Pharmacol,2014,171 (1):12-23.
[16]Kawamura T,Kadosaki M,Nara N,et al.Nicorandil attenuates NF-κB activation,adhesion molecule expression,and cytokine production in patients with coronary artery bypass surgery[J].Shock,2005,24(2):103-108.
(责任编辑:陈妙玲,罗 森)
Opening of ATP-sensitive K+channels protects H9c2 cardiac cells against high glucose-induced injury and inflammation by inhibiting TLR4/NF-κB pathway
LIANG Wei-jie1,2,CHEN Mei-ji3,HE Jie-yi1,2,HUANG Hui-min1,2,YU Sheng-long1,2,CHEN Jun1,2,CHEN Jing-fu4,SONG Ming-cai1,2,LIAO Xin-xue5
(1Department of Cardiology,Central Hospital of Panyu District,2Cardiovascular Institute of Panyu District,Guangzhou 511400,China;3Department of Pediatrics,4Cardiac Care Unit,Department of Cardiology,Huangpu Division of The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510700,China;5Department of Cardiology,The First Affiliated Hospital,Sun Yat-sen University,Guangzhou 510080,China.E-mail:liaoxinx@mail.sysu.edu.cn)
AIM:To investigate whether the opening of ATP-sensitive K+(KATP)channels protects H9c2 cardiac cells against high glucose(HG)-induced injury and inflammation by inhibiting the Toll-like receptor 4(TLR4)/nuclear factor-κB(NF-κB)pathway.METHODS:The protein levels of TLR4 and NF-κB p65 were determined by Western blot.The levels of interleukin-1β(IL-1β)and tumor necrosis factor-α(TNF-α)were detected by ELISA.The cell viability was measured by CCK-8 assay.Mitochondrial membrane potential(MMP)was examined by rhodamine 123(Rh 123) staining followed by photofluorography.The intracellular levels of reactive oxygen species(ROS)were detected by 2',7'-dichlorfluorescein-diacetate(DCFH-DA)staining followed by photofluorography.The number of apoptotic cells was observed by Hoechst 33258 nuclear staining followed by photofluorography.RESULTS:After the H9c2 cardiac cells were treated with HG(35 mmol/L glucose)for 24 h,the protein levels of TLR4 and phosphorylated NF-κB p65(p-NF-κB p65)were significantly increased.Pretreatment of the cells with 100 μmol/L diazoxide(DZ,a KATPchannel opener)for 30 min before exposure to HG considerably blocked the up-regulation of the TLR4 and p-NF-κB protein levels induced by HG.Moreover,co-treatment of the cells with 30 μmol/L TAK-242(an inhibitor of TLR4)obviously inhibited the HG-induced up-regulation of the p-NF-κB p65 protein level.On the other hand,pretreatment of the cells with 100 μmol/L DZ had a clear myocardial protection effect,which attenuated the HG-induced cytotoxicity,inflammatory response,mitochondrial damage,oxidative stress and apoptosis,evidenced by an increase in the cell viability,and decreases in the levels of IL-1β and TNF-α,MMP loss,ROS generation and the number of apoptotic cells.Similarly,co-treatment of H9c2 cardiac cells with 30 μmol/L TAK-242 or 100 μmol/L PDTC(an inhibitor of NF-κB)and HG for 24 h also obviously reduced the above injuries and inflammation induced by HG.CONCLUSION:The opening of KATPchannels protects H9c2 cardiac cells against HG-induced injury and inflammation by inhibiting the TLR4/NF-κB pathway.
ATP-sensitive K+channels;Toll-like receptor 4;Nuclear factor-κB;High glucose;Cardiomyocytes;Injury;Inflammation
R363
A
10.3969/j.issn.1000-4718.2016.07.001
1000-4718(2016)07-1153-08
2016-02-02
2016-03-21
国家自然科学基金资助项目(No.81270296);番禺区科技计划项目(No.2015-Z03-57);番禺区中心医院青年基金资助项目(No.2014-Q-01)
△Tel:020-87332628;E-mail:liaoxinx@mail.sysu.edu.cn
