硫化氢在ob/ob小鼠皮肤创面愈合中的作用与调控机制*
2016-08-24赵蕙琛柴家超王媛妹王园园郭秀芝管庆波刘元涛
赵蕙琛, 柴家超, 郑 杰, 王媛妹, 王园园, 郭秀芝, 管庆波, 刘元涛
(山东大学第二医院1内分泌科,4心内科,5肾内科,山东济南250033;2青岛市立医院内分泌科,山东青岛266071;山东大学附属省立医院3儿外科,7内分泌科,山东济南250021;6泰安市中心医院分院职二科,山东泰安271000)
硫化氢在ob/ob小鼠皮肤创面愈合中的作用与调控机制*
赵蕙琛1,2, 柴家超3, 郑 杰4, 王媛妹1, 王园园5, 郭秀芝6, 管庆波7△, 刘元涛2△
(山东大学第二医院1内分泌科,4心内科,5肾内科,山东济南250033;2青岛市立医院内分泌科,山东青岛266071;山东大学附属省立医院3儿外科,7内分泌科,山东济南250021;6泰安市中心医院分院职二科,山东泰安271000)
目的:观察硫化氢(H2S)对ob/ob小鼠皮肤创面愈合的影响并探讨其作用机制。方法:将ob/ob小鼠随机分为生理盐水组、胰岛素组和NaHS(H2S供体)组,C57BL/6小鼠作为对照组,构建小鼠背部皮肤创面模型。干预后检测各组H2S释放量;用Western blot检测胱硫醚γ-裂解酶(CSE)及基质金属蛋白酶-9(MMP-9)蛋白的表达差异;用RT-qPCR检测CSE的mRNA表达变化;使用免疫组织化学法检测中性粒细胞及单核/巨噬细胞的浸润数量;使用ELISA检测肿瘤坏死因子(TNF)-α和白细胞介素(IL)-6的水平;用Masson染色检测胶原沉积情况。结果:ob/ob小鼠皮肤创面肉芽组织中H2S释放及CSE蛋白、mRNA的表达水平以及胶原沉积显著低于C57BL/6小鼠(P<0.05)。外源性H2S可加速ob/ob小鼠皮肤创面愈合(P<0.05),增加胶原沉积。ob/ob小鼠创面中性粒细胞及单核/巨噬细胞浸润数量,TNF-α、IL-6的水平及MMP-9蛋白表达水平显著增加(P<0.05),NaHS组显著降低。结论:H2S可显著改善糖尿病难愈性溃疡的愈合,作用机制可能与其抗炎作用有关。
糖尿病;创面愈合;硫化氢;胱硫醚γ-裂解酶;抗炎作用
糖尿病足是糖尿病常见的微血管并发症,常引起较高的致残率和致死率[1]。近年来研究表明,糖尿病持续炎症状态是糖尿病难愈性溃疡的重要机制。有学者发现在糖尿病患者中,中性粒细胞、单核/巨噬细胞数量、肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-6、IL-1β等炎症反应因子持续升高[2];大量的炎性因子可刺激创面多种细胞产生过量基质金属蛋白酶(matrix metalloproteinases,MMPs),分解细胞外基质成分,从而影响成纤维细胞、上皮细胞、内皮细胞等修复细胞在创面的附着及肉芽组织形成,导致伤口愈合延迟。
硫化氢(hydrogen sulfide,H2S)是继一氧化碳(carbon monoxide,CO)及一氧化氮(nitric oxide,NO)后发现的气体信号分子。在哺乳动物体内,硫化氢是以L-半胱氨酸为底物,在吡哆醛磷酸盐依赖性胱硫醚γ-裂解酶(cystathionine γ-lyase,CSE)及胱硫醚β-合酶(cystathionine β-synthase,CBS)催化下产生的[3]。CBS主要分布于神经系统中,而CSE主要分布于外周系统中,特别是血管系统中[4]。在很长的时间里,硫化氢被认为是一种有毒的气体,最近研究发现硫化氢参与到很多生理病理过程中,尤其对炎症反应、基质金属蛋白酶等有重要的调节作用,最新研究发现硫化氢可以促进糖尿病小鼠的伤口愈合,其机制可能与恢复内皮祖细胞功能及激活血管紧张素-1有关[5],但是H2S/CSE代谢通路与糖尿病难愈性溃疡中炎症细胞浸润及MMPs之间有无内在联系尚未见报道。本文拟观察硫化氢在糖尿病伤口愈合的作用,从其对炎症的调控方面探讨其作用机制。
材料和方法
1 材料
C57BL/6及 B6.VLepob/J(leptin-deficient,ob/ ob)小鼠购于北京华阜康实验动物技术有限公司。兔抗CSE购于Proteintech。NaHS、兔抗CD68、兔抗EPO和兔抗MMP-9购于Abcam。兔抗GAPDH、鼠抗β-actin及辣根过氧化物酶标记的羊抗兔及羊抗鼠Ⅱ抗购于北京中杉金桥公司。ECL发光液、改良型BCA试剂盒、反转录试剂盒和实时荧光定量PCR试剂盒购于北京康为世纪生物科技有限公司。小鼠IL-6 ELISA试剂盒及小鼠TNF-α ELISA试剂盒购于联科生物科技有限公司。
2 主要方法
2.1 创立糖尿病小鼠创面模型 尾静脉检测ob/ob小鼠的血糖水平,随机血糖≥11.1 mmol/L确定为2型糖尿病模型。所有小鼠在乙醚麻醉状态下,行背部皮肤全层皮肤切开术,创立直径9 mm的圆形伤口。将ob/ob小鼠随机分为3组:生理盐水组、胰岛素(6 U·kg-1·d-1)组和NaHS(50 μmol·kg-1· d-1)组[5];C57BL/6组注射生理盐水作为对照组。创面创立的时间设为第0天,建立后2 h开始腹腔注射药物干预至创面完全愈合,每隔1 d给创面拍照,使用三脚架保证数码相机距离创面的距离固定,Photoshop CS6软件计算创面愈合速率,愈合速率为: 1-(第x天创面面积/第0天创面面积)。分别在创面创立后第3天、第6天或者第10天处死小鼠,第10天处死小鼠前尾静脉测定空腹血糖(fasting blood glucose,FBG)。第3天和第6天处死小鼠后快速取创面及周围1 cm皮肤放入液氮储存或者放入4%多聚甲醛中固定,待用。该动物实验研究经过山东大学医学院动物实验伦理审查委员会同意。
2.2 H2S浓度测定 药物干预6 d后,取小鼠背部创面肉芽组织20 mg置于100 mmol/L冰冻磷酸钾缓冲液中(pH 7.4)匀浆,4℃条件下离心 20 min (14 000 r/min)取上清并用BCA法测定蛋白浓度,冰上配制反应液500 μL(430 μL的组织裂解液,20 μL 10 mmol/L的L-半胱氨酸,20 μL 2 mmol/L的5-磷酸吡多醛,30 μL PBS);将离心管封口,37℃水浴孵育30 min;依次加入250 μL 1%的醋酸锌、250 μL 10%的三氯醋酸、133 μL 20 mmol/L对苯二胺盐酸、133 μL 30 mmol/L三氯化铁,避光20 min后取300 μL终反应液,于670 nm测量吸光度。根据标准曲线计算H2S的含量,并使用蛋白浓度矫正结果[5]。
2.3 Western blot实验 称取20 mg肉芽组织于300 μL RIPA及3 μL PMSF中匀浆,冰上裂解1 h,4℃条件下离心30 min(14 000 r/min),取上清并用BCA法测定蛋白浓度。取20 μg蛋白上样,经10%SDS聚丙烯酰胺凝胶电泳后电转至PVDF膜。5%TBS封闭1 h,4℃条件下,I抗孵育过夜;TBST洗膜8 min 4次,1∶5 000稀释的辣根过氧化物酶标记 II抗室温孵育1 h;充分洗膜后,ECL显色;NIH ImageJ 1.42定量分析结果。
2.4 RT-qPCR实验 依照已发表文章[6]的操作步骤提取肉芽组织RNA,根据反转录试剂盒及荧光定量PCR试剂盒的说明分别进行反转录及荧光定量聚合酶链式反应,18 s rRNA的上游引物为5’-CGCGGTTCTATTTTGTTGGT-3’,下游引物为5’-AGTCG-GCATCGTTTATGGTC-3’;CSE的上游引物为 5’-CCATCCACGTGGGACAAGAG-3’,下游引物为5’-GCGGCTGTATTCAAAACCCG-3’。
2.5 免疫组织化学染色法 创面组织固定后经石蜡包埋,切成5 μm的切片。经脱蜡及水化后,置于微波炉内进行抗炎修复,3%过氧化氢溶液室温避光孵育25 min,3%BSA室温封闭30 min,平放于湿盒内4°C加I抗孵育过夜,洗涤后加HRP标记的II抗室温孵育50 min,洗涤后DAB显色,Harris苏木素复染细胞核,最后脱水封片,镜下观察。
2.6 Masson染色 经脱蜡及水化后的肉芽组织切片经Weigert氏铁苏木素染色5 min;流水冲洗后用1%的盐酸乙醇分化数秒钟;流水冲洗返蓝;丽春红染色5~10 min,超纯水快速漂洗;磷钼酸处理3~5 min;不用水洗,直接用苯胺蓝液复染5 min;1%冰醋酸处理1 min;最后封片镜下观察。细胞核呈蓝黑色;胶原纤维呈蓝色;纤维素以及肌纤维显示红色。
2.7 ELISA 取肉芽组织10 mg于PBS及PMSF (1∶100)中匀浆,4℃条件下离心20 min(12 000 r/ min),取上清并用改良型BCA法测定蛋白浓度。取上清液后根据ELISA试剂盒的说明分别测量TNF-α 和IL-6的含量,并使用蛋白浓度来矫正结果。
3 统计学处理
采用GraphPad Prism 5.0统计分析,各组测定值均以均数±标准误(mean±SEM)表示,两组间数据比较采用两样本t检验;不同时间和处理4组间的比较使用两因素重复测量方差分析,各时点处的组间比较使用Bonferroni校正t检验;单纯4组间比较采用完全随机设计资料的方差分析,组间比较使用Bonferroni校正t检验;以P<0.05为差异有统计学意义。
结果
1 在 ob/ob小鼠中,H2S释放及 CSE的蛋白及mRNA的表达水平降低
为确定H2S/CSE代谢通路与糖尿病难愈性溃疡发生机理的关系,我们首先比较了皮肤及肉芽组织中H2S的浓度在糖尿病小鼠及非糖尿病小鼠中的差异。如图1所示,糖尿病小鼠的皮肤及肉芽组织中H2S的浓度均显著下降(P<0.05),经过6 d的NaHS治疗,肉芽组织中H2S的浓度明显升高(P<0.01)。同样的,CSE的蛋白及mRNA表达水平在糖尿病小鼠中显著下降。创面创立后第10天检测ob/ ob小鼠空腹血糖显示,NaHS组的血糖水平与生理盐水组比较无统计学显著性。
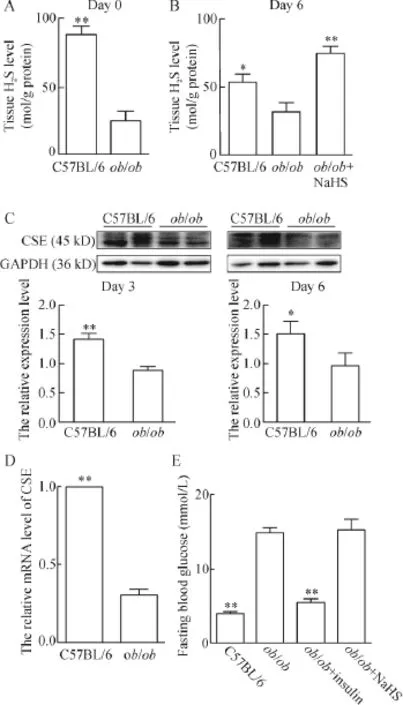
Figure 1.The levels of H2S,CSE protein and CSE mRNA in wound granulation tissue were decreased in diabetic mice.A:the skin tissue H2S levels in C57BL/6 and ob/ob mice;B:granulation tissue H2S level at day 6 after wound establishment and NaHS treatment;C: the CSE protein expression in wound granulation tissue was decreased in ob/ob mice at different time points; D:the mRNA level of CSE in the wound granulation tissue was decreased in ob/ob mice;E:the fasting blood glucose changes.Mean±SEM.n=3.*P<0.05,**P<0.01 vs ob/ob group.图1 ob/ob小鼠皮肤及肉芽组织中H2S浓度及CSE的蛋白及mRNA的表达水平降低
2 H2S可促进ob/ob小鼠创面愈合
为了进一步确定H2S/CSE代谢通路表达降低与糖尿病难愈性溃疡是否有关,我们检测了外源性H2S对伤口愈合的影响。结果显示ob/ob小鼠的创面愈合速度明显低于C57BL/6小鼠,经过NaHS干预,与ob/ob小鼠加生理盐水干预相比创面愈合速率明显加快(P<0.05或P<0.01),胰岛素治疗后愈合速率稍有增加,但差异无统计学显著性,见图2。
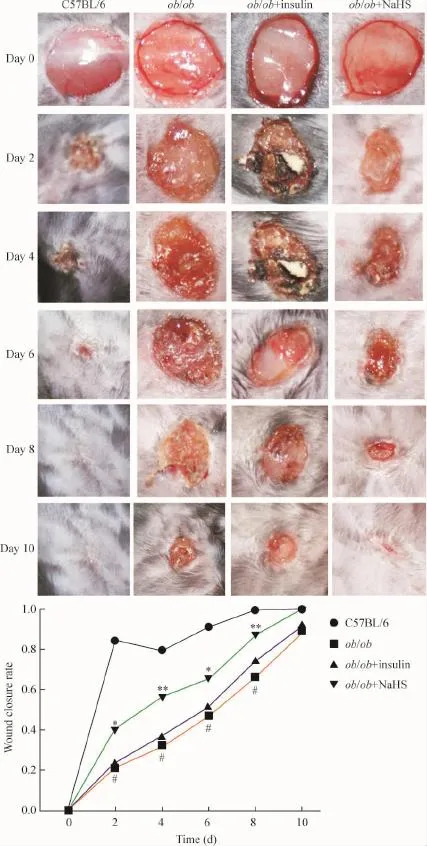
Figure 2.NaHS(H2S donor)accelerated wound healing in the ob/ob mice.Mean±SEM.n=4.#P<0.05 vs C57BL/6;*P<0.05,**P<0.01 vs ob/ob.图2 H2S促进ob/ob小鼠皮肤创面愈合
3 H2S可抑制创面中性粒细胞及单核/巨噬细胞的浸润
ob/ob小鼠创面中性粒细胞及单核/巨噬细胞数量明显多于C57BL/6小鼠(P<0.01),经过NaHS治疗6 d后,ob/ob小鼠的中性粒细胞及单核/巨噬细胞数量显著降低(P<0.01),经胰岛素治疗后ob/ob小鼠炎症细胞数量的变化差异无统计学显著性,见图3。
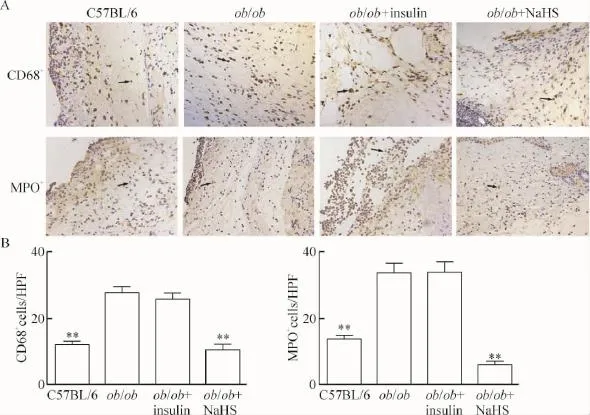
Figure 3.H2S attenuated neutrophil and macrophage infiltration in the ob/ob mice.A:the images showed representative neutrophil (MPO+)and monocyte/macrophage(CD68+)infiltration that stained brown(×200);B:the quantitative analysis of neutrophil and monocyte/macrophage infiltration measured under microscope as the total number of infiltrating MPO+or CD68+cells per high power field(HPF,×400).Mean±SEM.n=5.**P<0.01 vs ob/ob group.图3 H2S抑制ob/ob小鼠皮肤创面的中性粒细胞及单核/巨噬细胞的浸润
4 H2S可降低促炎症因子的产生
ob/ob小鼠肉芽组织中IL-6及TNF-α炎症因子的水平明显高于对照组小鼠(P<0.05),而经过NaHS干预6 d后,ob/ob小鼠中的IL-6及TNF-α水平明显降低(P<0.05),而经过胰岛素治疗后,IL-6 及TNF-α水平的变化差异无统计学显著性,见图4。
5 H2S可降低MMP-9的蛋白表达
ob/ob小鼠创面肉芽组织MMP-9的蛋白表达明显高于C57BL/6小鼠(P<0.05),经过NaHS治疗3 d后,ob/ob小鼠MMP-9的蛋白表达显著降低(P<0.05),见图5。
6 H2S可增加胶原蛋白的沉积
ob/ob小鼠创面的胶原沉积明显多于野生型小鼠,经过NaHS治疗6 d后,ob/ob小鼠的创面胶原沉积显著降低,经胰岛素治疗后ob/ob小鼠创面胶原沉积无明显增加,见图5。
讨论
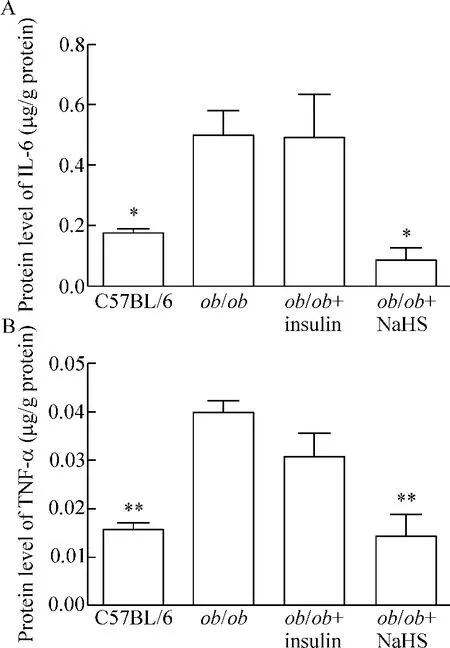
Figure 4.The effects of H2S on IL-6(A)and TNF-α(B)secretion in ob/ob mice.Mean±SEM.n=3.*P<0.05,**P<0.01 vs ob/ob group.图4 H2S显著降低TNF-α和IL-6水平
血管系统中内源性H2S主要通过半胱氨酸由CSE催化作用产生[7],具有强大的抗氧化、抗凋亡、促进血管生成和抗炎作用[8-9]。有研究发现糖尿病小鼠血浆中H2S浓度及CSE活性显著降低[5]。本研究发现糖尿病小鼠皮肤及肉芽组织中H2S释放量明显低于对照组小鼠,这与其他学者研究结果是一致的[5,10],CSE是分布于血管系统中催化产生H2S的酶,我们研究中证实糖尿病小鼠肉芽组织中CSE蛋白及mRNA表达水平明显低于野生型小鼠。此外,我们用以100 μmol/L的NaHS(可为H2S的供体)[5]经过6 d干预,肉芽组织中的H2S释放量明显升高。为了明确H2S与糖尿病难愈性溃疡的关系,我们进一步观察了H2S干预后糖尿病小鼠创面愈合的变化,结果显示H2S治疗显著地促进糖尿病创面愈合速率。有学者发现给予外源性H2S对于胰岛素敏感性无明显改善作用[11],可以促进骨骼肌细胞对葡萄糖的摄取,同时可以直接抑制高糖刺激下的胰岛素分泌[12]。我们的实验显示NaHS组的血糖水平与生理盐水组比较无统计学显著性。同时为排除血糖水平对创面愈合速率的影响,我们设置了胰岛素治疗组,结果显示胰岛素治疗组愈合速率与对照组相比无统计学显著性,从而提示H2S/CSE代谢通路表达降低可能是造成糖尿病难愈性溃疡的机制之一。
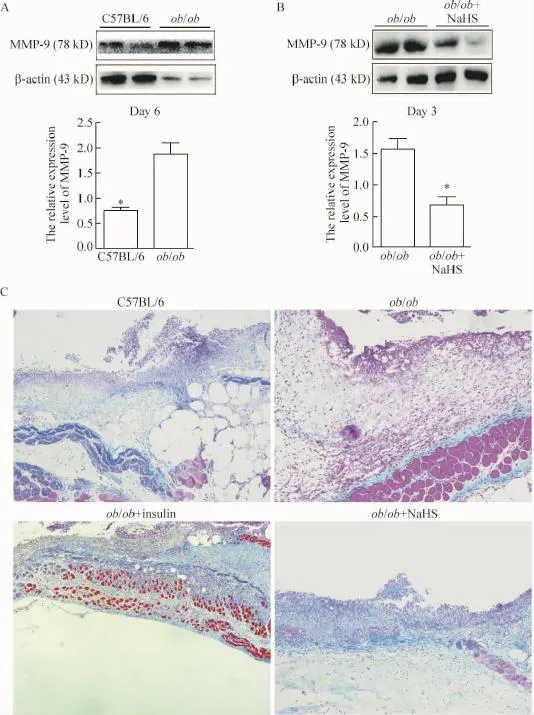
Figure 5.The effects of H2S on the protein expression of MMP-9 and collagen formation in the granulation tissues.A:the protein expression of MMP-9 in the wound granulation tissues was increased in ob/ob mice;B:the effect of H2S on the protein levels of MMP-9;C:representative photomicrographs of Masson trichrome staining(×40).Mean±SEM.n=3.*P<0.05 vs ob/ob.图5 H2S显著降低MMP-9蛋白表达的水平,增加创面的胶原沉积
为进一步确定H2S促进糖尿病创面愈合的作用机制,我们观察了H2S外源性供体(NaHS)干预后对创面炎症细胞浸润和炎症因子水平的影响。结果提示H2S抑制创面中性粒细胞及单核/巨噬细胞的浸润,并且降低TNF-α和IL-6的水平。众所周知,糖尿病难愈性溃疡的形成与创面慢性炎症迁延有密切关系。正常情况下,适当的炎症反应是创面愈合的必要条件。组织损伤后,中性粒细胞、单核/巨噬细胞向创伤部位迁移,通过去除坏死组织为伤口愈合提供床面,为下一步修复创造条件[13],同时这些细胞还分泌各种细胞因子及生长因子,吸引周围成纤维细胞及血管内皮细胞向创面迁移,通过产生细胞外基质及血管再生形成肉芽组织。正常情况下,创面急性炎症反应是自限性的,而糖尿病状态下创面炎症反应失控,主要表现为修复期炎症细胞的持续浸润以及TNF-α、IL-6等炎症因子水平持续升高[14]。因此,硫化氢对促进糖尿病创面愈合的作用机制可能是通过其抗炎作用实现的,但详细机制尚有待进一步探讨。
MMPs是由巨噬细胞分泌的蛋白酶超家族,可以降解多种细胞外基质成分(extracellular matrix,ECM)。而ECM可以为创面愈合提供床面,帮助内皮细胞、纤维母细胞、角质细胞迁移附着以及胶原沉积。Vacek等[15]发现过表达CSE和CBS、增加内源性H2S可显著性增加MMPs水平,同时降低特异性抑制因子金属蛋白酶组织抑制剂(tissue inhibitors of metalloproteinase,TIMPs)的水平。H2S可以降低MMP-9的表达同时诱导MMP-2的表达,我们实验发现在糖尿病小鼠肉芽组织MMP-9的表达水平升高,胶原沉积减少,而MMP-9水平的升高是糖尿病难愈性溃疡的机制之一,经H2S治疗后,可以降低ob/ob小鼠肉芽组织MMP-9的表达水平并且增加了创面的胶原沉积。所以,我们有理由相信H2S通过抑制MMP-9的表达来促进伤口愈合。
总之,本研究结果提示H2S/CSE代谢通路表达降低可能是糖尿病难愈性溃疡形成的重要机制之一。而外源性H2S可以促进糖尿病创面愈合,其机制可能与抑制中性粒细胞、单核/巨噬细胞炎症细胞浸润,降低炎症因子及MMP-9的表达水平有关。本研究为糖尿病难愈性溃疡的防治提供了新的思路,研究结果有待体内实验进一步证实。
[1] Geach T.Closing the NET on impaired wound healing in diabetes mellitus[J].Nat Rev Endocrinol,2015,11(8): 443.
[2] Wong SL,Demers M,Martinod K,et al.Diabetes primes neutrophils to undergo NETosis,which impairs wound healing[J].Nat Med,2015,21(7):815-819.
[3] Tao BB,Cai WJ,Zhu YC.H2S is a promoter of angiogenesis:identification of H2S"receptors"and its molecular switches in vascular endothelial cells[J].Handb Exp Pharmacol,2015,230:137-152.
[4] Liu Y,Zhao HC,Qiang Y,et al.Effects of hydrogen sulfide on high glucose-induced glomerular podocyte injury in mice[J].Int J Clin Exp Pathol,2015,8(6):6814-6820.
[5] Liu F,Chen DD,Sun X,et al.Hydrogen sulfide improves wound healing via restoration of endothelial progenitor cell functions and activation of angiopoietin-1 in type 2 diabetes[J].Diabetes,2014,63(6):1763-1778.
[6] Chen J,Ren J,Jing Q,et al.TSH/TSHR signaling suppresses fatty acid synthase(FASN)expression in adipocytes[J].J Cell Physiol,2015,230(9):2233-2239.
[7] 刘 晔,彭 力,卢圣霞,等.硫化氢对高糖诱导的小鼠足细胞损伤的影响[J].中国病理生理杂志,2014,30(4):670-674.
[8] Vacek TP,Rehman S,Neamtu D,et al.Matrix metalloproteinases in atherosclerosis:role of nitric oxide,hydrogen sulfide,homocysteine,and polymorphisms[J].Vasc Health Risk Manag,2015,11(1):173-183.
[9] Wallace JL,Ferraz JG,Muscara MN.Hydrogen sulfide: an endogenous mediator of resolution of inflammation and injury[J].Antioxid Redox Signal,2012,17(1):58-67.
[10]Wang G,Li W,Chen Q,et al.Hydrogen sulfide accelerates wound healing in diabetic rats[J].Int J Clin Exp Pathol,2015,8(5):5097-5104.
[11]于 婷.胰岛素抵抗大鼠硫化氢/胱硫醚γ-裂解酶体系的实验观察[D].山东:山东大学,2007.
[12]陈玉涵,李荣娜,王红霞.硫化氢对代谢综合征小鼠血糖和血胰岛素水平的调节[J].中国医药导报,2013,10(35):11-14.
[13]Bauer SM,Bauer RJ,Velazquez OC.Angiogenesis,vasculogenesis,and induction of healing in chronic wounds [J].Vasc Endovasc Surg,2005,39(4):293-306.
[14]Hanses F,Park S,Rich J,et al.Reduced neutrophil apoptosis in diabetic mice during staphylococcal infection leads to prolonged TNFα production and reduced neutrophil clearance[J].PLoS One,2011,6(8):e23633.
[15]Vacek TP,Rehman S,Neamtu D,et al.Matrix metalloproteinases in atherosclerosis:role of nitric oxide,hydrogen sulfide,homocysteine,and polymorphisms[J].Vasc Health Risk Manag,2015,11(1):173-183.
(责任编辑:陈妙玲,罗 森)
Effects of hydrogen sulfide on impaired wound healing in ob/ob mice
ZHAO Hui-chen1,2,CHAI Jia-chao3,ZHENG Jie4,WANG Yuan-mei1,WANG Yuanyuan5,GUO Xiu-zhi6,GUAN Qing-bo7,LIU Yuan-tao2
(1Department of Endocrinology,4Department of Cardiology,5Department of Nephrology,The Second Hospital of Shandong University,Jinan 250033,China;2Department of Endocrinology,Qingdao Municipal Hospital,Qingdao 266071,China;3Department of Pediatric Orthopaedic,7Department of Endocrinology,Provincial Hospital Affiliated to Shandong University,Jinan 250021,China;6The Second Department of Occupational Medicine,Central Hospital Branch of Taian City,Taian 271000,China.E-mail:sduliuyuantao@163.com;guanqingbo@medmail.com.cn)
AIM:To investigate the role of hydrogen sulfide(H2S)on impaired wound healing in ob/ob mice and the underlying mechanism.METHODS:The ob/ob mice were randomly divided into 3 groups,including vehicle,insulin and NaHS for treatment.C57BL/6 mice were treated with vehicle as control.Full-thickness punch biopsy wounds were created on the mice.Firstly,H2S concentrations in the skins and granulation tissues were measured.The mRNA expression of cystathionine γ-lyase(CSE)was detected by RT-qPCR.The protein expression of CSE and MMP-9 were determined by Western blot.The neutrophil and monocyte/macrophage infiltration was analyzed by immunohistochemistry method.The levels of tumor necrosis factor(TNF)-α and interleukin(IL)-6 were measured by ELISA.Collagen formation was measured by Masson staining.RESULTS:The H2S levels in the skin and granulation were significantly decreased in ob/ob mice and increased in the NaHS-treated mice(P<0.05).CSE expression at mRNA and protein levels was significantly decreased in ob/ob mice compared with the control mice(P<0.05).The wound healing period was significantly shorter in NaHS group than that in vehicle-treated ob/ob mice group(P<0.05),in which the insulin group had no difference with vehicle ob/ob mice group.The neutrophil and monocyte/macrophage infiltration,and TNF-α and IL-6 levels were significantly increased in ob/ob groups,but were decreased in NaHS group(P<0.01 or P<0.05).Meanwhile,NaHS increased collagen formation in the granulation tissues of ob/ob mice.CONCLUSION:H2S/CSE down-regulation contributesto impaired wound healing in diabetes,which is alleviated by exogenous H2S possibly through anti-inflammation.
Diabetes;Wound healing;Hydrogen sulfide;Cystathionine γ-lyase;Anti-inflammation
R587.2;R363
A
10.3969/j.issn.1000-4718.2016.07.003
1000-4718(2016)07-1167-07
2016-02-24
2016-05-16
山东省自然科学基金资助项目(No.ZR2012HL50)
△刘元涛Tel:0532-88905638;E-mail:sduliuyuantao@163.com;管庆波Tel:0531-85186910;E-mail:guanqingbo@ medmail.com.cn
