乳酸乳球菌乳脂亚种BTQY-112增殖培养基的优化
2016-08-23王菲菲包头轻工职业技术学院内蒙古包头014045
王菲菲(包头轻工职业技术学院,内蒙古包头014045)
乳酸乳球菌乳脂亚种BTQY-112增殖培养基的优化
王菲菲
(包头轻工职业技术学院,内蒙古包头014045)
对乳酸乳球菌乳脂亚种BTQY-112增殖培养基进行优化研究。经试验确定乳酸乳球菌乳脂亚种BTQY-112最适培养基为:葡萄糖为5 g/L,乳糖为5 g/L,酪蛋白胨3.3 g/L,大豆蛋白胨3.3 g/L,鱼蛋白胨3.3 g/L,β-甘油磷酸二钠28.5 g/L,Tween-80 0.5 g/L,七水硫酸镁0.25 g/L,乙酸钠1.55 g/L,K2HPO40.83 g/L,柠檬酸钠0.62 g/L,抗坏血酸钠1.5 g/L。在此增殖培养基中经30℃,14 h培养活菌数提高了4.3倍。
乳酸乳球菌乳脂亚种;增殖培养基;优化
乳酸乳球菌乳脂亚种是一类具有潜在益生特性的乳酸菌,在食品、医药等行业具有广泛的应用前景。作为发酵剂的重要菌种来源,乳酸乳球菌乳脂亚种在益生菌发酵乳制品生产中发挥了重要作用[1],也可用于干酪的生产,其产品组织状态和风味良好[2]。本文就乳酸乳球菌乳脂亚种BTQY-112增殖培养基进行优化,以得到最适的培养基组成,为该菌株高密度培养以及商品发酵剂的研究奠定基础。
1 材料与方法
1.1试验菌株
乳酸乳球菌乳脂亚种BTQY-112:分离自锡林锅勒盟牧区,由包头轻工职业技术学院乳品工程学院菌种库保藏。
1.2菌株的保存与活化
乳酸乳球菌乳脂亚种BTQY-112菌株于甘油管中-80℃保存,使用前,接种于M17培养基30℃培养8 h~10 h,活化两代后备用。
1.3主要培养基
M17液体培养基:蛋白胨10.0 g,酵母粉2.5 g,牛肉膏5 g,β-甘油磷酸二钠28.5 g,MgSO4·7H2O 0.25 g,抗坏血酸钠1.5 g,乳糖10 g,蒸馏水1 000 mL,1 mol/L HCl调pH为7.2,121℃15 min灭菌。
M17琼脂培养基:M17液体培养基中加人1.5%琼脂粉,121℃15 min灭菌[3]。
1.4主要仪器
LDZX-50KBS高压灭菌锅:上海申安医疗器械厂;BPX-82电热恒温培养箱:上海博迅实业有限公司医疗设备厂;BCN-1360B超净工作台:哈尔滨东联电子技术开发有限公司;AL204电子分析天平、FE20K PH计:梅特勒-托利多食品(上海)有限公司;T6紫外/可见分光光度计:北京普析通用仪器有限公司;GL-20G-Ⅱ高速冷冻离心机:上海安亭科学仪器厂;Kjeltec 2300全白动凯氏定氮仪:丹麦Foss公司;FT120乳成分分析仪:瑞士FOSS公司;Nova Satety乳脂肪离心机:德国Gerber公司。
1.5方法
在M17基础培养基上,采用单因素试验对其增殖培养基成分中的氮源、碳源、生长因子及缓冲盐进行选择,通过正交试验对各成分之间的配比进行优化。
2 结果与讨论
2.1培养基碳源的优化
在M17基础培养基上,用不同的碳源分别取代M17中的碳源,筛选出适宜菌株生长的碳源,采用不同比例的适宜碳源,接种发酵,根据生长末期菌体生长情况判断菌体适合生长的碳源及其碳源比例。采用复合配比试验确定优化的不同碳源的复配效果。不同碳源对菌株BTQY-112生长情况的影响见图1,不同浓度葡萄糖和乳糖对BTQY-112菌株生长情况的影响见图2。
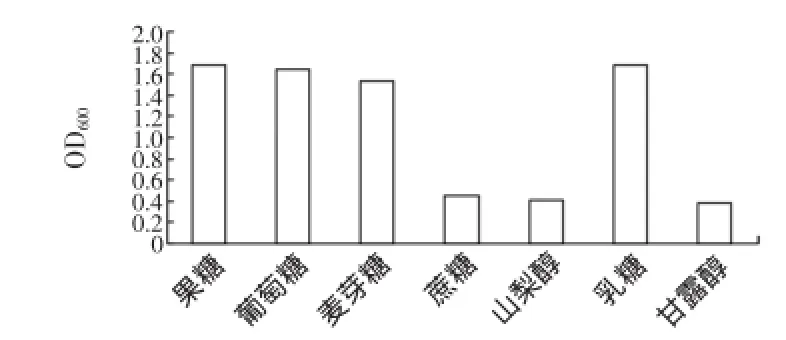
图1 不同碳源对菌株BTQY-112生长情况的影响Fig.1 The effectofcaborn on the growth of BTQY-112

图2 不同浓度葡萄糖和乳糖对BTQY-112菌株生长情况的影响Table 2 The effectofratio of glucose and lactose on the growth of BTQY-112
从图1、图2可知,不同种类碳源以及不同碳源浓度对菌体浓度的影响比较明显,为降低培养基成本,选择乳糖和葡萄糖作为优化后碳源,且菌株BTQY-112利用葡萄糖和乳糖的最佳浓度为0.5%。
2.2培养基氮源的优化
用不同的氮源代替M17中的氮源,筛选出适宜菌株生长的氮源,并采用不同比例的适宜氮源,以优化碳源基础培养基为对照,接种发酵,根据生长末期菌体生长情况判断菌体适合生长的氮源及其氮源比例。采用复合配比试验确定优化氮源的复配效果。不同氮源对菌株BTQY-112生长的影响见图3。

图3 不同氮源对菌株BTQY-112生长的影响Fig.3 The effect of nitrogen on lactic acid bacteria growth of BTQY-112
如图3可见,酪蛋白胨、大豆蛋白胨和鱼蛋白胨对菌株增殖效果较好,固按总氮的添加量1%对酪蛋白胨、大豆蛋白胨和鱼蛋白胨进行复配,见表1。不同氮源复配对菌株BTQY-112生长的影响见图4。
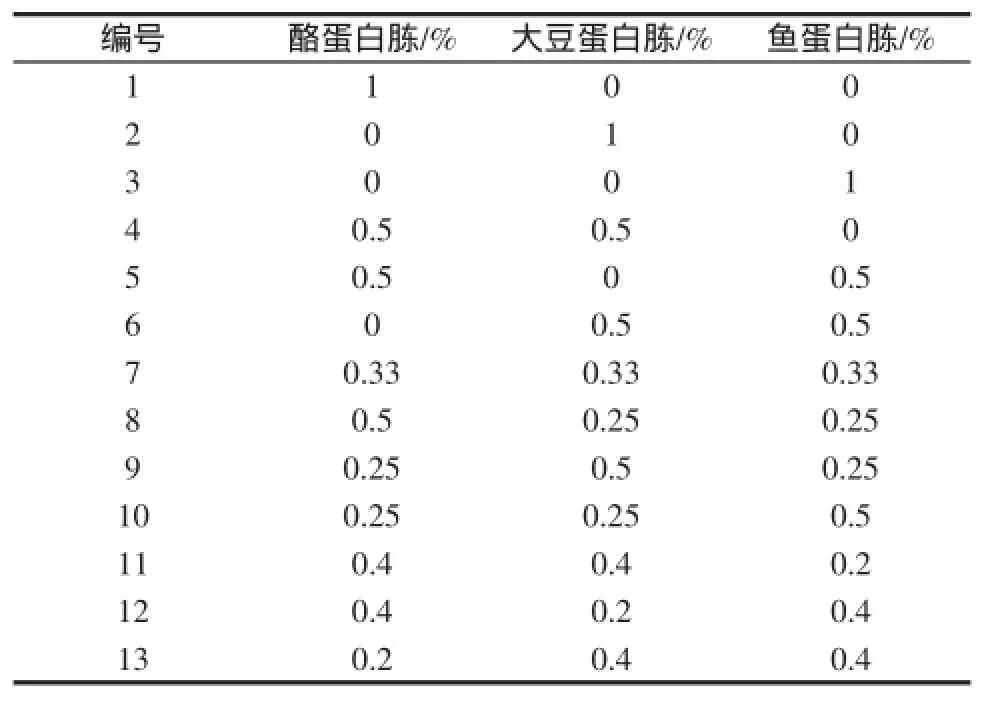
表1 氮源复配试验方案Table 1 Test Scheme ofcomplex formulation of carbon source

图4 不同氮源复配对菌株BTQY-112生长的影响Fig.4 The effectof ratio ofnitrogen on the lactic acid bacteria growth of BTQY-112
从图4可见,7#复配氮源条件下菌株的生长情况良好,所以确定酪蛋白胨∶大豆蛋白胨∶鱼蛋白胨复配氮源的比例为0.33%∶0.33%∶0.33%。
2.3培养基生长因子的优化
在上述优化碳源和氮源的基础上,以Tween80、抗坏血酸钠、CaCl2、半胱氨酸盐酸盐(CysHCl)和啤酒5种为生长因子,按不同的浓度添加到培养基中,以不添加生长因子的优化基础培养基为对照,接种试验菌株发酵,根据最终菌体生长情况,确定微量元素及生长因子的种类和浓度[4]。不同生长因子对菌株BTQY-112生长的影响见图5。
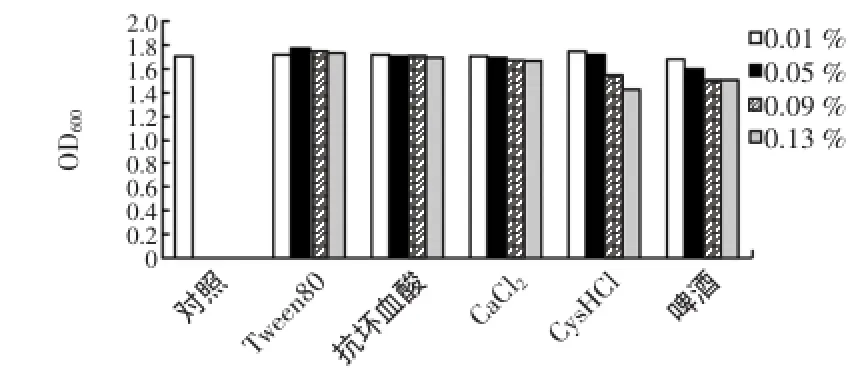
图5 不同生长因子对菌株BTQY-112生长的影响Fig.5 The effect ofratio ofgrowth factors on the growth of BTQY-112
图5所示不同种类、不同浓度的生长因子抗坏血酸钠、CaCl2、半胱氨酸盐酸盐对菌株生长增殖情况改善不大,这说明已确定培养基中增殖因子种类和含量已满足菌株生长所需,不需要优化上述生长因子。啤酒生长因子反而降低了菌株生物量,阻碍菌体生长。该菌株对半胱氨酸盐酸盐更为敏感,随着浓度的增加,生物量明显降低。只有Tween-80具有一定的促生长效果,且最佳添加量为0.05%。
2.4培养基缓冲体系的优化
以上述优化条件后的M17培养基为基础,添加不同的缓冲盐体系,以不添加缓冲盐的优化培养基为对照,接种试验菌株发酵,根据最终菌体生长情况,确定最优的缓冲体系。优选的缓冲盐之间的优化效果采用正交试验确定。不同缓冲盐体系培养基中BTQY-112的菌体密度见表2。
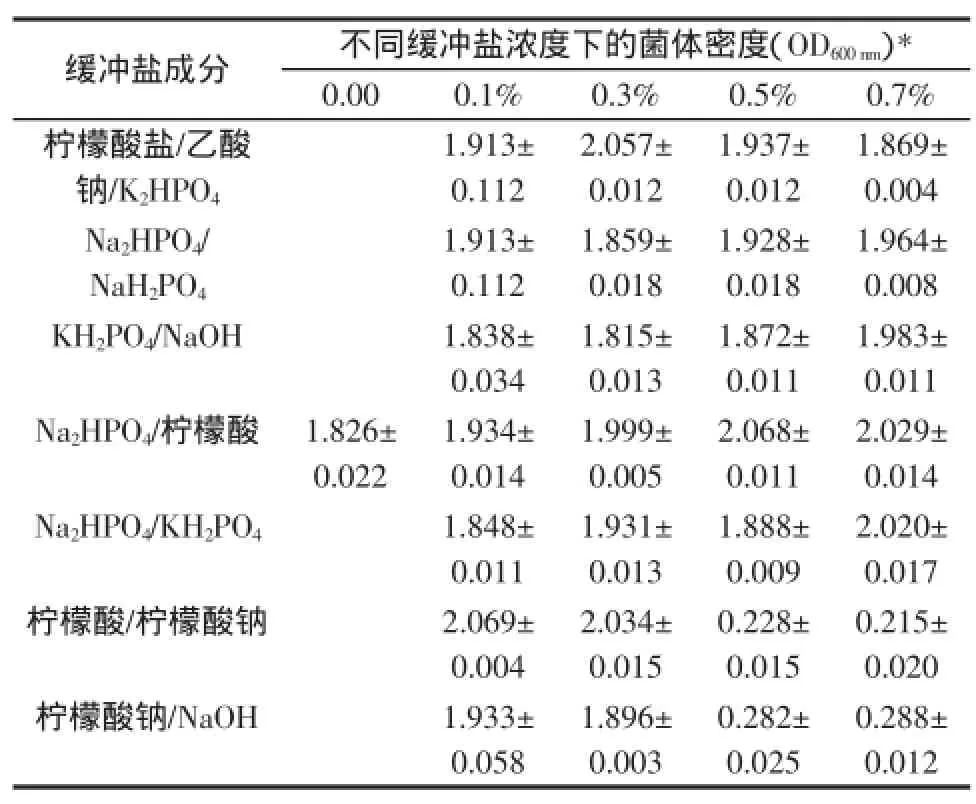
表2 不同缓冲盐体系培养基中BTQY-112的菌体密度Table 2 Celldensity of BTQY-112 growing in medium with differentbuffers
根据表2的试验结果,选定K2HPO4、柠檬酸钠和乙酸钠的复合缓冲盐体系进行下一步试验。设计三因素三水平正交试验对缓冲盐体系组成比例进行调节优化。试验因素设计及其结果见表3。

表3 缓冲盐的正交试验设计及结果Table 3 The results of orthogonaltests of buffer salt
从表3正交试验极差分析结果可以看出,三因素对菌株生长的影响值大小为C>A>B,即乙酸钠> K2HPO4>柠檬酸钠,最优缓冲盐配比为C1A2B1,即乙酸钠∶K2HPO4∶柠檬酸钠为0.15%∶0.08%∶0.06%,经试验在此配比下得到的OD值为2.413。
2.5正交试验设计对培养基各组分的优化
经过上述单因素优化试验后,进行正交分析试验,以确定各影响因素最佳的比例浓度。增殖因子Tween-80用量非常少,用量为0.05%,为了方便试验不将它作为试验因素考虑,只作为固定因子以0.05%用量添加到M17培养基。其中复合碳源为葡萄糖∶乳糖(0.5%∶0.5%),复合氮源为酪蛋白胨∶大豆蛋白胨∶鱼蛋白胨(0.33%∶0.33%∶0.33%),复合缓冲盐体系为乙酸钠∶K2HPO4∶柠檬酸钠(0.15%∶0.08%∶0.06%)。M17各组分优化正交试验因素水平设计如表4所示。
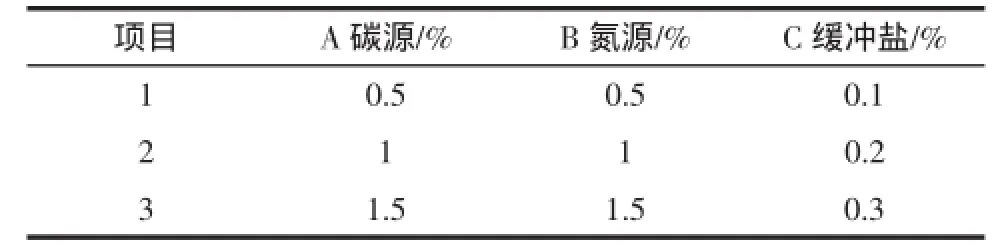
表4 优化M17培养基各物质正交因素水平表Table 4 Factors and levels of orthogonalexperimentin M17
按照表4正交试验因素水平表对M17培养基各影响因子进行正交试验分析,接种后30℃静置培养8 h后取出试验样品,检测其OD值。正交结果及分析结果如表5所示。

表5 优化增菌培养基M17的正交分析试验结果表Table 5 Results oforthogonalexperimentin M17
乳酸乳球菌乳脂亚种BTQY-112效应值大小为A>B>C,即碳源>氮源>缓冲盐,优化培养基配比为A2B2C3,复合碳源为1%,即葡萄糖为0.5%,乳糖为0.5%。复合氮源为1%,即酪蛋白胨0.33%,大豆蛋白胨0.33%,鱼蛋白胨0.33%。缓冲盐总添加量为0.3%,即乙酸钠1.55 g/L,K2HPO40.83 g/L,柠檬酸钠0.62 g/L。
3 结论
经试验确定乳酸乳球菌乳脂亚种BTQY-112最适培养基为:葡萄糖为5 g/L,乳糖为5 g/L,酪蛋白胨3.3 g/L,大豆蛋白胨3.3 g/L,鱼蛋白胨3.3 g/L,Tween-80 0.5 g/L,β-甘油磷酸二钠28.5 g/L,MgSO4·7H2O 0.25 g/L,乙酸钠1.55 g/L,K2HPO40.83 g/L,柠檬酸钠0.62 g/L,抗坏血酸钠1.5 g。在此增殖培养基中经30℃,14 h培养活菌数提高了4.3倍,为该菌株的高密度培养确定适宜增殖培养基组成,进而为其工业化生产奠定良好基础。
[1]王蕊.开菲尔(Kefir)酸牛乳酒中乳酸菌分离及发酵性能测定[J].中国酿造,2009(7):99-102
[2]任娟.发酵剂在羊奶干酪中应用技术的研究[D].西安:陕西师范大学,2010
[3]曹文海,任国谱.嗜热链球菌的检验培养基(M17)的改良[J].中国乳业,2006(1):43-45
[4] 张龙翔,张庭芳,李令媛.生化实验方法和技术(第二版)[M].北京:高等教育出版社,1997:33
Study on the Optimization of Enrichment Medium of Lactococcus lactis subsp.BTQY-112
WANG Fei-fei
(Baotou Light Industry Vocational TechnicalCollege,Baotou 014045,Inner Mongolia,China)
The optimization ofproliferation culture medium for Lactococcus lactis subsp.BTQY-112 was studied.The bestmedium was gotwith the composition of5 g/L glucose,lactose 5 g/L,casein peptone 3.3 g/L,soybean peptone 3.3 g/L,fish peptone 3.3 g/L,β-glycerol phosphate disodium salt 28.5 g/L,Tween-80 0.5 g/L,MgSO4·7H2O 0.25 g/L,sodium acetate 1.55 g/L,K2HPO40.83 g/L,sodium citrate 0.62 g/L,sodium ascorbate 1.5g/L.After cultivated in enrichmentmedium for 14 h at30℃,number oflive bacteria increased 4.3 times.
Lactococcus lactis subsp.;proliferation culture medium;optimization
10.3969/j.issn.1005-6521.2016.12.037
王菲菲(1980—),女(汉),讲师,硕士,研究方向:食品科学与工程。
2015-06-05
