蜜环菌生长培养基的优化及杂菌的分离鉴定
2016-08-23李再新唐文才四川理工学院生物工程学院四川自贡643000
李再新,唐文才(四川理工学院生物工程学院,四川自贡643000)
蜜环菌生长培养基的优化及杂菌的分离鉴定
李再新,唐文才
(四川理工学院生物工程学院,四川自贡643000)
为提高蜜环菌产量,采用正交试验法对蜜环菌生长培养基中葡萄糖、酵母粉、维生素B13个组分的添加量进行优化,利用平板法分离出影响蜜环菌生长的主要杂菌并采用分子生物学的方法对污染菌株进行鉴定。试验结果表明:葡萄糖45 g/L、酵母粉9 g/L、维生素B10.05 g/L为最佳配方。分离出两株霉菌,经过鉴定,分别为橘青霉Penicillium citrinum t1、塔宾黑曲霉Aspergillus tubingensis t2。
蜜环菌;正交试验;rDNA-ITS菌种鉴定;筛选
蜜环菌属于担子菌纲、伞菌目、真菌的一属。名贵药材天麻,猪苓的生长离不开蜜环菌,蜜环菌是天麻无性繁殖生长阶段的物资基础[1]。近年人们对天麻保健功能的不断认识,天麻价格不断上涨且其需求旺盛,种植面积快速扩张,据统计2012年天麻全国的总产量大概在2 000 t左右[2]。优质天麻的生长主要在海拔1 500 m~3 000 m的偏远高寒山区,山区种植资源狭窄,种植技术落后,长期处于贫困状态,因此天麻的栽培是山区人们致富的重要途径。天麻对蜜环菌具有寄生关系,蜜环菌的健壮生长是高品质天麻栽培的基本条件,但在天麻栽培过程中蜜环菌主要以阔叶树木的木块为原料,积累营养,为天麻的生长提供养料[3],同时蜜环菌生长固体琼脂糖平板培养基也需要用木块的浸提液配制,这种培养基成分也非常适合木霉和青霉菌等杂菌的生长而且比蜜环菌生长更快,因此在蜜环菌的培养中木霉和青霉污染对蜜环菌的纯培养形成了巨大的威胁,也降低了在栽培过程中蜜环菌对有限木材的利用率,严重影响了天麻的产量和品质[4]。本研究旨在对蜜环菌生长所需要的条件进行优化,并对污染蜜环菌纯种培养的菌进行分离鉴定,对以后蜜环菌培养基中杂菌专一抑制剂的筛选奠定了基础。
1 材料与方法
1.1菌种
蜜环菌:由昭通天麻生产基地提供。
1.2培养基
蜜环菌培养基:琼脂15 g/L,马铃薯200 g/L,K2HPO43 g/L,MgS041.5 g/L,葡萄糖45 g/L,维生素B10.05 g/L,酵母粉3 g/L,蒸馏水1 000 mL,pH自然。
1.3主要仪器
D3024台式高速微量(冷冻型)离心机:大龙创新实验仪器(北京)有限公司;BD-30生物显微镜:深圳市博视达光学仪器有限公司;GZ-250-HSH恒温恒湿培养箱:韶关市广智科技设备有限公司。
1.2方法
1.2.1蜜环菌生长培养基的优化
切取约0.5 cm3大小的供试菌株菌块接种于装有20 mL加富型固体PDA瓶装培养基中。25℃恒温培养30 d。待培养基内长满白色粗壮菌索后待用。
参考彭述敏等[5]、程显好等[6]的单因素营养条件筛选结果,选取葡萄糖,酵母浸粉和维生素B1作为研究因素。设计三因素三水平的正交试验,见表1。

表1 L9(34)正交试验的因素及水平Table 1 The factors and levels of L9(34)orthogonalexperimen
按表1进行试验,每个试验号做3个平行。灭菌后每20 mL培养基倒入直径为9 cm培养瓶中。每一个培养瓶中接种约1 cm3的蜜环菌菌种块。在装液量为20 mL/瓶(直径为9 cm的培养瓶),接种量为1 cm3/瓶,温度为25℃,恒温培养13 d后测定蜜环菌干重。
1.2.2密环菌培养基中杂菌的分离
从被杂菌污染的密环菌培养基中挑取杂菌菌斑,在无菌条件下,接种到盛有25 mL无菌生理盐水中,在150 r/min、30℃条件下振荡30 min,再以无菌生理盐水进行10-1、10-2、10-3、10-4、10-5梯度稀释,分别取各梯度稀释液0.1 mL涂布于含有100 mg/mL头孢霉素以及10滴/L的25%乳酸的PDA培养基上,同时做平行和空白对照,然后在28℃恒温条件下倒置培养3 d。挑取优势单菌落纯化(划线3次以上)后接种到试管斜面于4℃冰箱保存备用[7-10]。
1.2.3形态学特征鉴定
将筛选得到的菌株接种到加富PDA培养基上,28℃插片培养3、5、7、15 d后,通过光学显微镜分别观察气生菌丝及基内菌丝发育情况[11-13]。
1.2.4杂菌基因组DNA的提取及rDNA-ITS菌种鉴定
采用CTAB法提取菌丝体基因组总DNA,用1.2%的琼脂糖凝胶电泳定性检测,再用紫外分光光度计定量检测[14]。
采用rDNA-ITS序列分析技术对杂菌进行分子鉴定。采用rDNA-ITS的PCR扩增体系为:10×PCR Buffer 2.5μL,10 mmol/L dNTPs 2μL,25 mmol/L MgCl22μL,5 U/μL Taq DNA酶0.3μL,10μmol/L ITS5/ITS4引物各1μL,17 ng/μL模板DNA 3μL,ddH2O 14.2μL,反应总体积为25μL。94℃预变性1 min后;92℃变性15 s,61℃退火15 s,72℃延伸1 min,共30个循环;最后于72℃补平5 min,终止温度为4℃。采用1.5%的琼脂糖凝胶电泳检测rDNA-ITS的PCR扩增产物,用凝胶图像分析仪摄取扩增图谱。然后用DNA凝胶回收试剂盒从1.2%的琼脂糖凝胶中回收ITS的PCR扩增片段,并用DNA/RNA紫外分光光度计(GeneQuant Pro,GE Healthcare公司)检测浓度。将扩增后的DNA送往上海杰李生物有限公司测序,测序结果进行BLAST比对及构建系统发育树确定菌株分类[15-16]。
2 结果及分析
2.1正交试验结果
正交试验结果及结果分析见表2、表3。
表3显示,在蜜环菌培养基优化的试验中,极差RA>RC>RB,所以影响蜜环菌菌索生长因素的主次顺序为A(葡萄糖)、C(维生素B1)、B(酵母粉)。方差分析结果(表3)显示葡萄糖的含量对菌索的生长影响显著。

表2 L9(34)正交试验结果Table 2 The resultoforthogonalexperiment

表3 方差分析结果Table 3 The analysis ofvariance
由表2可知,蜜环菌菌株生长的最优方案为A3B3C1。方差分析结果显示仅葡萄糖对蜜环菌菌索生长具有显著影响,且显著性影响:A>C>B,因此蜜环菌菌索生长培养基的最佳配方为A3B3C1。
2.2杂菌分离结果
通过平板法从30瓶被污染的蜜环菌培养基中筛选得到了两种比较常见的杂菌,分别命名为t1和t2,结果见图1。
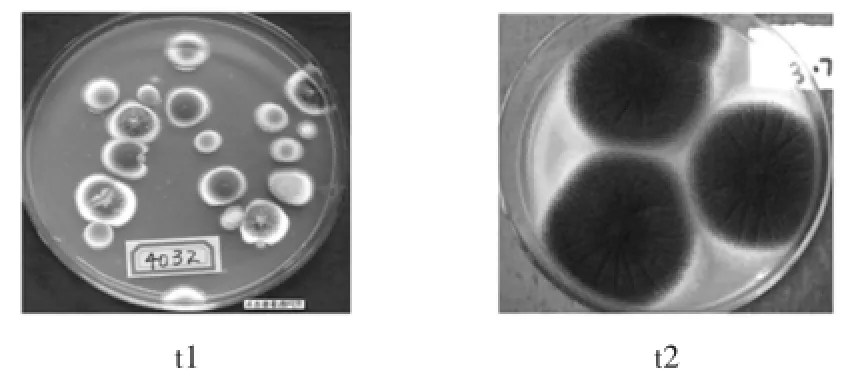
图1 蜜环菌培养基中杂菌的固态培养特征Fig.1 The characteristics ofmixed bacteria in the solid state culture of armillaria medium
2.3杂菌形态学特征鉴定结果
将菌株t1,t2通过划线的方法接种到加富PDA培养基上,28℃恒温培养5 d察菌落形态,再采用插片法培养7 d,显微镜观察菌丝形态,结果见图2。

图2 杂菌显微镜下观察特征Fig.2 Microscope characteristics of miscellaneous bacteria
在加富PDA培养基中,28℃培养5 d后,观察到菌落并在显微镜下观察菌丝体。t1形态学鉴定:菌落绒状,厚实,中央呈浅灰绿色,反面为暗黄色,表面有颗粒状物质,具有放射状皱纹。显微镜下观察菌丝有横隔,分生孢子梗顶端不膨大,无顶囊,经多次分支产生对称或不对称的小梗,梗顶端产生成串的青色分生孢子。
t2形态学鉴定:菌落为暗黑褐色,粉末状,稍有放射状沟纹,反面颜色为黄褐色。显微镜观察分生孢子的顶囊为球形或近球形,小梗双层,第一层粗大,第二层短小,呈放射状排列,布满整个顶囊,黑色,顶端有链形孢子。
通过形态学特征可以初步判定t1为青霉,t2为黑曲霉。
2.4系统发育树的构建
将菌株t1、t2的18SrDNA进行扩增,扩增结果见图3。

图3 PCR扩增产物电泳图Fig.3 The electrophoresis of PCR products
扩增后后测序,结果在NCBI上进行Blast同源性比对,比对结果显示t1与Penicillium citrinum MSSRFIS1﹙HQ232482.1﹚相似度为99%,t2与Aspergillus tub-ingensis F4-0(JN561261.1)相似度为99%。根据比对结果筛选出相似度较高(>97%)的16SrDNA序列,以Clustal软件进行序列比对,采用Neighbor-Joining(NJ)法构建系统发育树,结果见图4、图5。

图4 采用Neighbor-Joining(NJ)法构建t1的16SrDNA系统进化树Fig.4 Phylogenetic tree drawn from neighbor-joining analysis based on the 16SrDNA sequence alignment oft1

图5 采用Neighbor-Joining(NJ)法构建t2的16SrDNA系统进化树Fig.5 Phylogenetic tree drawn from neighbor-joining analysis based on the 16SrDNA sequence alignmentof t2
由图4、图5可知,菌株t1与Penicillium citrinum MSSRF-IS1﹙HQ232482.1﹚处于同一聚类分支上,且分支置信度为65%,可以确定菌株t1属于桔青霉属,将该菌株命名为Penicillium citrinum t1。菌株t2与Aspergillus tubingensis F4-04(JN561261.1)处于同一聚类分支上,且分支
置信度为65%,菌株t2属于黑曲霉属,将其命名为Aspergillus tubingensis t2。
3 结论
蜜环菌是天麻无性繁殖生长阶段的关键因素,蜜环菌的生长与天麻产量息息相关,本对蜜环菌的生长培养基优化结果表明:葡萄糖45 g/L、酵母粉9 g/L、维生素B1为0.05 g/L最适宜蜜环菌的生长。对影响蜜环菌生长的杂菌的分离及鉴定结果表明:影响蜜环菌生长的主要菌株为黑曲霉和青霉。
[1]谭周进,谢达平,王征,等.蜜环菌多糖分离纯化及性质的研究[J].食品科学,2002,23(9):49-53
[2] 李娟娟,刘志涛,王晓雯,等.天麻的研究现状与展望[J].中国民族民间医药杂志,2014(14):16-17
[3]孙立夫,田淑敏,杨国亭,等.中国东北地区5个常见蜜环菌生物种的培养特性[J].东北林业大学学报,2007,35(2):48-51
[4]杨世林,兰进,徐锦堂.天麻的研究进展[J].中草药,2000,31(1):66-69
[5]彭述敏,陈玉惠,程立君,等.2株优良天麻共生蜜环菌生长条件筛选[J].中国食用菌,2010,29(4):22-25
[6]程显好,刘林德,懂洪新,等.蜜环菌菌丝体培养条件的优化[J].中药材,2007(5):509-512
[7] 柳玲玲,毛堂芬,朱国胜,等.优质蜜环菌菌株的初步筛选[J].贵州农业科学,2015(1):87-89
[8]黄万兵,桂阳,朱国胜,等.贵州天麻产区蜜环菌的分离及rDNAITS序列分析[J].西南师范大学学报,2014,39(6):35-42
[9]杨利珍,周乐,徐虹,等.一株青霉菌的分离鉴定及抑菌活性成分研究[J].西北农业学报,2009,18(4):89-102
[10]张雨山,王静,郝建安,等.絮凝活性产紫青霉EL-02的分离鉴定及其絮凝活性初探[J].微生物学报,2010,50(7):917-922
[11]许鹏辉,邢顺林,段双全,等.西藏冬虫夏草寄生镰孢属真菌生物学特性分析[J].安徽农业科学,2012,40(25):12354-12356,12381
[12]邓建珍,韦红群,陈燕珍,等.黑曲霉(Aspergillus niger)产菊粉酶菌株的筛选及培养条件的研究[J].生物学杂志,2007,24(6):26-29
[13]王宇光,卢娟,孙建波,等.一株拮抗香蕉枯萎病的青霉菌的分离及鉴[J].中国农学通报,2011,20(4):178-182
[14]吴发红,黄东益,黄小龙,等.几种真菌DNA提取方法比较[J].中国农学通报,2009,25(8):62-64
[15]张伟铮,肖倩,屈平华,等.ITS基因序列分析在鉴定暗色真菌中的应用[J].实用医学杂志,2014,30(15):2493-2496
[16]李海波,吴学谦,王立武,等.青藏高原黄绿蜜环菌纯培养菌种的分离培养及分子鉴定[J].菌物学报,2008,27(6):873-883)
Armillaria Growth Medium Optimization and the Separation of Mixed Bacteria Identification
LIZai-xin,TANG Wen-cai
(College of Bioengineering,Sichuan University of Science and Engineering,Zigong 643000,Sichuan,China)
In order to improve the yield of Armillaria,glucose,yeast powder,vitamin B1three components were optimized by the method of orthogonal experiment.The end of plate method was used to isolate the main bacterial and affect the growth of Armillaria strains of pollution by using molecular biology method.The results showed that the glucose 45 g/L,yeast powder 9 g/L,vitamin B10.05 g/L as the best formula.Two strains of the mold were isolated and identified,the results showed thatthe one was Penicillium citrinum t1,the other was Aspergillus tubingensis t2.
Armillaria;the orthogonalexperiment;rDNA-ITS strain identification;screening
10.3969/j.issn.1005-6521.2016.12.036
李再新(1972—),男(汉),教授,博士,主要从事生物制药方面的研究。
2015-06-04
