肉桂内生细菌转化肉桂醛的研究
2016-08-23刘斌李子院韩文李海云广西高校食品安全与检测重点实验室桂林理工大学化学与生物工程学院广西桂林541004
刘斌,李子院,韩文,李海云(广西高校食品安全与检测重点实验室,桂林理工大学化学与生物工程学院,广西桂林541004)
肉桂内生细菌转化肉桂醛的研究
刘斌,李子院,韩文,李海云*
(广西高校食品安全与检测重点实验室,桂林理工大学化学与生物工程学院,广西桂林541004)
采用单因素试验法对肉桂内生细菌Pseudomonas sp.RGEB06转化肉桂醛合成肉桂醇的反应条件进行了研究。在改良M9液体培养基的基础上,以肉桂醛转化率、肉桂醇转化产率、肉桂醇选择性等为指标,考察了转化过程中的肉桂醛底物浓度、初始pH、转化温度、接种量、装液量、摇床转速、预培养时间、转化时间等因素对Pseudomonas sp.RGEB06转化肉桂醛合成肉桂醇的影响。结果表明:在转化温度30℃、初始pH 6.5、装液量100 mL/250 mL三角瓶、接种量20%、摇床转速150 r/min、预培养时间24 h、底物浓度2.64 mg/mL、转化时间24 h时,肉桂醇的转化率达到最大值88.08%,生成肉桂醇的选择性为94.21%,转化液中肉桂醇的浓度为2.36 mg/mL。
内生细菌;微生物转化;肉桂醛;肉桂醇
肉桂醇又称桂皮醇,β-苯基丙烯醇。作为香料、药物、食品及其它精细化工产品生产的重要原料和中间体,肉桂醇在有机合成中有着广泛的应用[1-3]。目前制备肉桂醇的研究主要集中于肉桂醛选择性加氢合成[4-7],而利用肉桂醛微生物转化合成肉桂醇的研究较少。马丽等[8-9]研究了Mucor sp.JX23发酵液直接生物催化肉桂醛选择加氢制肉桂醇的反应,在最优反应条件下,肉桂醛的转化率为82.9%,产物肉桂醇的选择性为90.4%。
近几年来,植物内生菌的生物转化性能逐渐受到人们的重视[10-14],但鲜见有肉桂内生菌的分离及其生物转化性能研报道。本课题组前期从新鲜肉桂皮中分离、筛选出一株可催化肉桂醛加氢生成肉桂醇的内生细菌RGEB06,经鉴定为Pseudomonas sp.,本文对该菌株转化肉桂醛合成肉桂醇的条件进行研究。
1 材料与方法
1.1材料
1.1.1菌种
肉桂内生细菌Pseudomonas sp.RGEB06:分离自新鲜肉桂皮(2014年10月采自广西桂平金田林场)。
1.1.2培养基
1.1.3主要试剂
乙酸乙酯:淄博润沃商贸有限公司;二甲亚砜:西陇化工股份有限公司;无水乙醇:天津市新天科技开发有限公司;肉桂酸、肉桂醛、肉桂醇等:购于上海阿拉丁生化科技有限公司。所用药品均为AR或生化试剂。1.1.4主要仪器
BS223S电子天平:赛多利斯科学仪器(北京)有限公司;LRH-150-Z振荡培养箱:广东省医疗器械厂;HX-I回旋式振荡器:广东省环保仪器设备厂;DL-5-B离心机:上海安亭科学仪器厂;LC-20A液相色谱仪:日本岛津公司;SW-CJ-IF超净工作台:苏州安泰空气技术有限公司;LS-B-50L压力蒸汽灭菌锅:上海华岩

1.2.2高效液相色谱分析
采用高效液相色谱方法测定转化体系中的肉桂醛、肉桂醇、肉桂酸含量。测定在日本岛津LC-20A色谱仪上进行,色谱柱为Phenomenex Luna C18柱(250 mm× 4.6 mm,5μm),检测器为SPD-M20A二极阵列管,柱温室温(25℃),流动相流速0.8 mL/min,进样体积5μL。流动相由含0.1%甲酸的乙腈(B)和含0.1%甲酸的H2O(A)两种溶液组成,二元梯度洗脱,洗脱程序为:0~20 min,流动相B由30%升至50%;20 min~22 min,流动相B恒定为50%;22 min~27 min,流动相由50%降至30%;27 min~30 min,流动相B恒定为30%。
2 结果与讨论
2.1初始pH的影响
按1.2.1方法,固定其他条件不变,改变液体培养基初始pH分别为5.5、6.0、6.5、7.0、7.5、8.0,考察初始pH对转化反应的影响。培养基初始pH对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响如图1所示。
图1结果表明,随着pH值的逐渐增大,肉桂醇的转化产率先增大后减小。当pH值为6.5时,肉桂醇的转化产率及选择性达到最大值。当pH值高于7.0时,仪器设备有限公司。
1.2方法
1.2.1肉桂醛的生物转化
斜面保存的Pseudomonas sp.RGEB06经平板培养活化24 h后,挑取一环接入100 mL改良M9液体培养基中(250 mL三角瓶),在温度为30℃,转速为150 r/min的摇床上振荡培养24 h,即为种子液。将种子液按照20%的接种量接入到装有80 mL p H 6.5的改良M9液体培养基的250 mL三角瓶中,在温度为30℃、转速为150 r/min的摇床上振荡培养24 h。无菌条件下,加入1 mL 264 mg/mL肉桂醛二甲亚砜溶液,相同条件下继续培养24 h。转化结束后,取转化液1 mL,在1×104r/min的条件下离心10 min,收集上清液,用2 mL乙酸乙酯萃取3次,收集乙酸乙酯萃取液,减压旋转蒸干,加入10 mL甲醇溶解后,进行高效液相色谱分析,测定转化体系中肉桂醛、肉桂醇及肉桂酸的浓度,按下述各式计算肉桂醇摩尔转化产率及肉桂醇产物选择性。转化产率和选择性急剧下降,这是由于肉桂醛氧化生成肉桂酸的趋势增大所致。选择转化的初始pH为6.5。

图1 初始pH对肉桂醛生物转化生成肉桂醇的影响Fig.1 Effects ofinitialpH on the biotransformation of cinnamaldehyde into cinnamylalcohol
2.2转化温度的影响
按1.2.1方法,固定其他条件不变,改变转化温度分别为20、25、30、35℃,考察转化温度对转化反应的影响。转化温度对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响如图2所示。
由图2可知,随着转化温度的逐渐增大,肉桂醇的转化产率先增大后减小,说明了在肉桂醛转化为肉桂醇的过程中转化温度会影响菌体细胞所产酶的活性、稳定性和选择性,较高的温度会使反应体系中的酶受到抑制,甚至失活。同时,偏高的温度也会加速肉桂醛和肉桂醇的氧化速率,从而导致肉桂醇的转化产率降低。因此,最适转化温度为30℃。

图2 转化温度对肉桂醛生物转化生成肉桂醇的影响Fig.2 Effects of conversion temperature on the biotransformation ofcinnamaldehyde into cinnamylalcohol
2.3底物浓度的影响
按1.2.1方法,固定其他条件不变,改变加入的肉桂醛浓度,使转化体系中底物肉桂醛的浓度分别为1.32、1.98、2.64、3.30、3.96 mg/mL,考察底物肉桂醛浓度对转化反应的影响。底物肉桂醛浓度对肉桂醇摩尔转化产率及肉桂醇选择性的影响,结果如图3所示。

图3 底物浓度对肉桂醛生物转化生成肉桂醇的影响Fig.3 Effects ofsubstrate concentration on the biotransformation ofcinnamaldehyde into cinnamylalcohol
图3结果表明,在试验的底物浓度范围内,肉桂醛的转化率、肉桂醇的转化产率及选择性均随着底物浓度的增大而逐渐减小。肉桂醇转化产率的降低主要是由于肉桂醛对微生物细胞具有较强的毒害作用,当肉桂醛浓度过高时,会抑制细菌的生长和新陈代谢能力,从而影响菌体细胞的催化能力,导致转化效率的降低。产物选择性的降低一方面是由于底物转化率的降低所致,另一方面则是由于转化体系中随着肉桂醛浓度的增大,被空气中氧气氧化的产物肉桂酸含量增大所致。当底物浓度为2.64 mg/mL时,转化体系中的肉桂醇浓度可达到最大值。因此,综合考虑肉桂醇的产量及其选择性,选择底物浓度为2.64 mg/mL。
2.4预培养时间的影响
考虑到底物肉桂醛对微生物的毒害作用较强,本试验采用预培养再转化的方法。按1.2.1方法,固定其他条件不变,改变预培养时间分别为0、12、24、36、48 h,考察预培养时间对转化反应的影响。预培养时间对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响如图4所示。

图4 预培养时间对肉桂醛生物转化生成肉桂醇的影响Fig.4 Effects of pre-incubation time on the biotransformation of cinnamaldehyde into cinnamylalcohol
从图4可看出,随着预培养时间不断增大,肉桂醇的转化产率先增大后减小。在预培养时间为24 h时,肉桂醛的转化率、肉桂醇的转化产率和选择性均达最大。当预培养时间过短时,菌体繁殖的时间太短,菌体的数量少,不能满足后期的转化反应;预培养时间过长时,菌体数量过多,营养物质消耗大,生长空间不足受到抑制,也促使菌体停止生长甚至死亡,不利于后期转化反应。故选择预培养时间为24 h。
2.5接种量的影响
按1.2.1方法,固定其他条件不变,改变接种量分别为5%、10%、15%、20%、25%,考察接种量对转化反应的影响。接种量对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响如图5所示。
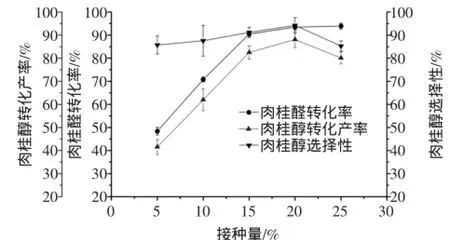
图5 接种量对肉桂醛生物转化生成肉桂醇的影响Fig.5 Effects ofinoculum on the biotransformation of cinnamaldehyde into cinnamylalcohol
图5结果表明,随着接种量的逐渐增大,肉桂醇的转化产率先增大后减小,说明了在肉桂醛转化为肉桂醇的过程中随着接种量的越大,菌体增多,有利于提高肉桂醛的转化率。然而过大的接种量又会影响溶解氧以及营养物质的传递速率,从而抑制肉桂醛的转化率,进而导致肉桂醇的转化产率降低。故最适接种量为20%。
2.6装液量的影响
按1.2.1方法,固定其他条件不变,改变250 mL三角瓶中的装液量分别为40、60、80、100、120 mL,考察装液量对转化反应的影响。装液量对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响如图6所示。
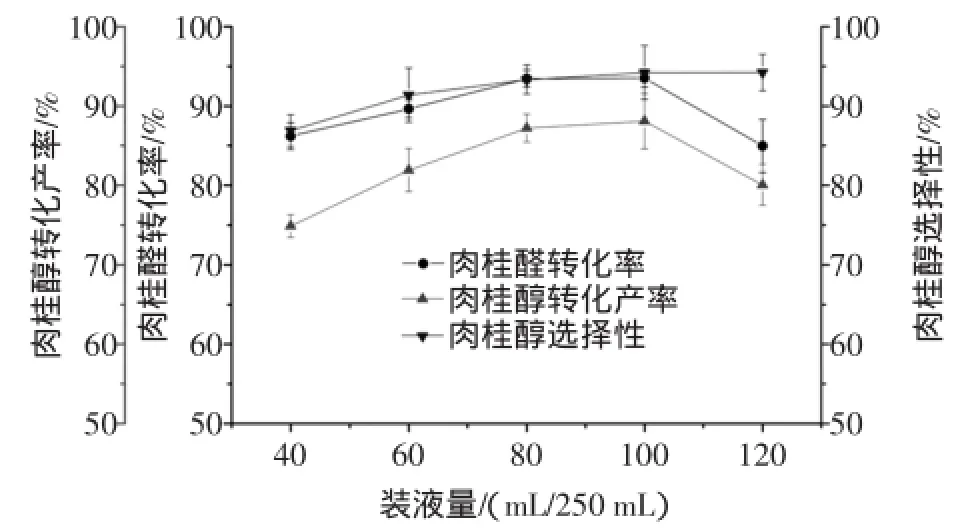
图6 装液量对肉桂醛生物转化生成肉桂醇的影响Fig.6 Effects ofliquid volume on the biotransformation of cinnamaldehyde into cinnamylalcohol
由图6可知,当装液量逐渐增大时,肉桂醇的转化产率先增大后减小,主要原因是在固定体积的三角瓶内,装液量越大,三角瓶内的的氧气消耗越快,而缺氧又使得细胞的产酶量少,催化反应进行缓慢,肉桂醛的转化率也会相对较低,从而导致肉桂醇的转化产率降低。因此,最佳的装液量为100 mL/250 mL三角瓶。
2.7转速的影响
摇床转速影响到培养液中氧气的溶解量以及底物、产物的传质过程。按1.2.1方法,固定其他条件不变,改变摇床转速分别为90、120、150、180 r/min,考察摇床转速对转化反应的影响。摇床转速对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响如图7所示。结果表明,最适摇床转速为150 r/min。

图7 摇床转速对肉桂醛生物转化生成肉桂醇的影响Fig.7 Effects ofshaker speed on the biotransformation of cinnamaldehyde into cinnamylalcohol
2.8转化时间的影响
按1.2.1方法,固定其他条件不变,改变转化时间分别为8、12、24、36、48、72 h,考察转化时间对转化反应的影响。预培养时间对肉桂醛转化率、肉桂醇转化产率及肉桂醇选择性的影响见图8。
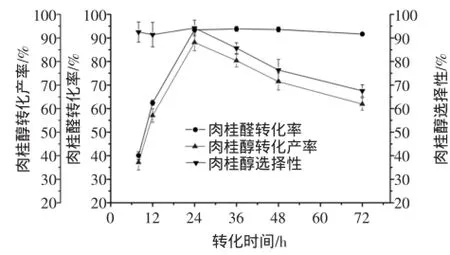
图8 转化时间对肉桂醛生物转化生成肉桂醇的影响Fig.8 Effects of conversion time on the biotransformation of cinnamaldehyde into cinnamylalcohol
由图8可知,当转化时间低于24 h时,肉桂醛的转化率和肉桂醇的转化产率不断提高,当转化时间为24 h时,肉桂醇的转化产率达到最大值。因为转化时间越长,转化液中的菌体越接近衰亡,催化能力降低,有更多的肉桂醛被空气氧化为肉桂酸,从而导致了肉桂醇的转化率降低。因此,最适转化时间为24 h。
在上述最佳转化条件下,肉桂醇的转化产率达到最大值88.08%,生成肉桂醇的选择性为94.21%,转化液中肉桂醇的浓度可达2.36 mg/mL。
3 结论
肉桂内生细菌Pseudomonas sp.RGEB06具有较好的催化肉桂醛加氢生成肉桂醇的能力。在初始pH 6.5的改良M9液体培养基中,按100 mL/250 mL三角瓶装液量、20%接种量接种后,在30℃、摇床转速150 r/min条件下预培养时间24 h后,加入底物肉桂醛使其浓度达2.64 mg/mL,转化24 h,肉桂醇的转化产率达到最大值88.08%,生成肉桂醇的选择性为94.21%,转化液中肉桂醇的浓度为2.36 mg/mL。如何提高转化体系中的底物浓度是该生物转化体系今后应该重点研究的方向。
[1]孙宝国,何坚.香料化学与工艺学[M].北京:化学工业出版社,2004: 89-90
[2]徐克勋.精细有机化工原料及中间体手册[M].北京:化学工业出版社,1998:151
[3]陈海燕,何春茂.肉桂油的深加工产品及其应用[J].广西林业科学,2009,38(3):179-182
[4]武文涛,贾颖萍,尹静梅,等.肉桂醛选择性加氢合成肉桂醇的研究进展[J].化工中间体,2009,5(4):1-5
[5]Rong Z M,Sun Z H,Wang Y,et al.Selective Hydrogenation of Cinnamaldehyde to cinnamyl alcohol over graphene supported Pt-Co bimetallic catalysts[J].Catalysis Letters,2014,144(6):980-986
[6]Chen H N,Cullen D A,Larese J Z.Highly efficientselective hydrogenation ofcinnamaldehyde to cinnamylalcoholcover gold supported on zinc oxide materials[J].Journalof Physical Chemistry C,2015, 119(52):28885-28894
[7]Yamanaka R,Nakamura K,Murakami M,et al.Selective synthesis ofcinnamylalcoholby cyanobacterialphotobiocatalysts[J].Tetrahedron Letters,2015,56(9):1089-1091
[8] 马丽,刘雄民,韦一萍.Mucor sp.JX23发酵液生物催化肉桂醛选择加氢制肉桂醇[J].化工进展,2009,28(8):1431-1434
[9]Ma L,Liu X M,Liang J J,etal.Biotransformations of cinnamaldehyde,cinnamic acid and acetophenone with Mucor[J].World Journal MicrobiolBiotechnol,2011,27(9):2133-2137
[10]Borges K B,Borges WS,Pupo M T,etal.Endophytic fungias models for the stereoselective biotransformation of thioridazine[J].Applied microbiology and biotechnology,2007,77(3):669-674
[11]Pedrini P,GiovanniniP P,Mantovani M,etal.Reduction screening with endophytic fungi:Synthesis ofhomochiralsecondary alcohols[J]. JournalofMolecular Catalysis B:Enzymatic,2009,60(3/4):145-150
[12]Fu S,Yang J,Cui J,etal.Biotransformation of ursolic acid by an endophytic fungus from medicinal plant Huperzia serrata[J].Chemical &Pharmaceutical Bulletin,2011,59(9):1180-1182
[13]李端华,陈祈磊,邹昆,等.内生真菌SEFl5927对截短侧耳素的微生物羟化研究[J].中国抗生素杂志,2011,36(8):590-592
[14]陈峻青,王伊文,冯成亮,等.杜仲内生真菌的分离鉴定及其对异甜菊醇的生物转化研究[J].东南大学学报:医学版,2012,30(6): 861-865
Biotransformation of Cinnamaldehyde by Endophytic Bacteria Isolated from Cinnamomum cassia
LIU Bin,LIZi-yuan,HAN Wen,LIHai-yun*
(Guangxi Colleges and Universities Key Laboratory of Food Safety and Detection,College of Chemistry& Bioengineering,Guilin University of Technology,Guilin 541004,Guangxi,China)
Biotransformation conditions of cinnamaldehyde into cinnamic alcohol by an endophytic bacteria Pseudomonas sp.RGEB06 isolated from Cinnamomum cassia were studied by the single factor test method. Based on the modified M9 liquid medium,effects of cultural conditions on cinnamaldehyde conversion rate,yield and production selectivity of cinnamyl alcohol were studied in detail.The results of single factor experiments indicated thatthe suitable biotransformation conditions for the production ofcinnamylalcoholwere as followed:conversion temperature of 30℃,initial pH 6.5,liquid volume 100 mL/250 mL flask,inoculation amount20%,shaker speed 150 r/min,pre-culture time 24 h,substrate concentration 2.64 mg/mL,conversion time of24 h.Under the optimalconditions,the yield and production selectivity ofcinnamylalcoholwere 88.08% and 94.21%,respectively,and the finalconcentration ofcinnamylalcoholin the culture was 2.36 mg/mL.
endophytic bacteria;microbialtransformation;cinnamaldehyde;cinnamylalcohol
10.3969/j.issn.1005-6521.2016.12.035
国家自然科学基金项目(31460409);广西高校食品安全与检测重点实验室资助项目
刘斌(1990—),男(汉),在读硕士研究生,研究方向:生物化工。
李海云(1975—),男(汉),副教授,主要从事天然活性物质及生物转化研究。
2016-03-09
