麻疯树果壳多糖的提取及抗氧化作用研究
2016-08-23张金磊李鹏飞马博赵丹丹全青敏雷福厚广西高校桂西生态环境分析和污染控制重点实验室百色学院广西百色533000广西民族大学广西林产化学与工程重点实验室广西南宁530006
张金磊,李鹏飞,马博,赵丹丹,全青敏,雷福厚(.广西高校桂西生态环境分析和污染控制重点实验室百色学院,广西百色533000;.广西民族大学广西林产化学与工程重点实验室,广西南宁530006)
麻疯树果壳多糖的提取及抗氧化作用研究
张金磊1,李鹏飞2,马博1,赵丹丹1,全青敏1,雷福厚2
(1.广西高校桂西生态环境分析和污染控制重点实验室百色学院,广西百色533000;2.广西民族大学广西林产化学与工程重点实验室,广西南宁530006)
研究麻疯树果壳多糖的提取工艺条件及抗氧化活性。采用麻疯树果壳为原料,以多糖得率为指标,在单因素的基础上,通过正交试验,研究了提取温度、提取时间、料水比和乙醇浓度4个因素对麻疯树果壳多糖得率的影响,并对其抗氧化活性进行研究。结果表明,麻疯树果壳多糖的最佳提取工艺条件为:温度90℃,时间2.5 h,料水比1∶20(g/mL),乙醇体积分数为90%,在此条件下麻疯树果壳多糖得率为5.75%。乙醇体积分数对麻疯树果壳多糖得率的影响程度达显著水平,而提取温度、料水比和提取时间对麻疯树果壳多糖得率没有显著的影响。麻疯树果壳多糖具有较好的清除·OH和DPPH·的能力,且其具有一定的还原能力。
麻疯树果壳;多糖;提取工艺;抗氧化活性
麻疯树(Jat Ropha Curcas L.)又名小桐子、膏桐、芙蓉树等,是一种抗旱耐瘠的速生树种,在我国主要分布在云南、贵州、四川、广西、广东等省区的热带及干热河谷地区[1]。传统的应用是将果壳作为普通燃料直接燃掉,这种方法附加值不高,经济效益差,造成了极大的资源浪费。由于其中含有较高含量的硫分,燃烧尾气还会对环境造成污染[2]。我国潜在的可利用麻疯树果壳资源十分丰富[3-6]。如果将其应用,将是一份非常大的资源。
多糖是所有生命有机体的重要组成部分,同维持生物机能密切相关,从天然产物中提取出来的多糖能参与生物体内细胞中的各种活动,具有重要与特殊的生理活性。多糖的抗氧化性可能是多糖抗肿瘤、抗衰老、抗感染等其他活性的重要原理之一。因此,近年来提取植物中的多糖受到人们的关注。目前已报道的多糖的提取来源有:蓝莓叶[7]、仙人掌[8]、大蒜[9]、枸杞[10]等。但是,关于麻疯树多糖的提取和抗氧化性的研究还少有报道。因此,以麻疯树果壳作为原料提取多糖,是极具前景的开发利用果壳资源的有效途径,以期为麻疯树果壳多糖的开发利用提供理论参考。
1 材料与方法
1.1试剂与仪器
麻疯树果壳:市售;无水乙醇、丙酮、乙醚等试剂(均为分析纯):天津市光复科技发展有限公司;HH-4型数字恒温水浴锅:国华电器有限公司;SHB–B95型循环水式多用真空泵:郑州长城科工贸有限公司;LD-100手提式实验室粉碎机:长沙市常宏制药机械设备厂;粉碎机:绍兴市公路仪器设备有限公司;TGL–16M高速台式冷冻离心机:湖南湘仪实验室仪器开发有限公司;DHG–9030电子恒温鼓风干燥箱:上海贺德实验设备有限公司;721型可见分光光度计:上海菁华科技仪器有限公司。
1.2方法
1.2.1原料处理
将麻疯树果壳和麻疯树籽分离,并对果壳进行挑选,弃去腐烂及其他杂质,热风干燥后经粉碎机粉碎,过60目筛,放置于干燥箱里备用。
1.2.2麻疯树果壳多糖的提取[11]
精确称1.000 0 g麻疯树果壳粉末,对其按一定的时间、温度、料液比浸提,自然冷却后对提取液进行抽滤;将滤液加热浓缩到其体积基本不变,按试验探究的乙醇体积分数加入乙醇对浓缩液进行沉淀,然后放置在4℃冰箱中沉淀过夜,次日进行离心(8 000 r/min),对沉淀依次用一定量的无水乙醇、丙酮、无水乙醚进行洗涤,经55℃干燥后即为麻疯树果壳多糖。
1.2.3麻疯树果壳多糖含量的测定(采用苯酚-硫酸法[12])
1.2.3.1葡萄糖标准曲线的绘制
配制不同浓度的葡萄糖标准溶液,然后各加入1.20 mL苯酚(50 g/L),混匀,快速加入6.00 mL浓硫酸,充分摇匀,于30℃水浴30 min,然后在490 nm波长处测定吸光度,并用蒸馏水代替葡萄糖溶液作为空白对照组。葡萄糖标准曲线图的绘制,以葡萄糖质量分数为横坐标,490 nm波长处的吸光度为纵坐标。
1.2.3.2麻疯树果壳粗多糖中多糖含量的测定
精确称取麻疯树果壳粗多糖样品0.016 0 g,用蒸馏水溶解并定容至10 mL的容量瓶中,然后准确移取0.60 mL,按1.3.2.1中的操作方法,在波长为490 nm处测其吸光度值,麻疯树果壳多糖的浓度可以根据标准曲线计算,再进一步计算就可以得到样品中多糖的含量。
1.2.4麻疯树果壳多糖得率和含量的计算[12-13]
麻疯树果壳多糖得率/%=麻疯树果壳粗多糖质量/麻疯树果壳原料质量×100
麻疯树果壳多糖含量/%=粗多糖中多糖质量/麻疯树果壳粗多糖质量×100
1.2.5麻疯树果壳多糖提取单因素试验
称取约1.0 g麻疯树果壳粉末作为提取原料,放置于250 mL的锥形瓶中,在其他条件相同的情况下,采用不同提取温度、提取时间、料液比、乙醇体积分数进行提取多糖的单因素试验,逐个考察各提取条件对提取效果的影响。
1.2.6麻疯树果壳多糖提取的正交试验设计
根据单因素试验结果来确定正交试验的参数范围,以麻疯树果壳多糖得率为考察指标,对提取时间、提取温度、料液比和乙醇体积分数4个因素进行L9(34)的正交试验设计[14],根据正交表进行试验,然后对试验数据进行方差分析,得到提取麻疯树果壳多糖的最佳工艺条件,并进行最佳提取条件的验证试验。
1.2.7麻疯树果壳多糖提取的验证试验
称取1.000 0 g麻疯树果壳粉末,放置于150 mL的锥形瓶中,在正交试验得出的最佳提取工艺条件下按2.3.2中方法进行提取,重复3次取平均值,以确定试验结果的准确性。
1.2.8麻疯树果壳多糖的体外抗氧化活性测定
精确称取一定量的麻疯树果壳粗多糖和VC,分别用蒸馏水溶解,再分别移于50 mL的容量瓶中,配制成浓度为5 mg/mL的储备液。分别精确移取麻疯树果壳多糖及VC储备液于50 mL的容量瓶中,定容成浓度为0.2、0.3、0.4、0.5、0.6 mg/mL待测溶液。
1.2.8.1多糖对羟基(·OH)清除率的测定[15]
在待测的反应体系中分别依次加入下列溶液:1.00 mL邻二氮菲(0.75 mmol/L),2.00 mL PBS缓冲液(0.15 mol/L,pH=7.4),1.00 mL不同浓度的粗多糖溶液,摇均匀后加入1.00 mL硫酸亚铁(0.75 mmol/L),摇匀后再加入1.00 mL过氧化氢(0.01%),充分混均匀。将配制好的待测液放置于37℃水浴30 min,自然冷却至室温,在波长为510 nm处测定其吸光度,并用VC溶液作为阳性对照组。
样品对·OH的清除率计算公式如下:·OH清除率/%=(Aj-Ai)/(Ac-Ai)×100
式中:Ac为水代替过氧化氢及样品溶液的吸光度;Ai为以水代替样品溶液的吸光度;Aj为加入样品溶液反应后的吸光度。
1.2.8.2多糖对DPPH·清除率的测定[16]
在待测的反应体系中分别依次加入下列溶液:1.50 mL不同浓度的粗多糖溶液,1.50 mL蒸馏水,3.00 mL DPPH溶液(2×10-4mol/L,无水乙醇配制)。充分摇均匀,后将其放置于25℃水浴30 min,自然冷却至室温,然后在波长为517 nm处测定其吸光度。以水代替样品溶液、无水乙醇代替DPPH溶液作为空白试验调零。
样品对DPPH·的清除率计算公式如下:DPPH·的清除率/%=Ac-(Ai-Aj)/Ac×100
式中:Ac为无水乙醇代替样品溶液及蒸馏水的吸光度;Ai为样品溶液的吸光度;Aj为无水乙醇代替DPPH的吸光度。
1.2.8.3多糖的还原能力测定[17]
在待测的反应体系中分别依次加入下列溶液:2.50 mL不同浓度的样品溶液,2.50 mL PBS缓冲液(0.2 mol/L,pH=6.6),2.50 mL铁氰化钾溶液(1%),充分摇均匀,将其放置于50℃水浴20 min,然后继续加入2.50 mL三氯乙酸(10%),充分摇均匀,在3 000 r/min下离心8 min。吸取2.50 mL上清液,然后加入2.50 mL蒸馏水和0.50 mL三氯化铁(1%),摇匀,在波长为700 nm处测定其吸光度,吸光度越大表明还原能力越强。以蒸馏水代替样品溶液做空白实验调零,并用VC溶液作为阳性对照组。
2 结果与讨论
2.1单因素试验
2.1.1提取温度的影响
当提取时间为2.0 h、料液比为1∶20(g/mL)、乙醇体积分数为80%沉淀多糖时不同提取温度对多糖得率的影响如图1所示。从图1可以看出,当温度在40℃~80℃时,随着提取温度的增加多糖得率上升较明显,高于80℃时,多糖得率受温度影响较小。因此,取80℃为麻疯树果壳多糖提取的最佳温度,选定70、80、90℃3个温度浸提水平为优化的参数。
2.1.2提取时间的影响
当提取温度为80℃、料液比为1∶20(g/mL)、乙醇体积分数为80%沉淀多糖时不同提取时间对多糖得率的影响,结果如图2所示。

图1 提取温度对多糖得率的影响Fig.1 Effect of extraction temperature on polysaccharides yield

图2 提取时间对多糖得率的影响Fig.2 Effect of extraction time on polysaccharides yield
从图2可以看出,在0.5 h~2.0 h范围内,多糖得率呈上升趋势,并在2.0 h达到最大值,因此最佳提取时间为2.0 h。此后随提取时间的延长,多糖得率又开始下降。原因可能是因为在较高的温度下浸提时间过长会导致多糖的降解和变性,反而使多糖的得率下降。因此选定1.5、2.0、2.5 h 3个浸提时间水平为优化的参数。
2.1.3料水比的影响
当提取温度为80℃、提取时间为2.0 h、乙醇体积分数为80%沉淀多糖时不同料液比对多糖得率的影响见图3。
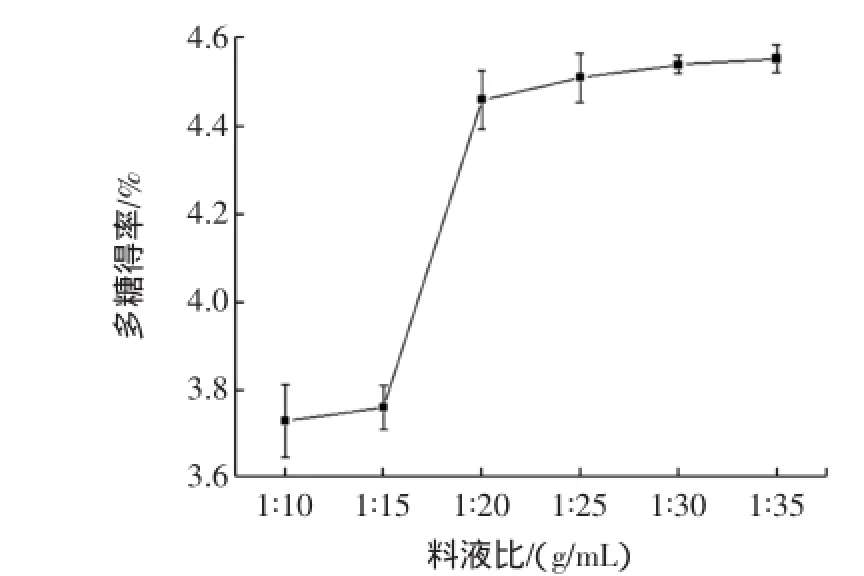
图3 料水比对多糖得率的影响Fig.3 Effectof ratio ofmaterialto solvent on polysaccharides yield
从图3可以看出,料液比在1∶25(g/mL)之前,多糖得率有较显著的提升,但料液比在1∶25(g/mL)之后,多糖得率随料液比的增大变化不大。因此取1∶25(g/mL)为最佳的提取料液比,选定1∶20、1∶25、1∶30(g/mL)3个浸提料液比水平为优化的参数。
2.1.4乙醇体积分数的影响
当提取温度为80℃、时间2.0 h、料液比为1∶25(g/mL)时不同乙醇体积分数沉淀多糖时对多糖得率的影响见图4。

图4 乙醇体积分数对多糖得率的影响Fig.4 Effectofethanolconcentration on polysaccharides yield
由图4可以看出,当乙醇体积分数在40%~80%时,随着乙醇体积分数的增大,多糖得率也随之逐渐增大,当乙醇体积分数大于80%后,多糖得率变化不大,即选取80%为最佳的提取乙醇体积分数。因此选定70%、80%、90%3个醇沉体积分数水平为优化的参数。
2.2最佳提取工艺的确定
在单因素的基础上选取提取温度、提取时间、料水比和乙醇体积分数4个因素,每个因素选取3个水平进行正交试验见表1,试验结果分析见表2,显著性检验见表3。

表1 因素水平设计表Table 1 Levels and factors for orthogonaltest
由表2极差分析结果可知,极差大小顺序为R4> R1>R3>R2,试验所选取的4个因素对多糖得率影响的主次顺序:D(乙醇体积分数)>A(温度)>C(料液比)>B(时间)。通过对K值的分析比较,可知最佳提取工艺条件组合为A3B3C1D3,即提取温度为90℃、料液比为1∶20(g/mL)、浸提时间为2.5 h、乙醇体积分数为90%。由表3方差分析可知,在考察范围内乙醇体积分数对于麻疯树果壳多糖的提取具有显著的影响,温度的影响次之,料液比和提取时间在考察范围内无显著影响。

表2 正交试验结果及分析Table 2 Results and analysis oforthogonalexperiment

表3 正交试验结果方差分析Table 3 Variance analysis oforthogonaltest
2.3验证试验
最佳工艺条件组合在9组正交试验中并没有出现,因此根据正交试验得到的最佳工艺条件进行3次重复性验证试验,通过对试验结果分析得到麻疯树果壳多糖的平均得率为5.75±0.27%。因此,通过正交试验优化的多糖提取工艺参数对多糖的提取具有一定的参考价值。
2.4体外抗氧化活性试验
2.4.1麻疯树果壳多糖清除羟基(·OH)活性测定
麻疯树果壳多糖对·OH的清除能力见图5。
由图5可知,麻疯树果壳多糖清除·OH效果显著,并且随着浓度的增加麻疯树果壳多糖对·OH的清除能力显著增强。当麻疯树果壳多糖浓度为0.6 mg/mL时,多糖对·OH的清除率达到72.76%,说明麻疯树果壳多糖对·OH具有较好的清除能力。但在试验范的条件范围内,麻疯树果壳多糖对·OH的除能力明显低于VC。当VC浓度为0.2 mg/mL时,对·OH的清除率达到75.17%,而等浓度的麻疯树果壳多糖对·OH的清除率仅为11.03%。

图5 麻疯树果壳多糖对·OH的清除能力Fig.5 Scavening effect on hydroxylradicalofpolysaccharides from Jatropha Curcas FruitShells
2.4.2麻疯树果壳多糖对DPPH·清除作用
麻疯树果壳多糖对DPPH·清除能力见图6。

图6 麻疯树果壳多糖对DPPH·清除能力Fig.6 Scavening effecton DPPH·ofpolysaccharides from Jatropha Curcas Fruit Shells
由图6可知,麻疯树果壳多糖对DPPH·是具有一定清除能力的。当多糖浓度在0.2 mg/mL~0.3 mg/mL范围时,DPPH·的清除能力增强显著。但当多糖浓度在0.3 mg/mL~0.6 mg/mL范围时,DPPH·的清除能力变化不大。当麻疯树果壳多糖浓度为0.6 mg/mL时,DPPH·的清除率为59.26%,VC对DPPH·的清除率基本稳定在95%。因此,与VC相比,麻疯树果壳多糖对DPPH·清除能力相对较弱。
2.4.3还原能力测定
麻疯树果壳多糖还原能力见图7。
由图7可知,当多糖浓度在0.2 mg/mL~0.5 mg/mL范围时,麻疯树果壳多糖吸光值逐渐增大,但当多糖浓度大于0.5 mg/mL后,其吸光值基本不变。而VC的吸光值基本保持在3.000左右,VC的还原能力与其浓度没有定量的关系。当麻疯树果壳多糖浓度在0.6 mg/mL时,其吸光值为1.352,说明麻疯树果壳多糖具有一定的还原力。

图7 麻疯树果壳多糖还原能力Fig.7 Reducing power of polysaccharides from Jatropha Curcas FruitShells
3 结论
在单因素试验的基础上进行了四因素三水平的正交试验设计,对传统的水浴醇沉法提取麻疯树果壳多糖的工艺进行了优化。通过试验结果的方差分析可知,在试验中各个因素对麻疯树果壳多糖得率的影响作用大小顺序依次是乙醇体积分数>提取温度>提取时间>料液比。提取多糖的最优工艺参数为:提取温为90℃、提取时间2.5 h、提取料液比1∶20(g/mL)、乙醇体积分数90%。在这个优化工艺条件下,进行3次重复验证试验的平均多糖得率为(5.75±0.27)%。
麻疯树果壳多糖的体外抗氧化活性试验结果表明该多糖对·OH和DPPH·有较好的清除能力,同时随着测定的质量浓度的增加,两种自由基的清除能力也相应增强,且在一定的浓度范围内,呈现一定的量效关系。当麻疯树果壳多糖浓度为0.6 mg/mL时,对·OH的清除率达到72.76%,对DPPH·的清除率达到59.26%,但其清除效果明显低于VC。并且麻疯树果壳多糖还具有一定的还原力。总体而言,麻疯树果壳多糖是一种具有抗氧化活性的物质。
[1]赵瑞方,华坚,陈放,等.麻风树果壳活性炭表面分形维数的实验研究[J].安全与环境学报,2008,8(2):51-54
[2] 邓志军,程红焱,宋松泉.麻疯树种子的研究进展[J].云南植物研究,2005,27(6):605-612
[3]王广慧,戴明,魏雅.冬香菇多糖的提取工艺研究[J].食品科技, 2013,38(1):192-194
[4]郝利民,张建春,鲁吉珂,等.云南种植玛咖中多糖提取工艺的优化研究[J].食品工业科技,2013,34(3):262-264,268
[5]敬思群,张晓鸣.超高压处理金鸡菊多糖提取工艺条件优化[J].食品科技,2013,38(2):168-172
[6] 丁宏伟.超声波结合微波辅助提取米糠多糖的研究[J].核农学报, 2013,27(3):329-333
[7]李颖畅,王亚丽,齐凤元,等.响应面法优化蓝莓叶多糖提取工艺[J].食品工业科技,2015,36(3):227-231
[8]李恒,李莉梅,何春梅,等.野生仙人掌多糖提取工艺优化及抗氧化活性研究[J].食品工业科技,2015,36(4):210-214
[9]宋兴良,李冰冰,高振珅.大蒜多糖及皂苷的多指标优化提取工艺研究[J].食品科技,2015,40(1):216-219
[10]陈亮,张炜,陈元涛,等.响应曲面法优化黑果枸杞多糖的超声提取工艺[J].食品科技,2015,40(1):220-227
[11]沈建福,康海权,陈亚琪,等.油茶果壳多糖的提取及抗氧化作用研究[J].中国粮油学报,2010,25(8):51-54
[12]吴向阳,范群艳,仰榴青,等.匙羹藤粗多糖的提取及其清除羟自由基活性研究[J].食品科学,2008,29(1):107-110
[13]刘航,国旭丹,马雨洁,等.超声波辅助提取苦荞麦多糖工艺优化及其体外抗氧化研究[J].食品科学,2013,34(14):45-50
[14]杨方美,王林,胡秋辉.鼠尾藻多糖的制备及其抗氧化活性[J].食品科学,2005,26(2):224-227
[15]周晓薇,王静,段浩,等.铁棍山药蛋白质的分离纯化及体外抗氧化活性[J].食品科学,2011,32(9):31-35
[16]张丽美,杨婷婷,胡蒋宁,等.超声波辅助提取茶粕多糖及其抗氧化活性研究[J].食品科学,2013,34(18):36-40
[17]郑义,王卫东,李勇,等.高良姜多糖提取工艺优化及其抗氧化活性研究[J].食品科学,2014,35(2):126-131
Extraction and Antioxidant Activity of Polysaccharides from Jatropha Curcas Fruit Shell
ZHANG Jin-lei1,LIPeng-fei2,MA Bo1,ZHAO Dan-dan1,QUAN Qing-min1,LEIFu-hou2
(1.Guangxi Colleges and Universities Key Laboratory of Regional Ecological Environment Analysis and Pollution Control of West Guangxi,Baise University,Baise 533000,Guangxi,China;2.GuangxiKey Laboratory ofChemistry and Engtneering of Forest Products,Guangxi University for Nationalities,Nanning 530006,Guangxi,China)
The extraction technology and antioxidation activity of polysaccharides from Jatropha curcas Fruit Shell were studied.The content of polysaccharides was determined using fruit shell of jatropha as raw material. On the basis ofsingle factor test,the effects of four factors including temperature,time,solid-liquid ratio and ethanolconcentration on polysaccharide yield were studied through or thogonal experiment design.Besides,antioxidant activity of the polysac charides was studied in this paper.The established optimum technological parameters were temperature 90℃,extraction time 2.5 h,solid-water ratio1∶20(g/mL),and ethanolcon centration 90%.The yield of polysac charides was 5.75%under the opticalconditions.The ethanol concentration had significant effecton polysac charide yield,and extraction temperature,solid-water ratio and extraction time had no signifi cant effect.The polysac charides of fruitshell of jatropha showed good capabilities to scavenge·OH and DPPH·with certain reducing power activity.
Jatropha Curcas Fruit Shell;polysac charides;extraction technology;antioxidant activity
10.3969/j.issn.1005-6521.2016.12.010
广西高等学校优势特色专业建设项目(桂教高教[2014]52号);广西教育厅科研项目(201203YB171;KY015YB278);广西高校桂西生态环境分析和污染控制重点实验室开放基金(1215KF09);广西林产化学与工程重点实验室开放基金(GXFC13-07)
张金磊(1984—),女(汉),讲师,硕士,研究方向:电分析和林产化学。
2015-06-22
