硒处理对发芽糙米组分含量的影响
2016-08-23申娟利张祎赵婷婷王昕吉林大学生物与农业工程学院吉林长春130025
申娟利,张祎,赵婷婷,王昕(吉林大学生物与农业工程学院,吉林长春130025)
硒处理对发芽糙米组分含量的影响
申娟利,张祎,赵婷婷,王昕*
(吉林大学生物与农业工程学院,吉林长春130025)
研究不同浓度硒对富硒发芽糙米有机硒含量、无机硒转化率、干物质损失率、发芽率、粗脂肪、粗蛋白、可溶性蛋白、总糖、还原糖的影响,结果表明,随着亚硒酸钠溶液浓度的增大,有机硒含量呈先增大后趋于稳定的趋势,无机硒转化率呈下降趋势;干物质损失率、可溶性蛋白含量和还原糖含量先升高后下降,发芽率呈下降趋势,粗脂肪、粗蛋白和总糖先下降后升高。
发芽糙米;硒;组分含量
谷物一直以来都是人类获取能量和营养的主要来源,而糙米作为谷物原料之一,其营养价值高、来源丰富,越来越受到人们的重视。糙米是指去除稻壳后,仍含有胚、糊粉层和皮层的物质。糙米具有γ-氨基丁酸(GABA)、维生素、蛋白质、膳食纤维等营养物质,尤其是GABA,具有缓解动脉硬化、降低血压、镇定兴奋等重要的生理功能。糙米发芽的过程,实际上是其内部呼吸作用增强、内源酶活化、大分子物质降解、维生素及矿物质含量增加的过程[1]。通过这个过程,糙米的食用特性得到提高,且一些功能性物质如谷胱甘肽、γ-氨基丁酸也得以积累,从而使糙米的营养价值得到充分利用[2-4]。硒是谷胱甘肽过氧化物酶的活性中心,而谷胱甘肽过氧化物酶是生物机体内部重要的抗氧化酶之一[5],可以把有毒的过氧化物还原为无毒的羟基化合物,从而防止生物体内的细胞等结构遭到破坏[6-7]。
本研究在糙米的发芽过程中引入了硒这种特殊元素,有必要对糙米富硒发芽过程中的生理活性成分和硒的富集进行探讨,以期为富硒发芽糙米的功能性及其富集规律提供理论参考。本文主要研究外源无机硒在糙米体内的转化率以及不同浓度亚硒酸钠对糙米发芽期间干物质损失率、发芽率、粗脂肪、粗蛋白、可溶性蛋白、总糖、还原糖的影响。
1 材料和方法
1.1材料与试剂
糙米(北稻3号):产自黑龙江省绥化市。
硫酸铜、氢氧化钠、硼酸、甲基红指示剂、溴甲酚绿指示剂、酚酞无水乙醚、次甲基蓝、酒石酸钾钠、亚铁氰化钾、亚硒酸钠、碘化钾、盐酸:均为国产分析纯,来自北京化工厂。
1.2试验仪器
超微粉碎机:北京环亚天元机械技术有限公司;TU-1810型紫外分光光度计:北京谱析通用仪器有限责任公司;KDY-9810凯氏定氮仪、KXL-1010型控温消煮炉:北京市通润源机电技术有限责任公司;SZT-06A脂肪测定仪:苏州市天威仪器有限公司。
1.3方法
1.3.1不同硒浓度的发芽糙米的制备
富硒发芽糙米制备工艺:在浸泡温度30℃、浸泡时间9 h、发芽温度31℃、发芽时间18.9 h,亚硒酸钠溶液浓度分别为0、10、20、40、60、80、100 mg/L的条件下培养糙米,成品粉碎过60目筛,密封包装,保存于低温避光处,备用。
1.3.2总硒、无机硒、有机硒含量测定
1.3.2.1总硒含量的测定
参照刘娜等[8]的方法,取一定量样品,于150 mL磨口烧瓶中,用少量水湿样后,加消化液(双氧水∶硫酸∶高氯酸=3∶1∶3,体积比),振荡摇匀,置电炉上消化至终点,冷却后,加氢氧化钠溶液调节pH为7.0,摇匀后,用甲酸调节pH至2.0~3.0,加4 mL 40%盐酸羟胺,后定容至50 mL,取消化液10 mL于分液漏斗中,加4 mL 5%乙二胺四乙酸二钠溶液,2 mL 0.5%的3,3-二氨基联苯胺溶液,摇匀后于暗处反应30 min,氨水调节pH 至6.5~7.0,后加4 mL甲苯,充分振荡萃取3 min,分层后,在425 nm波长处测定溶液的吸光度,用同样的方法制作标准曲线,查出与吸光度对应的硒含量。
1.3.2.2无机硒含量的测定
参照刘娜等[8]的方法,取1.0 g样品于50 mL蒸馏水,超声振荡30 min,后用小火微沸30 min,过滤定容至50 mL,取10 mL上清液,加4 mL甲苯,充分振荡萃取3 min,分层后,在425 nm波长处测定溶液的吸光度。
1.3.2.3有机硒含量测定
总硒减去无机硒含量即为有机硒含量。
1.3.3测定指标与方法
干物质含量:取发芽后的新鲜样品,称重后,105℃干燥15 min,再于75℃烘箱中烘至恒重,测定干重。
发芽率:糙米发芽结束后,随机取100粒种子,计算发芽率。
粗蛋白和粗脂肪的测定:分别按照SN/T 0800.3-1999《进出口粮食、饲料粗蛋白质检验方法》和GB/T 5512-2008《粮油检验粮食中粗脂肪含量测定》测定。
可溶性蛋白的测定:甲醛滴定法。
总糖含量测定:斐林试剂法。
还原糖含量测定:DNS(3,5-二硝基水杨酸)比色法。1.3.4相关性分析
运用SPSS18.0设计软件进行分析。
2 结果与分析
2.1不同硒浓度处理对发芽糙米中硒含量的影响
糙米经不同浓度亚硒酸钠溶液处理后,硒含量测定结果见图1,糙米中硒转化率结果见图2。
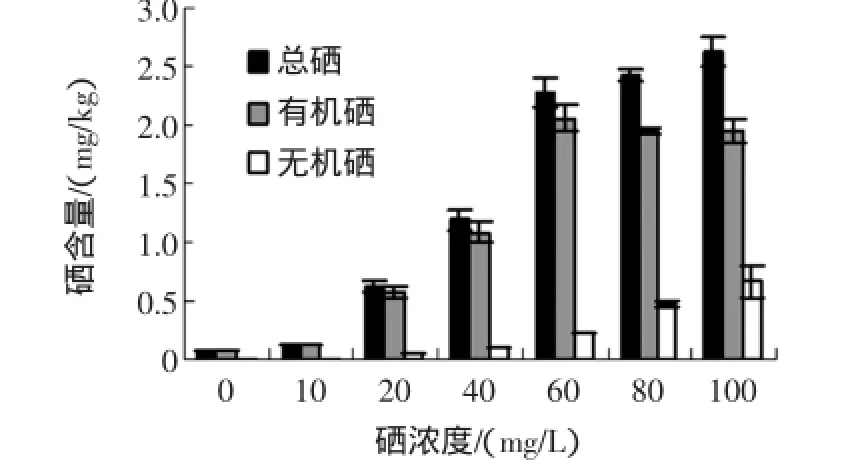
图1 硒质量浓度对糙米中硒含量的影响Fig.1 Effect ofselenium concentration on the selenium content
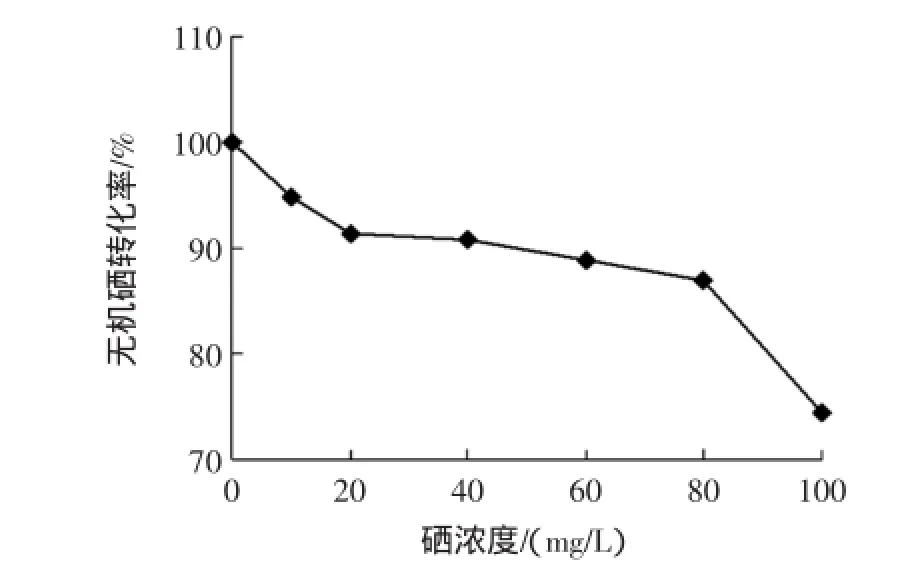
图2 硒质量浓度对糙米中硒转化率的影响Fig.2 Effect of selenium concentration on the conversion of the selenium
由图1可见,与对照组(0 mg/L亚硒酸钠溶液处理的发芽糙米)相比,经过亚硒酸钠溶液浸泡处理后,糙米中的总硒和有机硒含量显著提高,总硒含量最大能够提高40.62倍,有机硒最大能够提高33.50倍;此外,富硒发芽糙米中的总硒、有机硒和无机硒含量随着亚硒酸钠溶液浓度的增大而不断增加,当亚硒酸钠溶液质量浓度超过60 mg/L后,总硒含量缓慢增加,有机硒含量达到最大。此后,随着亚硒酸钠溶液浓度的增大,有机硒含量逐渐趋于平稳,而无机硒含量随着亚硒酸钠浓度的增加而不断增大。由图2可见,无机硒的有机转化率随着亚硒酸钠浓度的增大而不断降低,当亚硒酸钠溶液浓度为10 mg/L时,无机硒的有机转化率为94.81%,当60 mg/L亚硒酸钠溶液处理时,无机硒的有机转化率为88.94%,当100 mg/L亚硒酸钠溶液处理时,无机硒的有机转化率为74.43%。
2.2不同硒浓度处理对糙米发芽率的影响
富硒发芽糙米发芽率与亚硒酸钠浓度的关系见图3。
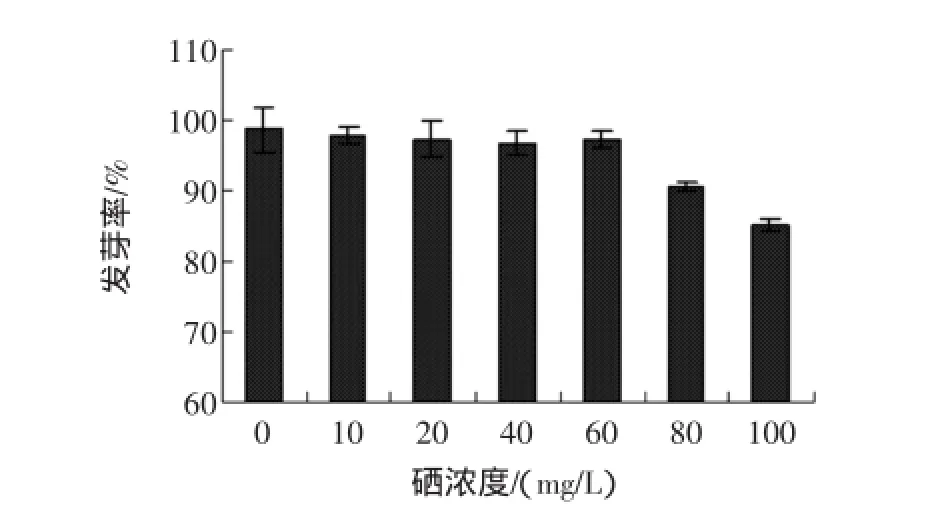
图3 不同硒浓度对发芽率的影响Fig.3 Effectofdifferentselenium concentration on the germination rate
由图3可看出,糙米发芽率与亚硒酸钠浓度密切相关,在一定浓度范围内,糙米发芽率随着亚硒酸钠浓度的增加而缓慢降低,但是当浓度大于60 mg/L时,糙米发芽率急剧下降,说明高浓度硒会抑制糙米发芽,影响糙米的正常生理活动[9]。这可能是由于无机硒被糙米吸收后,糙米能够通过自身的新陈代谢作用将无机硒转化为硒代甲硫氨酸或者硒代半胱氨酸等有机硒来组合到蛋白质中,但是当硒浓度过高时,蛋白质的结构会遭到破坏,从而对其产生毒害作用[10-12]。
2.3不同浓度硒处理对糙米干物质损失率的影响
富硒发芽糙米干物质损失率与亚硒酸钠浓度的关系见图4。
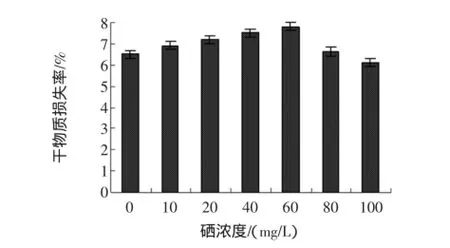
图4 不同硒浓度对干物质损失率的影响Fig.4 Effect of different selenium concentration on the loss amount ofdry substance
由图4可看出,糙米发芽后干物质的损失率随着亚硒酸钠浓度的增大而逐渐增加,但当亚硒酸钠浓度超过60 mg/L时,相对于空白,富硒发芽糙米中干物质损失率减少了。干物质的损失主要是为细胞呼吸等生理活动提供能量,在种子发芽刚开始时,细胞生长所需的能量和必须物质主要靠种子中贮藏物质降解,随着发芽的进行,在没有外加营养物质的情况下,细胞需要消耗更多的贮藏物质,以致干物质消耗加剧[13-14]。结合发芽率随硒浓度的变化,可推测出干物质损失率出现上述变化,可能是因为低硒时,糙米发芽受影响不是很显著,细胞由贮藏物质的降解获取大量能量,而随着硒浓度的增加,发芽受抑制的程度逐渐增加,表现为细胞呼吸受阻逐渐加深,导致种子中的贮藏物质降解速度减慢,最终使得干物质损失率又逐渐降低。
2.4不同浓度硒处理对发芽糙米可溶性蛋白的影响
富硒发芽糙米可溶性蛋白与亚硒酸钠浓度的关系见图5。
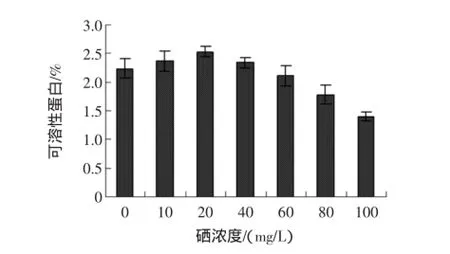
图5 不同硒浓度对可溶性蛋白的影响Fig.5 Effectofdifferentselenium concentration on the soluble protein
由图5可看出,糙米经亚硒酸钠溶液处理后,富硒发芽糙米中可溶性蛋白含量随着亚硒酸钠浓度的增加逐渐增加,但是当浓度超过20 mg/L后,可溶性蛋白含量随着亚硒酸钠浓度的增加反而逐渐降低,且浓度越高,降低速度越剧烈。这说明低浓度亚硒酸钠溶液可以提高蛋白酶活性,促进蛋白质的降解,高浓度亚硒酸钠则会产生抑制作用。
2.5不同浓度硒处理对发芽糙米粗脂肪的影响
富硒发芽糙米粗脂肪与亚硒酸钠浓度的关系见图6。
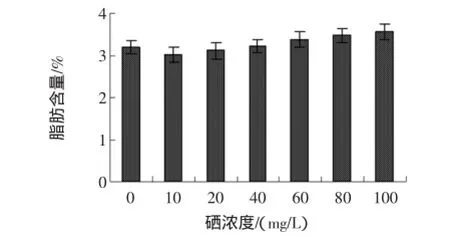
图6 不同硒浓度对粗脂肪的影响Fig.6 Effectofdifferent selenium concentration on the fattiness
由图6可看出,低浓度亚硒酸钠溶液处理后,富硒发芽糙米中粗脂肪含量降低,当亚硒酸钠溶液浓度超过20 mg/L后,富硒发芽糙米中粗脂肪含量缓慢增加,这表明硒对脂肪酶的活性有一定的影响。
2.6不同浓度硒处理对发芽糙米粗蛋白的影响
富硒发芽糙米粗蛋白含量与亚硒酸钠浓度的关系见图7。
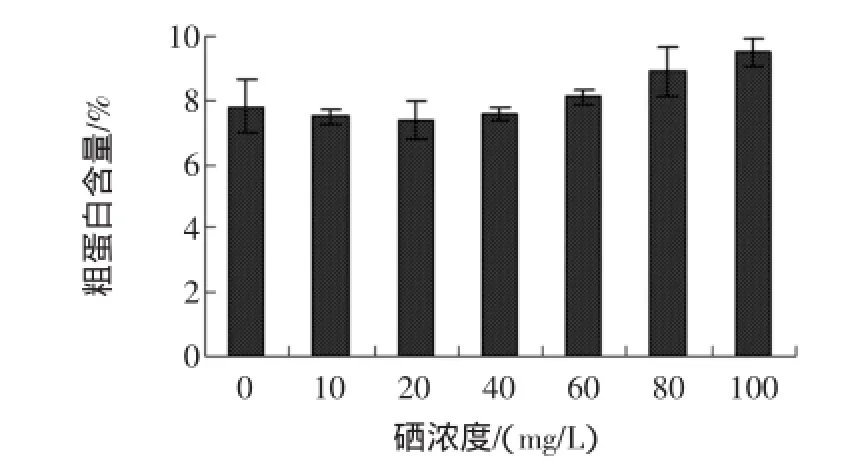
图7 不同硒浓度对粗蛋白的影响Fig.7 Effectofdifferent selenium concentration on the crube protein
由图7可看出,低浓度亚硒酸钠溶液处理后,富硒发芽糙米中粗蛋白含量缓慢降低,但当亚硒酸钠浓度超过20 mg/L后,富硒发芽糙米中粗蛋白含量逐渐增加。这可能是由于20 mg/L的亚硒酸钠浓度已经超过糙米发芽耐受限度,导致蛋白酶的活性收到抑制,从而引起富硒发芽糙米中粗蛋白含量有升高的趋势。
2.7不同浓度硒处理对发芽糙米总糖的影响
富硒发芽糙米总糖含量与亚硒酸钠浓度的关系见图8。
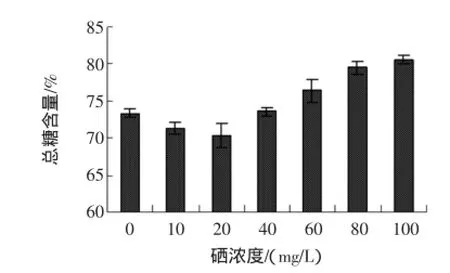
图8 不同硒浓度对总糖的影响Fig.8 Effect ofdifferentselenium concentration on the totalsugar
由图8可看出,亚硒酸钠溶液处理对富硒发芽糙米中的总糖含量影响比较明显,总糖含量随着亚硒酸钠浓度的升高缓慢降低,但是当亚硒酸钠溶液浓度超过20 mg/L后,富硒发芽糙米中的总糖含量逐渐上升。糙米在发芽过程中,酶系统形成,淀粉等大分子贮藏物质降解,分解成小分子的糖类供种子发芽[15],在此过程中,低浓度硒促进种子的生理代谢,而高浓度硒抑制其代谢。
2.8不同浓度硒处理对发芽糙米还原糖的影响
富硒发芽糙米还原糖含量与亚硒酸钠浓度的关系见图9。
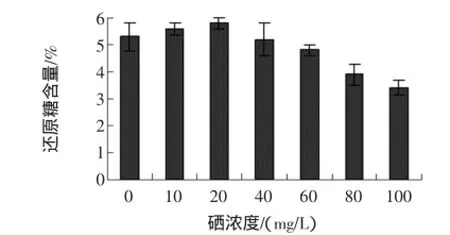
图9 不同硒浓度对还原糖的影响Fig.9 Effect of different selenium concentration on the reducing sugars
由图9可看出,亚硒酸钠溶液处理对富硒发芽糙米中的还原糖含量影响比较明显,低浓度亚硒酸钠溶液处理后,随着亚硒酸钠浓度的增大,富硒发芽糙米中还原糖含量逐渐上升,但是当亚硒酸钠浓度超过20 mg/L后,富硒发芽糙米中还原糖含量急剧下降。种子在萌发过程中,种子的萌发与淀粉酶的活性呈正相关性,由于淀粉酶被激活或重新合成,淀粉不断被降解为还原糖等小分子物质,为种子的萌发提供必要的物质,如果淀粉酶活性收到抑制,则相应的种子发芽也受到抑制[16]。试验结果说明高浓度亚硒酸钠抑制淀粉酶的活性,阻碍了还原糖的生成。
2.9相关性分析
通过SPSS18.0设计软件,得到富硒发芽糙米硒浓度与各指标之间的相关性,分析结果见表1。
由表1可以看出,硒浓度同粗脂肪、粗蛋白、总糖均呈显著正相关;硒浓度同可溶性蛋白、还原糖、发芽率均呈显著负相关;硒浓度同干物质损失相关性不显著。

表1 硒浓度与各指标之间的相关性Table 1 Correlation analysis between selenium concentration and these variables
3 结论
本文主要对糙米发芽期间硒的富集以及贮藏物质变化进行了研究,主要结论如下:
1)随着亚硒酸钠浓度的增大,有机硒含量呈先增大后降低的趋势,无机硒转化率呈下降趋势。
2)随着亚硒酸钠浓度的升高,干物质损失率先升高后下降,在硒浓度为60 mg/L时损失率最大;发芽率呈下降趋势,超过60 mg/L时,下降明显;粗脂肪及粗蛋白含量先下降后升高,分别在硒浓度为10 mg/L和20 mg/L时最低;可溶性蛋白含量先升高后下降,在硒浓度为20 mg/L时最大;总糖和还原糖分别呈现先下降后升高和先升高后下降的趋势,分别在硒浓度为20 mg/L时有最小值和最大值。
3)硒浓度同粗脂肪、粗蛋白、总糖均呈显著正相关;硒浓度同可溶性蛋白、还原糖、发芽率均呈显著负相关;硒浓度同干物质损失相关性不显著。
[1]杨颗.富硒发芽糙米制备工艺及其滚筒干燥技术的研究[D].安徽:安徽农业大学,2012:1-45
[2]Ahmed F A R,Abdel-Rahim E A M,Abdel-Fatah O M,etal.The changes of protein patterns during one week of germination of some legume seeds and roots[J].Food chemistry,1995,52(4):433-437
[3]Callis J.Regulation of protein degradation[J].The Plant Cell,1995, 7(7):845
[4]Ohtsubo K,Suzuki K,Yasui Y,et al.Bio-functional components in the processed pre-germinated brown rice by a twin-screw extruder [J].Journal of food composition and analysis,2005,18(4):303-316
[5]郑艺梅,李群,华平.发芽对糙米蛋白质及氨基酸组成特性的影响[J].中国粮油学报,2007(5):7-11
[6]Carmagnol F,Sinet P M,Jerome H.Selenium-dependent and nonselenium-dependent glutathione peroxidases in human tissue extracts[J].Biochimica et Biophysica Acta(BBA)-General Subjects, 1983,759(1):49-57
[7]Ursini F,Bindoli A.The role ofselenium peroxidases in the protection againstoxidative damage of membranes[J].Chemistryand Physics of Lipids,1987,44(2):255-276
[8]刘娜,朱棠君,赵志湘.联苯胺比色法测定饲料中有机硒的含量[J].中国畜牧杂志,2011(24):54-55
[9]C M Lim,J W Jhoo,G Y Kim.Determination of Volatile Flavor Compounds during Storage of Cereal Added Yogurtusing HS-SPME [J].KOREAN JOURNAL FOR FOOD SCIENCE OF ANIMAL RESOURCES,2013,33(5):646-654
[10]Matsumoto H.Cell biology of aluminum toxicity and tolerance in higherplants[J].Internationalreview ofcytology,2000,200:1-46
[11]Tao Z,Yu-Xi G,Bai L,et al.Study of selenium speciation in selenized rice using high-performance liquid chromatography-inductively coupled plasma mass spectrometer[J].Chinese Journal of Analytical Chemistry,2008,36(2):206-210
[12]De Souza M P,Lytle C M,Mulholland M M,et al.Selenium assimilation and volatilization from dimethyl selenonio propionate by Indian mustard[J].Plantphy siology,2000,122(4):1281-1288
[13]Mbithi-Mwikya S,Van Camp J,Yiru Y,etal.Nutrient and Antinutrient Changes in Finger Millet(Eleusine coracan)During Sprouting [J].LWT-Food Science and Technology,2000,33(1):9-14
[14]Chavan J K,Kadam S S,Salunkhe D K.Changes in tannin,free amino acids,reducing sugars,and starch during seed germination of low and high tannin cultivars of sorghum[J].Journal of Food Science, 1981,46(2):638-639
[15]F F Wu,H Y Chen,N Yang,et al.Effect of germination time on physicochemical properties of brown rice flour and starch from different rice cultivars[J].JOURNAL OF CEREAL SCIENCE,2013,58 (2):263-271
[16]曹雅君,江玲.水稻品种休眠特性的研究[J].南京农业大学学报, 2001,24(2):1-5
Studies on the Effects of Selenium on Component of Brown Rice
SHEN Juan-li,ZHANG Yi,ZHAO Ting-ting,WANG Xin*
(College ofAgriculture and Biology Engineering,Jilin University,Changchun 130025,Jilin,China)
The effectof Se-enriched on the chemical composition of brown rice was investigated.Along with increasing of the concentration ofsodium selenite solution,the organic selenium was increased and then tended to stable;the conversion of the inorganic selenium was decreased;the loss rate of dry substance,the reducing sugar and soluble protein were increased and then were decreased;germination rate was decreased;the content ofthe crude protein,crude fatand totalsugars were decreased and then were increased.
germinated brown rice;selenium;component
10.3969/j.issn.1005-6521.2016.12.007
申娟利(1988—),女(汉),硕士生,研究方向:食品科学与工程。
2015-04-27
