糙海参精子的发生及超微形态结构
2016-08-23杨学明吴明灿陈福艳
杨学明,吴明灿,张 立,杨 琼,潘 英,陈福艳
(1.广西水产科学研究院海水养殖研究室,广西南宁 530021;2.广西大学 动物科学技术学院,广西 南宁 530004)
糙海参精子的发生及超微形态结构
杨学明1,吴明灿2,张 立1,杨 琼1,潘 英2,陈福艳1
(1.广西水产科学研究院海水养殖研究室,广西南宁 530021;2.广西大学 动物科学技术学院,广西 南宁 530004)
为了解糙海参(Holothuria scabra)精子发生的过程及其形态结构,作者于2013年11月~2014年4月每月采集2头海南岛的野生雄性糙海参,取精巢组织固定后分别制作投射电镜、扫描电镜切片和石蜡包埋切片,在电镜和光镜下连续观察。观察结果表明,糙海参精子发生经历了精原细胞、初级精母细胞、次级精母细胞、精细胞和成熟精子5个阶段。精细胞分化过程可分为3个时期,早期:细胞核前端出现前顶体囊;中期:顶体腔内出现围顶体物质;后期:胞质往尾部方向收缩,形成精子中部。糙海参成熟精子全长约60 μm,由头部、中部和尾部3部分组成,为典型的鞭毛型精子。精子头部呈球形,精子核中顶体形态为“U”型内陷囊状体,围顶体物质呈“月牙”形,核染色质凝集成团块状。精子中部由一个巨大的线粒体和中心粒复合体融合而成。精子尾部鞭毛横切面为典型的“9+2”微管结构。本研究可为糙海参的繁殖生物学和人工育苗提供理论参考。
糙海参(Holothuria scabra);精子发生;形态;超微结构
doi:10.11759//hykx20141219001
糙海参(Holothuria scabra)属棘皮动物门(Echinodermata),海参纲(Holothuroidea),楯手目(Aspidochirotida),海参科(Holothuriidae),海参属(Holothuria),两广地区称为“白参”。糙海参属热带-亚热带种,在国外广泛分布于印度-西太平洋海域,在中国主要分布在海南岛、西沙群岛和广东中、西部至北部湾较浅的海域[1-2];糙海参肉厚且肉质软嫩,具有较高的商业价值,是全球40余种可食用海参中较重要的经济海参之一。国外早已开发了该种类的人工育苗和增养殖技术[3];近年来国内已开展了海南糙海参人工育苗的相关研究,初步掌握了人工育苗技术并且获得了批量化参苗[4-5],糙海参有望成为华南沿海新兴的海水养殖种类。
动物精子发生过程与其形态结构是发育生物学的重要研究内容之一,也是繁殖生物学的基础。叶素兰等[6]认为精子形态结构的差异不仅是动物分类的依据,也是分析不同动物类群之间亲缘关系的重要依据。目前国外学者[7-12]对海参纲物种精子超微结构的研究报道较多,国内仅见对仿刺参(Apostichopusjaponicus)[13-14]和 白 肛 海 地 瓜(Acaudina leucoprocta)[15]的精子发生及其超微结构做了详细观察。目前关于糙海参的精子发生及其超微结构的研究还未见报道。作者通过电镜及光镜对糙海参精子发生及其超微结构进行了观察和研究,旨在丰富其繁殖生物学资料,为人工繁殖提供理论参考。
1 材料与方法
1.1 材料
试验用雄性野生糙海参,于2013年11月~2014 年4月采自海南省陵水县新村港(18°22′N~18°47′N,109°45′E~110°08′E)的暂养围网中。每次采样时从围网海底随机捞取糙海参10头,活体称质量、解剖,根据性腺颜色辨别雌雄(雄性为乳白色,雌性为橙红色)。随机取2只雄性个体,用尖嘴镊摘取精巢组织各1~2 g,立即用3%戊二醛溶液固定,4℃保存,用于制作电镜样品;把其余精巢放入Bouin氏液中固定,常温保存,用于制作光镜切片,然后分别送广西医科大学电镜室及医学实验中心制样。试验糙海参数量及规格见表1。
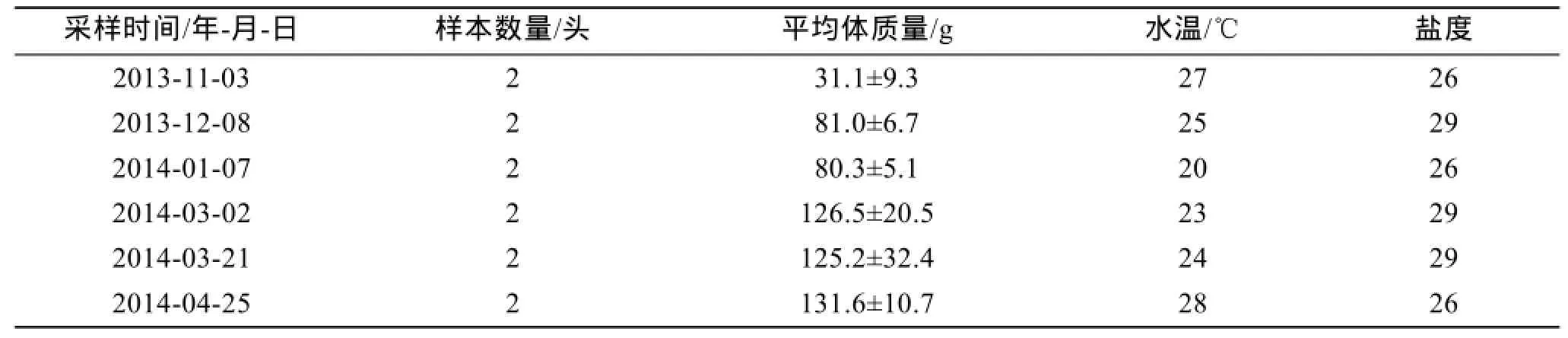
表1 不同月份采集的雄性糙海参样本规格及采样点水质指标Tab.1 Male Holothuria scabra samples collected at different times and the water quality index at the sampling location
1.2 方法
1.2.1 透射电镜(TEM)样品的制备及观察
将用3%戊二醛4℃固定过夜的样品,切成1 mm× 2 mm 的长条小块,用0.1 mol/L磷酸缓冲液充分漂洗3次(每次15 min),再用1%锇酸固定1.5 h,固定后的组织经磷酸缓冲液漂洗后,用乙醇-丙酮逐级脱水,Epon618环氧树脂渗透并包埋,接着进行35、45、60℃下聚合,使用徕卡UC7超薄切片机切片,醋酸铀和柠檬酸铅双重染色,在日立H-7650透射电子显微镜下观察并拍照。
1.2.2 扫描电镜(SEM)样品的制备及观察
样品用3%的戊二醛在4℃下固定2 h后,用0.1 mol/L磷酸缓冲液充分漂洗3次(每次15 min),分别用50%、70%、80%、90%、100%浓度的乙醇梯度脱水,接着用六甲基二硅胺烷置换3次(每次10 min),IB3离子溅射仪喷金镀膜,最后在捷克TESCAN公司VEGA 3 LMU型扫描电镜下观察拍照。
1.2.3 光镜样品的制备及观察
精巢在Bouin氏液中固定24 h后,取出精巢切成厚约0.5 cm的小块,常规石蜡包埋,切片厚7 μm,H.E染色,Motic BA410显微镜下观察并拍照。
2 结果
2.1 精原细胞
在透射及扫描电镜下,精原细胞紧靠基膜,呈不规则形或椭圆形(图1,图2),长直径7.8~8.0 μm,短直径5.2~7.8 μm。细胞紧密排列,细胞质较少,只有随机分布的少量线粒体;线粒体为圆形,其嵴很少;此时出现一些电子密度较高的物质;细胞核位于细胞中央,呈椭圆形,长直径5.6~5.8 μm,短直径3.8~4.8 μm,核膜清晰,核周腔较明显,染色质较少,附在核内膜或者不均匀地呈絮状分布在核质中(图1-1,图1-2,图2-1,图2-2)。
2.2 精母细胞
2.2.1 初级精母细胞
初级精母细胞由精原细胞经过有丝分裂转化而来,位于精原细胞内侧,呈椭圆形,大小和精原细胞相当。在其胞质一侧分布有许多线粒体,体积不断增大,数量变多,嵴渐增多;高尔基体发育良好,其周围有许多高尔基小泡;由一层膜包裹的致密小颗粒变多;细胞核位于线粒体集团的对面,一边靠近褶皱的细胞膜,长直径5.0~5.7 μm,短直径2.5~4.3 μm;核内染色质进一步增多,电子密度变大;核周腔明显,核周腔外膜扩大为不规则的核膜泡;整个细胞具有一定的极性(图1-1,图1-2,图1-3)。

2.2.2 次级精母细胞
次级精母细胞由初级精母细胞经过减数分裂而成。此期明显的特征是靠近线粒体集团一端的胞质出现突起(“尾巴”)。次级精母细胞呈卵圆形,长直径2.6~3.0 μm,短直径2.6~2.4 μm;细胞核亦呈卵圆形,长直径2.0~2.2 μm,短直径1.8~2.0 μm,核内膜明显,核膜内的染色质增多;线粒体进一步融合,高尔基体和内质网少,电子致密颗粒变大;这时期观察到“三联体”现象,即3个次级精母细胞的胞质未分开而细胞核已分开的现象(图1-4,图1-5,图1-6,图1-7)。随着次级精母细胞发育进行,突起的尾巴边长(图2-3,图2-4)。
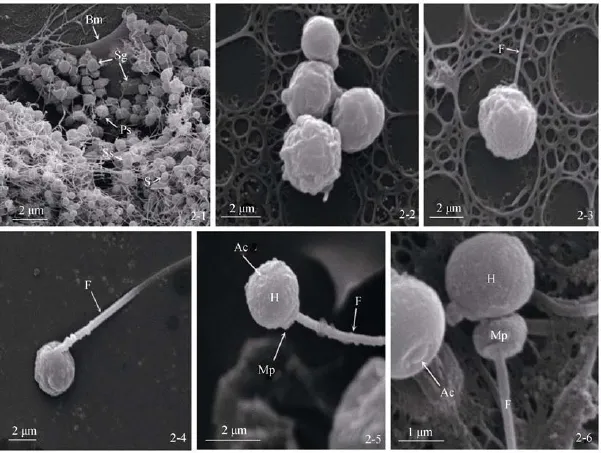
图2 糙海参精子发生及形态的超微结构(扫描电镜)Fig.2 Scanning electron micrographs of spermatogenesis and sperm morphology in sea cucumber,Holothuria scabra2-1,2-2,2-3,2-4.精子发生的不同阶段:Bm.基膜,Sg.精原细胞;Ps.初级精母细胞;Ss.次级精母细胞;S.精子;F.尾部;(余同图);2-5.精细胞分化早期:Ac.顶体,H.头部,Mp.中部;2-6.成熟精子:Ac.顶体2-1,2-2,2-3,and 2-4.different stages of spermatogenesis:Bm.basement membrane,Sg.spermatogonia,Ps.primary spermatocytes,Ss.secondary spermatocyte,S.spermatozoon;F.flagellum(same below):2-5.early spermatid:Ac.acrosome,H.head,Mp.mid-piece;2-6.spermatozoon:Ac.acrosome
2.3 精细胞分化
精细胞由次级精母细胞第二次减数分裂形成,体积进一步缩小。根据细胞形状、细胞器变化、核染色质凝集程度,可分成3个时期:
2.3.1 早期
细胞进一步缩小,呈梨型。长直径2.7~2.8 μm,短直径2.3~2.4 μm;细胞核在细胞前端,核长直径1.8~2.0 μm,短直径1.5~1.7 μm;其前面出现呈“U”型的前顶体囊,内含大量电子密度较小的泡状颗粒;核内充满颗粒状的染色质;线粒体往细胞中部的中心粒复合体方向移动,进一步融合形成两个大型线粒体,周围有高尔基体消失后留下的空泡,高密度颗粒消失,出现核后窝;尾部变长,直径约0.25 μm(图1-8,图1-9,图2-5)。
2.3.2 中期
细胞形状不变,细胞核呈扁圆形,核染色质继续凝集。顶体腔中出现围顶体物质(也称亚顶体腔);剩余的胞质进一步往尾部方向收缩;两个大型线粒体高度发达,其嵴数量多,环绕在中心粒复合体周围(图1-10)。
2.3.3 后期
精细胞已经分化为成熟的精子。核染色质高度浓缩,成为精子的头部,剩余胞质进一步往尾部收缩,两个大型线粒体融合成一个线粒体环,形成精子的中部;尾部鞭毛最长(图1-11,图1-12,图1-13,图2-1,图2-6,图3)。
2.4 精子结构
2.4.1 扫描电镜观察
糙海参精子为鞭毛型,全长约60 μm,可分为3段:头部、中部和尾部。精子头部呈扁球形,横轴长约1.8 μm、纵轴长约1.4 μm。头部后端为中部,形态和细胞核类似,长轴1.2 μm,短轴0.6 μm。尾部鞭毛粗细均匀,直径约为0.3 μm(图2-6)。
2.4.2 透射电镜观察
2.4.2.1 头部
精子头部和精细胞分化中期的发育状态一样,主要包括质膜、顶体、围顶体物质和细胞核。质膜是一层褶皱、波浪形的薄膜,包裹细胞核上半部分;顶体位于精子的前端。从精子纵切面的方向可以看到顶体陷在细胞核内,呈“U”型结构,电子密度基本相同,顶体前段为突起的乳头状,长度为细胞核纵轴长的1/3;围顶体物质是顶体和细胞核之间一层电子密度较顶体大的物质,越陷向细胞核里面,体积越大,呈“月牙”形;细胞核中出现一个小核泡(图1-10)。
2.4.2.2 中部
糙海参精子的中部位于头部与尾部之间,由线粒体和中心粒复合体组成。从横切面看,可以观察到一个线粒体围绕在中心粒复合体周围;从纵切面看,中心粒复合体由近端中心粒和远端中心粒相互垂直排列组成。近端中心粒为中空的短圆筒状结构,由9组三联微管排列而成,为“9+0”结构,与细胞核长轴垂直,直径约0.3 μm。远端中心粒长度约0.2 μm,偏离中心线延伸出精子的轴丝(图1-11,图1-12)。
2.4.2.3 尾部
尾部为精子的运动器官。从横切面看尾部呈圆形,平均直径为0.25 μm,外包一层较薄的质膜,内有9对环轴丝,中间有双微管,是典型的“9+2”型鞭毛结构(图1-13)。
以上结果可知,糙海参精子发生经历了精原细胞、初级精母细胞、次级精母细胞、精细胞,最终形成成熟精子(图2-1,图3)。
3 讨论
3.1 糙海参与海参纲其他种类精子结构的比较
精子的形态主要取决于精子头部顶体、细胞核的形态以及围顶体物质和核后窝结构等。在已报道的文献中,海参顶体的形态主要有3种类型:(1)圆球形,如仿刺参、白肛海地瓜[13-15];(2)圆柱形,如卢氏瓜参(Cucumaria lubrica)[7];(3)片状,裴氏瓜参(Cucumaria pseudocurata)[9]。糙海参精子顶体为“U”字型囊状体,内陷在精子核前端,具有乳头状突起,里面含有密度均匀的顶体颗粒物,形态属于圆球形。有文献报道,一些海参精子顶体前端由一层顶体颗粒膜包裹,如纽细锚参(Leptosynapta clarki)[8]和贾氏光参(Cucumaria japonica)[11],偶尔有侧边消失现象。本研究未观察到糙海参精子顶体颗粒膜缺失的现象。
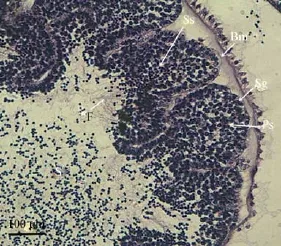
图3 糙海参精子发生的显微结构Fig.3 Light microscopic photographs of spermatogenesis in sea cucumber,Holothuria scabra生殖管纵切:Bm.基膜;Sg.精原细胞;Ps.初级精母细胞;Ss.次级精母细胞;S.精子;F.尾巴Longitudinal section of male gonad:Bm.basement membrane;Sg.spermatogonia;Ps.spermatocytes;Ss.secondary spermatocytes;S.spermatozoon;F.flagellum
Tyurin等[12]认为在不同种类海参中,顶体的大小、结构不同,顶体内的物质分布也不同。糙海参精子的顶体密度均匀,围顶体物质电子密度高于顶体,但低于顶体颗粒膜,与白肛海地瓜[15]一样具有相同的间隔描述。糙海参与纽细锚参[8]的精子顶体一样,电子密度呈同心圆排列;但与斯氏海参(Roweia stephensoni)、黑赤星海参(Holothuria cinerascens)[11]等种类的精子顶体中心的电子密度大于周围电子密度,没有同心圆排列的状况有差异。
糙海参精核内物质高度致密,且分布均匀,为球形,偶尔在个别精子中发现大小不等的核泡结构,但一个精子始终只有一个核泡。在海参纲的其他物种中,白肛海地瓜[15]、纽细锚参[8]和仿刺参[13-14]也有明显的核泡结构。软体动物如泥蚶(Tegillarca granosa)[16]、大珠母贝(Pinctada maxima)[17]、栉孔扇贝(Chlamys farreri)[18]和皱纹盘鲍(Haliotis discus hannai)[19]等也常见这样的核泡。另外,糙海参的精子和白肛海地瓜[15]一样都有核后窝,无核前窝。Popham[20]认为,核前窝的出现可能与顶体轴棒的出现有关,核后窝的发生与远端中心粒卫星体的出现有关。吴莹莹[21]认为,核后窝在精子运动中起到关节窝的作用,可降低精子尾部运动时对头部的冲击。
线粒体是精子运动的能量供应中心,其内膜、嵴分布有许多酶系和运转载体,在能量转换中起主要作用。精子尾部的摆动就是依靠线粒体提供的能量。糙海参精子中部由一个大型线粒体和中心粒复合体(含近端与远端中心粒)构成。线粒体环绕中心粒复合体,这与白肛海地瓜[15]、艾氏光参(Cucumaria miniata)[10]的结构有所不同,而与仿刺参[13-14]精子中部结构类似。因此竺俊全等[22]认为精子中段线粒体的数目及排列方式是区别种、属的特征之一。比较不同种类海参精子线粒体,可以为分类提供一些重要依据。
从远端中心粒长出的轴丝不断向外延伸,形成了精子的尾部。尾部是精子游动的器官。糙海参精子尾部横切面为典型的“9+2”结构,一般情况下,内有2条轴丝,各由一层质膜包裹;庞震国等[13-14]发现仿刺参精子尾部也为“9+2”结构,但具有轴丝共质膜现象,即2条或多条轴丝共有一层质膜。而Atwood等[9]报道裴氏瓜参精子尾部内有3条轴丝,为“9+3”结构。
3.2 胞质细胞器在糙海参精子顶体形成过程中的作用
顶体是凹陷于精子头部的囊状细胞器,在保证受精时精子与卵的特异性结合及精子入卵中起着重要作用。因此,精子顶体历来是生殖学研究的热点。在水产动物精子顶体形成机理的研究中,有多种不同的观点,学术界对此还没有统一的认识。顶体形成大致有两种途径:一种是高尔基体形成顶体,如软体动物瓣鳃类的如青蛤(Cyclina sinensis)[23]、菲律宾蛤仔(Ruditapes philippinarum)[24]和腹足类的台湾东风 螺 (Babylonia formosae)[25]、 泥 螺 (Bullacta exarata)[26]等均有观察到高尔基体囊泡形成顶体的现象,即高尔基体分泌的嗜锇液泡或囊泡(前顶体颗粒)逐渐形成前顶体囊,且不断融合迁移到细胞核的前端,最终形成精子顶体。另外一种途径是由高尔基体、溶酶体、线粒体等细胞器形成的复合体聚集形成顶体,如甲壳动物日本沼虾(Macrobrachium nipponense)[27]。本试验在透射电镜下观察到,糙海参从精原细胞开始有密度很高的复合体,这些高密度颗粒分散在胞质中,没有观察到像仿刺参[13-14]那样有一个典型、明显的前顶体颗粒。当精子发生到精细胞分化早期阶段,在胞质中已经看不到这些高密度颗粒,而此时出现前顶体囊,由此推断这些高密度颗粒的出现和消失极可能与顶体的形成有关。在糙海参初级精母细胞中,观察到大量的线粒体和典型的高尔基体,到次级精母细胞时,胞质中只有线粒体和少量的高尔基体。高尔基体没有内质网提供的物质来源,不可能合成前顶体颗粒,所以作者认为,这些高密度颗粒可能是在精母细胞期就已合成好了,后期逐步移动、融合,与高尔基体和线粒体等细胞器一起参与糙海参精子顶体的形成,属于第二种途径。当然,精子顶体的形成是一个复杂的过程,对于糙海参精子顶体的形成机理,还需要进一步深入研究。
致谢:感谢广西大学实验助理李健、研究生杨磊提供显微镜拍照帮助。
[1] 廖玉麟.中国动物志[M].北京:科学出版社,1997:115-117.
Liao Yulin.The faunal monographs of China[M].Beijing:Science Press,1997:115-117.
[2] Conand C,Byrne M.A review of recent developments in the world sea cucumber fisheries[J].Mar Fish Rev,1993,55:1-13.
[3] Beni G D,Grisida I.Australia's first commercial sea cucumber culture and sea ranching project in Hervey Bay,Queensland,Australia[J].SPC Beche-de-mer Information Bulletin,2005,21:29-31.
[4] 杨学明,张立,李有宁,等.南方糙海参的人工催产与育苗初步试验[J].南方水产科学,2011,7(1):40-44.
Yang Xueming,Zhang Li,Li Youning,et al.Primary test on artifical spawning induction and larvae rearing ofHolothuria scabra[J].South China Fisheries Science,2011,7(1):40-44.
[5] 陈水春,毛海峰,曹俊明,等.糙海参的繁育生物学和人工育苗研究进展[J].广东农业科学,2011,3(1):111-114.
Chen Shuichun,Mao Haifeng,Cao Junming,et al.Advances in reproductive biology and artificial breeding ofHolothuria scabra[J],Guangdong Agricultural Sciences,2011,3(1):111-114.
[6] 叶素兰,吴常文,傅正伟,等.曼氏无针乌贼精子的超微结构[J].中国水产科学,2009,16(1):8-14.
YeSulan,Wu Changwen,Fu Zhengwei,etal.Ultrastructure of spermatozoa inSepiella maindroni[J].Journal of Fishery Sciences of China,2009,16(1):8-14.
[7] Atwood D G,Chia F S.Fine structure of an unusual spermatozoon of a brooding sea cucumber,Cucumaria lubrica[J].Journal of Zoology,1973,52(4):519-523.
[8] Atwood D G. Fine structure of spermatognia,spermatocytes,and spermatids of the sea cucumbers Cucumaria lubrica and Leptosynapta clarki (Echinodermata:Holothuroidea)[J].Journal of Zoology,1974,52(11):1389-1396.
[9] Atwood D G.Fine structure of an elongated dorsoventrally compressed echinoderm(Holothuroidea)spermatozoon[J].Journal of Morphology,1975,145(2):189-208.
[10]ChiaFS,Atwood D,CrawfordB.Comparative morphology of echinoderm sperm and possible phylogenetic[J].Implications Integrative and Comparative Biology,1975,15(3):533-565.
[11]Hodgson A N,Bernard R T F.Spermatozoon structure of eight species of South African Holothurians (Echinodermata)[J].JournalofMorphology,1992,211(2):179-186.
[12]Tyurin S A,Drozdov A L.Spermatozoon ultrastructure of two holothurian species of the genusCucumaria (Dendrochirotida,Holothuroidea)from the sea of Japan[J].Russian Journal of Marine Biology,2001,28 (1):61-64.
[13]庞震国,孙慧玲,燕敬平,等.刺参精子发生的超微结构研究[J].海洋水产研究,2006,27(3):26-31.
Pang Zhenguo,Sun Huiling,Yan Jingping,et al.Ultrastructuralstudies on spermatogenesis ofsea cucumberApostichopus japonicus[J].Maring Fisheries Research,2006,27(3):26-31.
[14]姚红伟,宋冠南,郭晋,等.仿刺参精子形态与超微结构的研究[J].大连水产学院学报,2009,24(增刊1):73-76.
Yao Hongwei,Song Guannan,Guo Jin,etal.Morphology and ultrastructure of the spermatozoon in sea cucumberApostichopus japonicus[J].Journal of Dalian Fisheries University,2009,24(S1):73-76.
[15]冯维达,金春华,苏秀榕,等.白肛海地瓜精子发生及形态的超微结构[J].动物学杂志,2012,47(5):66-73.
Peng Weida,Jin Chunhua,Su Xiurong,etal.Spermatogenesis and sperm morphology of sea cucumberAcaudina leucoprocta[J].Chinese Journal of Zoology,2012,47(5):66-73.
[16]孙慧玲,方建光,王清印,等.泥蚶精子的超微结构[J].水产学报,2000,24(4):297-302.
Sun Huiling,Fang Jianguang,Wang qingyin,et al.Ultrastructure of the spermatozoon of Tegillaca granosa[J].Journal of Fisheries of China,2000,24(4):297-302.
[17]杜晓东.大珠母贝精子发生超微结构变化的研究[J].武汉大学学报(自然科学版),1996,42(2):219-224.
Du Xiaodong.Studies on the ultrastructural changes in spermatogenesis ofPinctada maxima Jameson[J].Journal of Wuhan University(Natural Science Edition),1996,42(2):219-224.
[18]任素莲,王如才,王德秀.栉孔扇贝精子超微结构的研究[J].青岛海洋大学学报(自然科学版),1998,28(3):387-392.
Ren Sulian,Wang Rucai,Wang Dexiu.Ultrastructure of spermatozoon ofthe chlamysfarreri[J].Journalof Ocean University of Qingdao,1998,28(3):387-392.
[19]包振民,胡景杰,姜明,等.皱纹盘鲍(Haliotis discus hannai)精子的超微结构[J].青岛海洋大学学报,1998,28(2):283-287.
Bao Zhenmin,Hu Jingjie,Jiang Ming,et al.Ultrstructure of the spermatozoa of the abalone (Haliotis disc ushannai)[J]. JournalofOcean University of Qingdao,1998,28(2):284-287.
[20]Popham J D.Comparative spermatozoon morphology and bivalve phylogeny[J].Malacological Review,1979,12(1):1-20.
[21]吴莹莹.半滑舌鳎精子发生及其受精过程[D].青岛:中国海洋大学,2008:15.
Wu Yingying.Spermatogensis and fertilization process ofCynoglossus semilaevisGunthe[D].Qingdao:Ocean University of China,2008:15.
[22]竺俊全,杨万喜,张海琪.青蚶精子的生殖进化特征[J].宁波大学学报(理工版),2003,30(6):681-686.
Zhu Junquan,Yang Wanxi,Zhang Haiqi.Reproductive evolutionary characteristics of spermatozoa inBarbatia virescens[J].Journal of Zhejiang University(Science Edition),2003,30(6):681-686.
[23]曾志南,李复雪.青蛤精细胞分化的超微结构研究[J].海洋学报,1991,13(4):547-551.
Zeng Zhinan,Li Fuxue.Ultrastructure of sperm cells differentiation inCyclina sinensis[J].Acta Oceanologica Sinica,1991,13(4):547-551.
[24]代培芳,饶小珍,陈寅山.菲律宾蛤仔的精子发生和精子超微结构[J].动物学杂志,2004,39(2):26-32.
Dai Peifang, Rao Xiaozhen, Chen Yinshan.Ultrastructural studies on spermatozoon and spermatogenesis of Ruditapes philippinarum[J].Chinese Journal of Zoology,2004,39(2):26-32.
[25]柯才焕,李复雪.台湾东风螺精子发生和精子形态的超微结构研究[J].动物学报,1992,38(3):233-238.
Ke Caihuan,Li Fuxue.U ltrastructural studies on spermatogenesis and sperm mrphoology ofBabylonia formosae(Sowerby)(Gastropoda)[J].Acta Zoologica Sinica,1992,38(3):233-238.
[26]应雪萍,姜乃澄,杨万喜.泥螺精子发生的超微结构研究[J].动物学研究,2002,23(5):400-404.
Ying Xueping, Jiang Naicheng, Yang Wanxi.Ultrastructural studies on spermatogenesis ofBullacta exarata(Philippi)[J].Zoological Research,2002,23(5):400-404.
[27]杨万喜,堵南山,赖伟.日本沼虾高尔基体在精子发生过程中的变化[J].动物学报,1984,44(4):377-383.
Yang Wanxi,Du Nanshan,Lai Wei.Changes of golgi apparantus during spermatogenesis ofMacrobrachium nipponense[J].Acta Zoologica Sinica,1988,44(4):377-383.
(本文编辑:谭雪静)
Spermatogenesis and sperm morphology of sea cucumber, Holothuria scabra
YANG Xue-ming1,WU Ming-can2,ZHANG Li1,YANG Qiong1,PAN Ying2, CHEN Fu-yan1
(1.Mariculture Lab of Guangxi Academy of Fishery Sciences,Nanning 530021,China;2.College of Animal Science and Technology,Guangxi University,Nanning 530004,China)
Dec.19,2014
Holothuria scabra;spermatogenesis;morphology;ultrastructure
The wild sea cucumber,Holothuria scabra,was sampled monthly at Hainan Island from November 2014 to April 2015 to understand spermatogenesis and sperm ultrastructure.The testis were removed and fixed in situ to prepare histological sections.The sections were observed under a scanning electron microscope,a transmission electron microscope,and a light microscope.The results showed that spermatogenesis in H.scabra included five stages of spermatogonium,primary spermatocyte,secondary spermatocyte,spermatid and spermatozoon.Differentiation of spermatids was subdivided into three stages of early spermatid(formation of the proacrosomal vesicle at the front of the nucleus),mid-spermatid(periacrosomal material in the acrosomal cavity),late spermatid(cytoplasm shrinking and formation of flagellum)and spermatozoon.The mature spermatozoon was flagellated,approximately 60 μm long,and consisted of a head,mid-piece and tail.The head was spherical,and the acrosome was a U-shaped cystid.The periacrosomal material space was crescent shaped,and the chromatin in the acrosome was condensed into a nucleus.Large mitochondria and the centriole complex were located in the mid-piece of the spermatozoon,and the flagellum in the tail had the typical“9+ 2”microtubular structure.These results will provide a theoretical reference for reproductive biology and artificial breeding of the sea cucumber.
Q248
A
1000-3096(2016)05-0049-08
2014-12-19;
2015-05-05
国家自然科学基金资助项目(31260636);广西自治区直属公益性科研院所资助项目(GXIF-2014-008)
[Foundation:National Natural Science Foundation of China,No.31260636;The public welfare scientific research projects directly under Guangxi municipality,GXIF-2014-008]
杨学明(1969-),四川人,副研究员,博士,从事热带海参种质遗传研究,电话:13878831412,E-mail:nnyxming@126.com
