天然产物oblongifolin C诱导ROS和线粒体降解
2016-08-19谢伟东徐宏喜许乃寒
程 敏 许 玮 刘 磊 谢伟东 徐宏喜 许乃寒*
(1 清华大学生命科学学院,北京,100084; 2 清华大学深圳研究生院生命与健康重点实验室,深圳,518055;3 上海中医药大学中药学院,上海,201203; 4 中药创新药物研发上海高校工程研究中心,上海,201203)
天然产物oblongifolin C诱导ROS和线粒体降解
程敏1许玮1刘磊1谢伟东2徐宏喜3,4许乃寒2*
(1 清华大学生命科学学院,北京,100084; 2 清华大学深圳研究生院生命与健康重点实验室,深圳,518055;3 上海中医药大学中药学院,上海,201203; 4 中药创新药物研发上海高校工程研究中心,上海,201203)
目的:探讨藤黄属植物中提取的多环多异戊烯基间苯三酚类天然小分子化合物oblongifolin C(OC)对细胞线粒体功能和细胞凋亡的影响。方法:以野生型和促凋亡基因bax/bak双敲除的小鼠胚胎成纤维细胞MEF和人结肠癌细胞HCT116为研究模型,通过流式细胞术,共聚焦显微术和蛋白质免疫印迹法检测OC对ROS,线粒体功能和细胞凋亡的影响。结果:OC能够诱导细胞产生ROS,破坏线粒体结构,降低线粒体膜电位,最终造成线粒体降解和细胞内ATP耗竭,使细胞走向凋亡。结论:OC能通过多条途径诱导细胞凋亡,是一种极有抗癌潜力的天然化合物。
藤黄;Oblongifolin C;ROS;线粒体;凋亡
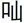
Oblongifolin C(OC)是藤黄属植物中提取的一类多环多异戊烯基间苯三酚化合物,具有较强的诱导肿瘤细胞凋亡的能力[6]。研究发现OC是一种新型的自噬抑制剂,能够抑制自噬溶酶体的形成和溶酶体组织蛋白酶Cathepsin B和Cathepsin D的表达和活性,从而降低肿瘤细胞对饥饿的耐受力[7]。此外,OC还能引起DNA双链断裂损伤和内质网压力,上调转录因子CHOP的表达并激活JNK蛋白激酶活性,诱导不依赖促凋亡蛋白Bax和Bak的细胞凋亡[8]。本研究深入探讨了OC对线粒体功能的影响,为从天然产物中筛选抗肿瘤新药的研究提供了科学依据。
1 材料与方法
1.1实验材料
1.1.1细胞系野生型(WT)及bax/bak基因双敲除(DKO)小鼠胚胎成纤维细胞MEF和人结肠癌细胞HCT116由英国Beatson癌症研究所Kevin Ryan教授提供。
1.1.2试剂与仪器Dulbecco modified Eagle medium(DMEM)高糖培养基,RPMI1640培养基,青霉素-链霉素(penicillin-streptomycin)溶液购自Gibco/Invitrogen公司;胎牛血清(FBS)购自PAA Laboratories GmbH公司;Oblongifolin C(OC)由上海中医药大学徐宏喜教授提供;ATP检测试剂盒,线粒体探针MitoTracker和Rho123购自Molecular Probes公司;COXIV抗体购自Cell Signaling Technology公司;GAPDH抗体购自Proteintech公司;HRP偶联的二抗以及ECL显色液购自KPL公司;流式细胞仪BD InfluxTM购自美国BD公司;共聚焦显微镜购自日本Olympus公司。
1.2实验方法
1.2.1细胞培养与处理野生型和bax/bak-/-MEF和HCT116细胞分别用加有10% FBS的DMEM高糖培养基和RPMI1640培养基培养,置放于含有5% CO2的37 ℃恒温培养箱培养。当细胞密度达到培养板的80%左右时,用0.25%胰酶-EDTA溶液消化细胞,按合适比例种到细胞培养板中用于后续实验。化合物OC用DMSO溶解配置成10 mM母液,药物使用终浓度为15 μM处理24 h(特殊说明情况除外)。Caspase抑制剂Z-VAD-FMK和Ac-LETD-CHO的使用浓度为50 μM处理24 h。
1.2.2共聚焦显微镜试验将对照组细胞和药物处理过的MEF细胞用线粒体荧光染料MitoTracker Red CMXRos(50 M)在常温染色20 min,然后用PBS漂洗细胞2次除去染料。在Olympus共聚焦显微镜下观察线粒体的形态并拍照。
1.2.3流式细胞术线粒体数量用MitoTracker Green FM检测,线粒体膜电势用Rh123检测。分别收集对照组细胞和药物处理过的MEF细胞悬液用线粒体荧光染料MitoTracker Green FM(50 M),Rh123(10 M),或者DCFH-DA(10 M)在常温下避光染色30 min,然后用PBS漂洗细胞2次,用BD InfluxTM流式细胞仪进行检测。
1.2.4细胞ATP水平检测ATP水平用ATP检测试剂盒(Molecular Probes)测定,将一定体积含有荧光素酶的反应试剂放在黑色96孔板中,加入细胞悬液开始反应,用酶标仪检测荧光素酶活性。
1.2.5蛋白质免疫印迹将药物处理过的MEF或者HCT116细胞样品收集后用裂解液(50 mMTriseHCl,pH 8.0,4M urea and 1% Triton X-100)进行裂解收集总蛋白,用Bradford法进行蛋白定量。以浓度为12%的SDS-PAGE进行蛋白质凝胶电泳对样品进行蛋白的分离,然后电转至硝酸纤维膜上。用5%脱脂奶粉/TBST(含0.2%Tween-20的TBS溶液)在室温下封闭1 h,然后分别加入COXIV和内参GAPDH抗体室温孵育2 h。用TBST溶液洗膜后加入HRP偶联的二抗室温孵育1 h后,加入适量ECL化学发光底物反应1 min后用X胶片进行曝光,显影和定影。
1.2.6统计学方法本研究中所有的试验均进行了3次独立重复试验,利用非配对的双尾t检验法进行显著性差异分析,当P值<0.05时显示差异有统计学意义,以*表示。
2 结果
2.1化合物OC诱导细胞ROS增多本研究用荧光探针DCFH-DA进行细胞内活性氧的检测。DCFH-DA本身没有荧光,进入细胞后细胞内的活性氧可以氧化无荧光的探针使之发出荧光。如图1所示,流式细胞仪检测结果表明OC处理MEF细胞1 h,2 h,4 h后细胞内活性氧水平明显增加。因此,本研究推测OC诱导的细胞凋亡可能与细胞内活性氧的增多有关。

图1 流式细胞试验检测OC对MEF细胞ROS的影响
2.2MitoTracker Red染色观察OC导致细胞线粒体肿胀变形及膜电位降低活性氧的产生与线粒体损伤密切相关。为了研究天然化合物OC对线粒体的影响,笔者用线粒体荧光染料MitoTracker Red分别对野生型(WT)和bax/bak-/-(DKO)型MEF和HCT116细胞进行活细胞染色。如图2A所示,对照组野生型细胞表现为明显的长线状或卷曲线状线粒体。促凋亡蛋白Bax和Bak的缺失对线粒体形状有较大的影响,线粒体断裂较显著,但仍然能够看到线形线粒体形态。而在15 M OC处理8 h的细胞中,线粒体则肿胀断裂呈小球状。上述结果提示,OC可以影响线粒体的动态变化,破坏线粒体的形态。
线粒体形态的变化预示着膜电位的下降和线粒体通透性的改变,因此作者用Rh123结合流式细胞仪检测了OC对线粒体膜电位的影响。如图2B所示,在OC处理的野生型和bax/bak基因双敲除细胞中。线粒体膜电位均显著降低。

图2 A.OC引起线粒体肿胀断裂并降低线粒体膜电位;B.OC降低线粒体膜电位
2.3OC导致细胞线粒体数量减少为确定OC对线粒体数量的影响,笔者用MitoTracker Green FM标记线粒体并用流式细胞仪检测细胞线粒体数量。有报道称蛋白酶体抑制剂MG132能诱导线粒体降解导致线粒体数量减少,因此,本文用MG132作为本实验的阳性对照。如图3所示,流式细胞结果显示OC(15 M)或者MG132(25 M)处理细胞24 h后MitoTracker Green FM的曲线明显向左偏移,提示线粒体数量减少(n=3,*P<0.05);OC导致的线粒体数量的减少与Bax和Bak蛋白的缺失没有明显的相关性。因此上述结果表明OC不仅破坏线粒体的形态,也会造成线粒体数量的减少。
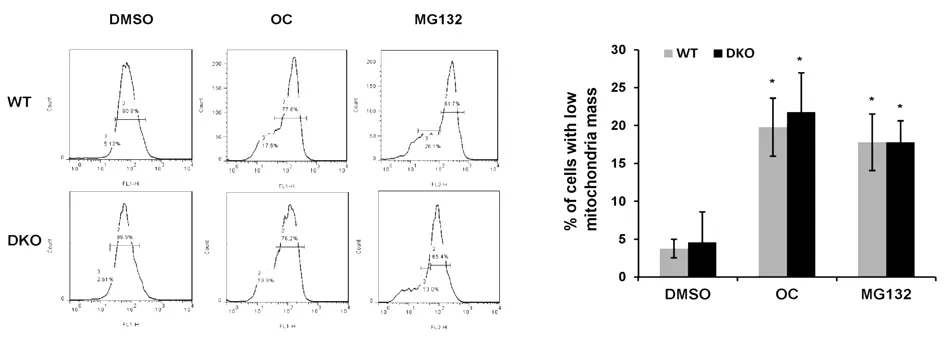
图3 OC处理细胞后细胞中线粒体的数量显著减少
2.4OC导致线粒体蛋白降解和ATP水平降低为了进一步验证OC对线粒体的影响,Western blot检测了线粒体内膜蛋白细胞色素c氧化酶亚基IV(COXIV)的表达水平。如图4A所示,OC(15 M)处理野生型和bax/bak双基因敲除的MEF细胞24 h后,细胞样品中COXIV蛋白含量显著降低,而内参蛋白GAPDH的表达不受OC的影响。上述结果提示,OC能直接诱导线粒体的降解从而使线粒体数量减少。
线粒体是细胞的能量代谢中心,笔者检测了OC对细胞内ATP水平的影响。野生型和双敲除MEF细胞分别用5,10,20 M OC处理24 h后检测ATP,检测结果用细胞内总蛋白含量做归一化处理。如图4B所示,OC显著降低细胞内ATP水平,低浓度OC(5 M)就能导致细胞内ATP产量下降60%以上,而高浓度OC(20 M)则导致细胞内ATP水平降低90%(n=3,**P<0.01),并且OC导致的ATP水平降低与Bax和Bak蛋白表达与否没有相关性。以上结果提示,OC诱导的细胞凋亡与线粒体损伤相关。
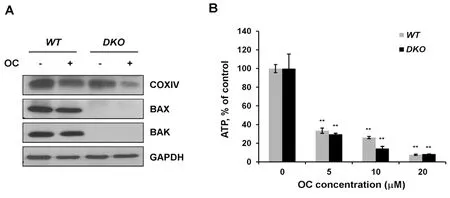
图4 OC导致线粒体蛋白降解和细胞内ATP水平降低
3 讨论
研究发现,癌细胞中存在很多正常基因的突变,传统的放化疗法对许多凋亡基因突变的癌细胞起不到杀伤作用,这是由于细胞不能感知死亡信号的刺激,因而不能诱发细胞凋亡。Bax和Bak是Bcl-2家族中起促凋亡作用的重要成员,调控线粒体外膜的通透和细胞色素c的释放从而启动下游的凋亡通路[9-10]。Bax和Bak蛋白表达的缺失使细胞对凋亡信号不敏感,细胞不能发生凋亡,因此Bax和Bak缺失的细胞往往对大多数传统的癌症疗法都有抵抗作用[11-13]。本研究中以野生型和Bax/Bak双敲除的MEF和HCT116为体外实验模型,检测了藤黄属植物中分离的天然产物OC对细胞ROS,线粒体功能和细胞凋亡的影响。实验结果表明OC诱导ROS,破坏线粒体结构,降低线粒体膜电位,并最终造成线粒体降解和ATP的耗竭。通过对比OC在野生型和DKO细胞中对凋亡的影响结果可以看出OC对于凋亡通路缺陷而化疗耐受的恶性肿瘤治疗有较好的应用前景。
线粒体是真核生物细胞内最重要的一种细胞器,参与调控细胞内多种生命活动,包括细胞凋亡除了广为人知的线粒体凋亡信号通路外,线粒体自身的损伤和线粒体功能的破坏也在凋亡过程中发挥重要作用。近年的研究发现一种线粒体死亡的现象Mitoptosis,在某些情况下细胞内的线粒体会发生大范围的断裂并最终通过凋亡将线粒体吞噬[14-16]。有报道表明蛋白酶体抑制剂MG132处理的HCT116细胞中膜电位降低,线粒体片段化并降解,线粒体功能丧失并最终诱导细胞走向不依赖Bax/Bak的细胞凋亡[17]。本研究中的天然化合物OC有和MG132类似的诱导线粒体死亡的现象,说明线粒体功能的丧失可能导致了最终的细胞凋亡。
本课题组在之前的研究中发现OC是一种自噬抑制剂,通过抑制肿瘤细胞饥饿应激条件下的自噬活性降低细胞对饥饿的耐受力,诱导肿瘤细胞发生细胞凋亡。OC还能引起DNA双链断裂损伤和内质网压力,激活内质网压力诱导的细胞凋亡信号通路。本实验发现OC诱导细胞ROS增多,ROS的积累会导致DNA氧化损伤,激活线粒体依赖的内源性凋亡通路。同时,OC还能直接作用于线粒体本身,破坏线粒体结构造成线粒体降解,因此OC能通过多条途径诱导细胞凋亡,是一种极有抗癌潜力的天然化合物。
[1]Han,Q B and H X Xu.Caged Garcinia xanthones:development since 1937[J].Curr Med Chem,2009,16(28):3775-3796.
[2]Pandey,M K,B Sung,K S Ahn,et al.Gambogic acid,a novel ligand for transferrin receptor,potentiates TNF-induced apoptosis through modulation of the nuclear factor-kappaB signaling pathway[J].Blood,2007,110(10):3517-3525.
[3]Zhao,L,Q L Guo,Q D You,et al.Gambogic acid induces apoptosis and regulates expressions of Bax and Bcl-2 protein in human gastric carcinoma MGC-803 cells[J].Biol Pharm Bull,2004,27(7):998-1003.
[4]Liu,W,Q L Guo,Q D You,et al.Anticancer effect and apoptosis induction of gambogic acid in human gastric cancer line BGC-823[J].World J Gastroentero,2005,11(24):3655-3659.
[5]Yang,Y,L Yang,Q D You,et al.Differential apoptotic induction of gambogic acid,a novel anticancer natural product,on hepatoma cells and normal hepatocytes[J].Cancer Lett,2007,256(2):259-266.
[6]Feng,C,L Y Zhou,T Yu,et al.A new anticancer compound,oblongifolin C,inhibits tumor growth and promotes apoptosis in HeLa cells through Bax activation[J].Int J Cancer,2012,131(6):1445-1454.
[7]Lao,Y,G Wan,Z Liu,et al.The natural compound oblongifolin C inhibits autophagic flux and enhances antitumor efficacy of nutrient deprivation[J].Autophagy,2014,10(5):736-749.
[8]Xu,W,M Cheng,Y Lao,X Wang,J Wu,L Zhou,Y Zhang,H Xu,and N Xu.DNA damage and ER stress contribute to oblongifolin C-induced cell killing in Bax/Bak-deficient cells[J].Biochem Biophys Res Commun,2015,457(3):300-306.
[9]Youle,R J and A Strasser.The BCL-2 protein family:opposing activities that mediate cell death[J].Nat Rev Mol Cell Biol,2008,9(1):47-59.
[10] Chipuk,J E and D R Green.How do BCL-2 proteins induce mitochondrial outer membrane permeabilization?[J].Trends Cell Biol,2008,18(4):157-164.
[11]Fischer,U,K Janssen,and K Schulze-Osthoff.Cutting-edge apoptosis-based therapeutics:a panacea for cancer?[J].BioDrugs,2007,21(5):273-297.
[12]Wei,M C,W X Zong,E H Cheng,T Lindsten,V Panoutsakopoulou,A J Ross,K A Roth,G R MacGregor,C B Thompson,and S J Korsmeyer.Proapoptotic BAX and BAK:a requisite gateway to mitochondrial dysfunction and death[J].Science,2001,292(5517):727-730.
[13]Zong,W X,T Lindsten,A J Ross,G R MacGregor,and C B Thompson.BH3-only proteins that bind pro-survival Bcl-2 family members fail to induce apoptosis in the absence of Bax and Bak[J].Genes Dev,2001,15(12):1481-1486.
[14]Skulachev,V P.Programmed death phenomena:from organelle to organism[J].Ann N Y Acad Sci,2002,959:214-237.
[15]Tinari,A,T Garofalo,M Sorice,M D Esposti,and W Malorni.Mitoptosis:different pathways for mitochondrial execution[J].Autophagy,2007,3(3):282-284.
[16]Skulachev,V P,L E Bakeeva,B V Chernyak,L V Domnina,A A Minin,O Y Pletjushkina,V B Saprunova,I V Skulachev,V G Tsyplenkova,J M Vasiliev,L S Yaguzhinsky,and D B Zorov.Thread-grain transition of mitochondrial reticulum as a step of mitoptosis and apoptosis[J].Mol Cell Biochem,2004,256-257(1-2):341-358.
[17]Lomonosova,E,J Ryerse,and G Chinnadurai.BAX/BAK-independent mitoptosis during cell death induced by proteasome inhibition?[J].Mol Cancer Res,2009,7(8):1268-1284.
(2016-07-05收稿责任编辑:洪志强)
Natural Product Oblongofilin C Induces ROS and Mitochondrial Dysfunction
Cheng Min1,Xu Wei1,Liu Lei1,Xie Weidong2,Xu Hongxi3,4,Xu Naihan2*
(1SchoolofLifeSciences,TsinghuaUniversity,Beijing100084,China; 2KeyLabinHealthyScienceandTechnology,GraduateSchoolatShenzhen,TsinghuaUniversity,Shenzhen518055,China; 3SchoolofPharmacy,ShanghaiUniversityofTraditionalChineseMedicine,Shanghai201203,China; 4EngineeringResearchCenterofShanghaiCollegesforTCMNewDrugDiscovery,Shanghai201203,China)
Objective:To study the effect of natural product Oblongifolin C(OC),a polycyclic polyprenylated acylphloroglucinol isolated from Garcinia yunnanenis Hu,on mitochondrial function and apoptosis.Methods:Wild type and bax/bak-/-mouse embryonic fibroblast MEF and human colon carcinoma cell line HCT116 were used as in intro model systems.Flow cytometry,confocal microscopy and immunoblotting were performed to detect the impacts of OC on ROS,mitochondrial function and apoptosis.Results:OC results in mitochondrial degradation and ATP depletion by increasing ROS production,disrupting mitochondrial outer membrane,reducing mitochondrial membrane potential,and finally induces apoptotic cell death.Conclusion:OC induces apoptosis through multiple pathways and it might be an attractive anticancer compound for the treatment of tumors.
Garcinia; Oblongifolin C;ROS;Mitochondria;Apoptosis
深圳市知识创新计划基础研究项目(编号:JCYJ20140417115840281)
程敏(1992.01—),女,硕士研究生,研究方向:细胞自噬,E-mail:ch-cm@qq.com
许乃寒(1973.02—),女,博士,副教授,硕士研究生导师,研究方向:细胞自噬,细胞周期,细胞凋亡,E-mail:xu.naihan@sz.tsinghua.edu.cn
Q28
A doi:10.3969/j.issn.1673-7202.2016.07.001
专题——中药活性物质基础及作用机制研究
