纳米炭淋巴结示踪剂在cN0舌鳞状细胞癌颈淋巴清扫术中的应用
2016-08-19李婷婷蒋灿华陈洁吴立萌张瑞璞翦新春
李婷婷 蒋灿华 陈洁 吴立萌 张瑞璞 翦新春
中南大学湘雅医院口腔颌面外科,长沙 410008
纳米炭淋巴结示踪剂在cN0舌鳞状细胞癌颈淋巴清扫术中的应用
李婷婷蒋灿华陈洁吴立萌张瑞璞翦新春
中南大学湘雅医院口腔颌面外科,长沙 410008
目的探讨纳米炭淋巴结示踪剂在cN0舌鳞状细胞癌患者颈淋巴清扫术中的应用价值。方法选取96例cN0舌鳞状细胞癌患者作为研究对象,随机分为纳米炭组(试验组,50例)和对照组(46例),其中纳米炭组患者于术前12 h在距离肿块边缘0.5 cm处黏膜下多点注射纳米炭混悬注射液(每个注射点0.1 mL,共计3~4个注射点)。根据原发肿瘤的大小及部位选择行肩胛舌骨肌上(Ⅰ~Ⅲ区)或全颈(Ⅰ~Ⅴ区)淋巴清扫术。标本离体后解剖、分离所有淋巴结,并行病理学检查,记录检获的淋巴结数目、大小、部位、病理结果。将试验组与对照组所得数据进行比较,采用SPSS 19.0统计软件包进行统计学分析。结果31例患者行肩胛舌骨肌上颈淋巴清扫术,共检出淋巴结1 137枚,纳米炭组平均每例检出淋巴结数(43.79±19.23)枚,显著高于对照组的(30.82±8.77)枚(P=0.019),两组均以Ⅲ区检出的淋巴结数最多,但纳米炭组Ⅱ区检出的淋巴结数及构成比均显著高于对照组(P=0.000)。65例全颈淋巴清扫术共检出淋巴结3 938枚,纳米炭组平均每例检出淋巴结数为(66.67±20.02)枚,对照组为(53.03± 20.98)枚,两组差异有统计学意义(P=0.026),两组在各区(Ⅰ~Ⅴ区)检出淋巴结数的构成比的差异无统计学意义(P=0.354)。两种颈淋巴清扫术式中,纳米炭组检出微小淋巴结的比例和检获淋巴结的准确率均高于对照组(P=0.000);纳米炭组中染色淋巴结癌转移的检出率高于未染色的淋巴结(P=0.000)。结论纳米炭淋巴结示踪剂可以显著提高cN0舌鳞状细胞癌患者颈淋巴清扫术中淋巴结特别是微小淋巴结的检出率,有助于提高颈淋巴清扫术的彻底性和患者临床病理分期的准确性。
舌鳞状细胞癌;颈淋巴清扫术;纳米炭;淋巴结示踪剂
舌鳞状细胞癌的根治性手术治疗主要包括原发肿瘤的扩大切除和颈部淋巴结的清扫。随着功能性外科理念的推广,如何在保存重要解剖结构的同时彻底清除颈部淋巴结特别是微小癌转移淋巴结[1]是减少颈部复发、提高患者生存率和术后生存质量的关键之一。淋巴结示踪剂有助于外科医生术中准确辨识淋巴结。自1950年Weinberg等[2]首次报道在胃癌手术中采用天蓝染料显示淋巴引流系统以来,许多学者对淋巴结示踪剂的材料、理化特性和示踪原理进行了大量研究。纳米炭作为第3代淋巴结示踪剂,现已广泛应用于甲状腺癌、乳腺癌及胃肠癌等多种恶性肿瘤的淋巴清扫术中。本研究将纳米炭应用于cN0舌鳞状细胞癌患者颈淋巴清扫术,探讨其对颈部淋巴结的示踪效果与临床应用价值。
1 材料和方法
1.1病例资料
选取2014年11月—2015年7月在中南大学湘雅医院口腔颌面外科手术治疗的96例cN0舌鳞状细胞癌患者作为研究对象。纳入标准:1)术前病理证实为舌鳞状细胞癌;2)原发灶未累及舌中线;3)患者为首次手术,且未行放化疗;4)临床无癌转移(临床触诊未发现肿大淋巴结,经B超或/和CT或/和磁共振成像检查,淋巴结直径<1 cm,且无淋巴结转移的影像学表现);5)患者知情同意并签署书面知情同意书。本研究得到中南大学湘雅医院伦理委员会批准。
研究对象随机分为纳米炭组(试验组,50例)和对照组(46例);其中男性89例,女性7例;年龄33~78岁,中位年龄49岁;T1期26例,T2期68例,T3期2例;高分化61例,高-中分化18例,中分化10例,中-低分化4例,低分化3例;肿块位于舌前份16例,舌中份46例,舌后份34例,其中38例患者口底有肿瘤侵犯。试验组和对照组年龄、性别、T分期、肿瘤分化程度、肿块部位的比较无统计学差异(P<0.05)。试验组术前注射纳米炭淋巴结示踪剂后再行手术,对照组术前不注射示踪剂。
1.2纳米炭淋巴结示踪剂的注射方法
纳米炭混悬注射液为重庆莱美药业股份有限公司产品,规格每支0.5 mL(每支25 mg)。用1 mL注射器于术前12 h在距离肿块边缘0.5 cm处黏膜下多点注射(每个注射点0.1 mL,共计3~4个注射点),注射完成后用干棉球压迫注射点防止药物溢出。
1.3颈淋巴清扫术的术式选择与原发灶切除
根据肿块大小与部位选择颈淋巴清扫术式[3-5]。原发灶位于舌前、舌中份且为T1或T2期的患者选择肩胛舌骨肌上颈淋巴清扫术;原发灶累及舌根部或T3期的患者选择全颈淋巴清扫术。所有病例均先行颈淋巴清扫术,原发灶的扩大切除遵循无瘤原则,距肿瘤边界外1.5 cm将肿瘤连同被纳米炭黑染的组织一并切除,术中冷冻切片快速检查证实切缘阴性。
1.4颈部淋巴结的分离与病理检查
标本离体后,由同一高年资主治医师按解剖部位标记分区,仔细分离所有淋巴结,记录其大小与纳米炭染色情况,并送病理检查。
1.5统计学处理
采用SPSS 19.0统计软件进行分析,计量资料以均数±标准差表示,组间比较采用独立样本t检验,计数资料比较采用χ2检验。检验水准为双侧α=0.05。
2 结果
96例cN0舌鳞状细胞癌患者均按照术前计划顺利完成手术,纳米炭组50例患者在颈部淋巴结清扫过程中可见大部分淋巴结染成黑色,呈肾形或类圆形,与周围组织易于区分(图1、2),其中1例患者于口底舌下腺旁发现1枚明显黑染的淋巴结(图3)。原发灶周围组织明显黑染,但肿瘤中心未见染色。
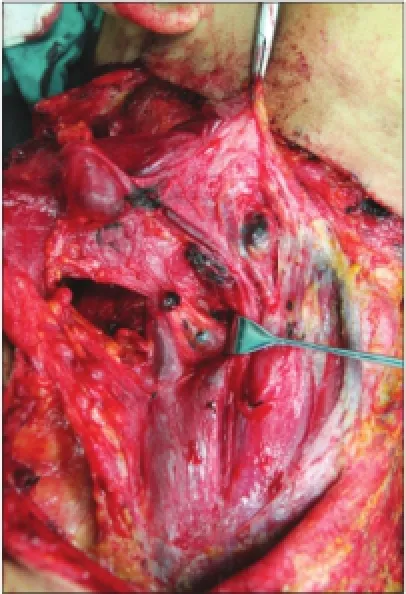
图1 纳米炭组患者颈淋巴清扫术中见大部分淋巴结染成黑色,与周围组织易于区分Fig 1 In the carbon nanoparticles group, most of the lymph nodes were stained black, forming sharp contrast to the surrounding tissue during the operation
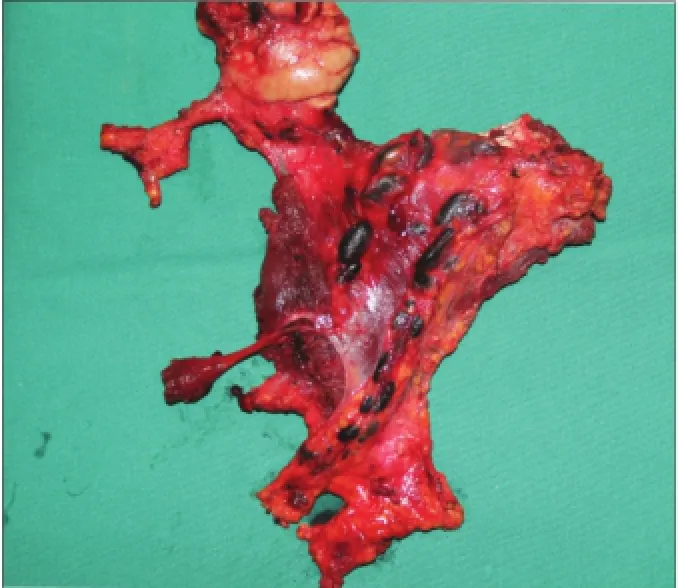
图2 颈淋巴结垂直链被纳米炭染成黑色Fig 2 Lymph nodes were stained black along the internal jugular vein
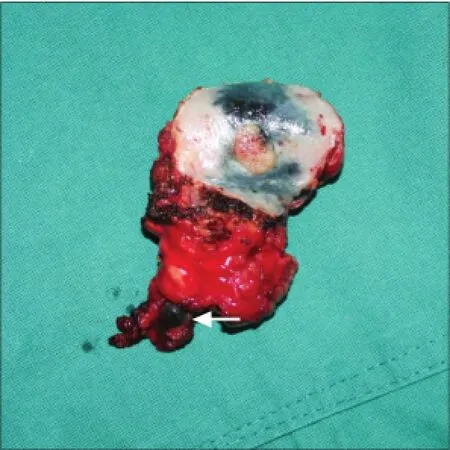
图3 黑染的口底淋巴结(箭头示)Fig 3 The lymph node stained black in the floor of mouth (the arrow showed)
2.1纳米炭组和对照组检获淋巴结准确性的比较
纳米炭组50例患者术中共检出可疑淋巴结3 398枚,病理回报证实有3 013枚,准确率88.7%;对照组46例患者共检出可疑淋巴结2 410枚,病理回报证实2 062枚,准确率为85.6%。纳米炭组的准确率高于对照组,两组差异有统计学意义(χ2=12.364,P= 0.000)。
2.2肩胛舌骨肌上颈淋巴清扫术纳米炭组与对照组淋巴结检获情况的比较
有31例患者行肩胛舌骨肌上颈淋巴清扫术,纳米炭组14例,对照组17例,术中检获及经病理证实的淋巴结分布见表1。纳米炭组14例患者,术中共检获淋巴结742枚,经病理证实的淋巴结613枚,平均每例(43.79±19.23)枚;对照组17例患者,术中共检获淋巴结587枚,经病理证实者524枚,平均每例(30.82±8.77)枚。纳米炭组平均检出淋巴结数高于对照组,差异具有统计学意义(t=6.179,P= 0.019)。笔者将术中检获的淋巴结按直径分组(表1),将小于2 mm的淋巴结定义为微小淋巴结[6],纳米炭组检获的微小淋巴结占所有检获淋巴结的比例为13.3%(99/742),显著高于对照组的3.4%(20/ 587),差异有统计学意义(χ2=45.744,P=0.000)。将病理证实的淋巴结按照分区进行区分(表1),纳米炭组和对照组均以Ⅲ区检出的淋巴结数最多,但两组之间各区淋巴结数目的构成比存在统计学差异(χ2=15.599,P=0.000),纳米炭组Ⅱ区检出的淋巴结数及构成比均明显高于对照组。
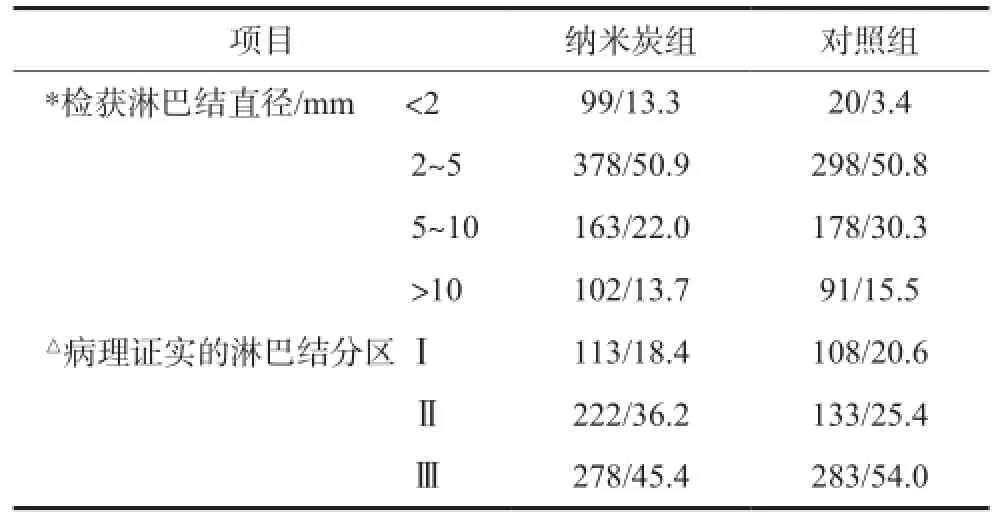
表1 肩胛舌骨肌上颈淋巴清扫术纳米炭组与对照组淋巴结检获情况的比较Tab 1 Detected lymph node data comparison between the carbon nanoparticles group and the control group utilizing supraomohyoid neck dissection method n/%
2.3全颈淋巴清扫术纳米炭组与对照组淋巴结检获情况的比较
有65例患者行全颈淋巴清扫术,纳米炭组36例,对照组29例,术中检获及经病理证实的淋巴结分布见表2。纳米炭组术中共检获淋巴结 2 656枚,经病理证实的淋巴结2 400枚,平均每例(66.67±20.02)枚;对照组术中共检获淋巴结1 823枚,经病理证实者1 538枚,平均每例(53.03±20.98)枚。纳米炭组平均检出淋巴结数高于对照组,差异具有统计学意义(t=5.188,P=0.026)。将术中检获的淋巴结按照直径分组(表2),纳米炭组检获微小淋巴结占所有检出淋巴结的比例为11.2%(297/2 656),显著高于对照组的4.2%(76/1 823),二者差异具有统计学意义(χ2=71.156,P=0.000)。将病理证实的淋巴结按照分区进行区分(表2),纳米炭组和对照组均以Ⅱ、Ⅲ区检出的淋巴结数最多,但两组之间各区淋巴结数目的构成比无统计学差异(χ2=4.407,P=0.354)。

表2 全颈淋巴清扫术纳米炭组与对照组淋巴结检获情况的比较Tab 2 Detected lymph node data comparison between the carbon nanoparticles group and the control group utilizing comprehensive neck dissection method n/%
2.4淋巴结转移率及其与染色的关系
纳米炭组50例患者共检出经病理证实的淋巴结3 013枚,其中染色淋巴结1 597枚,转移率为2.5% (40/1 597),未染色淋巴结1 416枚,转移率0.6% (9/1 416),差异有统计学意义(χ2=16.389,P= 0.000)。
肩胛舌骨肌上颈淋巴清扫术纳米炭组检出淋巴结的转移率为0.7%(4/613),对照组检出淋巴结的转移率为1.1%(6/524),差异无统计学意义(χ2= 0.786,P=0.375);全颈淋巴清扫术纳米炭组检出淋巴结的转移率为1.9%(45/2 400),对照组检出淋巴结的转移率为2.6%(40/1 538),差异亦无统计学意义(χ2=2.338,P=0.144)。
3 讨论
3.1颈淋巴清扫术后颈部复发的原因
口腔癌术后复发可分为局部复发和区域复发,其中区域复发即颈部淋巴结转移是影响预后的重要因素之一。目前针对颈部复发的原因主要有两种解释:1)术中微小癌转移灶的遗漏导致癌转移淋巴结未被完全清除[1];2)非常规淋巴结的转移,如口底、二腹肌深面及咽旁等部位的癌转移淋巴结,由于位于颈淋巴清扫术的“盲区”,常常被遗漏而成为复发根源。因此,完全彻底地清除所有的可疑转移淋巴结无疑有助于提高患者的生存率。直径小于2 mm的微小淋巴结广泛存在于颈部,但在常规颈淋巴清扫手术中难以凭肉眼全部发现,尤其在功能性颈淋巴清扫术中,术野的限制更容易导致微小淋巴结的遗漏;而针对非常规转移部位淋巴结的清扫会延长手术时间,增加手术的难度和并发症风险。因此,如能对需要清扫区域的淋巴结进行标记,增加其辨识度,在提高微小淋巴结与非常规转移部位淋巴结可见性的同时,又可以加强对重要组织结构的保护。
3.2临床常用淋巴结示踪剂的种类与优缺点
淋巴结示踪剂根据其染料的不同主要可以分为放射性核素、荧光染料和非荧光染料三大类。99mTc是具有代表性的放射性核素示踪剂,常被制成99mTc-硫胶体用于淋巴示踪,能快速、特异性进入淋巴管,汇集在第一站淋巴结,并停留足够长的时间;但其价格昂贵,副作用较大,限制了临床的广泛应用[7]。荧光染料示踪剂可利用荧光实时显像技术来引导手术,具有成本低、无辐射、操作简单、直观准确等优点,但由于荧光常被较厚的组织结构遮挡而难以穿透,临床使用受到一定限制[8-9]。
常用的非荧光染料示踪剂主要有靛卡红、异硫蓝、专利蓝、亚甲蓝[9]和纳米炭。异硫蓝和专利蓝由于相对分子质量小,组织弥散快,时限性强,并有发生过敏反应的风险,已少有临床应用。亚甲蓝为小分子水溶性化合物,注射后既可进入毛细淋巴管又可进入毛细血管,使周边组织一起蓝染导致手术视野不清,不利于临床应用。
有学者[10-12]将染料示踪剂和放射性核素示踪剂联合使用,术前使用放射性核素显像确定大致范围,术中用γ探测仪精确定位前哨淋巴结,切开组织后再使用染料示踪剂来进行直接观察,这样可以提高前哨淋巴结的检出率。
3.3纳米炭淋巴结示踪剂的染色原理与应用优势
Hagiwara等[13]最早将活性炭用于淋巴结示踪,但由于碳颗粒大小不等,导致黑染不均,局部黑染严重。纳米炭团粒直径平均为150 nm,大于毛细血管内皮细胞间隙(20~50 nm),故纳米炭粒不能进入血管。而毛细淋巴管内皮细胞间隙约120~150 nm,与纳米炭团粒直径基本相同,且其基膜往往发育不完全,故纳米炭注射后能迅速进入淋巴管,并滞留集聚于相应淋巴结,实现肿瘤区域引流淋巴结的活体染色,因而具有高度的淋巴系统趋向性[14]。
进入淋巴管网的纳米炭,随着淋巴液的回流和巨噬细胞的移行,能够黑染相应的淋巴管和淋巴结。纳米炭对淋巴管网的显色非常短暂,但会在淋巴结内长期滞留,染色效果可持续7 d以上。大部分纳米炭随术中淋巴清扫被清除体外,少数未被清扫的黑染淋巴结中,纳米炭颗粒被巨噬细胞捕获后,在数月内最终通过肺和肠道排泄而消除。
3.4纳米炭在cN0舌鳞状细胞癌颈清扫术中的应用价值
纳米炭因具有安全、有效,显色时间短,染色持续时间长等优点,目前已有许多学者将其应用于甲状腺癌[15-16]、胃肠癌[17-18]、乳腺癌[19-20]的淋巴清扫术或前哨淋巴结活检术。关丽梅等[21]于术前对45例口腔鳞状细胞癌患者肿瘤边缘黏膜下注射纳米炭混悬液,术中发现颈淋巴结有广泛的不同程度的黑染,有利于防止清扫过程中对淋巴结的挤压破溃,且检获的淋巴结数高于对照组。但该研究采用的术式均为改良根治性颈淋巴清扫术,无法比较纳米炭在不同颈淋巴清扫术式中的应用情况,也没有对检获淋巴结的大小、准确性以及各颈部分区淋巴结数的构成比等进行分析。
本研究纳入的cN0舌鳞状细胞癌患者多为T1~T2期,主要是考虑到如果原发灶直径太大,术前在肿块周围正常黏膜下注射纳米炭较为困难。31例肩胛舌骨肌上颈淋巴清扫术患者中,纳米炭组和对照组均以Ⅲ区检出的淋巴结数最多,但纳米炭组Ⅰ、Ⅱ、Ⅲ区检出淋巴结总数与Ⅱ区检出淋巴结占所有淋巴结的比例均显著高于对照组;65例全颈淋巴清扫术患者中,纳米炭组患者平均检出淋巴结数也显著高于对照组,差异有统计学意义。两组均以Ⅱ、Ⅲ区检出的淋巴结数最多,但各区(Ⅰ~Ⅴ区)检出淋巴结数的构成比的比较无统计学差异。此结果提示: 1)术前肿瘤边缘纳米炭的注射能够增加颈淋巴清扫术淋巴结的检出数,其原因主要是淋巴结的黑染有利于手术过程中及术后标本处理时对淋巴结的辨认,从而提高了术中清扫和术后淋巴结分离的彻底性;2)纳米炭的注射更加有利于肩胛舌骨肌上颈淋巴清扫术中Ⅱ区淋巴结的检获,其原因可能是在肩胛舌骨肌上颈淋巴清扫术的过程中,术野相对狭小,尤其在清扫Ⅱb区时,由于胸锁乳突肌的阻挡且需要对副神经进行解剖、保留,手术难度较大,易于遗漏部分难以发现的淋巴结。纳米炭的使用使淋巴结染色易于辨认,便于术者发现并清除。而全颈淋巴清扫术的术野相对开阔,即使是对Ⅱb区的清扫手术难度也较小,淋巴结没有黑染也易于清除,因而纳米炭的使用不会对各区(Ⅰ~Ⅴ区)检出淋巴结数的构成比产生影响。
将检获的直径小于2 mm的淋巴结定义为微小淋巴结[6]。在肩胛舌骨肌上颈淋巴清扫术中,纳米炭组检出的微小淋巴结占所有检出淋巴结的比例显著高于对照组;在全颈淋巴清扫术中,纳米炭组检出微小淋巴结占所有检出淋巴结的比例亦显著高于对照组。两种术式的结果均提示纳米炭在提高微小淋巴结的检出率方面具有明显优势。
在分离淋巴结特别是微小淋巴结进行病理学检查时,很容易将脂肪颗粒误认为淋巴结。本研究发现,纳米炭组检出淋巴结的准确率为88.7%(3 013/ 3 398),显著高于对照组的85.6%(2 062/2 410),纳米炭的使用无疑有利于减少医务人员的工作负荷,节约医疗资源。
染色淋巴结转移率2.5%(40/1 597),未染色淋巴结转移率0.6%(9/1 416),差异具有统计学意义。其原因可能是转移淋巴结通常位于Ⅰ、Ⅱ区且多伴有淋巴结的肿大,易于早期被纳米炭染色所致;但也有部分发生癌转移的肿大淋巴结并没有被纳米炭染色,对于这种现象,推测其原因可能是淋巴管被转移的癌栓堵塞所致。由此可见,淋巴结是否发生转移与纳米炭染色并无明显关联,因而在颈淋巴清扫术中,术者不能只重视对染色淋巴结的清扫而遗漏未染色的淋巴结。
发生转移的非常规部位的淋巴结,由于位于颈淋巴清扫术的盲区,往往容易被遗漏而成为复发根源。本研究中,对位于舌前、中份但肿瘤直径接近2.0 cm的T1期患者,在与患者充分交流病情的基础上,由其决定是否同期行颈淋巴清扫术,在这部分患者的手术中,发现1例患者口底舌下腺旁有1枚直径5 mm大小的黑染淋巴结,予以切除后病理学检查证实发生了癌转移。
综上所述,纳米炭淋巴结示踪剂可以显著提高cN0舌鳞状细胞癌患者颈清扫术中淋巴结特别是微小淋巴结的检出率,有助于确保颈淋巴清扫术的彻底性及提高患者临床病理分期的准确性。
[1] Rodriguez-Bigas MA, Maamoun S, Weber TK, et al. Clinical significance of colorectal cancer: metastases in lymph nodes <5 mm in size[J]. Ann Surg Oncol, 1996, 3(2):124-130.
[2] Weinberg J, Greaney EM. Identification of regional lymph nodes by means of a vital staining dye during surgery of gastric cancer[J]. Surg Gynecol Obstet, 1950, 90(5):561-567.
[3] 郑家伟, 李金忠, 涂文勇, 等. 口腔颌面部恶性肿瘤治疗指南[J]. 中国口腔颌面外科杂志, 2010, 8(2):98-106. Zheng JW, Li JZ, Tu WY, et al. Treatment guidelines of oral and maxillofacial malignant tumor[J]. Chin J Oral Maxillofac Surg, 2010, 8(2):98-106.
[4] Iqbal H, Bhatti AB, Hussain R, et al. Regional failures after selective neck dissection in previously untreated squamous cell carcinoma of oral cavity[J]. Int J Surg Oncol, 2014:205715.
[5] 李思毅, 胡永杰, 张陈平, 等. cN0早期舌体鳞癌的颈部处理探讨[J]. 华西口腔医学杂志, 2011, 29(6):596-599. Li SY, Hu YJ, Zhang CP, et al. Study on neck management for tongue squamous cell carcinoma of cN0 stage[J]. West Chin J Stomatol, 2011, 29(6):596-599.
[6] Sun SP, Zhang Y, Cui ZQ, et al. Clinical application of carbon nanoparticle lymph node tracer in the Ⅵ region lymph node dissection of differentiated thyroid cancer[J]. Genet Mol Res, 2014, 13(2):3432-3437.
[7] Tausch C, Baege A, Rageth C. Mapping lymph nodes in cancer management—role of99mTc-tilmanocept injection [J]. Onco Targets Ther, 2014, 7:1151-1158.
[8] van der Vorst JR, Vahrmeijer AL, Hutteman M, et al. Nearinfrared fluorescence imaging of a solitary fibrous tumor of the pancreas using methylene blue[J]. World J Gastrointest Surg, 2012, 4(7):180-184.
[9] Buda A, Di Martino G, Vecchione F, et al. Optimizing strategies for sentinel lymph node mapping in early-stage cervical and endometrial cancer: comparison of real-time fluorescence with indocyanine green and methylene blue[J]. Int J Gynecol Cancer, 2015, 25(8):1513-1518.
[10] van den Berg NS, Brouwer OR, Klop WM, et al. Concomitant radio- and fluorescence-guided sentinel lymph node biopsy in squamous cell carcinoma of the oral cavity using ICG-99mTc-nanocolloid[J]. Eur J Nucl Med Mol Imaging,2012, 39(7):1128-1136.
[11] Kraft JC, Ho RJ. Interactions of indocyanine green and lipid in enhancing near-infrared fluorescence properties: the basis for near-infrared imaging in vivo[J]. Biochemistry, 2014,53(8):1275-1283.
[12] Sondak VK, King DW, Zager JS, et al. Combined analysis of phase Ⅲ trials evaluating99mTc tilmanocept and vital blue dye for identification of sentinel lymph nodes in clinically node-negative cutaneous melanoma[J]. Ann Surg Oncol,2013, 20(2):680-688.
[13] Hagiwara A, Takahashi T, Sawai K, et al. Selective drug delivery to peri-tumoral region and regional lymphatics by local injection of aclarubicin adsorbed on activated carbon particles in patients with breast cancer—a pilot study[J]. Anticancer Drugs, 1997, 8(7):666-670.
[14] 张润, 王思洋, 汪晓东, 等. 纳米碳的临床应用研究进展[J]. 肿瘤学杂志, 2012, 18(11):865-869. Zhang R, Wang SY, Wang XD, et al. Research progress of carbon nanoparticles in clinical application[J]. J Chin Oncol,2012, 18(11):865-869.
[15] Hao RT, Chen J, Zhao LH, et al. Sentinel lymph node biopsy using carbon nanoparticles for Chinese patients with papillary thyroid microcarcinoma[J]. Eur J Surg Oncol, 2012, 38(8): 718-724.
[16] Li Y, Jian WH, Guo ZM, et al. A meta-analysis of carbon nanoparticles for identifying lymph nodes and protecting parathyroid glands during surgery[J]. Otolaryngol Head Neck Surg, 2015, 152(6):1007-1016.
[17] Cai HK, He HF, Tian W, et al. Colorectal cancer lymph node staining by activated carbon nanoparticles suspension in vivo or methylene blue in vitro[J]. World J Gastroenterol,2012, 18(42):6148-6154.
[18] Yan J, Zheng X, Liu Z, et al. A multicenter study of using carbon nanoparticles to show sentinel lymph nodes in early gastric cancer[J]. Surg Endosc, 2016, 30(4):1294-1300.
[19] Jiang Y, Lin N, Huang S, et al. Tracking nonpalpable breast cancer for breast-conserving surgery with carbon nanoparticles: implication in tumor location and lymph node dissection[J]. Medicine: Baltimore, 2015, 94(10):e605.
[20] Wu X, Lin Q, Chen G, et al. Sentinel lymph node detection using carbon nanoparticles in patients with early breast cancer[J]. PLoS ONE, 2015, 10(8):e0135714.
[21] 关丽梅, 高琼, 赵德安, 等. 纳米炭混悬注射液在颈淋巴结清扫术中应用[J]. 延安大学学报(医学科学版), 2008,6(4):106-107. Guan LM, Gao Q, Zhao DA, et al. The application of carbon nanoparticles suspension injection in neck dissection[J]. J Yanan Univ (Med Sci Ed), 2008, 6(4):106-107.
(本文编辑吴爱华)
Application of carbon nanoparticles as lymph node tracers in patients with cN0 lingual squamous cell carcinoma un-dergoing neck dissection
Li Tingting, Jiang Canhua, Chen Jie, Wu Limeng, Zhang Ruipu, Jian Xinchun.(Dept. of Oral and Maxillofacial Surgery, Xiangya Hospital, Central South University, Changsha 410008, China)
Supported by: The National Natural Science Foundation of China (81271154); Clinical Research Foundation of Central South University (2015102). Correspondence: Jiang Canhua, E-mail: canhua-j@sohu.com.
ObjectiveThis study aimed to investigate the value of carbon nanoparticles as lymph node tracers in neck dissection for cN0 lingual squamous cell carcinoma patients. MethodsNinety-six patients with cN0 lingual squamous cell carcinoma were recruited to undergo surgical treatment were randomly divided into two groups, namely, the carbon nanoparticlelabeled group (the experimental group, 50 cases) and the control group (46 cases). Carbon nanoparticle suspension was injected into the submucosal layer around the site of the primary tumor at three or four points (0.1 mL for each point) 12 h before surgery. Supraomohyoid neck dissection (SOHND, Levels Ⅰ to Ⅲ) or comprehensive neck dissection (CND, Levels ⅠtoⅤ) were performed based on the size and location of the primary tumor. All the lymph nodes were dissected and separated from the ex vivo surgical specimens for histopathological evaluation. The number, size, location, and pathological result of all the lymph nodes were compared between the two groups. Statistical analyses were conducted by SPSS 19.0 software. ResultsA total of 1 137 lymph nodes were detected in 31 SOHND patients. The average number of lymph nodes detected in the experimental group was (43.79±19.23) /case,which was significantly higher than that in the control group [(30.82±8.77) /case] (P=0.019). Level Ⅲ covered the largest number of lymph nodes in the two groups. However, the number and proportion of lymph nodes found in Level Ⅱ of the experimental group were significantly higher than those of the control group (P=0.000). A total of 3 938 lymph nodes were detected in 65 CND patients. The average number of lymph nodes detected in the experimental group [(66.67±20.02) /case]was larger than that in the control group [(53.03±20.98) /case] (P=0.026). The difference in the lymph node location between the two groups was not statistically significant (P=0.354). In the two neck dissection methods, both the proportion of minute lymph nodes and the accuracy of the detected lymph nodes in the experimental group were significantly larger than those in the control groups (P=0.000). Compared with the control group, more metastases were proven by the carbon nanoparticlelabeled lymph nodes (P=0.000) in the experimental group. ConclusionCarbon nanoparticles as lymph node tracers in patients with cN0 lingual squamous cell carcinoma undergoing neck dissection can increase the number of detected lymph nodes,especially the minute nodes. Such nanoparticles can further ensure the thoroughness of neck dissection and the accuracy of clinicopathological stage.
lingual squamous cell carcinoma;neck dissection;carbon nanoparticles;lymph node tracers
R 730.56
A
10.7518/hxkq.2016.04.018
2015-12-15;
2016-04-12
国家自然科学基金(81271154);中南大学临床科研基金(2015102)
李婷婷,住院医师,硕士,E-mail:litingting1001kq@sina.com
蒋灿华,教授,博士,E-mail:canhua-j@sohu.com
