氨-碳酸盐法分离PTA废渣中的钴和锰
2016-08-18何沁华刘维桥邹超魏成文尚通明周全法高峰江苏理工学院江苏常州3000无锡中经金属粉末有限公司江苏无锡4000
何沁华,刘维桥,邹超,魏成文,尚通明,周全法,高峰(江苏理工学院,江苏 常州 3000;无锡中经金属粉末有限公司,江苏 无锡 4000)
研究开发
氨-碳酸盐法分离PTA废渣中的钴和锰
何沁华1,刘维桥1,邹超1,魏成文1,尚通明1,周全法1,高峰2
(1江苏理工学院,江苏 常州 213000;2无锡中经金属粉末有限公司,江苏 无锡 214000)
精对苯二甲酸(PTA)生产中的废钴锰催化剂中钴低锰高,常用的钴锰分离方法一般不适用,分离钴锰时非常容易互相夹带,导致分离不完全。本文采用氨-碳酸盐法分离PTA废渣浸出液中的钴和锰。在正交试验的基础上,以钴剩余率和锰沉淀率作为考核指标,考察了碳酸盐的种类、反应时间、反应温度、搅拌速度、氨的用量和碳酸盐的用量等因素对钴、锰分离效果的影响。实验结果表明,在氨-碳酸钠、氨-碳酸铵、氨-碳酸氢铵 3种溶液中,最佳搅拌速度、反应时间、反应温度分别为200r/min、8h和20℃,氨的最佳用量分别为理论化学反应计量的1.9倍、1.4倍和1.7倍,碳酸盐的用量分别为理论化学反应计量的1.0倍、1.3倍和1.3倍。在最佳反应条件下,氨-碳酸钠、氨-碳酸铵、氨-碳酸氢铵3种溶液中,钴的最大剩余率分别可达到96.0%、99.8%和99.5%,锰沉淀率均可达到100%。
废物处理;回收;配合物;分离
近年来,我国精对苯二甲酸(PTA)的需求不断增加,2005年我国PTA的生产能力只有640.5万吨,2014年达到4316.0万吨,预计到2018年,我国PTA的总生产能力将超过6000.0万吨[1-2]。每生产1万吨PTA就消耗乙酸钴3.3t、乙酸锰6.7t,基本都随PTA氧化残渣一同排出,其中含有的大量钴和锰是重要的二次资源[3-4]。
但是PTA氧化残渣的成分非常复杂,各组分的含量也是变化的,除了废钴锰催化剂外还有生产过程中产生的有机物副产物和苯二甲酸钠盐废料,这给 PTA氧化残渣的综合回收利用带来了一定的技术难度。目前,处理PTA氧化残渣的方法包括焚烧法和溶剂抽提法[5-6]。美国杜邦公司采用草酸盐回收残渣中的钴锰催化剂,剩余有机酸废液直接排出焚烧。日本三井则用薄膜蒸发器回收乙酸,用无离子水萃取,得到乙酸钴和乙酸锰萃取液经浓缩后直接返回PTA装置使用,剩余有机酸残渣造粒排出送焚烧炉。焚烧法虽然是一种彻底处置PTA氧化残渣的方法,但存在燃烧效率不高、锅炉腐蚀、工艺控制条件复杂和成本较高等问题。溶剂抽提法分为两种。一是将钴锰同时回收,重新作为钴锰催化剂在PTA的生产中进行使用。于文敦等[7]采用 NH4HCO3沉淀-乙酸溶解的方法,得到乙酸钴锰盐混合物,再用于PTA的生产中;二是将钴、锰分离,再分别回收利用[8];黄又明[9]用硫化钠沉淀-浓酸溶解法分离钴锰,该法会产生硫化氢气体且硫化钴难溶解;刘昭林等[10]先用硫酸浸出钴、锰,再使用氟化钠作为添加剂,用电沉积方法,从CoSO4和MnSO4电解液中提取钴。这些方法普遍存在回收率低、分离效果差、环境污染大或回收成本高等问题。其他钴锰分离方法[11-15]还有化学沉淀法、溶剂萃取法、电解法和离子交换法。何显达[16]用硫酸铵-碳酸铵-氨水混合溶液分离人造金刚石酸洗废液中的镍钴和锰;HARPER等[17]先用盐酸或溴酸将钴、锰混合物溶解,再加入金属锰,将钴置换出来,再用磁性分离的方法将钴和锰分离,不过锰的量不易控制;王成彦等[18]采用 P204萃取与反萃取相结合的方法对钴锰的分离进行研究,最后得到的萃取液中锰含量为2g/L;PIROM等[19]采用充满P204的三级HFSLM分离钴锰,锰的萃取率为98.14%。这些方法所处理的原料中钴含量高、锰含量低,但PTA氧化残渣中钴锰比为1∶(2~3),锰含量高出钴很多倍,而分离后的钴要作为电池材料,对杂质含量要求较高[20]。锰的去除率必须要保证在99.9%以上才可以制备出符合要求的钴产品,常用的钴锰分离方法一般不适用处理这种钴低锰高的原料,分离钴锰时非常容易互相夹带,导致分离不完全。
本文在氨-碳酸盐法基础上开展研究[21-24],分离钴和锰,在氨溶液中,对碳酸钠、碳酸铵和碳酸氢铵3种碳酸盐考察了反应时间、反应温度、搅拌速度和氨的用量等因素对钴剩余率的影响,以及碳酸盐的用量对钴剩余率和锰沉淀率的影响。
1 实验部分
1.1实验方法
实验原料为某石化厂生产PTA时产生的废渣,经硝酸浸出并除去有机物后得到浸出液,浸出液pH 为1.2,钴含量为50.25g/L,锰含量为95.75g/L。先用氢氧化钠将pH调至4.0~5.0,铁离子水解沉淀,过滤,再将溶液调至7.0,加入一定量的氨水和碳酸盐,使用磁力搅拌器搅拌,反应一定时间后,使用真空抽滤泵抽滤,得到钴氨络合液和碳酸锰沉淀,从而使得钴、锰分离。分别测定络合液和沉淀中钴和锰的含量以确定钴和锰的分离效果,实验中,钴和锰均主要存在于络合液及锰沉淀物中,基本无损失,因此以钴剩余率和锰沉淀率来描述钴和锰的分离效果,计算如式(1)、式(2)。

1.2分析与表征
ICP-AES,2100DV(PerkinElmer),工作参数:等离子体流量 15L/min,辅助气流量0.2L/min,泵进样量1.5mL/min,射频功率1300W,雾化器流量0.8L/min。
X射线衍射光谱仪,Xpert Powder (PANalytical),工作参数:连续扫描,2θ范围10°~80°,步长0.013°,计数时间8.67s/步,工作温度25℃,工作电压40kV,工作电流40mA。
2 实验结果与讨论
2.1反应时间对钴剩余率的影响
在氨溶液中,Co2+与 NH3络合生成可溶性的[Co(NH3)n]2+配合离子,[Co(NH3)n]2+在空气中很容易被氧化成[Co(NH3)n]3+,而溶液中的 Mn2+则与碳酸盐反应,生成溶解度很小的MnCO3沉淀。
实验发现,反应时间如果小于6h,经抽滤得到的钴氨络合液随即变浑浊,有碳酸锰沉淀析出。说明由于时间过短,碳酸盐与锰的反应尚未达到平衡,过滤后,钴氨络合液中Mn2+会与CO32-继续反应,直到达到平衡为止。
保持反应温度20℃,搅拌速度200r/min,氨的用量为理论用量的2.0倍,碳酸盐用量为理论用量的1.4倍,在6~14h范围内考察反应时间对钴剩余率的影响如图1所示。由图1可见,在6~14h范围内,随着反应时间的延长,钴剩余率先增加后降低,在反应8h时,钴剩余率达到最大值。产生这一结果的原因可能是 CoCO3与 MnCO3溶度积分别为1.4×10-13与 1.8×10-11,Co2+比Mn2+更容易与CO32-反应生成碳酸盐沉淀,因此,在反应过程中,CO32-和NH3与钴发生竞争反应,反应初始生成的CoCO3逐渐和NH3络合,释放出的CO32-再与Mn2+反应生成碳酸锰沉淀。因此,反应时间小于8h时,钴剩余率先增加。
在实验中发现,反应过程中得到钴氨络合液的颜色为深红色,而三价六氨合钴络合液的颜色应为橙黄色。这可能是实际反应过程中只有一部分钴形成了三价的六氨合钴络合物,剩余的钴只是形成了[Co(NH3)n]2+或者是[Co(NH3)n]3+(n<6),稳定性较弱,随着反应时间的延长这一部分不稳定的钴逐渐沉淀下来与碳酸锰反应生成了锰酸钴,钴沉淀下来,导致8h后钴剩余率的下降。
图2、图3分别为在氨-碳酸钠、碳酸铵和碳酸氢铵体系中反应8h和反应12h的锰的沉淀的XRD谱图。由图2、图3可见,在3个体系中,反应8h时所生成的沉淀为碳酸锰,但反应12h时所生成的沉淀除了碳酸锰以外可能还有锰酸钴,用ICP-AES对沉淀的元素含量进行分析,8h沉淀中钴的含量对应分别为2.31%、0.16%和0.32%,12h沉淀中钴的含量对应分别为 7.98%、3.61%和 4.15%,这与KATSIAPI等[25]在氨-碳酸铵法浸出钴锰氢氧化物沉淀中钴的研究中浸出得到的沉淀物中除了氢氧化锰还有有锰酸钴相的结论一致。
2.2搅拌速度对钴剩余率的影响
保持反应温度20℃,氨的用量为理论用量的2.0倍,反应时间8h,碳酸盐用量为理论用量的1.4倍,在100~600r/min考察搅拌速度对钴剩余率的影响,结果见图4。由图4可以发现,在3个体系中,随着搅拌速度的增加钴剩余率逐渐降低,大于200r/min时,钴剩余率显著降低。产生这一结果的原因可能是:搅拌速度的增加使得钴氨络合反应、碳酸锰沉淀反应和锰酸钴沉淀反应速率同时增加,而其中对锰酸钴沉淀反应影响最大,钴氨络合还未稳定,而生成的MnCO3沉淀与溶液接触更充分,MnCO3与Co2+反应生成锰酸钴沉淀更快,从而导致了钴剩余率的下降。由于反应体系中固液比较大、搅拌速度为100r/min时,烧杯底部会有部分固体沉积,无法搅拌完全,搅拌速度为200r/min时钴剩余率与100r/min相差不多,因此,为了保证反应体系反应均匀,最佳搅拌速度为200r/min。
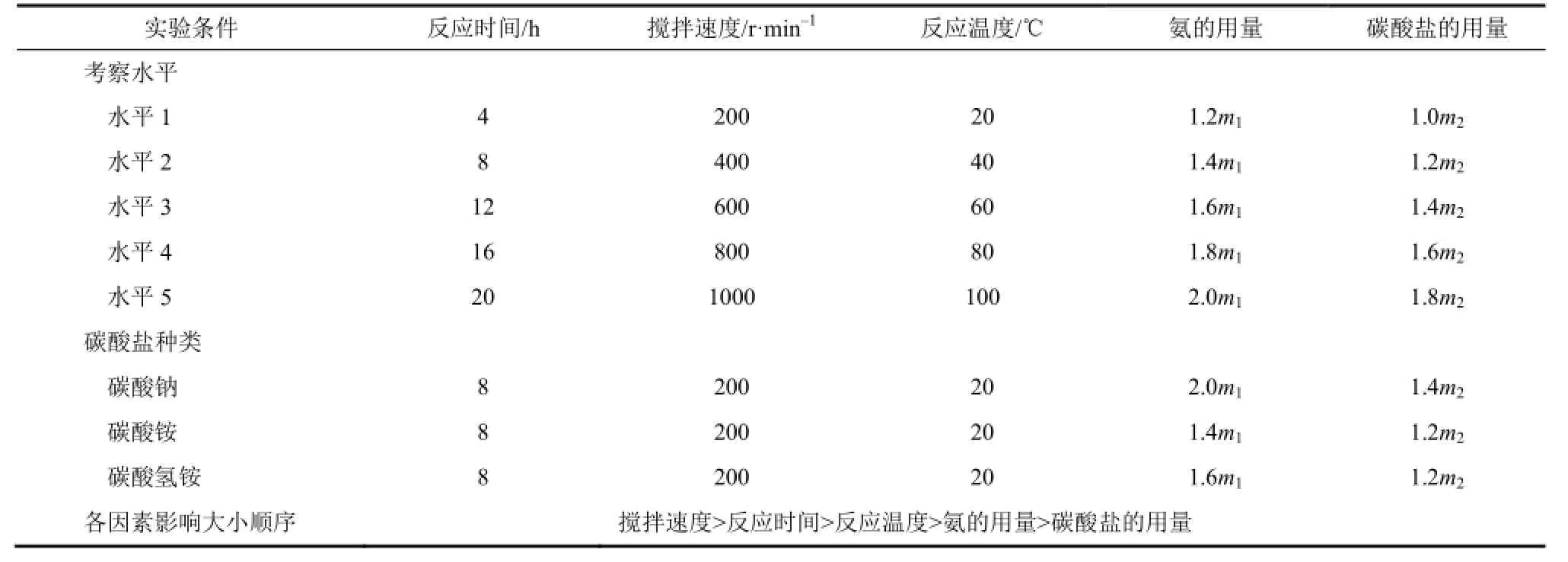
表1 正交实验各因素考察水平及最优条件
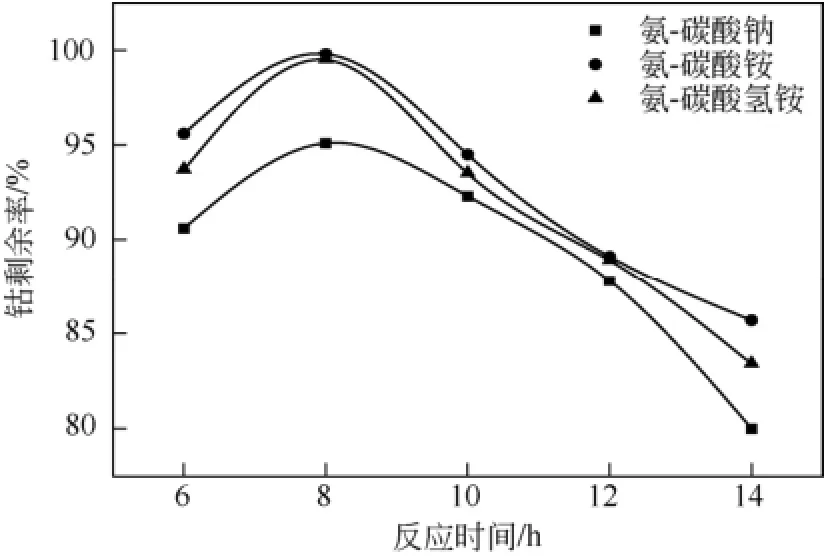
图1 反应时间对钴剩余率的影响
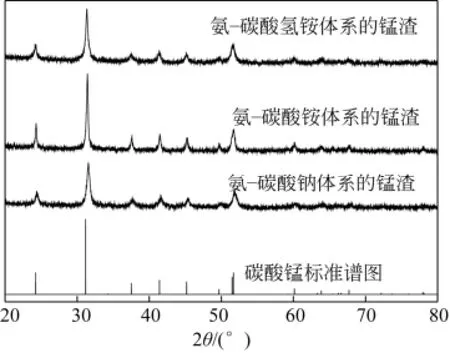
图2 反应8h锰渣的XRD谱图
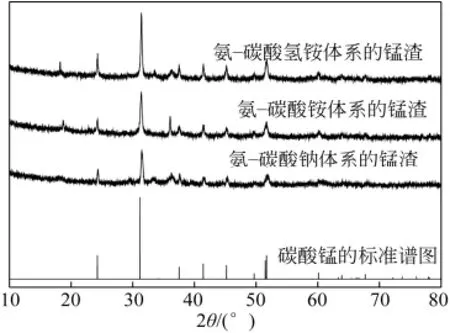
图3 反应12h锰渣的XRD谱图
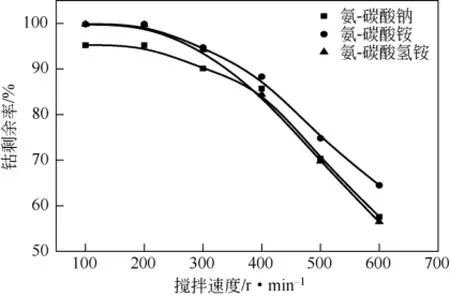
图4 搅拌速度对钴剩余率的影响
2.3反应温度对钴剩余率的影响
钴氨络合反应以生成三价六氨合钴为主,其化学反应方程式如式(1)所示。
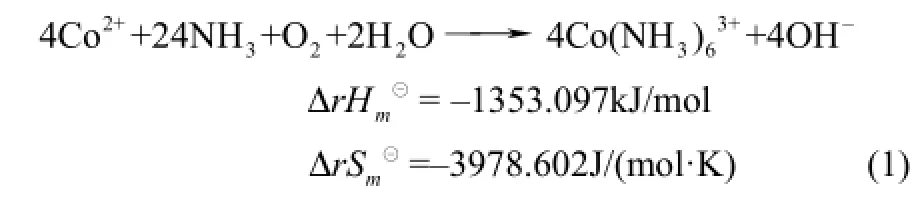
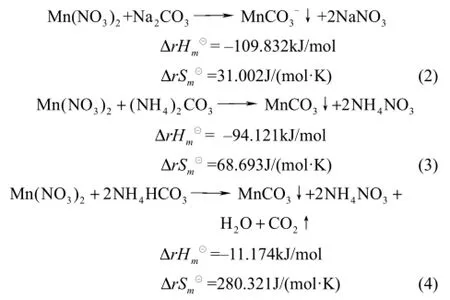
碳酸盐与锰反应的化学反应方程式如式(2)~式(4)所示。
根据上式计算反应的理论反应温度。对反应式(1)有
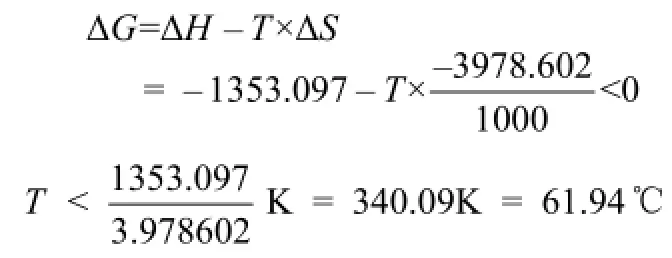
所以,反应温度应低于 61.94℃。对反应式(2)~式(4),由于T恒大于0,因此,ΔG恒小于0。反应式(2)~式(4)在任何温度下均可以自发进行。由于反应式(1)和反应式(2)~式(4)在同一体系中同时进行。因此,反应温度低于61.94℃就可以将钴、锰进行分离。
保持搅拌速度200r/min,氨的用量为理论用量的2.0倍,反应时间8h,碳酸盐用量为理论用量的1.4倍,在10~60℃范围内考察反应温度的变化对钴剩余率的影响,结果见图5。由图5可见,在3个体系中,钴剩余率均随着温度的降低而升高,这与理论分析相符;在3个体系中,温度分别为10℃与20℃时,钴剩余率几乎保持一致,没有明显差异;在30℃时,氨-碳酸钠体系中钴剩余率明显降低,而氨-碳酸氢铵及氨-碳酸铵体系仍与20℃时的回收率保持一致,超过30℃后明显开始降低;在同一反应温度不同反应体系中,钴剩余率大小顺序为:氨-碳酸氢铵≥氨-碳酸铵>氨-碳酸钠,这是因为在氨-碳酸氢铵及氨-碳酸铵体系中存在 NH3-NH4+的缓冲平衡体系,反应方程式如式(5)。
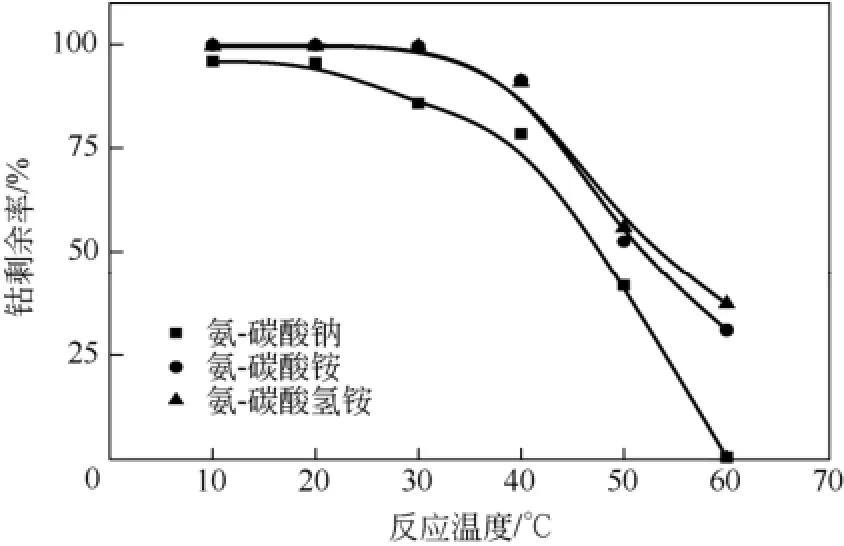
图5 温度对钴剩余率的影响
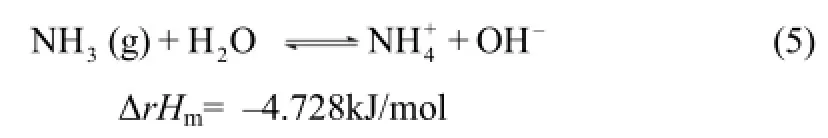
在反应的过程中,NH3不断消耗,[NH3]降低,平衡向负反应方向进行,则ΔrHm=4.728kJ/mol,为吸热反应,使得体系中的温度降低,从而促进钴氨络合反应正向进行。
由于降低温度需要增加额外成本用于制冷,而且在氨-碳酸铵和氨-碳酸氢铵体系中,温度为20℃时,钴剩余率已经接近 100%。因此,综合考虑回收率和成本因素,最佳反应温度选择20℃。
2.4氨的用量对钴剩余率的影响
氨易挥发,一定过量的氨才可以保证钴的完全络合。保持反应温度20℃,搅拌速度200r/min,反应时间8h,碳酸盐用量为理论用量的1.4倍,在理论用量的1.0~2.0倍范围内考察氨的用量对钴剩余率的影响,结果见图6。
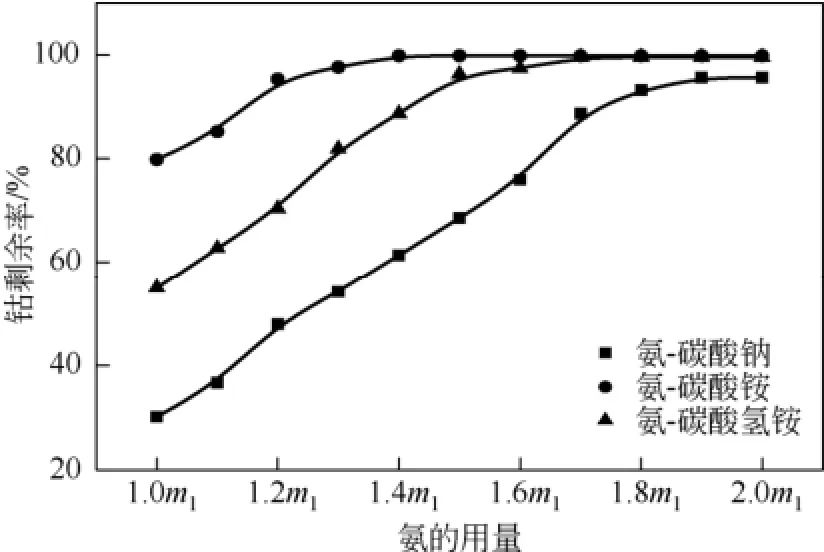
图6 氨的用量对钴剩余率的影响

2.5碳酸盐的用量对钴、锰分离效果的影响
钴和锰的分离原理为钴形成钴氨络合液,而锰形成碳酸锰沉淀,若要使钴、锰分离完全,则不仅要有高的钴剩余率,还需要保证高的锰沉淀率,而碳酸盐的用量对锰的沉淀起到至关重要的作用,同时也会影响钴的回收情况。保持反应温度20℃,搅拌速度200r/min,反应时间8h,氨的用量为理论用量的1.9倍,碳酸钠、碳酸铵及碳酸氢铵作为沉淀剂研究其对钴、锰分离效果的影响如图7所示。
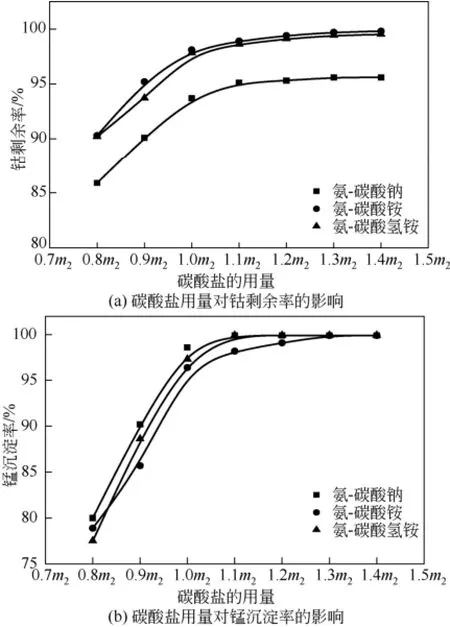
图7 碳酸盐用量对钴、锰分离效果
由图 7(a)可见,随着碳酸盐用量的增加,钴剩余率逐渐增加并且达到最大值后没有随着碳酸盐用量的增加而降低。可能的原因是,当碳酸盐的用量少于与锰反应的用量时,部分锰未完全沉淀,在碱性条件下与钴生成了锰酸钴沉淀,随着碳酸盐用量的逐渐增加,碳酸锰达到最大沉淀量,而钴由于与氨形成了稳定的钴氨络合物,不再与CO32-反应,钴剩余率达到最大值。其中,在3个体系中,相同的碳酸盐用量的条件下,钴剩余率大小顺序为:氨-碳酸氢铵>氨-碳酸铵>氨-碳酸钠。
综合图7(a)和(b)可见,在氨-碳酸氢铵体系中,当碳酸氢铵用量大于锰的物质的量的1.1倍时,锰的沉淀率几乎为100%;大于1.3倍时,钴剩余率大于99%。在氨-碳酸铵体系中,碳酸铵用量大于1.1倍时,锰的沉淀率几乎为100%;大于1.4倍时,钴剩余率大于99%。在氨-碳酸钠体系中,碳酸钠用量大于1.1倍时,锰的沉淀率几乎为100%;大于1.1倍时,钴剩余率趋于95%,并不随着碳酸钠用量的增加而提高。因此,在氨-碳酸氢铵体系中,不仅可以达到很好的钴、锰的分离效果,而且碳酸盐用量最少。
3 结 论
(1)对于锰钴比大于 2∶1的浸出液,用氨-碳酸盐法可以得到很好的钴、锰分离效果,研究结果表明:碳酸盐的种类、搅拌速度、反应时间、反应温度、氨的用量和碳酸盐的用量是影响分离效果的主要因素。
(2)3种碳酸盐溶液中各因素的影响机理及规律基本一致,其中氨-碳酸铵体系更好,具体反应条件为:搅拌速度为200r/min,反应时间为8h,反应温度为20℃,氨的用量为理论化学反应计量的1.4倍,碳酸盐的用量为理论化学反应计量的1.3倍,钴剩余率可以达到 99.8%,锰回收率可以到达100%。
[1]李长峰,常志鹏. PTA生产现状及技术分析[J]. 河南化工,2010,27(6):25-28.
[2]王海滨. 国内对苯二甲酸(PTA)产业发展方向研究[J]. 合成纤维,2010(3):1-4.
[3]赵标,万辉,管国锋. PTA生产最新进展[J]. 聚酯工业,2008,21 (4):1-5.
[4]CHAUHAN G,PANT K K,NIGAM K D,et al. Chelation technology:a promising green approach for resource management and waste minimization[J]. Environ. Processes Impact,2014,17(1):12-40.
[5]仁明,邵晓周,沈东升,等. PTA废渣的回收和利用[J]. 科技通报,2008,24(1):143-148.
[6]潘凡峰,金永功,汪雍. 一种对苯二甲酸废固母液中钴锰催化剂的回收方法:104743615A[P]. 2015-07-01.
[7]于文敦,刘晓东,孙秀云,等. PTA废液回收利用技术[J]. 化工环保,2001,21(5):290-293.
[8]王昶,綦晓倩,曾明,等. 苯甲酸生产残液中锰、钴和镍的提取及分离[J]. 化工环保,2015,35(1):59-63.
[9]黄又明. 钴锰催化剂混合料的回收及系列产品开发[J]. 精细与专用化学品,2000(12):10-12.
[10]刘昭林,郭鹤桐,童育林. 从废钴锰催化剂中电解回收金属钴[J].有色金属(冶炼部分),1994(4):38-40.
[11]梁勇. 钴基废合金中钴的回收工艺研究进展[J]. 稀有金属与硬质合金,2009,37(4):58-60.
[12]徐艳娥,谢克强,邢鹏. 湿法冶金中钴锰分离方法综评[J]. 矿冶,2014,23(1):55-60.
[13]甘昌远,罗昌璃,龙海平. 锰盐生产中钴镍回收试验探索[J]. 中国锰业,2013,31(1):35-37.
[14]XIE Y,XU Y,YAN L,et al. Recovery of nickel, cooper and cobalt from low-grade Ni-Cu sulfide tailings[J]. Hydrometallurgy,2005,80 (s1/s2):54-58.
[15]LI Ping,HUANG Binglin,YAO Dan,et al. Complete cobalt recovery from lithium cobalt oxide in self-driven microbial fuel cell-Microbial electrolysis cell systems[J]. Journal of Power Sources,2014,259(7):54-64.
[16]何显达. 人造金刚石酸洗触媒废液中镍、钴、锰回收研究[D]. 长沙:中南大学,2005.
[17]HARPER Jon J,PIETSCH Stephen J. Membrane separation of catalyst metals from trimellitic acid production and separation of cobalt from manganese:US4311521[P]. 1982-02-19.
[18]王成彦,王含渊,江培海,等. P204萃取分离钴锰铁试验研究[J]. 有色金属(冶炼部分),2006(5):2-5.
[19]PIROM T,WONGKAEW K,WANNACHOD T,et al. Separation of Co(Ⅱ) and Mn(Ⅱ) from sulphate media via a HFSLM:reaction flux model and experimental verification[J]. Journal of Industrial & Engineering Chemistry,2014,20(4):1532-1541.
[20]LI J,LI X,HU Q,et al. Study of extraction and purification of Ni, Co and Mn from spent battery material[J]. Hydrometallurgy,2009,99:7-12.
[21]何家成. 氨法回收人造金刚石酸洗废液中的镍、钴、锰[J]. 中国物质再生,1997(6):10-11.
[22]SHEN Yongfeng,XUE Wenying,LI Wei,et al. Recovery of Mn2+,Co2+and Ni2+from manganese nodules by redox leaching and solvent extraction[J]. Trans. Nonferrous Met. Soc. China,2007,17:1105-1111.
[23]YANG Shenghai, TANG Motang. Thermodynamics of Zn-NH3-NH4Cl-H2O system[J]. Trans. Nonferrous Met. Soc. China,2000,10(6):830-833.
[24]TAN W X,HASNAT M A,HANIS N,et al. Influence of flow rates on the electrogenerative Co2+recovery at a reticulated vitreous carbon cathode[J]. Chemical Engineering Journal,2012,s189/190:182-187.
[25]KATSIAPI A,TSAKIRIDIS P E,OUSTADAKIS P,et al. Cobalt recovery from mixed Co-Mn hydroxide precipitates by ammonia-ammonium carbonate leaching[J]. Minerals Engineering,2010,23:643-651.
Study on separation of cobalt and manganese from waste residue of PTA by ammonia-carbonate leaching
HE Qinhua1,LIU Weiqiao1,ZOU Chao1,WEI Chengwen1,SHANG Tongming1,ZHOU Quanfa1,
GAO Feng2
(1Jiangsu University of Technology,Changzhou 213000,Jiangsu,China;2Wuxi Zhongjing(Metal)Powder Co.,Ltd.,Wuxi 214000,Jiangsu,China)
The content of cobalt in the waste cobalt and manganese catalyst in the production of PTA was low and the content of manganese was high. The common cobalt and manganese separation methods generally were not suitable for this material and would make cobalt and manganese mixed with each other,leading to incomplete separation. Ammonia - carbonate method was used in the separation of the cobalt and manganese from lixivium of the waste residue of PTA in this paper. As the surplus rate of cobalt and the precipitation rate of manganese were used as assessment indicators,the effects of the carbonates' types,reaction time,temperature,stirring speed,the amount of ammonia and the amount of carbonate on the separation effect of cobalt and manganese were studied on the basis of orthogonal experiments. Experimental results show that,in the solutions of ammonia-sodium carbonate,ammonium carbonate and ammonium bicarbonate,the best reaction condition is: stirring rate 200r/min,reaction time 8 hours and temperature 20℃. The amount of ammonia is 1.9,1.4 and 1.7 times of chemical stoichiometric coefficient, respectively, and the amount of carbonate is 1.0,1.3 and 1.3 times. The surplus rate of cobalt in these three solutions can reach to 96.0%,99.8% and 99.5%,respectively,and the precipitation rate of manganese can all reach 100%.
waste treatment;recovery;complexes;separation
X 789;TQ 09
A
1000-6613(2016)08-2580-06
10.16085/j.issn.1000-6613.2016.08.44
2016-01-07;修改稿日期:2016-03-09。
何沁华(1991—),女,硕士研究生,研究方向为有色金属
资源再生利用。联系人:刘维桥,博士,教授,研究方向为有色金属资源再生利用。E-mail lwq@jsut.edu.cn。
