免疫比浊法检测血清游离轻链的方法学评价*
2016-08-18陈建平杨曙梅王惠民鞠少卿
陈建平,杨曙梅,丁 烨,王惠民,鞠少卿,丛 辉△
(1.南通大学附属医院检验科,江苏南通 226001;2.南通大学公共卫生学院医学检验系,江苏南通 226019)
·论著·
免疫比浊法检测血清游离轻链的方法学评价*
陈建平1,杨曙梅1,丁烨2,王惠民1,鞠少卿1,丛辉1△
(1.南通大学附属医院检验科,江苏南通 226001;2.南通大学公共卫生学院医学检验系,江苏南通 226019)
目的对Beckman Immage 800全自动特种蛋白分析仪检测血清游离κ、λ轻链(sFLC)进行方法学评价。方法通过Beckman Immage 800定量测定sFLC,探讨其精密度、正确度、分析测量范围、干扰和携带污染率,同时对其参考区间进行验证。结果κFLC低、高值批内精密度的变异系数(CV)分别为7.84%、2.95%,批间精密度的CV分别为7.38%、5.57%;λFLC低、高值批内精密度(CV)分别为4.59%、3.94%,批间精密度CV分别为3.97%、2.01%;测定κFLC、λFLC定值质控血清与靶值的偏倚小于5%;κFLC、λFLC分析测量范围分别为10.8~128.0 mg/L、10.1~121.0 mg/L时,a值在0.95~1.05,r2≥0.98;κFLC、λFLC携带污染率分别为0.411%、0.216%;干扰试验结果显示游离胆红素≤342.0 μmol/L、结合胆红素≤342.0 μmol/L、血红蛋白≤5 g/L和乳糜≤2 400浊度时,对sFLC结果无明显影响;40例健康体检者中有1例κFLC测定结果超出厂家推荐的参考区间,40例λFLC检测值均在厂家推荐的参考区间内。结论Beckman Immage 800全自动特种蛋白分析仪检测sFLC的主要分析性能符合质量目标的要求,能够为临床提供科学、准确的诊疗依据。
全自动特种蛋白分析仪;方法学评价;血清游离轻链
血清游离轻链(sFLC)包含游离κ、λ轻链,是判断患者体内是否存在克隆性浆细胞的高度敏感指标。定量检测sFLC以及计算游离κ/λ的比值有助于多发性骨髓瘤(MM)、原发性淀粉样变(AL)、未定性单克隆丙种球蛋白病(MGUS)等疾病的诊断、疗效判断及预后评估[1]。血清κ、λ轻链和免疫固定电泳在一定程度上有助于MM的诊断,但均有一定的方法学局限性,如血清轻链测定的是血清中总轻链量,敏感性差;免疫固定电泳的敏感度也仅有150~500 mg/L,从而易致患者的漏诊。2006年,国际骨髓瘤协作组(IMWG)将患者sFLC水平引入MM的评定标准中,作为完全缓解(sCR)的疗效分类标准,确立了sFLC定量检测在临床应用中的地位和价值[2]。近年来,sFLC的检测得到了国内越来越多临床医生的重视和患者的高度关注[3]。目前,我国临床实验室测定sFLC主要采用免疫比浊法,关于Beckman Immage 800全自动特种蛋白仪测定sFLC方法学评价的文献较少见。本次试验参考美国临床实验室标准化委员会(NCCLS)的相关文件及文献,探讨了Beckman Immage 800散射比浊法检测sFLC的方法学评价。
1 材料与方法
1.1一般资料选取2015年1~10月南通大学附属医院门诊和病房多发性骨髓瘤确诊患者40例及体检中心健康体检者血清40例。静脉抽血5 mL,4 000 r/min离心10 min,分离血清备用。
1.2仪器与试剂美国Beckman Coulter Immage 800全自动特种蛋白分析仪;英国Binding Site公司FreeliteTM血清游离轻链检测试剂盒(κFLC批号344785G,λFLC批号349269A);FreeliteTMsFLC配套校准品(κFLC批号344965,λFLC批号347207);FreeliteTMsFLC配套质控品(κFLC批号351843,λFLC批号347208);日本Sysmex A-Plus干扰试剂盒(批号ZS1001)。
1.3方法
1.3.1建立sFLC比浊法测定法根据FreeliteTMsFLC说明书设置仪器参数:标本量5 μL,Buffer 195 μL,稀释倍数1∶10。6点校准,每个浓度校准品重复测定两次。
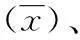
1.3.3正确度评价参照NCCLS EP15-A[5],按照检测定值的参考物质计算偏差进行验证:测定高、低两个水平质控品,每天测定2次,连续测定5 d,计算10次检测结果均值,将各自检测结果与靶值进行对比,计算检测值与靶值的相对偏倚(%),计算公式:偏倚=(测定值-靶值)/靶值×100%。
1.3.4分析测量范围评价参照NCCLS EP6-A[6]文件,分别选择sFLC含量接近厂家线性范围上限的新鲜血清标本1份作为高值浓度水平(H:κFLC 128.0 mg/L,λFLC 121.0 mg/L),sFLC含量低的健康体检者血清作为低值浓度水平(L:κFLC 10.8 mg/L,λFLC 10.1 mg/L)1份,按照5H、4H+L、3H+2L、2H+3L、H+4L、5L的关系分别配制6个浓度梯度,对各浓度水平进行sFLC测定,各浓度重复测定4次,对测定结果的均值和理论值进行线性回归统计,计算回归方程:Y=aX+b,进行分析测量范围评价。a值应在1±0.05范围内,相关系数(r2)≥0.950。
1.3.5携带污染率评价参考文献[7],分别选取高水平FLCs新鲜血清标本连续测定3次,测定值分别为H1、H2、H3;再分别选取低水平sFLC新鲜血清标本连续测定3次,测定值分别为L1、L2、L3,计算携带污染率。携带污染率=(L1-L3)/(H3-L3)×100%。携带污染率应≤2.0%。

1.3.7参考区间验证参照NCCLS C28-A2[9]文件选取2015年8月南通大学附属医院体检中心健康体检者40例。健康参考个体选择标准:(1)男、女各20例,年龄20~60岁,无吸烟、饮酒,自觉健康者;(2)无急慢性感染、呼吸系统疾病、过敏性疾病、肝胆管疾病、血液性疾病、肾脏疾病、风湿性疾病、血管病和高血压;(3)近期未手术、输血、大量失血和服用药物;(4)无慢性理化损伤或接触化学损伤。测定sFLC,将检测结果与参考区间比较(厂家参考区间:κFLC 3.30~19.40 mg/L;λFLC 5.71~26.30 mg/L)。检测结果若超出参考区间的数据不超过10%,则通过验证,以判定厂家提供的生物参考区间有效。

表1 4种干扰物各管浓度表
1.4统计学处理采用Microsoft Excel 2003软件对精密度试验、特异性试验数据进行统计及Origin75统计软件对分析测量范围数据进行回归分析。
2 结 果
2.1sFLC精密度评价结果分别用低、高两个浓度血清做批内和批间精密度评价,κFLC低、高浓度血清批内CV分别为7.84%、2.95%,批间CV分别为7.38%、5.58%;λFLC低、高浓度血清批内CV分别为4.59%、3.94%,批间CV分别为4.00%、2.01%,见表2。

表2 sFLC批内精密度
2.2sFLC正确度评价结果κ、λFLC正确度验证结果见表3,κFLC相对偏倚分别为3.01%、-3.81%,λFLC相对偏倚分别为2.28%、-4.58%,结果均低于厂家说明书的偏倚值,正确度满足要求。见表3。

表3 sFLC准确度评价试验
2.3sFLC分析测量范围评价结果分别测量sFLC 6个浓度混合血清,计算均值,将测定均值与理论预期值比较,偏倚均小于10%;同时将测定均值与理论值进行线性回归分析,本系统κFLC测定范围在10.8~128.0 mg/L,λFLC测定在10.1~121.0 mg/L呈线性。κFLC回归方程及相关系数的平方为:Y=1.0441X-4.0789,r2=0.986;λFLC回归方程及相关系数的平方为:Y=0.9887X+1.2471,r2=0.999,满足判断要求,散点图见图1、2。
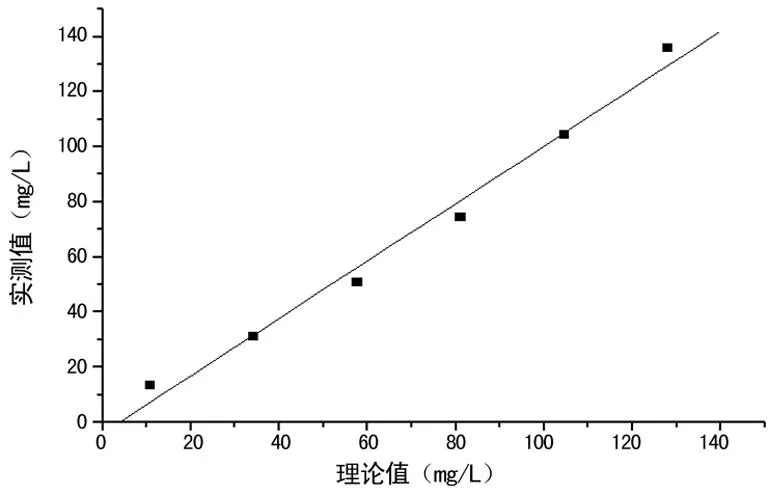
图1 κFLC线性回归分析
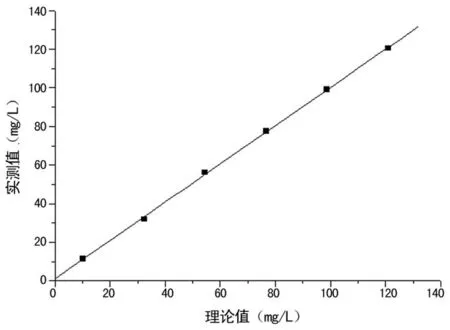
图2 λFLC线性回归分析
2.4sFLC携带污染率评价κFLC的H1、H2、H3分别为117.0、118.0、119.0 mg/L;L1、L2、L3分别为9.52、8.76、9.07 mg/L,计算携带污染率为0.411%。λFLC的H1、H2、H3分别为119.0、118.0、114.0 mg/L;L1、L2、L3分别为21.9、22.6、21.7 mg/L,计算携带污染率为0.216%。FLCs携带污染率均小于2%。
2.5sFLC特异性评价BU≤342.0 μmol/L、BC≤342.0 μmol/L、Hb≤5 g/L、乳糜物≤2 400浊度时,对κ和λFLC的测定基本无影响,干扰值均在空白组1.96s范围内。
2.6sFLC参考区间验证40例健康体检者κFLC测定结果有1例观察值为3.18 mg/L,在厂商提供的参考区间3.30~19.40 mg/L外;λFLC测定结果介于5.71~26.30 mg/L。在参考区间外的数据未超过10%,表明厂家提供的95%参考区间可以接受。
3 讨 论
Immage 800全自动特种蛋白分析仪方法学原理为免疫比浊法,有着较高的灵敏度和特异性。为了保证临床实验室检验质量,根据国家医学实验室认可(ISO15189)和美国病理学家协会(CAP)对临床实验室质量管理的要求[10]和临床实验室认可的要求[11],临床实验室在新的检验方法用于检测常规患者标本、仪器重要维修或试剂更换生产厂家前必须对检测系统的分析性能进行评价,确认检测系统的分析性能符合临床要求方可使用[12]。为了证实Immage 800全自动特种蛋白分析仪检测sFLC分析性能的可靠性,本次试验参考CLSI EP文件资料对Immage 800检测sFLC进行初步的分析性能评价,评价了本法的精密度、分析测量范围、携带污染率、特异性,同时还对sFLC参考区间进行了验证。
临床标本结果与真值间的偏离主要有不精密度、正确度、干扰。精密度是多次重复测量同一量时各测量值之间彼此符合的程度,表示测量过程中随机误差的大小。其是检测系统主要的分析性能之一,是进行其他性能评价的基础[13]。临床检测系统精密度的评价通常参考NCCLS EP5-A2文件评价方案,该方案是目前最具有统计效能的一种精密度评价方法。本次试验结果显示,κFLC低、高两个水平批内不精密度分别是7.84%和2.95%;批间不精密度分别是7.38%和5.58%。λFLC低、高两个水平批内不精密度分别是4.59%和3.94%;批间不精密度分别是4.00%和2.01%。结果表明本法检测sFLC精密度性能高,达到CLIA′88允许误差的1/3水平(允许不精密度<8.33%)。
在NCCLS EP9-A文件中,正确度验证方法是使用临床患者标本进行方法学比较和偏倚估计,这种方法需要对照,对于实验室新开展的检测项目来说存在一定的困难。因此,本次试验在进行sFLC正确度评价时,参照了NCCLS EP15-A文件的评价方案,采取使用有定值的参考物质来计算偏倚的方法来进行检测系统的正确度评价。试验结果分析发现κ、λFLC检测均值与质控的相对偏倚均小于5.0%,偏倚水平低于厂家说明书的偏倚允许范围,符合要求,说明本检测系统对sFLC浓度检测的正确度高。
分析测量范围即定量检测项目的线性范围,是分析方法的一个重要技术指标,是判断检测系统测得的浓度与实际浓度是否呈线性的性能。分析测量范围评价反映了整个检测系统的输出特性,有助于了解检测结果的准确性和可靠性。NCCLS EP6-A文件要求对分析测量范围评价时需要5~7个浓度,每个浓度至少测定2次。在本次试验中选择了6个浓度标本,每个标本检测4次,对检测系统进行分析测量范围验证。结果表明κFLC和λFLC均表现出较好的线性,a值和r2均满足要求,符合临床检验的要求。厂家说明书给予的κFLC线性范围是6.0~180.0 mg/L、λFLC线性范围是4.8~162.0 mg/L,本次试验中由于κFLC和λFLC的高值标本一时无法获得,因此κFLC和λFLC高值标本稍低于最高检测值,还需要后期补充验证。
携带污染是连续测量不同浓度标本间的相互影响,主要是高浓度标本对后续检测标本的影响。影响标本携带污染率的因素主要是清洗剂的清洗能力、清洗剂用量、清洗次数、清洗温度等。携带污染率是检测结果准确的必要条件,是评价检测系统的关键指标,携带污染率越低表明检测结果越准确。试验结果显示κFLC、λFLC携带污染率分别是0.411%、0.216%,均小于判断要求,表明检测系统携带污染率低,能够适应实验室常规临床标本的检测要求。
在EP7-A2文件中提供了两种实验方案进行干扰试验评价:(1)干扰筛选;(2)利用患者标本作偏倚分析。由于第2种评价方法需要高特异性的比较方法,本实验室难以满足其要求。因此,本次试验采用第1种方案,即将潜在干扰物添加到标本中来评价干扰性。将血红蛋白、三酰甘油、胆红素3种常见的物质作为干扰源对sFLC检测结果进行特异性分析。试验结果表明胆红素、血红蛋白、三酰甘油对κFLC及λFLC的测定影响较小,表明该检测系统检测sFLC的抗黄疸、溶血、脂血的能力较强。临床标本的质量对免疫比浊法检验的干扰需要临床检验者的重视,因此在临床标本sFLC检测结果报告时最好将反映溶血、脂血及黄疸程度的指数一并报告临床医生,使检验结果更严谨、可靠。
参考区间是临床判断健康与否的尺标,
合适的参考区间对疾病的预防、诊断、疗效评价及预后有着重要的意义[14]。本次试验中对厂家提供的sFLC参考区间进行了验证。厂家提供的κFLC参考范围是3.30~19.40 mg/L、λFLC参考范围是5.71~26.30 mg/L。通过对40例健康体检者进行sFLC检测分析,结果表明厂商提供的sFLC参考区间适用于本地区、本实验室使用。
本次研究结果表明,在Immage 800全自动特种蛋白分析仪上测定sFLC的方法精密度高,正确度高,线性良好,携带污染率低,抗干扰能力强。
综上所述,Immage 800检测sFLC的主要分析性能符合临床质量管理目标的要求,是一种简便、快捷、准确、可靠的临床检测方法,能够为临床医生在疾病的诊疗过程中提供可信的实验室依据。
[1]Katzmann JA,Willrich MA,Kohlhagen MC,et al.Monitoring IgA multiple myeloma:immunoglobulin heavy/light chain assays[J].Clin Chem,2015,61(2):360-367.
[2]Duri E,Harousseau JL,Miguel JS,et al.International uniform response criteria for multiple myeloma[J].Leukemia,2006,20:2220-2226.
[3]陈耐飞,崔久嵬,姚迪,等.血清游离轻链检测在多发性骨髓瘤诊治中作用的临床评价[J].临床血液学杂志,2012,25(6):703-705.
[4]NCCLS.Evaluation of precision performance of quantitative measurement methods.Approved gudelinesecond edition:EP5-A2[S].Wayne,PA,USA:NCCLS,2004.
[5]NCCLS.User demonstration of performance for precision and accuracy.Approved guideline:EP15-A[S].Wayne,PA,USA:NCCLS,2001.
[6]NCCLS.Evaluation of the linearity of quantitative measurement procedures.Statistical approved guideline:EP6-A[S].Wayne,PA,USA:NCCLS,2003.
[7]普程伟,尚柯,王建中,等.UniCel DxH 800血细胞分析仪临床应用评价[J].中华检验医学杂志,2012,35(7):643-646.
[8]CLSI.Interference testing in clinical chemistry:EP7-A2[S].Wayne,PA,USA:CLSI,2005.
[9]NCCLS.How to define and determine reference intervals in the clinical laboratory;approved guideline-second edition:C28-A2 [S].Wayne,PA,USA:NCCLS,2000.
[10]College of American Pathologists.Clinical Immunology Checklist [R].Northfield:CAP,2006:1-21.
[11]丛玉隆,冯仁丰,陈晓东.临床实验室管理[M].北京:中国医药科技出版社,2004:72-73.
[12]赵建忠.生化分析仪精密度、准确性以及线性范围性能验证[J].国际检验医学杂志,2011,32(10):1111-1112.
[13]蒋红君,蒋杰,王凡.全自动生化分析仪的检测精密度、正确度评价及参考区间的验证[J].国际检验医学杂志,2013,34(9):1147-1148.
[14]冯仁丰.临床检验质量管理技术基础[M].上海:上海科学技术文献出版社,2003:1-136.
Methodological evaluation on serum free light chains detected by immunoturbidimetry*
CHEN Jianping1,YANG Shumei1,DING Ye2,WANG Huimin1,JU Shaoqing1,CONG Hui1△
(1.DepartmentofClinicalLaboratory,AffiliatedHospitalofNantongUniversity,Nantong,Jiangsu226001,China;2.DepartmentofLaboratoryMedicine,SchoolofPublicHealth,NantongUniversity,Nantong,Jiangsu226019,China)
ObjectiveTo perform the methodological evaluation on Beckman Immage 800 automatic special protein analyzer for determining serum freeκ,λ light chains (sFLC).MethodsThe Beckman Immage800 automatic special protein analyzer was used to quantitatively detect sFLC values for investigating its precision and accuracy,analyzing its detecting range,interference and residual contamination rate,meanwhile verifying its reference intervals.ResultsThe low and high values of within-run precision coefficients of variation(CV) for κsFLC were 7.84% and 2.95% respectively;which of between-run precisionCVwere 7.38% and 5.57% respectively.The within-run precisionCVfor λFLC were 4.59% and 3.94% respectively,which of between-run precisionCVwere 3.97% and 2.01% respectively;bias for detecting the κFLC and λFLC fixed quality serum and the target values was less than 5%,when the analytical detection ranges of κFLC and λFLC were 10.8-128.0 mg/L and 10.1-121.0 mg/L,a value was 0.95-1.05,r2≥0.98;the carry-over rates of κFLC and λFLC were 0.411% and 0.216% respectively.The interference test results showed that when free hemoglobin≤342.0 μmol/L,conjugated bilirubin ≤342.0 μmol/L,hemoglobin≤5 g/L and chyle ≤2 400 turbidness,which had no influence on sFLC results;among 40 healthy subjects undergoing the physical examination,1 case of κFLC detection results exceeded the reference interval recommended by the manufacturer,while the λFLC detection values in these 40 cases were all within the reference interval recommended by the manufacturer.ConclusionThe main analytical performance of the Beckman Immage800 automatic special protein analyzer for detecting sFLC meets the requirements of quality objectives and can provides the scientific and precise evidence of diagnosis and treatment for clinic.
full automatic special protein analyzer;methodology evaluation;serum free light chains
2016-01-25修回日期:2016-05-04)
江苏省卫生厅项目(H201526);江苏省“六大人才高峰”基金项目(WS-066)。
陈建平,女,主管检验技师,从事临床免疫检验工作。△
,E-mail:huicjs@163.com。
10.3969/j.issn.1673-4130.2016.15.004
A
1673-4130(2016)15-2058-03
