3份典型菊属野生种耐盐性及其解剖结构比较1)
2016-08-17杨海燕孙明
杨海燕 孙明
(北京林业大学,北京,100083)
3份典型菊属野生种耐盐性及其解剖结构比较1)
杨海燕孙明
(北京林业大学,北京,100083)
以野菊、甘菊、菊花脑幼苗为试验材料,用含360 mmol·L-1NaCl溶液的Hoagland营养液进行胁迫处理,观察记录形态变化,分别于0(对照)、3、6、9 d取材测定相关生理指标,同时分别取0、6 d的叶片制作石蜡切片,观察并测量相关解剖结构特征。结果显示:3份材料在胁迫6 d时出现明显的表型差异,9 d时甘菊与菊花脑几全株死亡;叶片细胞质膜透性、脯氨酸质量分数及丙二醛质量摩尔浓度均随胁迫时间增加而增大,叶绿素质量分数则相反;叶片上下表皮厚度、栅栏组织厚度、海绵组织厚度、叶片厚度与中柱鞘直径均小于对照,仅野菊的栅栏组织厚度有所增加,且叶肉中央形成较大的通气组织,而甘菊与菊花脑在胁迫6 d时海绵组织结构模糊,叶肉细胞裂解严重,与表皮逐渐脱离。总之,3份菊属野生种材料均不宜在高浓度盐环境中生存,但野菊对盐环境有一定的适应能力;叶片质膜透性、光合指数与表皮细胞、叶肉细胞特征相关性较大。
菊属;野生种;耐盐性;解剖结构;生理特性
In order to reveal the relative of morphological, physiological and anatomical characteristics inChrysanthemumon salinity, we studied salt-tolerance and the anatomical features of its three typical species.C.indicum,C.lavandulifoliumandC.nankingensewere exposed to 360 mmol·L-1NaCl mixed with Hoagland for 9 days. Physiological parameters were determined at 0 (CK), 3, 6, 9 d, respectively. We measured anatomical variables of 0 and 6 d stressed plants. With the increasing of the stressed period, leaves membrane permeability, proline contents and MDA contents were increased, but the chlorophyll contents were the opposite. Compared to the control, thickness of epidermis, palisade mesophyll, spongy mesophyll and leaves as well as the diameter of mid-vein were mostly reduced in certain extent. However, there was a slightly increase of palisade mesophyll inC.indicumas well as development of aeration tissue. Besides,C.lavandulifoliumandC.nankingensewere collapsed in mesophyll cell and separated from epidermis under 6-day stress. Therefore, three species were not tolerant to high salinity,C.indicumshowed some adaptive ability to short-term stressed though, and the leaves membrane properties and photosynthesis characteristics were better related with features of the epidermis and mesophyll tissues.
根据中国土壤学会统计调查,中国已有包括碱土、滨海盐土、寒原盐土、漠境盐土以及酸性硫酸盐土在内的盐碱土约0.18亿hm2,占陆地国土面积1.92%[1],随着工业化的发展,土壤盐渍化越来越成为限制我国花卉作物生产及露地应用主要环境因子之一。地被菊是菊花“野化育种”的成果,是菊花(Chrysanthemum×morifolium)适于露地栽培的品种群之一,是由菊属内多个物种相互杂交,再经长期人工培育和选择而形成的[2]。野生种具有许多栽培菊花所缺乏的优良性状,如抗旱、抗病、抗虫、抗盐等,通过对其耐盐性的研究来筛选优异种质并进行品种改良是菊花抗性育种的一个重要方向。野菊(Chrysanthemumindicum)、甘菊(Chrysanthemumlavandulifolium)和菊花脑(Chrysanthemumnankingense)均是菊属中栽培菊花起源的重要种质资源[3-4],且倍性较低[5-7],是菊属中菊花耐盐性研究的优良模式植物资源。管志勇等[8]通过聚类分析认为以上3种菊属野生种均对盐胁迫敏感。而黄河[9]则认为甘菊为盐生植物,具有特殊的抗盐机制。镇兰萍等[10]利用光学显微镜探究了5种安徽野生菊属植物的叶下表面特征及其与植物分布、生态的相关性。但从形态上、生理特性上及解剖结构特征上综合比较分析菊属典型野生种(野菊、甘菊与菊花脑)在盐渍环境中的表现,还未见报道,这将有利于充分利用菊属野生种在耐盐性上的优良性状,为耐盐性菊花品种的培育奠定基础。
1 材料与方法
试验用的野菊、甘菊与菊花脑分别由本课题组从山东、北京、安徽采集,并栽培于北京林业大学菊花种质资源圃。分别采其脚芽扦插于V(珍珠岩)∶V(蛭石)=1∶1的穴盘中,待长至6片叶时,将根用去离子水洗净,转至含有石英砂(酸洗)的底部打孔的一次性塑料杯中,用Hoagland营养液进行培养,每3 d换1次,缓苗10 d后,用含NaCl溶液的Hoagland营养液进行处理,采用渐进胁迫的方式,第一天添加40 mmol·L-1NaCl溶液,以后每天增加浓度80 mmol·L-1,直至最终浓度为360 mmol·L-1。观察记录植株形态变化,每处理15株,3次重复。
叶片生理指标测定:分别于胁迫0(对照)、3、6、9 d时取植株4~8叶位叶片测定生理指标,细胞质膜透性的测定采用相对电导率的方法;叶绿素质量分数采用V(乙醇)∶V(丙酮)=1∶1法测定;脯氨酸质量分数采用磺基水杨酸法测定;丙二醛质量摩尔浓度采用10%三氯乙酸法测定。各指标测定均参照李合生等[11]的方法,具体参数略有改动。
叶片解剖结构观察:观察植株形态变化,于材料间开始具有明显差异的胁迫时间取第4叶位叶片(长1 cm,宽0.5 cm)固定于FAA固定液中至少24 h。文中根据尹冬梅[12]的方法摸索制片体系中的重要节点,即脱水30 min,透明20 min,番红染色4 h,固绿染色12 h。制片后用光学显微镜观察,用数码相机采集图像,并用图像分析软件测量相关数据,包括上表皮、下表皮、栅栏组织、海绵组织和叶片厚度以及中柱鞘直径,每处理取3张切片观察,每指标取5个视野测量。
数据处理:采用Excel与SPSS 20.0进行数据处理,采用单因素方差法(One-way ANOVA)进行数据分析(p<0.05),多重比较采用Duncan法,采用Dunnett T3法进行两两比较分析。
2 结果与分析
2.1植株形态变化
从图1可以看出,3份种质在360 mmol·L-1NaCl溶液胁迫过程中均没有生长量上的增长;胁迫3 d时,跟对照相比,形态上均没什么变化;胁迫6 d时,甘菊和菊花脑底部叶片均失绿、卷曲;到9 d时,均已全株受害,接近死亡。然而,野菊在胁迫9 d时,只有少数叶片表现出受害症状,但植株整体长势明显弱于较短时间胁迫的植株。
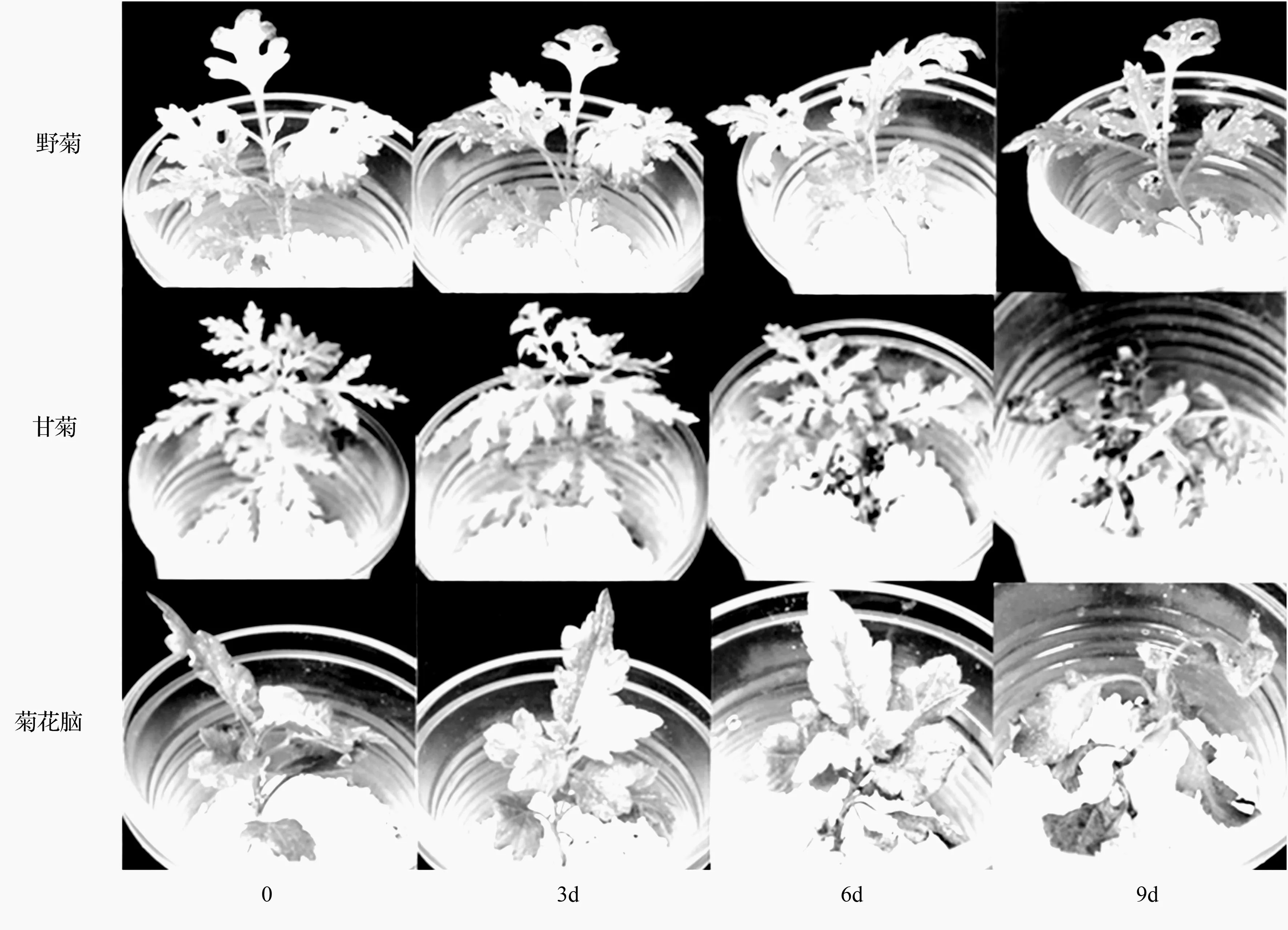
图1 360 mmol·L-1NaCl胁迫下3份菊属野生种幼苗的形态变化
2.2细胞质膜透性
根据单因素方差分析,显然,3份材料的叶片细胞质膜透性均随胁迫时间的增加而增大,且胁迫植株的质膜透性与对照植株差异显著(表1)。野菊与甘菊在胁迫3d时的质膜透性即大幅增加,分别增加了18.02%与35.84%,且后者增量将近两倍于前者,之后则较缓增加。而菊花脑在胁迫6 d时相对于3 d时增加了40.38%,到胁迫9d时相比对照增加了62.03%,野菊和甘菊分别比对照增加了44.13%和58.6%。
2.3叶绿素质量分数
由表1可知,3份材料的叶片叶绿素质量分数均随胁迫时间的增加而减少。其中,野菊表现为先大量减少再平稳减少,至胁迫9 d时与对照相比减少了0.35 mg·g-1;菊花脑和甘菊则分别减少了1.48、2.21 mg·g-1,且均在9 d时大幅减少,相对6 d时分别减了1.25、1.61 mg·g-1,与对照差异显著。从多重分析的结果看,与对照相比,野菊叶绿素质量分数在胁迫3~6 d时开始有显著变化;甘菊在胁迫6 d时有显著变化;而菊花脑在胁迫9 d时才有显著差异。
2.4叶片脯氨酸质量分数
单因素方差分析结果表明,3份材料的叶片脯氨酸质量分数均随胁迫时间增加而逐渐增加,且各处理植株均与对照表现为极显著差异(表1)。其中,野菊在胁迫3 d时即大量增加,之后增幅较小;菊花脑则表现为先平缓增加,到9 d时增幅最大(95.08 μg·g-1),接近于3 d和6 d时的两倍;甘菊在胁迫过程中脯氨酸质量分数的增幅先大后小再大幅增大,在9 d时比6 d时增加了74.77 μg·g-1,相比对照增加了170.17 μg·g-1,野菊和菊花脑相比对照分别增加了107.33、200.73 μg·g-1。
2.5叶片丙二醛质量摩尔浓度
3份材料的叶片丙二醛质量摩尔浓度均随胁迫时间的增加而增加(表1)。野菊在胁迫6 d时与对照有显著差异,到9 d时,差异极显著,增加了21.67 nmol·g-1;而甘菊和菊花脑均在3 d时即出现显著差异,6 d和9 d时与对照相比均表现为差异极显著,且在9 d时相比对照增幅均大于野菊,分别为39.18、42.77 nmol·g-1。野菊、甘菊和菊花脑的丙二醛质量摩尔浓度均在胁迫9 d时大幅增加,相比6 d时分别增加了9.64、21.67、24.30 nmol·g-1。

表1 360 mmol·L-1NaCl胁迫下3份菊属野生种幼苗相关生理指标的变化
注:表中数据为平均值±标准误;同列数字后不同小写字母表示差异显著(p<0.05)。
2.6叶片解剖结构
从图1可看出,3份材料均在胁迫6 d时开始表现出形态上的差异,取其叶片与对照叶片制作石蜡切片的结果如图2所示,从图2中可以看出,甘菊和菊花脑在胁迫6 d时即有大量细胞被破坏,尤其是海绵组织的细胞裂解最为严重,与表皮逐渐脱离;而野菊的大型薄壁细胞则裂解成较大的气腔,形成通气组织并保持海绵组织的完整性。此外,其叶片厚度也明显大于菊花脑和甘菊。具体数据与其他相关指标如表2所示。整体看,盐胁迫下3份材料的叶片结构特征数值均有所减小,除了野菊在栅栏组织上的增加。各指标在不同材料中差异显著,数值上基本表现为野菊较大,菊花脑次之,甘菊最小。在中柱鞘直径上则菊花脑(108.5 μm)明显小于野菊(199.3 μm)和甘菊(190.5 μm)的。与对照相比,各材料的中柱鞘直径、甘菊的上表皮厚度和叶片厚度表现出显著差异;野菊和甘菊的下表皮厚度、甘菊和菊花脑的海绵组织厚度以及野菊的叶片厚度与对照差异显著。
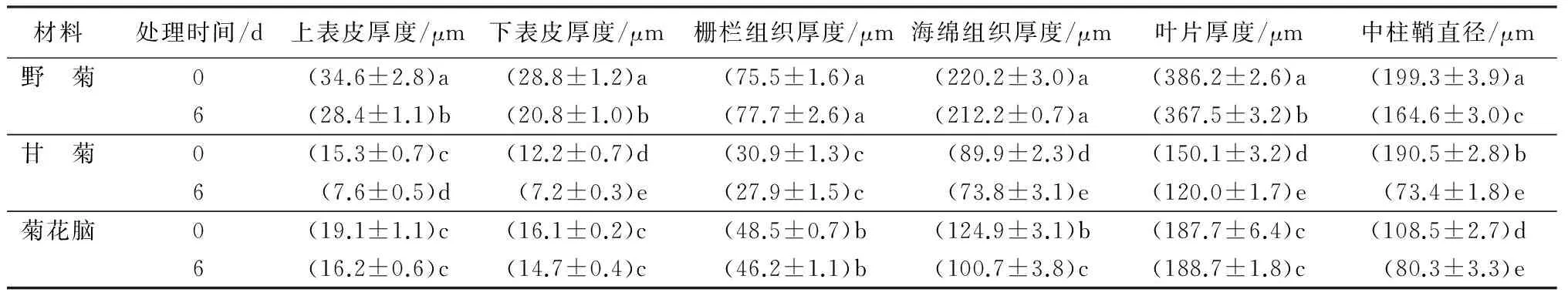
表2 360 mmol·L-1NaCl胁迫对3份菊属野生种叶片解剖结构的影响
注:表中数据为平均值±标准误;同列数字后不同小写字母表示差异显著(p<0.05)。
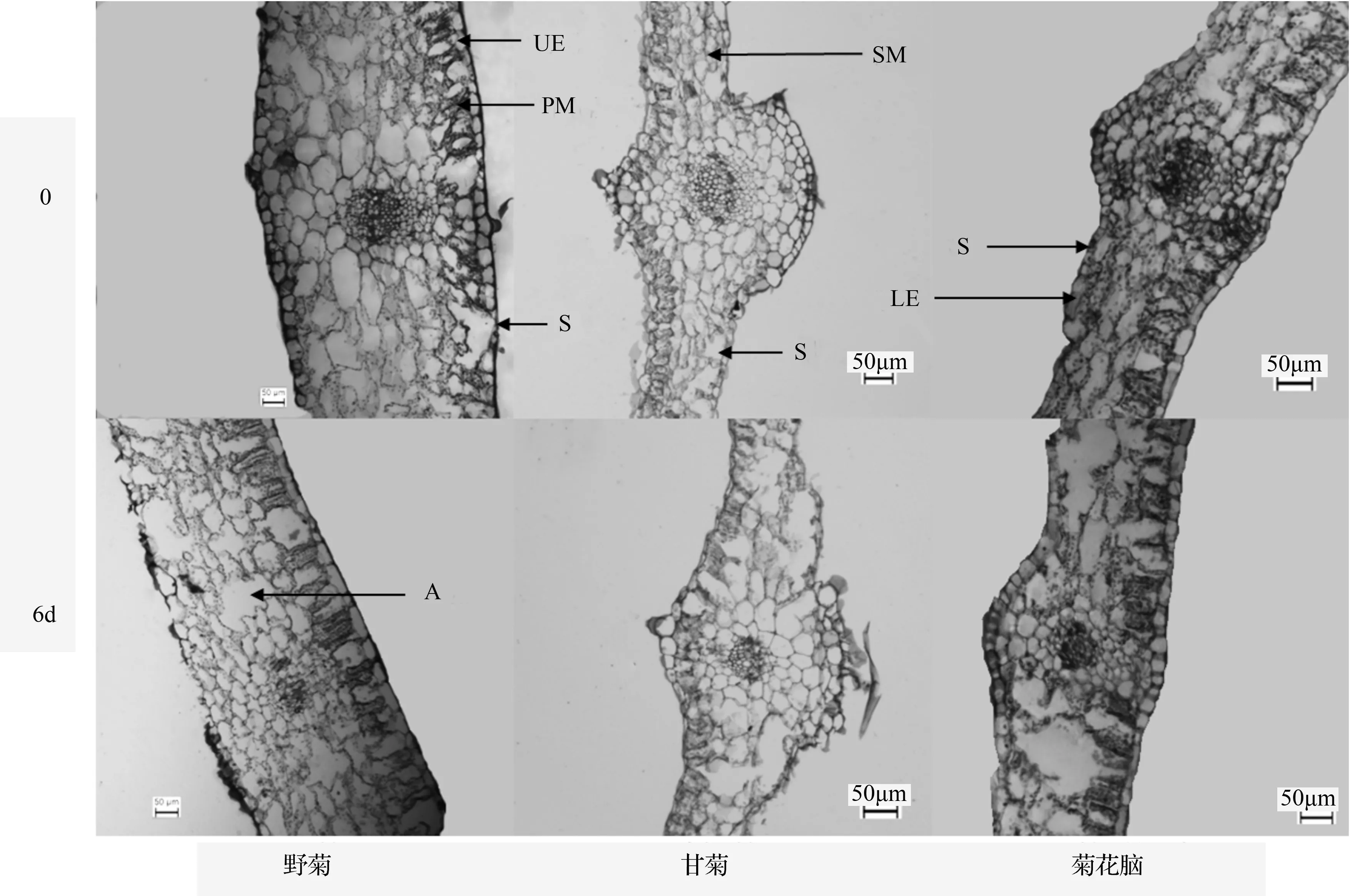
UE.上表皮;LE.下表皮;PM.栅栏组织;SM.海绵组织;LE.叶片厚度;S.气孔;A.通气组织。
3 结论与讨论
盐分对植物幼苗的最显而易见的效应就是抑制植株生长[13],从图1中也可以明显看出,在360 mmol·L-1NaCl溶液胁迫下,3份野生种质均不再有生长量上的增加,其受害症状也逐渐显露。
盐渍环境下,细胞质膜受到盐离子的胁迫而受伤,最显著的表现就是质膜透性增加,电导率的大小可以简明地反映细胞质膜受伤害程度:电导率值越高则质膜所受的伤害越大,其变化在耐盐指标中具有一定的参考价值[14]。而丙二醛是膜质过氧化的产物,其质量摩尔浓度通常用于表示膜质过氧化的程度,作为评定植物衰老以及判断植物对胁迫环境反应强弱的指标[11]。本研究中质膜透性和丙二醛质量摩尔浓度的递增趋势表明,3份材料在胁迫过程中持续受害,其中,野菊和甘菊在胁迫3 d时的质膜透性大幅增加,甘菊和菊花脑在胁迫3 d时的丙二醛质量摩尔浓度亦大幅增加,说明就质膜受害程度而言,甘菊表现出的耐受性最低,这也可以从图2中看出,胁迫6 d时,其叶片各组织细胞即严重溃散。
盐害通过影响某些特定的酶或代谢过程,尤其是叶绿素酶和光合过程的变化,使光合作用速率降低,同化物和能量供给减少,从而限制植物的生长发育[15]。从胁迫过程看,野菊、甘菊和菊花脑叶绿素质量分数的明显降低分别出现在3、6、9 d,从整体胁迫结果看,野菊仍保持一定叶绿素质量分数,而甘菊、菊花脑质量分数相比对照差异极显著,说明野菊对胁迫有一定的适应机制,而另两者则表现为被动受害。
渗透调节物质的积累是植物在受到环境胁迫时的一种代谢适应现象[16],研究表明,脯氨酸的积累能提高植物耐渗透胁迫的能力[17],也有研究者认为,是脯氨酸的动态平衡在植物响应逆境过程发挥重要作用[18]。在胁迫3 d时,3份材料脯氨酸质量分数的增量相当(50 μg·g-1左右),在胁迫9 d时,菊花脑和甘菊脯氨酸质量分数大幅增加(95.08、74.77 μg·g-1),文中认为在胁迫初期,三者即通过增加脯氨酸质量分数进行渗透调节,之后脯氨酸质量分数较缓增长,而到胁迫9 d时,甘菊与菊花脑即严重受害,大量合成脯氨酸,说明野菊通过脯氨酸调节响应盐胁迫的机制优于甘菊和菊花脑。
叶片是植物与外界环境进行物质和能量交换的主要器官,对生境条件的变化最为敏感,其形态和结构特征能体现环境对植物的影响或植物对环境的适应[19]。叶片的形态解剖结构对盐分胁迫的响应存在较大的种间和种内差异,不同耐盐类型植物在器官和组织结构上具有各自的特点[20]。Parida et al.[21]研究表明,在高浓度NaCl胁迫下,植物叶片栅栏组织、海绵组织和叶肉厚度减少。李瑞梅等[22]对海马齿(Sesuviumportulacastrum)植物叶片解剖结构的研究也有类似结果。在360 mmol·L-1NaCl胁迫6 d时,甘菊与菊花脑叶片结构尤其是海绵组织与栅栏组织受到严重破坏,组织厚度与上表皮厚度、下表皮厚度、叶片厚度及中柱鞘直径均不同程度地减小,这与Dawood et al.[23]的研究一致;从解剖结构的完整性上看,野菊在栅栏组织上的增加表明,这可能是其对盐环境适应的结果,Paz et al.[24]也有类似的结论。
文中采用360 mmol·L-1的NaCl溶液进行胁迫处理,含盐质量分数约为2%,为盐土表层含盐质量分数的下限[25]。3份菊属野生种野菊(山东)、甘菊(北京)、菊花脑(安徽)幼苗在形态特征、生理特性及解剖结构特征上的响应,说明其内在机制不足以使其在高浓度盐环境中生长发育,其叶片组织结构特征,尤其是表皮细胞与叶肉细胞的大小及完整性,直接与叶片质膜透性及光合特性相关,进而影响叶片表型。野菊在胁迫前后的叶片解剖结构上均与甘菊和菊花脑差异较大,说明其对盐环境耐受性较大。此外,野菊与甘菊均为菊属中的广布种,不同生境条件下其对逆境的响应也有所不同,如滨海生境的甘菊即被认为是耐盐植物[9]。虽然本次研究的指标尚不够揭示菊属野生种资源响应盐渍环境的内在机制,但相关结论有助于其耐盐性状的挖掘与利用,为进一步深入研究奠定基础,从而有利于开展耐盐菊花品种培育工作。
[1]史学正,于东升,潘贤章,等.我国1∶100万土壤数据库及其应用[R].沈阳:中国土壤学会,2004.
[2]陈俊愉,崔娇鹏.地被菊培育与造景[M].北京:中国林业出版社,2006.
[3]戴思兰,王文奎,黄家平.菊属系统学及菊花起源的研究进展[J].北京林业大学学报,2002,24(5/6):230-234.
[4]周杰.关于中国菊花起源的若干实验研究[D].北京:北京林业大学,2009.
[5]周树军,汪劲武.10种菊属(Dendranthema)植物的细胞学研究[J].武汉植物学研究,1997,15(4):289-292.
[6]汪劲武,杨继,李懋学.国产五种菊属植物的核型研究[J].云南植物研究,1991,13(4):411-416.
[7]李懋学,张学方,陈俊愉.我国某些野生和栽培菊花的细胞学研究[J].园艺学报,1983,10(3):199-205.
[8]管志勇,陈素梅,陈发棣,等.32个菊花近缘种属植物耐盐性筛选[J].中国农业科学,2010,43(19):4063-4071.
[9]黄河.甘菊响应盐诱导的分子机理研究[D].北京:北京林业大学,2012.
[10]镇兰萍,杨俊,俞年军.安徽野生菊属植物叶下表面特征的研究[J].植物科学学报,2013,31(1):99-106.
[11]李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[12]伊冬梅.菊花近缘种属植物耐涝性评价及耐涝机理研究[D].南京:南京农业大学,2011.
[13]杨少辉,季静,王罡宋,等.盐胁迫对植物影响的研究进展[J].分子植物育种,2006,4(3):139-142.
[14]赵可夫.植物对盐渍逆境的适应[J].生物学通报,2002,37(6):6-9.
[15]MUNNS R. Physiological processes limiting plant growth in saline soils: some dogmas and hypotheses[J]. Plant Cell Environ,1993,16(1):15-24.
[16]ASHRAF M, FOOLAD M B. Roles of glycine betaine and proline in improving plant abiotic stress resistance[J]. Environ Exp Bot,2007,59(2):206-216.
[17]BAGDI D L, SHAW B P. Analysis of proline metabolic enzymes inOryzasativaunder NaCl stress[J]. J Environ Bio,2013,34(4):677-681.
[18]KISHOR P B, POLAVARAPU B, SREENIVASULU N. Is proline accumulation per se correlated with stress tolerance or is proline homeostasis a more critical issue?[J]. Plant Cell Environ,2014,37(2):300-311.
[19]李正理,张新英,李荣敖,等.植物解剖学:上册:细胞与组织[M].北京:科学出版社,1986:87-134.
[20]HESTER M W, MENDELSSIOHN I A, MCKEE K L. Species and population variation to salinity stress inPanicumhemitomon,Spartinapatens, andSpartinaalterniflora: morphological and physiological constraints[J]. Environ Exp Bot,2001,46(3):277-297.
[21]PARIDA A K, DAS A B, MITTRA B. Effects of salt on growth, ion accumulation, photosynthesis and leaf anatomy of the mangrove,Bruguieraparviflora[J]. Trees,2004,18(2):167-174.
[22]李瑞梅,周广奇,郭建春,等.盐胁迫下海马齿叶片结构变化[J].西北植物学报,2010,30(2):287- 292.
[23]DAWOOD M G, TAIE H A A, NASSAR R M A, et al. The changes induced in the physiological, biochemical and anatomical characteristics ofViciafababy the exogenous application of proline under seawater stress[J]. S Afr J Bot,2014,93(3):54-63.
[24]PAZ R C, REINOSO H, ESPASANDIN D, et al. Akaline, saline and mixed saline-alkaline stresses induce physiological and morpho-anatomical changes inLotustenuisshoots[J]. Plant Biology,2014,16(6):1042-1049.
[25]俞仁培,蔡阿兴.盐渍土分类及改良分区专题讨论概况[J].土壤,1978,4(2):132-135.
Salt-tolerance and Anatomical Features of Three TypicalChrysanthemumSpecies//
Yang Haiyan, Sun Ming
(Beijing Forestry University, Beijing 100083, P. R. China)//Journal of Northeast Forestry University,2016,44(1):62-66.
Chrysanthemumspecies; Wild resource; Salt-tolerance; Anatomical features; Physiological characteristics
杨海燕,女,1991年9月生,北京林业大学园林学院、花卉种质创新与分子育种北京市重点实验室(北京林业大学)、城乡生态环境北京实验室(北京林业大学),硕士研究生。E-mail:kinayang@sina.cn。
孙明,北京林业大学园林学院、花卉种质创新与分子育种北京市重点实验室(北京林业大学)、城乡生态环境北京实验室(北京林业大学)、国家花卉工程技术研究中心(北京林业大学) ,副教授。E-mail:sun.sm@163.com。
2015年9月14日 。
S682.1+1;Q945.78
责任编辑:任俐。
