杨树白粉病病原菌鉴定1)
2016-08-17裴冬丽刘筱斐李成伟
裴冬丽 刘筱斐 李成伟
(植物与微生物互作重点实验室(商丘师范学院),商丘,476000) (商丘市第一高级中学) (植物遗传与分子育种重点实验室(周口师范学院))
杨树白粉病病原菌鉴定1)
裴冬丽刘筱斐李成伟
(植物与微生物互作重点实验室(商丘师范学院),商丘,476000)(商丘市第一高级中学)(植物遗传与分子育种重点实验室(周口师范学院))
对河南商丘地区的毛白杨白粉病菌进行了形态学和分子生物学鉴定。显微观察该病原菌无性和有性世代特征,初步鉴定为杨球针壳白粉菌(Phyllactiniapopuli);对该病原菌rDNA内转录间隔区(ITS)进行PCR扩增和序列测定,该序列与GenBank中杨球针壳白粉菌的同源性为99%。
毛白杨;杨球针壳白粉菌;形态学鉴定;ITS序列
毛白杨(Populustomentosa)因其具有生长快、树干挺拔、树形优美等特点,是优良的造林绿化树种之一,被广泛应用于城市绿化、速生材林、防护林等。杨树白粉病发生较为普遍,病害发生严重时,引起叶片小,生长势衰弱,影响绿化效果和树木材质。据研究报道,山西杨树白粉菌主要由杨球针壳菌(Phyllactiniapopuli)侵染所致[1],甘肃枫杨白粉菌由胡桃球针壳菌(P.juglandis)侵染所致[2],内蒙古杨树白粉菌主要由杨球针壳白粉菌(P.populi)和钩丝壳白粉菌(Uncinulamandshurica)侵染所致[3-4]。病原菌一般6—9月份致病,严重时使整个叶片呈白色,秋后形成闭囊壳,成熟后越冬。2013年6月,河南省商丘地区种植的毛白杨暴发了严重的白粉病,严重地块发病率达到了80%~90%。笔者报道了河南商丘地区白粉病菌的发生,对其进行了形态学、分子生物学鉴定和系统进化分析,为杨树白粉病防治提供理论依据。
1 材料与方法
1.1材料
供试植物材料为河南商丘师范学院校园内种植的毛白杨。
1.2病原菌显微形态鉴定
病原菌染色采用台盼兰染色法[5]。将感染叶片剪切后,浸没于固定液中(V(无水乙醇)∶V(冰醋酸)=3∶1),固定脱色12 h;0.3%的台盼兰溶液染色叶片组织,于水浴锅(70~80 ℃)中染色1 min后,叶片组织于染液中常温染色12 h;用2.5 g·mL-1的水合三氯乙醛冲洗被染色的叶片组织3次,最后样品可以于水合三氯乙醛中放置数月。显微观察时,制成水装片。
病原菌水装片制作:取新鲜发病叶片,挑取白粉菌的白粉层和闭囊壳,制成水装片,在显微镜下观察病菌的分生孢子、分生孢子梗、闭囊壳、子囊和子囊孢子的形态,并用分析软件测量其大小。
1.3病原菌致病性鉴定
采集菌丝茂盛的病叶,采用接触法,轻轻按压接种至未染病区域健康的毛白杨嫩叶上,观察其致病过程,与自然发病的杨树白粉病症状比较,再次收集病原菌,进行显微形态学观察。
1.4病原菌分子生物学鉴定
1.4.1基因组的提取
采用CTAB法提取杨树白粉菌DNA[6]。引物是核糖体ITS区段通用序列ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[7]。
1.4.2PCR扩增
PCR反应体系(20 μL):10×PCR反应缓冲液2.0 μL,dNTP混合物(各2.5 mmol·L-1)1.6 μL,Mg2+(25 mmol·L-1)1.6 μL,上游及下游引物(10 μmol·L-1)各1.0 μL,Taq聚合酶(5 U·μL-1)0.5 μL,模板DNA 1.0 μL,无菌水11.3 μL。
PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,53 ℃退火45 s,72 ℃延伸1 min,共35个循环;72 ℃延伸7 min。
1.4.3产物纯化与测序
切胶回收PCR产物,采用琼脂糖凝胶DNA纯化试剂盒(TakaRa)纯化产物,纯化后产物克隆至pMD18-T载体上,转化至EscherichiacoliDH5α感受态细胞内,鉴定出阳性菌落,送南京金丝瑞生物科技有限公司测序。
1.4.4序列分析
测得杨树白粉菌ITS序列于GenBank核酸序列数据库中进行BLASTn搜索,发现与其高同源性的序列。利用Clustal X软件和MEGA3.1软件对相关序列进行分析,基于Kimura-2-Parameter双参数模型,采用邻近接连法(N-J)构建系统进化树,分析亲缘关系。
2 结果与分析
2.1病原菌形态特征
毛白杨白粉菌可生长于叶的两面,发病初期叶片上出现圆形或不规则形白色斑点,后逐渐扩散,严重时白色粉状物(无性世代的分生孢子和菌丝体)可连成片,覆盖整个叶片(图1A);后期病斑上产生黄色到黑褐色的小颗粒(有性世代的闭囊壳),散生至聚生。
显微镜下观察其形态学特征。杨树白粉菌分生孢子为宽棍棒形,(70~79)μm×(23~32)μm(图1B);闭囊壳球形,直径160~190 μm;附属丝针状,基部膨大为球形,多为6~11根,长100~325 μm,为闭囊壳直径的0.7~1.5倍(图1C);每个闭囊壳内子囊8~20个,椭圆形,(45~90)μm×(25~45)μm;子囊内子囊孢子通常为2个,卵形或椭圆形,黄橙色,(23~44)μm×(15~30)μm(图1C)。依据其该病原菌显微形态学特征,初步鉴定为杨球针壳白粉菌[8]。

A.叶片上白粉菌菌斑;B.白粉菌菌丝和分生孢子(箭头所指为分生孢子);C.白粉菌闭囊壳(箭头所指为含有2个子囊孢子的子囊)。比例尺为50 μm。
2.2病原菌致病性鉴定
摘取病叶,采用按压接触法接种至健康5株毛白杨嫩叶上,10~12 d后,叶片上开始发病,病症与自然发病叶片症状相同;对接种后病斑进行显微形态学观察,其形态结构与接种病原菌相同。未接种的对照株不发病。
2.3病原菌分子生物学鉴定
以提取的毛白杨白粉病菌的基因组DNA为模板,用引物ITS1和ITS4进行PCR扩增,获得650 bp左右的目的片段(图2)。测定该片段序列,长度为657 bp,BLAST比对分析发现,该病原菌ITS序列中1~30 bp为部分18 S rDNA,31~263 bp为ITS1区段序列,264~417 bp为5.8 S rDNA的全序列,418~599 bp为ITS2区段序列,600~657 bp为部分28 S rDNA序列。该序列于GenBank中序列登记号为KC357772。
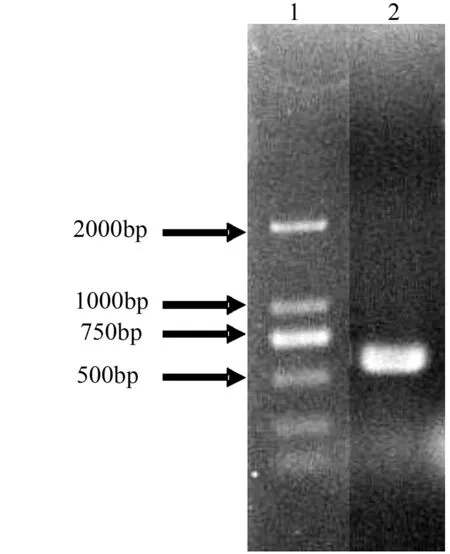
1.2 000 bp Marker;2.PCR扩增产物。
2.4ITS同源序列比对和系统进化树构建
杨树白粉菌KC357772序列(菌株编号:SQbaiyang-1)于GenBank核酸序列数据库中进行BLASTn,发现其与GenBank中登记的杨树杨球针壳白粉菌的ITS序列(登记号:JQ250805)具有99%的同源性。下载与其高度同源的球针属白粉菌ITS序列,应用MEGA3.1软件做近邻归群法分析。结果表明,依据ITS序列的不同,不同种球针属白粉菌聚为2个大的分支,而该菌株与P.populi聚在一个大分枝下的小枝,自展支持率达100%。其它球针壳属白粉菌因其寄主不同,分属于不同的种,分别为棒球针壳(Phyllactiniaguttata)、梣球针壳(P.fraxini)、胡桃球针壳(P.juglandis)、萨蒙球针壳(P.salmonii)、柿生球针壳(P.kakicola),说明了由于寄主范围的特异性形成白粉菌不同的小生境,进而激发了这些白粉菌的遗传差异的产生[9]。
分析结果进一步说明,来自河南商丘地区的杨树白粉病病原菌是杨球针壳白粉菌。
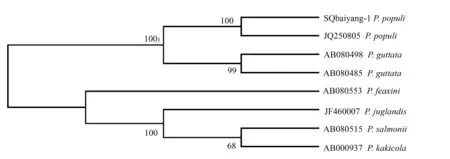
图3 依据ITS序列构建的球针属白粉菌N-J系统进化树
3 结束语
世界上杨树白粉菌报道共计3属9种,杨树白粉菌在我国山西、江西、甘肃、宁夏和内蒙古等省市均有报道,主要由胡桃球针壳菌、杨球针壳白粉菌和钩丝壳白粉菌3种白粉菌侵染所致[1-4]。河南省毛白杨白粉菌的报道对杨树白粉病病原菌的防治具有一定的意义。本研究报道了河南商丘地区毛白杨白粉菌的发生,通过对白粉菌的无性和有性世代显微形态学特征观察,致病性鉴定和分子生物学鉴定,明确了该病原菌为杨球针壳白粉菌,并进一步对白粉菌球针壳属进行了系统进化分析,指出了由于白粉菌针球菌属寄主不同造成的小生境的差异,导致球针菌属分化为不同的种来适应不同的环境。
[1]王建明,贺运春,李宏斌.山西白粉菌的种类、寄主及分布研究(I)[J].山西农业大学学报,1996,16(4):329-335.
[2]张如力,刘鸿源,鲁志颖.甘肃木本植物上的白粉菌[J].西北林学院学报,2006,21(3):83-86.
[3]陈阳,王立新,刘家骧,等.内蒙古白粉菌的种类研究[J].内蒙古农业科技,2004(4):25-26.
[4]王向霞,郑平,王梅,等.巴盟杨树白粉菌分类研究[J].内蒙古林业科技,2001(2):29-31.
[5]HUANG C C, GROOT T, MEIJER-DEKENS F, et al. The resistance to powdery mildew (Oidiumlycopersici) inLycopersiconspecies is mainly associated with hypersensitive responses[J]. European Journal of Plant Pathology,1998,104(4):399-407.
[6]庄彩云,李潞滨,胡陶,等.适用于rDNA ITS分析的兰属菌根真菌培养及DNA提取方法[J].北京农学院学报,2007,22(3):4-6,31.
[7]DUGAN F M, GLAWE D A. Powdery mildews on weeds in the pacific northwest: a miscellsany of new records[J]. Pacific Northwest Fungi,2007,2(1):1-7.
[8]郑儒永,余永年.中国真菌志:第1卷:白粉菌目[M].北京:科学出版社,1987:266-269.
[9]HIRATA T, CUNNINGTON J H, PAKSIRI U, et al. Evolutionary analysis of subsectionMagnicellulataeofPodosphaerasectionSphaerotheca(Erysiphales) based on the rDNA internal transcribed spacer sequences with special reference to host plants[J]. Canadian Journal of Botany,2000,78(12):1521-1530.
Identification of Powdery Mildew onPopulustomentosa//
Pei Dongli
(Key Laboratory of Plant-Microbe Interactions, Shangqiu Normal University, Shangqiu 47600, P. R. China); Liu Xiaofei(Shangqiu First Senior High School); Li Chengwei(Key Laboratory of Plant Genetics and Molecular Breeding, Zhoukou Normal University)//Journal of Northeast Forestry University,2016,44(1):100-102.
The experiment was conducted to test the morphological and molecular identification of powdery mildew onPopulustomentosa. It was identified asPhyllactiniapopuliby asexual generation and sexual generation characteristics by microscopic observation. The pathogen rDNA ITS was amplified and sequenced, which was with 99% identity withPhyllactiniapopulisequence from GenBank.
Populustomentosa;Phyllactiniapopuli; Morphological identification; ITS sequences
裴冬丽,女,1971年11月生,植物与微生物互作重点实验室(商丘师范学院),教授。E-mail:peidongli@126.com。
李成伟,植物遗传与分子育种重点实验室(周口师范学院),教授。E-mail:lichengweiwau@hotmail.com。
2014年8月13日。
S763.15
1)国家自然科学基金项目(31571997、31071807);河南省高等学校重点科研项目(13B210199、15A180019)。
责任编辑:程红。
