二氢杨梅素体外抗氧化活性研究
2016-08-16王恩花杨礼寿逯凤肖秦泽华郁建平
王恩花,杨礼寿,逯凤肖,秦 湉,秦泽华,郁建平
(贵州大学 药学院,贵州 贵阳 550025)
二氢杨梅素体外抗氧化活性研究
王恩花,杨礼寿,逯凤肖,秦湉,秦泽华,郁建平*
(贵州大学 药学院,贵州 贵阳 550025)

二氢杨梅素;体外抗氧化活性;自由基;总抗氧化活性
二氢杨梅素(Dihydromyricetin,DMY)为藤茶的主要功效成分,又名蛇葡萄素、白蔹素、福建茶素等[1]。DMY 属于黄酮类化合物,研究表明其毒性小,有优良的抑菌、护肝和抗癌等作用,可清除氧自由基,抑制自由基对人体组织器官的损害,具有很大的开发应用前景[2]。由于一些合成抗氧化剂,如二丁基羟基甲苯(BHT)、丁基羟基茴香醚(BHA)被发现有不同程度的致癌等毒副作用,因而在美国和日本已停止使用[3]。随着天然食品添加剂的开发,开发抗氧化活性好、毒性小的天然食品添加剂已成为研究热点。有研究发现葡萄科蛇葡萄属植物中大量存在DMY,且在显齿蛇葡萄中其含量极高,这使得DMY开发为食品抗氧化剂成为可能[4]。本研究采用改良的DPPH对照法测定DMY对DPPH的体外清除率,羟自由基、超氧阴离子体外清除能力、体外总抗氧化能力则是采用快速简便、稳定性好、再现性好的试剂盒方法进行测定。测定四个抗氧化性指标,较全面地对DMY进行抗氧化功能评价,为DMY在食品方面的开发应用提供进一步的参考。
1 材料与方法
1.1试验材料
由贵州大学生化营养研究所植化实验室提取的二氢杨梅素(DMY)。
1.2试剂
冰乙酸、无水乙醇、抗坏血酸(Vc)硫酸亚铁,水杨酸,griess试剂,gress氏试剂,氢氧化钠,三氯化铁,过氧化氢,菲啉试剂均为国产分析纯。特丁基对苯二酚(TBHQ)购买于河南千志商贸有限公司;对二苯基苦基肼自由基(DPPH)购买于阿拉丁;羟自由基测试盒、抗超氧阴离子测试盒、总抗氧化能力(T-AOC)测试盒购买于南京建成生物工程研究所。
1.3仪器与设备
ISO9001型电子分析天平(北京赛多利斯仪器系统有限公司),数显恒温水浴锅(上海梅香仪器有限公司),KX-1740QTD型超声波清洗仪(北京科玺世纪科技有限公司),TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限公司),GZE-9140 mBE型电热恒温鼓风干燥箱(上海博讯实业有限医疗设备厂),XK96-A型快速漩涡混匀器(江苏新康医疗器械有限公司)等。
1.4对 DPPH· 的清除测定
二苯代苦味肼基自由基(DPPH)能稳定存在于机溶剂中,不溶于水,在乙醇溶液中呈典型的紫色,并在517 nm处有最大吸收[5]。加入抗氧化剂时,抗氧化剂一个电子与DPPH分子中稳定的自由基配对,溶液的颜色由深紫色向黄色转变,其褪色程度与抗氧化剂清除自由基的能力有关。由于DPPH 检测法具有简便易行、灵敏可靠、不需要昂贵的仪器设备等优点而广泛应用于自由基清除剂的筛选和研究工作中[6]。
DPPH 溶液的配制:称取 DPPH 0.0201 g于100 mL烧杯中,加10 mL无水乙醇,超声5 min,转移至250 mL容量瓶,定容,得到摩尔浓度为0.2039 mmol/L,避光保存,3 h 之内用完。
取2.0 mL浓度分别为5.0、7.5、10.0、20.0、30.0、40.0、50.0、60.0 mg/mL的DMY溶液和TBHQ溶液放置于试管中,各加入2.0 mL浓度为0.2039 mmol/L 的DPPH 溶液,在25℃水浴中避光反应30 min,用分光光度计在517 nm下测定吸光度值(A1);取2.0 mL不同和浓度的溶液加入2.0 mL的无水乙醇,测定样品吸光度(A2);取2.0 mL蒸馏水加入2.0 mL DPPH溶液测得空白吸光度(A3)。以浓度分别为5.0、7.5、10.0、20.0、30.0、40.0、50.0、60.0 mg/mL 的Vc溶液为阳性对照。DPPH 清除率越高其抗氧化能力越强。
清除能力公式为:清除率(%)=[1-(A1- A2)/ A3]×100%
1.5对·OH的清除测定
生命代谢过程中会不断产生活性氧,羟基自由基为最活跃的活性氧,是高反应自由基,毒害大,能够激发油脂过氧化反应,因此在植物抗氧化性能力检测时有必要对羟基自由基清除能力进行检测[7-8]。羟基自由基检测法原理是H2O2和Fe2 +混合后,生成具有很高反应活性、能与水杨酸结合产生颜色,在550 nm处有强吸收,羟基自由基清除物质可与水杨酸竞争,从而使得有色物质减少,通过比色法测定待测物的清除能力[9]。具体操作按照试剂盒说明进行。
取浓度分别为0.01、0.02、0.03、0.04、0.05、0.06 mg/mL的DMY溶液和TBHQ溶液按说明书制备反应体系(见表1),混匀,放置20 min,波长550 nm,测定各管吸光度值。以浓度分别为0.01、0.02、0.03、0.04、0.05、0.06 mg/mL的Vc溶液为阳性对照,平行测定三次,取平均值。
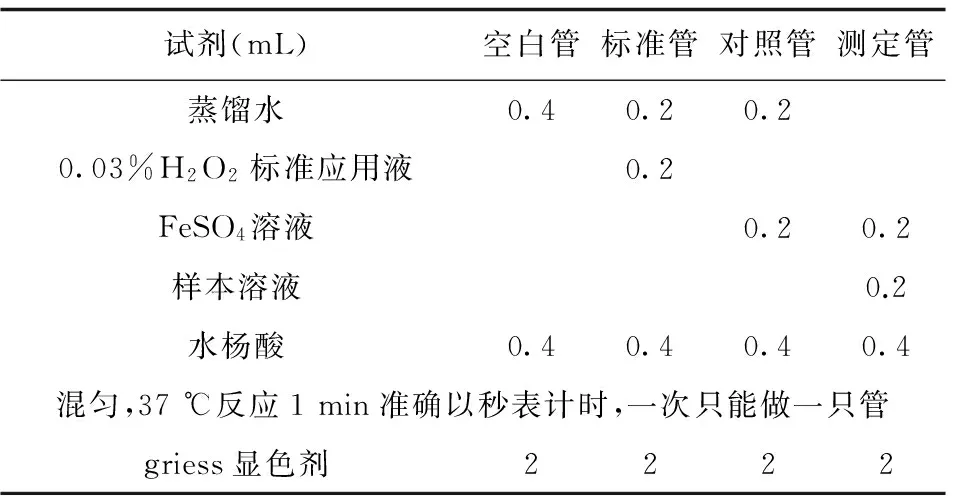
表1 清除羟自由基反应体系
注:抑制羟自由基能力的计算:抑制羟自由基能力(U/mL)=(对照OD值-测定OD值)÷(标准OD值-空白OD值)×44.12
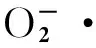
反应体系产生超氧阴离子自由基,加入电子传递物质及gress氏显色剂,使反应体系呈紫红色,体系含有超氧阴离子自由基抑制剂时,比色时测定管的吸光度低于对照管的吸光度。具体操作按照试剂盒说明进行。
分别取浓度为0.05、0.10、0.15、0.20、0.25、0.30 mg/mL的DMY溶液和TBHQ溶液按试剂盒说明书制备反应体系(见表2),混匀,放置10 min,550 nm波长处测定各管吸光度值。以浓度分别为0.05、0.10、0.15、0.20、0.25、0.30 mg/mL的Vc溶液为阳性对照,平行测定三次,取平均值。
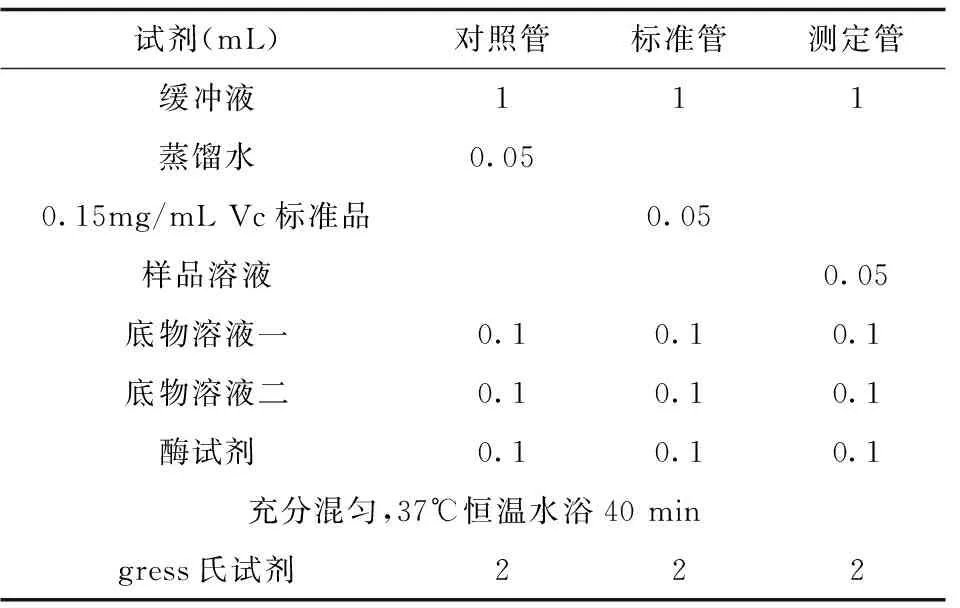
表2 抗超氧阴离子自由基反应体系
注:抗超氧阴离子活力计算:抗超氧阴离子活力单位(U/L)=(对照OD值-测定OD值)/(对照OD值-标准OD值)×150
1.7总抗氧化能力测定
体系中的抗氧化物质,能使Fe3+还原成Fe2+,后者可与菲啉试剂形成稳定的络合物,通过比色可测出其抗氧化能力的高低。具体操作按照试剂盒说明进行。
取浓度分别为0.05、0.10、0.15、0.20、0.25、0.30 mg/mL的 DMY溶液和TBHQ溶液按说明书制备反应体系(见表3),混匀,放置10 min,520 nm波长下测定各管吸光度值。以浓度分别为0.05、0.10、0.15、0.20、0.25、0.30 mg/mL的VC溶液为阳性对照,平行测定三次,取平均值。注意每个浓度都要测对照管。

表3 总抗氧化能力反应体系
注:总抗氧化能力计算公式:总抗氧化能力(单位/毫升溶液)=(测定OD值-对照OD值)÷0.3×37
2 结果与讨论
2.1对 DPPH 自由基的清除能力
不同Vc、DMY 和TBHQ浓度对DPPH清除能力的影响,见表4和图1。
从图1可以看出,DMY、TBHQ在5~20 mg/mL试验浓度范围内时,其对DPPH的清除能力与浓度呈正相关,当Vc、DMY、TBHQ浓度为20 mg/mL 时,清除率分别为76.91%、91.79%、90.74%,DMY组与Vc组对自由基清除率具有极显著差异(P< 0.01),再增加DMY、TBHQ的含量对自由基清除率增大不明显;常用抗氧剂VC对DPPH的清除作用随Vc 浓度(5~30 mg/ mL)的增加而增大,当含量达到30 mg/mL 时,清除率为95.25%,再增加Vc的含量对自由基清除率增大不明显。结果表明,DMY表现出较强的DPPH清除能力,浓度为20 mg/mL 清除率(91.79%)达最大值,与同浓度下Vc清除率(76.91%)有极显著差异(P< 0.01);当试验浓度为30 mg/mL 时,DMY组清除率大最大值为94.25%,Vc组也达最大清除率95.25%,两组没有显著性差异(P> 0.05),浓度再增加清除率变化不明显。由此可见,当试验浓度较低(5~20 mg/mL)时,DMY对清除DPPH的清除能力优于Vc,当Vc、DMY、TBHQ浓度为30~60mg/mL范围时,DPPH自由基清除率变化不大。
Tab.4DPPH· scavenging activities on Vc,

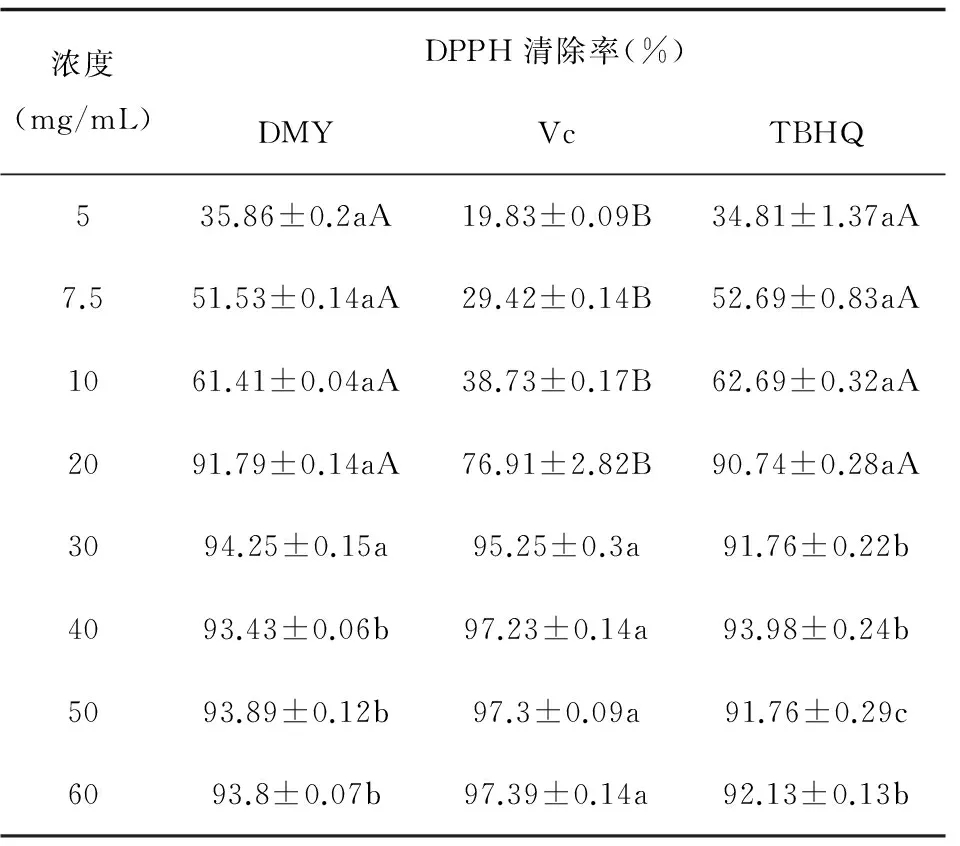
浓度(mg/mL)DPPH清除率(%)DMYVcTBHQ535.86±0.2aA19.83±0.09B34.81±1.37aA7.551.53±0.14aA29.42±0.14B52.69±0.83aA1061.41±0.04aA38.73±0.17B62.69±0.32aA2091.79±0.14aA76.91±2.82B90.74±0.28aA3094.25±0.15a95.25±0.3a91.76±0.22b4093.43±0.06b97.23±0.14a93.98±0.24b5093.89±0.12b97.3±0.09a91.76±0.29c6093.8±0.07b97.39±0.14a92.13±0.13b
注:同行小写字母不同表示有显著差异(P<0.05),同行大写字母不同表示有极显著差异(P< 0.01), 下同。

图1 VC、DMY 和TBHQ对 DPPH清除能力
2.2对羟基自由基(·OH)的清除能力
不同DMY、TBHQ和Vc浓度对羟基自由基清除能力的影响,见表5和图2。
采用Fenton 反应,对DMY清除羟自由基能力进行测定,从图2可以看出,在试验浓度范围内,清除率随着清除剂含量的增加而逐渐增大,三种清除剂对羟基自由基都表现出一定程度的清除能力,试验浓度为6 mg/mL时,Vc、TBHQ、DMY的清除能力分别达到617.49 U/mL、513.84% U/mL、495.09 U/mL,DMY组与Vc组有极显著差异(P< 0.01),与TBHQ组有显著差异(P< 0.05)。比较发,相同浓度下对羟基自由基清除能力 Vc > TBHQ > DMY,说明DMY对羟基自由基的清除效果要差一些。
表5DMY、TBHQ和Vc对羟基自由基清除能力
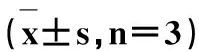
Tab.5 ·OH inhibiting activities on Vc,

浓度(mg/mL)清除羟自由基能力(U/mL)DMYVcTBHQ0.01135.19±0.73bB392.79±1.19A152.51±0.68bB0.02252.11±1.00bB438.46±1.32A272.21±1.26bB0.03350.77±1.22bB474.99±1.28A374.52±0.84bB0.04354.42±1.64cB569.99±1.60A449.42±0.39bB0.05469.52±1.22cB571.82±0.63A500.57±0.73bB0.06495.09±2.31bB617.49±0.84A513.84±2.61bB
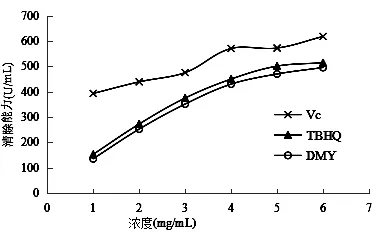
图2 DMY、TBHQ和Vc对羟基自由基清除能力
不同DMY、TBHQ浓度对超氧阴离子清除能力的影响,见表6和图3。
从图3可以看出,试验浓度范围内,DMY、TBHQ对超氧阴离子的清除能力均与其含量呈量效关系,随着超氧阴离子清除剂含量增加其清除能力逐渐增强。当试验浓度为0.30 mg/mL 时,DMY、TBHQ的清除能力达到182.61 U/L、186.26 U/L,DMY组与TBHQ相比具有显著性(P< 0.05)。从总体趋势来看,二者对超氧阴离子的清除能力相当。
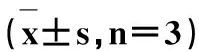
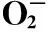

浓度(mg/mL)超氧阴离子自由基(U/L)DMYTBHQ0.05124.81±0.55b128.24±0.86a0.10146.56±0.83A135.88±0.56B0.15157.25±0.94b160.31±0.48a0.20161.83±0.27B171.76±0.29A0.25173.66±0.84b175.95±0.32a0.30186.26±1.08a182.61±1.64b
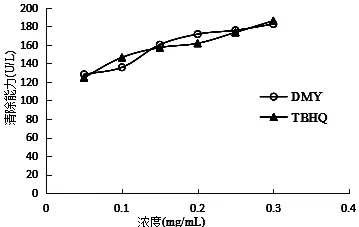
图3 DMY、TBHQ对超氧阴离子清除能力
2.4总抗氧化能力的测定
不同DMY、Vc和TBHQ浓度对总抗氧化能力的影响,见表7和图4。
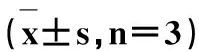
表7 DMY、Vc和TBHQ总抗氧化能力
从图4可以看出,在试验浓度范围内,DMY、Vc 和TBHQ都表现出一定程度的抗氧化活性,并且呈明显量效关系,DMY、Vc的总抗氧化效果要好于TBHQ,在浓度为0.30 mg/mL 时,DMY、Vc、TBHQ的总抗氧化能力分别为0.309 U/mL、0.313 U/mL、0.301 U/mL,DMY组较Vc组差异不显著(P> 0.05),DMY组较TBHQ组差异显著(P< 0.05)。
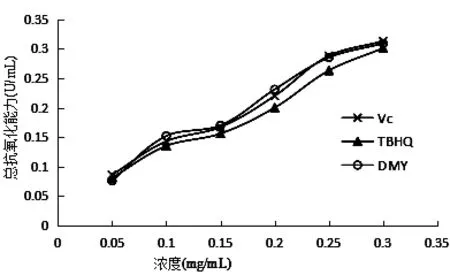
图4 DMY、Vc和TBHQ总抗氧化能力
3 结 论

[1]王丹丹,王文清,施春阳,熊微,侯小龙,方建国.藤茶中二氢杨梅素含量变异研究进展[J].中药材,2015(09):1995-1998.
[2]王丹,郁建平,刘灏.藤茶二氢杨梅素抗氧化活性研究[J].山地农业生物学报,2013(03):243-246.
[3]卢福山,马贵栋.车前草水煎液对超氧自由基清除作用[J].中兽医学杂志,2015(02):11-12.
[4] 梁琍,邱岚,赵成刚.梵净山野生藤茶中二氢杨梅素的提取及体外抗氧化研究[J].广州化工,2015(03):48-50.
[5]Benziel F F, Strain J J.The ferric reducing ability of plasmaasa measure of antiocidant power:The FRA Passay[J].Anal Biochem,1996(239):70-76.
[6]李雪莲,黄立新,许喜林.中草药对食用油脂的抗氧化作用[J].食品科学,2006(12):930-933.
[7]展锐,库尔班,苟萍,索菲娅.火绒草提取物抗氧化活性的研究[J].食品科学,2010(03):153-159.
[8]李姣娟,周尽花,戴瑜,黄克瀛.川桂叶总黄酮清除DPPH·自由基作用的研究[J].中南林业科技大学学报,2010(10):125-128, 132.
[9]曹纬国,刘志勤,邵云,陶燕铎.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003(12):2241-2247.
·研究简报·
Study on Antioxidant Activity of DihydromyricetininVitro
WANGEn-hua,YANGLi-shou,LUFeng-xiao,QINTian,QINZe-hua,YUJian-ping*
(CollegeofPharmacy,GuizhouUniversity,Guiyang,Guizhou550025,China)
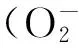
Dihydromyricetin; Antioxidant activityinvitro; Free radical; Total antioxidant activity
1008-0457(2016)03-0086-05国际DOI编码:10.15958/j.cnki.sdnyswxb.2016.03.017
2016-03-18;修回日期:2016-04-15
贵州省科技厅农业攻关项目“贵州省藤茶资源及深加工研究与应用”([黔科合NY[2011]3094 号)。
郁建平(1956-),男,博士,主要研究方向:食品化学、天然药物化学、生化分离工程及农副产品的开发及利用;E-mail: yujp666666@ 163.com。
R93
A
