转拟南芥BAS1基因提高烟草光合特性
2016-08-16姚新转吕立堂赵德刚
姚新转,吕立堂*,赵德刚*
(1.贵州大学 生命科学学院/农业生物工程研究院, 贵州 贵阳 550025;2.贵州大学 山地植物资源保护与种质创新省部共建教育部重点实验室,贵州 贵阳 550025)
转拟南芥BAS1基因提高烟草光合特性
姚新转1,2,吕立堂1,2*,赵德刚1,2*
(1.贵州大学 生命科学学院/农业生物工程研究院, 贵州 贵阳 550025;2.贵州大学 山地植物资源保护与种质创新省部共建教育部重点实验室,贵州 贵阳 550025)
本文通过农杆菌介导法将BAS1基因遗传转化烟草(Nicotianatabacumxanthin),经PCR鉴定,不同启动子转基因植株各获得30株以上。以转基因株系及其野生型为材料,探讨大田环境下植株成熟叶片的光合特性。结果表明,转基因烟草具有更强的光合能力,并伴随着气孔导度(Gs)、细胞间CO2浓度(Ci)、蒸腾速率(Tr)提高,其叶绿素组成成分的含量发生了变化,叶绿素总含量也显著高于野生型。因此,转BAS1基因提高烟草净光合速率。
BAS1基因;遗传转化;转基因烟草;叶绿素含量;光合特性
油菜素内酯(Brassinolide,简称BR)是一类甾醇类激素,BR能够通过维持较高的叶绿素含量或维持较高的可溶性蛋白质含量解除光对植物生长的抑制作用来提高叶片的净光合速率[1- 2],其在植物的根茎伸长、维管束分化、光形态建成、生殖发育和向性建成等生长发育过程中发挥着重要作用。叶面期喷施不同浓度的BR,可显著提高玉米的光合速率[3]。植物体内油菜素内酯水平的高低主要是通过油菜素内酯代谢相关基因的表达来调控[4]。BAS1基因编码一个细胞色素P450(CYP72B1),其过量表达导致油菜素内酯C-26羟基羟化[5-8],降低植物体内活性油菜素内酯含量。束红梅等[9]利用烟草根组织特异性表达基因TobRB7启动子油菜素内酯失活基因BAS1,转基因植株中根系油菜素内酯受体激酶基因BRI1的表达受到影响。本文以转BAS1基因烟草和野生型烟草为材料,探讨其成熟叶片的光合特性,旨在为揭示内源油菜素内酯与光合作用的关系提供了新线索。
1 材料与方法
1.1材料
以植物组成性启动子35S和杨树维管组织特异启动子pLXM5驱动BAS1基因表达转基因烟草植株35S∷BAS1和pLXM5∷BAS1的株系及其野生型植株为材料。
1.2方法
1.2.1烟草遗传转化
利用已构建好的pSH-35S-BAS1和 pSH-pLXM5-BAS1载体,参照采用农杆菌(Agrobacteriumtumefaciens)介导叶盘法[10]分别将带有不同启动子BAS1基因遗传转化烟草。选取盆栽烟草幼嫩叶片,在自来水下冲洗1~2 h,吸干叶片表面多余的水分,用75%的乙醇消毒30 s,无菌水冲洗两次,再用0.1%的升汞灭菌10 min左右,无菌水冲洗5~6次,然后切成1 cm×1 cm小叶块,将其置于农杆菌重悬液(MS+30 g/L蔗糖+1.0 mg/L 6-BA+0.1 mg/L NAA+100 μmol/L AS)侵染8 min (OD600=0.5)后用无菌滤纸吸去多余的菌液,将烟草叶块接种于共培培养基MS1(MS + 1.0 mg/L 6-BA+0.1 mg/L NAA+3%蔗糖+0.7%琼脂)上,28°C黑暗共培养2 d。共培养后的叶片块转移至筛选培养基MS2(MS +1.0 mg/L 6-BA+0.1 mg/L NAA+ 100 mg/L卡那霉素(kanamycin)+100 mg/L替门汀(Timentin)+30%蔗糖+0.7%琼脂)上,温度25°C、光照时间16 h/d培养2周,以诱导抗性芽分化。待抗性芽长至1~2 cm左右后自基部切下,去除表面愈伤组织,转移到生根培养基MS3(1/2MS+0.1 mg/L NAA+100 mg/L卡那霉素(kanamycin)+100 mg/L替门汀(Timentin)+30%蔗糖+0.7%琼脂)上诱导抗性芽生根,待再生苗长至5 cm后炼苗并移栽至预先处理好的混合土(黄土∶营养土∶珍珠岩=2∶1∶1,混匀后用0.3%的KMnO4消毒)中培养放于贵州大学农业生物工程试验田内,栽培技术及管理措施与当地优质烟的生产管理方法一致。
1.2.2转基因植株PCR鉴定
筛选的抗性烟草植株生长至4~6叶期时,按照TIANGEN BIOTECH公司新型植物总DNA提取试剂盒步骤分别提取GUS染色阳性植株和野生型植株的基因组DNA,用于转基因植株PCR鉴定。设计BAS1基因特异引物(P1:5′ GATAGAGCGGCGGAGACAAA 3′和P2:5′ CTTGGTCATGATGGACCGCT 3′),对抗性植株进行目的片段扩增。PCR扩增的体系及扩增条件:在PCR管中依次加入下列各组份:引物P1和P2各加0.8 μL,PlemixTaq10 μL,DNA模板2 μL,ddH2026.4 μL,总体积为20 μL。混匀后,于9700型仪上进行扩增反应,扩增条件为95℃预变性变性5 min,98℃预变性变性10 s,50℃退火30 s,72℃延伸20 s,72℃再延伸5 min,35个循环后再延伸。反应完毕,取4 μL扩增产物在含Gelredde的1.2%琼脂糖凝胶中电泳,在凝胶成像系统下检测结果。
1.2.2光合性能测定
光合性能测定采用LI-6400XT便携式光合作用测量系统,选择光照及气温相对比较高的晴天的上午9∶30~11∶30测定各项指标,叶室温度设置为30℃,光合有效辐射为1000 μmol/m2·s。测定时随机选用植株生长状况一致的向阳健康成熟叶片作为供试材料,野生型和转基因植株各测定不同株系,选取大致相同的部位,每叶位测定3次重复,取12次重复测定的平均值。
1.2.3叶绿素(Chl)及类胡萝卜素含量的测定
参照高均风[11]的测定方法略有改动,采用直接浸提法(丙酮∶乙醇∶水混合液)。将叶片去脉剪切成丝状,准确称取0.5 g,放入到25 ml棕色的锥形瓶中(丙酮∶乙醇∶水混合液=4.5∶4.5∶1)的混合液中,加入提取液15 mL摇匀,室温避光放置约24 h,期间不时摇动,等叶片变白,最后定容至25 mL,溶液5000 r/min离心10 min后,取上清液倒入光径1 cm的比色杯内,用UV-1102紫外可见分光光度计分别在波长663 nm和645 nm下比色测定吸光值,测定时间为光合测定后的第二天,每个株系及野生型烟草取5个株的平均值为测定值。
叶绿素含量的计算依据Arnon公式(1949):
叶绿素a含量(mg/g)=(12.7×A663-2.69×A645) ×V/(1000W);
叶绿素b含量(mg/g)=(22.7×A645-4.68×A663) ×V/(1000W);
叶绿素总含量(mg/g)=叶绿素a含量+叶绿素b含量
类胡萝卜素Cx含量(mg/g)=(1000×A470-3.27×Ca-104×Cb)/229
式中A663、A645分别为相应波长下的吸光度值,V为提取液体积,W为所取叶片鲜重质量。
1.2.4 统计分析
原始数据分析采用Microsoft Excel 2011软件,分别计算平均值及标准误差,并绘制图表。采用SPSS 22.0统计软件进行t检验。图中标注的“*”和“**”分别表示所测定项目在转基因与野生型烟草之间差异显著(P<0.05)和极显著(P<0.01)。
2 结果与分析
2.1转基因植株的获得
以烟草叶片为外植体,通过农杆菌介导的共转化法将含有不同启动的BAS1基因的农杆菌菌液对烟草进行转化, 共获得30株以上抗性植株(图 1和图2)。分别提取野生型和抗性株系的DNA,以BAS1基因引物进行PCR扩增, 在转化株系中都分别扩增出预期(图1-F和图2-F)目的条带, 在野生型烟草植株中未扩增出目的条带, 说明已经获得转基因烟草。通过统计不同启动子转基因植株各获得30株以上转基因烟草植株;转基因植株生长状况(图 3)所示,与野生型相比,转35S∷BAS1基因烟草植株发生叶片褶皱变小,叶片深绿,植株茎围变粗,而转pLXM5∷BAS1基因烟草生长正常。

图1 转35S∷BAS1基因烟草的遗传转化及鉴定

图2 转pLXM5∷BAS1基因烟草的遗传转化及鉴定

图3 转基因烟草生长状况Fig.3 The growth condition of transgenic tobacco WT:野生型烟草;35S∷BAS1: 转35S∷BAS1因烟草;pLXM5∷BAS1: 转pLXM5∷BAS1基因烟草植株生长
2.2转BAS1基因烟草株系的光合特性
不同株系净光合速率如图4所示,转基因35S∷BAS1、pLXM5∷BAS1烟草株系净光合速率分别为14.56 μmol/m2·s和16.974 μmol/m2·s,比野生型烟草分别增加38.45%和45.67%(图 4-A)。野生型烟草和35S∷BAS1、pLXM5∷BAS1转基因植株的净光合速率与叶片气孔导度(Gs)与蒸腾速率(Tr)、胞间CO2浓度(Ci)均提高,即转基因植株pLXM5∷BAS1和35S∷BAS1的净光合速率、蒸腾速率、气孔导度和胞间CO2浓度均高于野生型烟草。其中,转基因植株35S∷BAS1、pLXM5∷BAS1和野生型烟草净光合速率、气孔导度、蒸腾速率极显著高于野生型(图 4-B、D),转基因烟草和野生型胞间CO2浓度差异不显著(图 4-C)。表明转基因烟草比野生型烟草有着较高的气孔导度以维持胞间CO2浓度。
2.3转BAS1基因烟草株系叶绿素及内胡萝卜素含量
通过对转基因烟草光合色素含量分析,结果表明,转35S∷BAS1基因烟草的叶绿素a含量比野生型高67.8%,且其叶绿素b含量比野生型高67.5%;转pLXM5∷BAS1基因烟草的叶绿素a和叶绿素b含量分别提高89.4%和90.1%;但转35S∷BAS1基因烟草和转pLXM5∷BAS1基因烟草叶绿素a和叶绿素b含量无显著差异,同时野生型烟草、转35S∷BAS1基因烟草和转pLXM5∷BAS1基因烟草之间类胡萝卜素含量无显著差异(图 5-C)。说明BAS1基因能够提高烟草叶绿素a和叶绿素b的含量但不影响类胡萝卜素的含量。
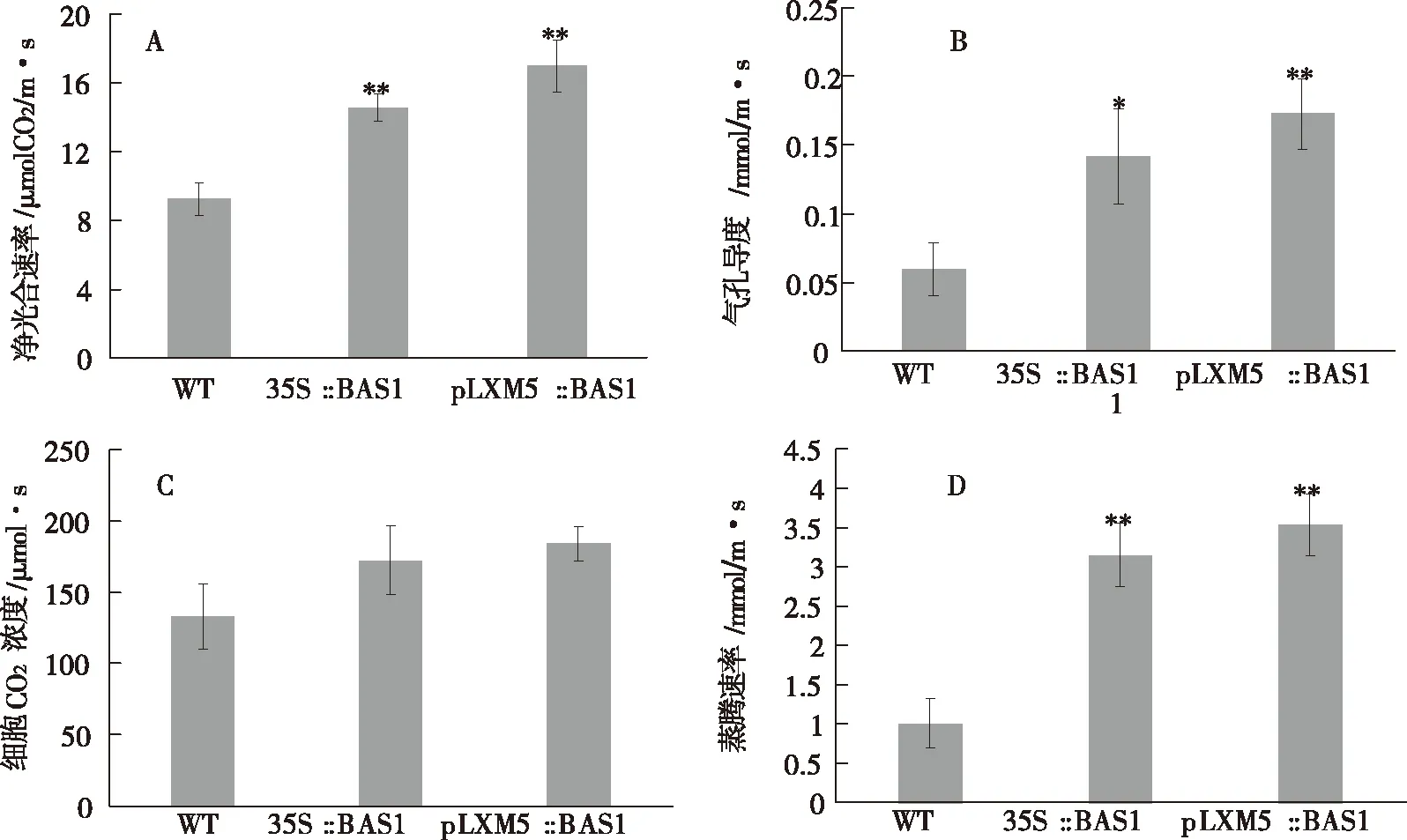
图4 转基因烟草的光合特性Fig.4 The photosynthetic characteristics of transgenic tobaccoA:净光合速率B:气孔导度C:细胞CO2的浓度D:蒸腾速率WT:为野生型
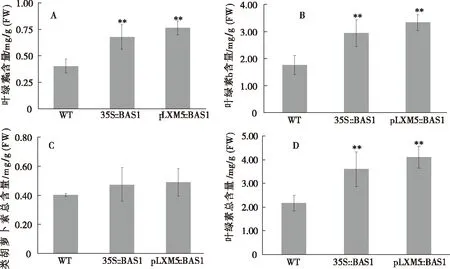
图5 转基因烟草株系叶绿素和类胡萝卜素含量Fig.5 The strain of transgenic tobacco chlorophyll and Carotenoid contentA:叶绿素a;B:叶绿素b;C:类胡萝卜素;D:叶绿素总量;WT:野生型
3 讨论与结论
光合速率是表示植物在单位面积在单位时间内的CO2吸收量,或者是O2释放量,通常情况下植物光合速率值越高,说明植物的生理状态越好[12]。对转基因植株净光合速率测定,发现转35S∷BAS1基因烟草的净光合速率比野生型高57.9%,转pLXM5∷BAS1基因烟草比野生型高84.1%。翁晓燕等[13]用浓度为0.01 mg/L的BRs处理处于抽穗期的水稻,发现水稻净光合速率降低的较慢。而郝建军等[3]用BRs处理玉米幼苗发现在3~6 d中能够增强玉米幼苗的光合速率,骆炳山[14]用BRs溶液处理苗期的大豆,发现大豆叶片的光合速率有所提高。本研究结果表明,适量表达BAS1基因的烟草植株的净光合速率增强,与外施BRs结果相似。其促进植株光合速率的增加主要是适量表达BAS1基因提高了转基因植株叶片叶绿素含量。已有的研究表明,外施BR处理植物幼苗,发现其叶绿素含量发生增加[15-16]。光合作用是植物合成有机物质和获得能量的根本来源,光合作用强度是影响作物生长发育和产量的关键因子。胡文海等[17]研究发现外源eBR之所以能够促进植物的光合作用,是因为其促进了植物光合机构对CO2的利用效率与本实验结果分析中转基因株系细胞间CO2浓度比野生型高结果趋势一致,从而提高植物叶片的光合碳同化能力,增加作物产量。
烟草光合作用强度是决定烟草生长发育,物质积累以及影响产量的一个重要因素,植株形态,光合生理特性和库-源关系又影响光合作用效率。研究转基因烟草的光合效率对高产烟草育种具有重要意义。光合反应中吸收利用光能的主要色素-叶绿素与光合速率之间有着密切的关系[18]。在一定范围内,叶绿素含量的增加可以增强叶绿体对光能的吸收与转化,进而增强光合速率。因此,叶片中叶绿素含量的高低是反映植物光合能力的一个重要指标。本研究结果发现,转基因株系叶绿素总含量比野生型烟草极显著增加,延缓了功能叶片的衰老与符家平等[19]转PSAG12-IPT基因苎麻株系光合性能研究趋势相一致。在相对一致条件下结果分析表明转基因烟草株系比野生型烟草有较高的气孔导度和蒸腾速率,使其能维持较高的光合速率和积累更多的光合作用产物为结实提供需要。证明BAS1基因导入烟草后在叶片中得到了表达使转基因烟草株系的叶绿素含量增加,光合性能得到了有效改善,可能为提高作物产量和品质提供了巨大潜力。
[1]Krishna P. Brassinosteroid-mediated stress responses[J].JournalofPlantGrowthRegulation, 2003, 22 (4): 289-297.
[2]Je B I, Piao H L, Park S J,etal. RAV-Like1 maintains brassinosteroid homeostasis via the coordinated activation of BRI1 and biosynthetic genes in rice[J].ThePlantCell, 2010, 22 (6): 1777-1791.
[3]郝建军, 玄美淑, 何若韫. 油菜素内酯对玉米幼苗光合速率与呼吸速率的影响[J]. 沈阳农业大学学报, 1990, 21 (01): 43-47.
[4]Symons G M, Reid J B. Brassinosteroids do not undergo long-distance transport in pea. Implications for the regulation of endogenous brassinosteroid levels[J].Plantphysiology, 2004, 135 (4): 2196-2206.
[5]Neff M M, Nguyen S M, Malancharuvil E J,etal. BAS1: A gene regulating brassinosteroid levels and light responsiveness in Arabidopsis[J].ProceedingsoftheNationalAcademyofSciences, 1999, 96 (26): 15316-15323.
[6]Choe S. Brassinosteroid biosynthesis and metabolism [M]. Plant Hormones. Springer, 2010: 156-178.
[7]Turk E M, Fujioka S, Seto H,etal. BAS1 and SOB7 act redundantly to modulate Arabidopsis photomorphogenesis via unique brassinosteroid inactivation mechanisms[J].ThePlantJournal, 2005, 42 (1): 23-34.
[8]Ohnishi T, Yokota T, Mizutani M. Insights into the function and evolution of P450s in plant steroid metabolism[J].Phytochemistry, 2009, 70 (17): 1918-1929.
[9]束红梅, 郭书巧, 巩元勇, 等. 油菜素内酯基因 BAS1 根系表达载体的构建及烟草的遗传转化[J]. 生物技术通报, 2015, 31 (6): 106-110.
[10]Horsch R, Fry J, Hoffmann N,etal. A simple and general method for transferring genes into plants[J].Science, 1985, 227 1229-1231.
[11]高俊风. 植物生理学实验指导书[M]. 北京:高等教育出版社, 2006.
[12]Fariduddin Q, Hayat S, Ahmad A. Salicylic acid influences net photosynthetic rate, carboxylation efficiency, nitrate reductase activity, and seed yield in Brassica juncea[J].Photosynthetica, 2003, 41 (2): 281-284.
[13]翁晓燕,蒋德安,陆庆,等. 表油菜素内酯对水稻产量和光合特性的影响[J]. 浙江农业大学学报, 1995, 21 (01): 51-54.
[14]骆炳山. 油菜素内酯对大豆生长及结实性的影响[J]. 植物生理学通讯, 1986(2): 14-17.
[15]周爱清, 骆炳山, 任筱波. 油菜素内酯对水稻幼苗生长及耐冷性的影响[J]. 华中农业大学学报, 1987, 6 (01): 8-13.
[16]郭本森,徐信光. 表油菜素内酯对大麦旗叶生理特性及粒重的影响[J]. 科技通报, 1996, 12 (04): 220-223.
[17]胡文海,黄黎锋, 毛伟华, 等. 油菜素内酯对黄瓜苗期叶片光合机构调节作用的研究[J]. 园艺学报, 2006, 33 (04): 762-766.
[18]李磊, 曾晓芳, 赵德刚. 贵州地方稻种来拢小圆粒半矮秆突变体srd-1筛选及鉴定[J]. 核农学报, 2015, 29 (04): 629-636.
[19]符家平, 汪波, 王辉, 等. 转PSAG12-IPT基因苎麻株系光合性能研究[J]. 湖北农业科学, 2009, 48 (01): 63-65.
Improving photosynthetic characteristics of tobacco plants withBAS1 gene in transgenic Arabidopsis thaliana
YAOXin-zhuan1,2,LVLi-tang1,2*,ZHAODe-gang1,2*
(1.CollegeofLifeSciencesandInstituteofAgro-Bioengineering,GuizhouUniversity,Guiyang,Guizhou550025,China; 2.TheKeyLaboratoryofPlantResourcesConservationandGermplasmInnovationinMountainousRegion,MinistryofEducation,Guiyang,Guizhou550025,China)
In this paper, PCR identification showed that more than 30 transgenic plants with different promoters were obtained, respectively, by using Agrobacterium-mediated method to transformBAS1 gene into tobacco(Nicotiana tabacum xanthin). Photosynthetic characteristics of mature leaves of plants grown in field environment were investigated with transgenic lines and their wild type as materials. Our work demonstrated that transgenic tobacco possessed stronger photosynthetic capacity accompanied by improvement in stomatal conductance, intercellular CO2concentration (Ci) and transpiration rate (Tr). Additionly, the chlorophyll components content was changed, and the total chlorophyll content was significantly higher than that of the wild type. Therefore, transformation ofBAS1 gene could heighten the net photosynthetic rate of tobacco.
BAS1 gene; genetic transformation ;transgenic tobacco; chlorophyll content ; photosynthetic characteristics;
1008-0457(2016)03-0030-05国际DOI编码:10.15958/j.cnki.sdnyswxb.2016.03.005
2016-04-07;修回日期:2016-05-22
国家自然科学基金(No. 31160149)
吕立堂(1976-),博士,副教授,主要研究方向:发育生物学和基因工程,E-mail: lvlitang@163.com;赵德刚(1961-),博士,教授,主要研究方向:基因工程、物生技术等,E-mail: dgzhao@gzu.edu.cn。
Q812
A
