湿生植物根系泌氧能力与其结构相关性研究
2016-08-13杨柳燕宋晓骏
张 权,杨柳燕,高 燕,甘 琳,宋晓骏
(1.污染控制与资源化研究国家重点实验室,江苏 南京 210023; 2.南京大学环境学院,江苏 南京 210023)
湿生植物根系泌氧能力与其结构相关性研究
张权1,2,杨柳燕1,2,高燕1,2,甘琳1,2,宋晓骏1,2
(1.污染控制与资源化研究国家重点实验室,江苏 南京210023; 2.南京大学环境学院,江苏 南京210023)
摘要:为了更好地了解湿生植物对湿地基质供氧能力,对西伯利亚鸢尾、风车草、芦竹和腺柳根系泌氧能力进行研究,并计算湿地植物泌氧能力,为人工湿地不同植物选择提供参考数据。结果表明:在26℃、3 000 lux光照的水培条件下,芦竹根系干重泌氧率最高,达到0.201 mmol/(g·h)。湿生植物植株干重泌氧速率与根重-根长比及植株-根系干重比呈显著正相关(p<0.01),也与根系孔隙度呈显著正相关。除木本植物腺柳外,西伯利亚鸢尾、风车草和芦竹单植株干重的泌氧率与通气组织面积占比呈显著正相关(p<0.01),而与根系表皮层平均厚度呈显著负相关(p<0.01),因此,通气组织发育程度和根系表皮层厚度也是影响湿生植物根系泌氧能力的重要因素。基于试验条件,湿地芦竹泌氧率为38.4 g/(m2·d),湿地腺柳泌氧率为98.3 g/(m2·d),都高于西伯利亚鸢尾和风车草泌氧率。因此,腺柳和芦竹有利于提高湿地基质中氧含量,其根际易于形成好氧环境。
关键词:湿生植物;根系泌氧;根系结构;西伯利亚鸢尾;风车草;芦竹;腺柳
湿地具有净化水质、提高水环境质量和保护水资源的功能,利用人工湿地能有效地去除污水处理厂尾水中氮、磷,实现对低污染水的深度净化。湿生植物作为湿地的重要组成部分,对湿地功能的发挥起着重要作用[1]。在湿地中,湿生植物的根系不仅能吸收水体中氮、磷等营养元素或通过分泌多种小分子有机物为根部微生物生长提供碳源[2],还能通过根系通气组织将光合作用产生的氧气输送到根际基质中。植物根系泌氧能使根系周围基质环境处于好氧状态,改变根际区域的氧化还原电位,有利于根际好氧菌群的生长,促进根际有害物质如PAHs、除草剂和杀虫剂等污染物的生物降解[3-4]。水培植物根系溶解氧浓度变化也明显影响其对水溶液中砷等金属吸收[5]。因此,湿生植物根系泌氧对基质环境有很大的影响,研究不同湿生植物根系泌氧能力具有十分重要意义。
西伯利亚鸢尾(IrissibiricaL.)、风车草(CyperusalternifoliusL.)、芦竹(ArundodonaxL.)和腺柳(SalixchaenomeloidesKimura)是湿地中常见的湿生植物。这4种植物的植株和根系形态存在显著差异。西伯利亚鸢尾为鸢尾科多年生草本,根状茎粗壮,侧根呈绳索状,有皱缩的横纹[6]。风车草属莎草科,多年生草本,丛生,根状茎短且须根木质化[7]。芦竹为禾本科多年生植物,具发达根状茎,茎节具侧根。腺柳属杨柳科柳属,为须根型的小乔木。植物根系形态如根系直径、根长、根系孔隙度及生物量的差异对植物的生长产生明显影响[8-9]。笔者通过对4种植物根系泌氧能力及与根系结构相关性的研究,了解不同湿生植物泌氧能力差异及其影响因素,探索不同湿生植物对湿地基质氧含量影响,为人工湿地构建中植物的选择提供参考依据。
1 材料和方法
1.1试验材料
试验所用的湿生植物西伯利亚鸢尾、风车草、芦竹和腺柳均采自南京大学仙林校区天籁河,用纯水洗净植株根系后,将植物放入含有0.1倍霍格兰德营养液的烧瓶中,在恒温光照植物培养箱内水培预培养2个月。培养箱设置温度为26 ℃,光照强度为3 000 lux,光照与黑暗时间比为16 h∶8 h,预培养期间每4 d更换一次充氧营养液。
1.2试验方法
1.2.1试验条件
为研究温度对植物根系泌氧能力的影响,参考湿地植物生长期的环境温度,设定试验温度为17℃、26℃和32℃,培养箱光照强度为3 000 lux。
1.2.2根系结构测定
取4种湿生植物根系较发达的植株各2株,将根系用超纯水洗净,选取其中粗壮根系,在距根尖50 mm处切长5 mm左右的根段,FAA液固定1d,随后用乙醇梯度脱水并干燥[10],固定喷金后用SEM (S-3400N Ⅱ, 日立公司,日本)观察根系截面结构。
1.2.3根系孔隙度测定
采用Kludze的方法测定根系孔隙度[11]。吸去植物根系表面水分后,取0.3 g根系,将25 mL比重瓶装满水称重,记为P,将0.3 g根系置入比重瓶中,称重记为Pr。然后将装有根系的比重瓶抽真空2 h,取出根系用研钵磨碎后放入比重瓶,装满水后称重记为Pgr。则根系孔隙度可以表示为
式中:Por为根孔隙度,%;r为根重,g。
1.2.4根系泌氧量的测定
采用柠檬酸钛比色法对植物根系泌氧量进行测定[12]。在500 mL烧瓶中加入195 mL 0.1倍的霍格兰德营养液,通入高纯氮15 min除去营养液中氧气。每种植物取生长情况相近的预培养2个月的植株3株,将其所有根系浸没于培养液中进行光照培养,同时设一组无植物的空白对照。在营养液表面缓慢倒入约2 cm厚的液状石蜡,用移液枪吸取5 mL柠檬酸钛溶液,枪头伸入石蜡层下加入并轻微晃匀,上述操作均在氮气吹扫条件下进行。植物组及对照组在恒温培养箱中按设定温度培养3 h后,取营养液样品3 mL在527 nm处进行比色分析,然后计算根系的泌氧量。
1.2.5根长与植株及根系干重
试验结束后将试验植株洗净,每株植物随机选取10条根系,自根系基部或茎节处测量根系长度,用平均长度表示,长度单位为mm。切下植株根系并将主根和侧根分开,然后分别放入烘箱于70℃烘至恒重。分别称量植株干重、根系干重或侧根干重,质量单位为g。
1.3数据分析及计算
1.3.1测量及数据分析
采用AutoCAD 2008对植物根系扫描电镜图的植物根系剖面表皮层厚度和通气组织面积进行测量分析,表皮层厚度用平均值表示。由于植物的光合作用强弱会影响植物氧气由地上部分向根系的输送量,植株干重的泌氧能力比根系干重泌氧能力更能反映植物类型对泌氧能力的影响,因此,利用SPSS 19.0对4种植物植株干重泌氧速率与植株-根系干量比、根重-根长比和根系孔隙度进行Kendall和Spearman相关关系分析。
1.3.2湿地湿生植物泌氧率计算
根据植物根系泌氧速率(root oxygen release rate,Ror)、植株质量(m)等在湿地环境中影响湿生植物泌氧量的主要因素,计算湿地湿生植物泌氧率(oxygen release per unit area,Ora):
式中:t为时间转换系数, d-1;ρ为种植密度,株/m2;M为氧气分子量,32 g/mol;α为湿地半年生植株质量与试验植株质量比,半年生植株采自稳定运行的人工湿地,晾干后称重。
2 结果和讨论
2.1湿生植物根系泌氧能力
由于植株生长情况与根系发达程度存在差异性,植物根系泌氧率(Ror)分别采用根系干重泌氧率Rorr和植株干重泌氧率Rorp2个指标来衡量。在17℃、26℃和32℃条件下,4种湿生植物根系泌氧率如图1所示。由图1可以看出,芦竹的根系干重泌氧率最高,在26℃达到最大值0.201 mmol/(g·h),其次是腺柳,在32℃可以达到0.163 mmol/(g·h)。西伯利亚鸢尾和风车草根系干重最大泌氧量分别是0.079 mmol/(g·h)和0.039 mmol/(g·h),分别为芦竹泌氧率的2/5和1/5。若以植株干重泌氧率进行比较,在26℃、3 000 lux培养条件下,西伯利亚鸢尾、风车草、芦竹和腺柳4种植物的植株干重泌氧率分别达到0.117、0.145、0.232和0.242 mmol/(g·h),这4种湿生植物间泌氧率差异相对变小,腺柳具有较高的植株干重泌氧率。除芦竹外,在不同温度下相同湿生植物植株干重泌氧率无显著性差异,因此,在17~32℃范围内温度变化对湿生植物泌氧能力影响较小。

注:图中字母表示不同植物间的差异性图1 不同温度下湿生植物干重根系泌氧率
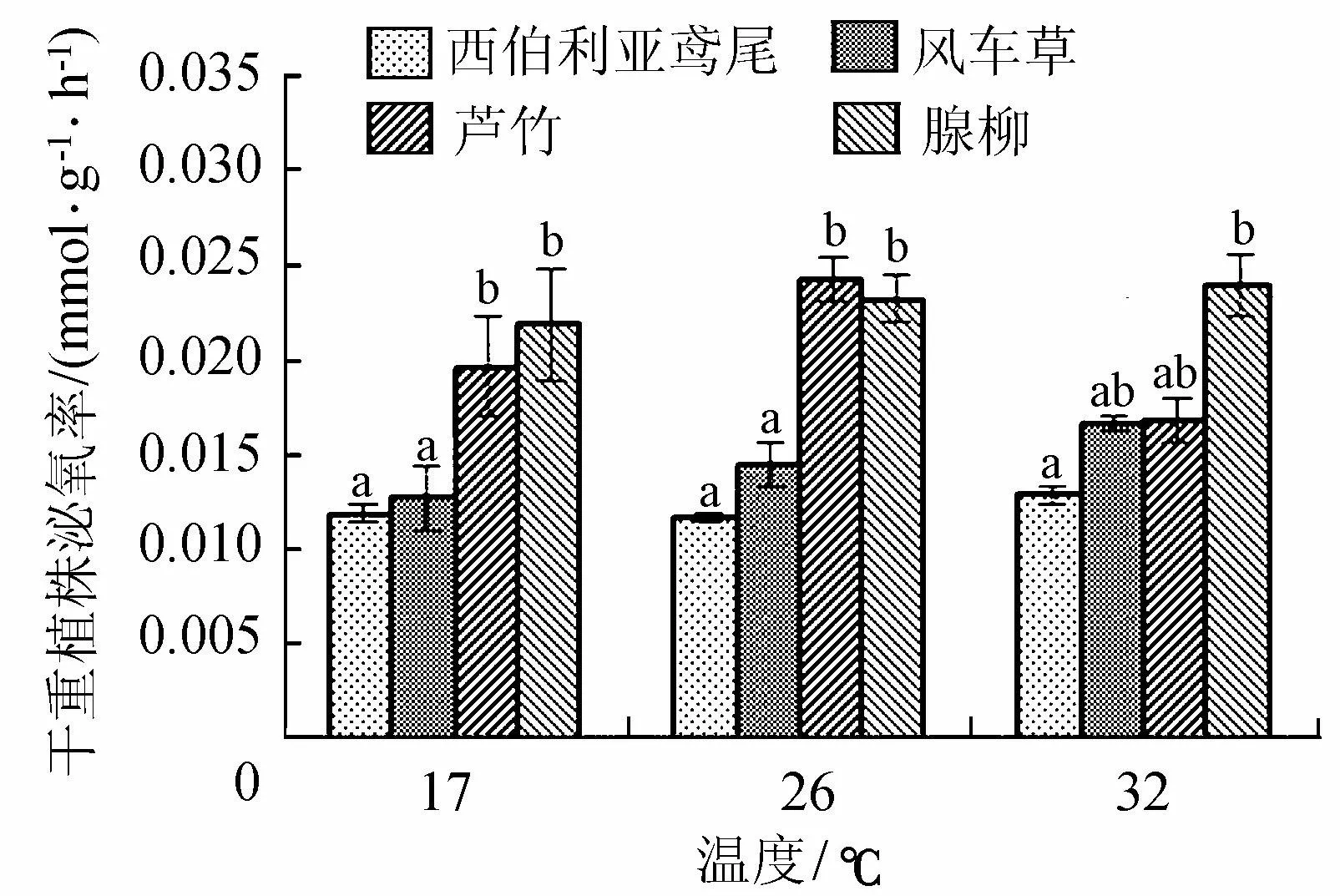
注:图中字母表示不同植物间的差异性图2 不同温度下湿生植物干重植株泌氧率
2.2湿生植物的根系外部结构特征与泌氧率关系
4种湿生植物植株干重、根系干重、平均根长、植株-根系干重比和根重-根长比如表1所示。西伯利亚鸢尾和芦竹属于根茎型植物,因而采用侧根的干重作为植物根系干重指标。
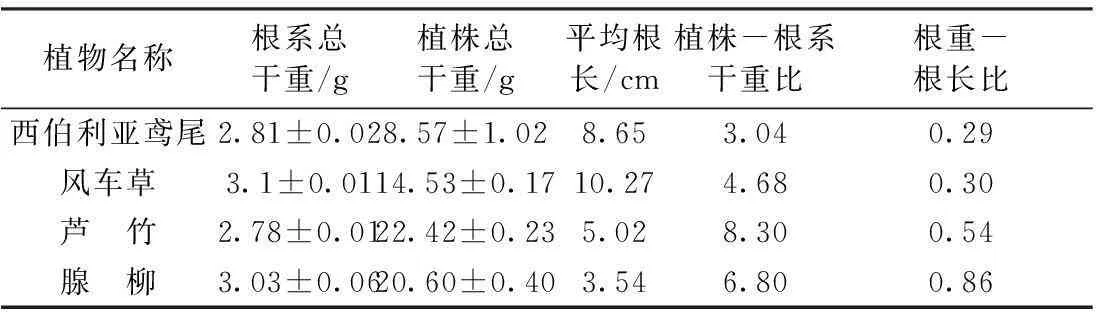
表1 湿生植物植株干重、根系干重、平均根长、植株-根系干重比和根重-根长比
西伯利亚鸢尾和风车草属于低矮丛生型植物,植株-根系干重比分别为3.04和4.68;而芦竹和腺柳植株-根系干重比则分别为8.30和6.80,植株生长末期更高大,芦竹植株株高可达2 m,腺柳株高可达1.5~2.5 m。因此,植株越高大,其植株-根系干重比越大。4种湿生植物根系形态差异较大。根据Chen等[8]的分类,挺水植物可以分为须根型植物和根状茎植物。芦竹、鸢尾为根状茎植物,其地下生物量多数为根状茎,占比可达80%[13-14]。根状茎类植物根系与土壤的接触面积有限,但也使得植物对厌氧环境有了更强的适应能力[15]。因此,它们为了提高与土壤接触面积,形成发达的侧根,如芦竹一级侧根上还会生长大量能够提高根表面积的第二级侧根。风车草和腺柳根系属于须根型,这种类型植物的根系往往具有较大的根表面积,有利于其对无机营养盐的吸收[16],为微生物提供附着的面积也更大[17]。根系发达的须根型植物具有更大的有效泌氧根系面积,一些植物发达的根系也使得须根型植物根系与土壤接触面积更大,能更有效地提高根际湿地的氧含量[18]。同时,腺柳浸没在水中的枝条会生长大量的不定根,有利于泌氧。
4种湿生植物的泌氧能力与植株-根系干量比和根重-根长比的相关性分析结果见表2。根据相关性分析结果,湿生植物植株干重泌氧速率与根重-根长比呈显著正相关(p<0.01)。根重-根长比越大,其根系中侧根的数量往往越多,有效泌氧根系面积就越大,根系外部特征能够有效增加植物的根系泌氧率。植株-根系干重比表征植物光合作用的强弱,与Rorp值也呈现较强的正相关。本研究表明在人工湿地植物选择中,种植须根型植物腺柳以及根系具第二级侧根的湿生植物芦竹更加有利于其根际形成好氧环境。

表2 湿生植物泌氧能力与植株-根系干质量比、根重-根长比和根系孔隙度的相关性
注:*为双尾检验在p<0.05水平上显著,**为双尾检验在p<0.01水平上显著。

图3 湿生植物根系剖面扫描电镜图
2.3湿生植物的根系内部结构特征与泌氧率关系
利用SEM对4种湿生植物的根系截面进行扫描(图3)。对根系中部维管束的面积和根系表皮层的平均厚度进行测量,并计算维管束中通气组织面积占比(表3)。由图2和表3可知,4种湿生植物的根系结构存在显著差异,西伯利亚鸢尾的根表皮层壁厚最大,平均为90 μm,其表皮层细胞排列紧密;而风车草根系表皮层细胞体积较大,排列疏松;芦竹的表皮层细胞排列较为松散,且在根系表面有很多直径2~4 μm的第二级侧根,这有别于其他3种植物根系。根系表皮细胞层厚度越小、表皮细胞体积越大意味着径向泌氧屏障越小,芦竹根系的结构越有利于氧气由根系内部向外扩散。因此,除腺柳外,湿生植物西伯利亚鸢尾、风车草和芦竹植株干重泌氧速率与根系表皮层平均厚度呈显著负相关(p<0.01)。

表3 湿生植物根系孔隙度、通气组织面积占比及根系表皮层平均厚度
植物根系内的通气组织发育程度与其面积占比呈正相关[19]。根系通气组织面积占比越高,植物通过根系向下输送氧气的能力越强。在4种湿生植物根系中,芦竹根系中通气组织的面积比例最大,达到20.54%,而西伯利亚鸢尾和风车草只有其一半。植物的根系孔隙度主要与植物根系结构以及生长环境有关。西伯利亚鸢尾、风车草、芦竹和腺柳的植株干重的Rorp与通气组织面积占比呈显著正相关(p<0.01),腺柳根系结构与红树属根系类似,在根系成熟区通气组织面积占比变大,有利于根系泌氧[20]。
4种湿生植物根系孔隙度在34.9%~52.6%之间,其中风车草和芦竹在根系成熟区皮质层会形成空腔,增大孔隙度。McDonald测得的芦竹根系孔隙度为32.6%,而本研究利用相同方法测量的芦竹根系孔隙度为50.9%,产生差异的主要原因在于两个试验中植物的水培时间不同。常淹水、基质紧实的湿地中植物泌氧能力比未淹水地区植物要高[21-22]。相较于土培,水培的植株根系有更发达的通气组织,以适应水体缺氧环境,水培时间越久的植物,根系内通气组织发育越完善[19]。4种湿生植物的泌氧能力与根系孔隙度的相关性见表2。根据Spearman相关性分析结果,湿生植物植株干重泌氧速率与根系孔隙度呈显著正相关(p<0.01)。其中,根系孔隙度反映了植物根系通气组织的发达程度,与根系向下输氧能力密切相关,能够有效影响植物的根系泌氧率。腺柳虽然根系表皮层厚度达到84 μm,但其根系泌氧能力却高于其他植物,可能孔隙率高是一个重要原因。因此,通气组织发育程度、根系表皮层厚度和孔隙率是影响湿地植物根系泌氧能力的重要因素。
2.4湿地湿生植物泌氧率
根据湿生植物泌氧率和湿地植物的生物量,计算得到湿地西伯利亚鸢尾、风车草、芦竹的泌氧率分别为5.6、9.1和38.4 g/(m2·d),湿地腺柳泌氧率高达98.3 g/(m2·d)。种植4种植物的湿地中,种植腺柳和芦竹湿地产氧率相对较高,尤其是种植腺柳湿地,其存在有利于提高人工湿地基质中溶解氧含量。在不同的试验条件和试验方法下,得到的植物泌氧率差异较大,如成水平等[23]研究表明湿生植物泌氧率约为5~45 g/(m2·d),而美国EPA给出的同类数据为0~3 g/(m2·d)[24]。由于湿地实际运行中自然条件复杂多样,因此,植物根系泌氧率也会有所差异[25]。本研究表明种植腺柳和芦竹能向湿地基质中分泌较多的氧气,有利于基质物质的好氧转化或降解。
3 结 论
a. 在26℃、3 000 lux培养条件下,西伯利亚鸢尾、风车草、芦竹和腺柳4种植物的植株干重泌氧率分别达到0.117、0.145、0.232和0.242 mmol/(g·h)。芦竹和腺柳具有较高的根系泌氧率。
b. 在不同植物根系类型中,须根型植物腺柳以及具第二级侧根的植物芦竹泌氧量更高。影响根系泌氧量的因素除了根系形态,还有植株-根系干重比、根重-根长比、根系表皮层厚度和根系孔隙度,其中最主要影响因素为植物根系的孔隙度和根系的根重-根长比。
c. 芦竹根系泌氧率约为38.4 g/(m2·d),腺柳根系泌氧率约为98.3 g/(m2·d),较西伯利亚鸢尾和风车草根系泌氧率高,因此,在人工湿地中腺柳和芦竹等根系发达的植物能更有效提高湿地基质氧含量,有利于根际好氧微生物群落的形成和对污染物的好氧降解。
参考文献:
[1] 周艳丽,佘宗莲,孙文杰.水平潜流人工湿地脱氮除磷研究进展[J].水资源保护,2011,27(2): 42-48.(ZHOU Yanli,SHE Zonglian,SUN Wenjie.Progress of research on removal of nitrogen and phosphorus in horizontal sub-surface flow constructed wetlands[J].Water Resources Protection,2011,27(2): 42-48.(in Chinese))
[2] 陆松柳,张辰,徐俊伟.植物根系分泌物分析及对湿地微生物群落的影响研究[J].生态环境学报,2011,20(4): 676-680.(LU Songliu,ZHANG Chen,XU Junwei.Root exudates of wetland plants and the influence on the microbial communit in constructed wetlands[J].Ecology and Environmental Sciences,2011,20(4): 676-680.(in Chinese))
[3] 吕晓磊.有毒污染物在小清河人工湿地的时空分布特征及土壤微生物的环境响应[D].哈尔滨:哈尔滨工业大学,2012.
[4] SMITH K E,LUNA T O.Radial oxygen loss in wetland plants: potential impacts on remediation of contaminated sediments[J].Journal of Environmental Engineering,2013,139(4): 496-501.
[5] MEI X Q,YE Z H,WONG M H.The relationship of root porosity and radial oxygen loss on arsenic tolerance and uptake in rice grains and straw[J].Environmental Pollution,2009,157(8): 2550-2557.
[6] 王冠群.德国鸢尾耐寒性与根状茎生长发育化学调控研究[D].杭州:浙江大学,2014.
[7] 陈章和,陈芳,刘谞诚,等.测定潜流人工湿地根系生物量的新方法[J].生态学报,2007,27(2): 668-673.(CHEN Zhanghe,CHEN Fang,LIU Xucheng,et al.A new method for root biomass measurement in subsurface flow gravel-bed constructed wetlands[J].Acta Ecologica Sinica,2007,27(2): 668-673.(in Chinese))
[8] CHEN Weiyin,CHEN Zhanghe,HE Qifan,et al.Root growth of wetland plants with different root types[J].Acta ecologica sinica,2007,27(2): 450-457.
[9] CHEN Zhanghe,CHEN Fang,CHEN Xiuyan,et al.Researches on macrophyte roots in the constructed wetlands (a review)[J].Current Topics in Plant Biology,2004,5: 131-142.
[10] PIRANI C,BUONAVOGLIA A,CIRULLI P P,et al.The effect of the NRT files instrumentation on the quality of the surface of the root canal wall[J].Journal of Applied Biomaterials & Biomechanics,2012,10(2):136-140.
[11] KLUDZE H K,DELAUNE R D,PATRICK W H.A colorimetric method for assaying dissolved oxygen loss from container-grown rice roots[J].Agronomy Journal,1994,86(3): 483-487.
[12] RASKIN I.A method for measuring leaf volume,density,thickness,and internal gas volume[J].Hort Science,1983,18(5): 698-699.
[13] TANNER C C.Growth and nutrient dynamics of soft-stem bulrush in constructed wetlands treating nutrient-rich wastewaters[J].Wetlands Ecology and Management,2001,9(1): 49-73.
[14] CHENG X Y,CHEN W Y,GU B H,et al.Morphology,ecology,and contaminant removal efficiency of eight wetland plants with differing root systems[J].Hydrobiologia,2009,623(1): 77-85.
[15] KYAMBADDE J,KANSIIME F,GUMAELIUS L,et al.A comparative study of Cyperus papyrus and Miscanthidium violaceum-based constructed wetlands for wastewater treatment in a tropical climate[J].Water Research,2004,38(2): 475-485.
[16] LAI W L,WANG S Q,PENG C L,et al.Root features related to plant growth and nutrient removal of 35 wetland plants[J].Water Research,2011,45(13): 3941-3950.
[17] 李丽.11种湿地植物在污染水体中的生长特性及对水质净化作用研究[D].广州:暨南大学,2011.
[18] OSEM Y,CHEN Y,LEVINSON D,et al.The effects of plant roots on microbial community structure in aerated wastewater-treatment reactors[J].Ecological Engineering,2007,29(2): 133-142.
[19] MCDONALD M P,GALWEY N W,COLMER T D.Similarity and diversity in adventitious root anatomy as related to root aeration among a range of wetland and dryland grass species[J].Plant,Cell & Environment,2002,25(3): 441-451.
[20] PI N,TAM N F Y,WU Y,et al.Root anatomy and spatial pattern of radial oxygen loss of eight true mangrove species[J].Aquatic Botany,2009,90(3): 222-230.
[21] JACKSON M B,ARMSTRONG W.Formation of aerenchyma and the processes of plant ventilation in relation to soil flooding and submergence[J].Plant Biology,1999,1(3): 274-287.
[22] PEZESHKI S R.Wetland plant responses to soil flooding[J].Environmental and Experimental Botany,2001,46(3): 299-312.
[23] 成水平,吴振斌,夏宜琤.水生植物的气体交换与输导代谢[J].水生生物学报,2003,27(4): 413-417.(CHENG Shuiping,WU Zhenbin,XIA Yizheng.Review on gas exchange and transportation in macrophytes[J].Acta Hydrobiologica Sinica,2003,27(4): 413-417.(in Chinese))
[24] U S Environmental Protection Agency.Constructed wetlands treatment of municipal waste waters[EB/OL].[2015-06-08].https://www.epa.gov/wetlands/constructed-wetlands.
[25] 程康睿,朱伟,董婵,等.水力条件对芦苇湿地系统DO质量浓度的影响[J].水资源保护,2014,30(3): 76-80.(CHENG Kangrui,ZHU Wei,DONG Chan,et al.Effects of different hydraulic conditions on DO concentration in Phragmites austrclis wetland[J].Water Resources Protection,2014,30(3): 76-80.(in Chinese))
DOI:10.3880/j.issn.1004-6933.2016.04.019
基金项目:太湖水污染治理专项(TH2014205);国家水体污染控制与治理重大专项(2012ZX07101006)
作者简介:张权(1991—),男,硕士研究生,研究方向为污染水体的生态治理。E-mail:766118010@qq.com 通信作者:杨柳燕,教授。 E-mail:yangly@nju.edu.cn
中图分类号:Q945.79
文献标志码:A
文章编号:1004-6933(2016)04-0117-05
(收稿日期:2015-10-15编辑:徐娟)
Oxygen release abilities of wetland plants’ roots and relation with root structures
ZHANG Quan1,2, YANG Liuyan1,2,GAO Yan1,2, GAN Lin1,2, SONG Xiaojun1,2
(1. State Key Laboratory of Pollution Control and Resource Reuse, Nanjing 210023, China;2.SchooloftheEnvironment,NanjingUniversity,Nanjing210023,China)
Abstract:In order to obtain a better understanding of wetland plants’ ability of to provide oxygen to wetland substrate, the oxygen release abilities of roots of wetland plants including Iris sibirica L., Cyperus alternifolius L., Arundo donax L., and Salix chaenomeloides Kimura were examined. The wetland plants’ abilities to release oxygen were calculated, providing references for properly selecting plants for artificial wetlands. The results show that Arundo donax L. had the highest root oxygen release rate per root dry weight, which was 0.201 mmol/(g·h) at 26 ℃ and 3 000 lux. The oxygen release rate per root dry weight had a significantly positive correlation with the ratio of the root weight to the root length and the ratio of the plant dry weight to the root dry weight (p < 0.01), and it also had a significantly positive correlation with the root porosity. The root oxygen release rates per plant dry weight of Iris sibirica L., Cyperus alternifolius L., and Arundo donax L. had significantly positive correlations with proportional area of aerenchyma (p<0.01), and significantly negative correlations with the average thickness of the epidermis (p<0.01), indicating that the development of aerenchyma and the thickness of the epidermis are also important factors influencing the root oxygen release ability of wetland plants. Under the experimental conditions, the oxygen release rates of Arundo donax L. and Salix chaenomeloides Kimura were 38.4 g/(m2·d) and 98.3 g/(m2·d), respectively, both of them being higher than those of Iris sibirica L. and Cyperus alternifolius L. Thus, planting Salix chaenomeloides Kimura and Arundo donax L. helps improve the oxygen content in the wetland substrate, forming the aerobic environment in the rhizosphere.
Key words:wetland plants; root oxygen release; root structure; Iris sibirica L.; Cyperus alternifolius L.; Arundo donax L.; Salix chaenomeloides Kimura
