猪瘟病毒E0基因检测方法的建立及甘肃河西地区E0基因特征分析
2016-08-13陈绍博曾巧英甘肃省兽医局甘肃兰州730030甘肃农业大学动物医学院甘肃兰州730030
陈绍博,曾巧英(.甘肃省兽医局,甘肃 兰州 730030;2.甘肃农业大学动物医学院,甘肃 兰州 730030)
猪瘟病毒E0基因检测方法的建立及甘肃河西地区E0基因特征分析
陈绍博1,曾巧英2*
(1.甘肃省兽医局,甘肃 兰州 730030;2.甘肃农业大学动物医学院,甘肃 兰州 730030)
为给甘肃地区猪瘟的防控和检测提供参考资料,本研究根据典型猪瘟病毒的E0基因设计引物,建立猪瘟RT-PCR检测方法,并评估其特异性,同时用该方法检测甘肃河西地区猪瘟的流行状况,通过基因测序分析E0基因序列特征。建立的猪瘟RT-PCR检测方法对猪瘟病毒cDNA检测为阳性,而对其他病毒cDNA检测为阴性,甘肃省河西地区猪瘟流行广泛存在,流行率为26.92%,且流行毒株核苷酸同源性为80.2%~96.3%;氨基酸同源性为73.0%~95.4%。结果表明本研究建立的猪瘟RT-PCR检测方法特异性强,且甘肃河西地区猪瘟的流行毒株E0基因进化高度保守。
猪瘟;RT-PCR;E0;甘肃
猪瘟(Classical swine fever,CSF) 是猪瘟病毒(Classical swine fever virus,CSFV)引起的急性病毒学传染病,具有较高的发病率和死亡率[1-3]。世界各国均有CSF分布,其中养猪较多的国家感染更为严重,可造成严重的农业经济损失[2]。CSFV为含有一个正向单链RNA且被囊膜包裹的病毒粒子,分类学上属于黄病毒科、瘟病毒属重要成员。CSFV基因组长度约为12.3 kb,但在长期流行过程中,CSFV的稳定性较高,仅有较少的核苷酸发生改变[4,5],其中E0基因作为一种具有多功能的结构蛋白,可编码糖膜,诱导机体产生中合体[6],长期进化过程中E0一直保持RNase活性,介导宿主淋巴细胞的凋亡而使宿主产生免疫抑制导致持续感染[6],这些机制表明CSFV感染致病过程中E0基因发挥着重要作用。RT-RCR作为现代诊断技术之一,在CSFV诊断技术中敏感性最强,而E0基因进化过程中高度保守,是CSFV分子诊断方法建立的重要靶基因,但CSFV流行过程中,随着感染时间的推移病毒基因的变异不能忽视。因此本研究试图通过E0基因优化CSFV的 RT-PCR检测方法,建立更加稳定、准确的CSFV检测方法,同时利用该方法分析甘肃河西地区CSFV的流行状况及E0基因序列特征,为CSF防控提供可靠数据。
1 材料与方法
1.1材料
1.1.1病毒猪瘟病毒参考株为疫苗毒株,参照毒株猪细小病毒(Porcine parvovirus,PPV)、牛病毒性腹泻黏膜病毒(Bovine viral diarrhea virus,BVDV)、猪圆环病毒(Porcine circovirus,PCV)等毒株都由甘肃省动物疫病预防控制中心提供。
1.1.2病料疑似猪瘟病毒感染组织病料由甘肃省动物疫病预防控制中心采集、共计52份,其中武威10份、张掖14份、酒泉11份、嘉峪关8份,金昌9,病料组织主要为动物肝脏,置于-70℃保存。
1.1.3主要试剂动物组织总RNA提取试剂盒、反转录试剂盒、PCR mix、PCR产物胶回收试剂盒均为OMEGA公司;PMD-18T载体、T4DNA ligase、DH5α大肠杆菌感受态细胞均购自TaKaRas生物公司。
1.1.4引物设计与合成根据 Genbank中已公布的CSFV全基因组序列采用Mega6.0软件分析其保守性,通过Primer5.0软件设计可以扩增CSFV E0基因序列的上下游引物E0-F:TACCAACCAGTTGAAGCCGA和E0-R TCTTTCCGTCTTCCGCGTTA,与其扩增片段为835bp,由华大基因(北京)公司合成,用DEPC水将其稀释终浓度为25 μmol/L,-20℃保存备用。
1.2方法
1.2.1病毒RNA的提取及反转录 参照总RNA提取试剂盒说明书分别从病毒毒株或病料中提取总RNA,溶解于20μL的ddH2O中,参照反转录试剂盒说明书合成cDNA,-20℃保存。
1.2.2E0基因的PCR检测用设计的引物检测不同病毒,PCR反应体系为2×PCR Mix10 μl、上下游引物各0.5 μl、cDNA模板1 μl、ddH2O 8 μl,总反应体积20 μl。PCR反应程序为:95℃5 min;95℃30 s,60℃30 s,72℃1 min,反应35个循环;最后延伸72℃10 min,反应结束后取PCR产物进行凝胶电泳,凝胶浓度为12 mg/ml,120V电泳30 min,凝胶成像系统呈像观察。
1.2.3病料中E0基因的PCR检测用以上建立的E0基因PCR检测方法对收集的52份病料进行检测,每个地区随机选取1株E0基因为阳性的PCR产物,用胶回收试剂盒回收PCR扩增的条带,将回收DNA用PMD-18T载体和T4DNA ligase进行连接,转入DH5α大肠杆菌感受态细胞中,经Amp+平板筛选,选取单个菌落进行培养,并对菌液进行PCR检测,阳性菌液送华大基因生物公司进行测序。同时分析不同地区病料中E0基因的阳性比率。
1.2.4 E0基因和氨基酸的序列比对分析用DNAstar 和Mega 6.0软件,将本研究获得阳性猪瘟病毒E0基因与Genbank发表的国内外典型猪瘟代表株进行核苷酸和氨基酸同源性比较,构建进化树。
2 结果
2.1 E0基因的PCR检测结果
以不同的病毒cDNA和超纯水为模板,PCR扩增产物经琼脂糖凝胶电泳表明,只有以猪瘟病毒为模板的PCR反应可检测出835 bp的目的条带,与预期大小一致(图1),其他3种毒株和超纯水为模板的反应中未见扩增条带(图1),表明所建立的E0基因的PCR检测方法具有较强的特异性。
2.2不同地区疑似病料CSFV检测
用建立的E0基因PCR检测方法检测甘肃省河西地区武威(10份)、张掖(14份)、酒泉(11份)、嘉峪关(8份)、金昌(9份)5市疑似CSF的动物肝脏组织,PCR扩增产物经凝胶电泳显示共有14份病料为阳性,阳性率为26.92%(14/52);其中武威2份(图2D)、张掖4份(图2E)、酒泉3份(图2C)、嘉峪关2份(图2A)、金昌3份(图2B)、,阳性率分别为20.00% (2/10);28.57%(4/14)、27.27%(3/11)、33.33%(3/9)和25.00%(2/4)。

图1 CSFV E0基因RT-PCR检测方法的特异性M:DNA maker(2000bp);1-5分别为CSFV,PPV,BVDV,PCV和水的RT-PCR检测结果.

图2 甘肃河西不同地区疑似病料RT-PCR检测结果A:嘉峪关;B:金昌;C:酒泉;D:武威;E:张掖
2.3不同地区CSFV E0基因测序
随机选取一份甘肃省河西地区5市E0基因为阳性的病料PCR产物,胶回收产物用PMD-18T载体和T4DNAligase进行连接转化感受态细胞后菌液进行E0基因PCR检测,发现5份菌液均可检测到835 bp的扩增条带(图3),测序后获得5株CSFV流行毒株的E0基因序列,分别命名为GSWW01-E0、GSZY01-E0、GSJQ01-E0、GSJYG01-E0和GSJC01-E0。
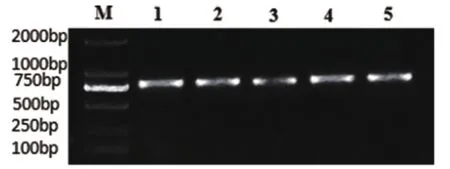
图3 部分CSEV阳性菌业RT-PCR检测鉴定M:DNA maker(2000bp);1-5分别为嘉峪关、酒泉、金昌、武威和张掖部分CSFV毒株RT-PCR检测结果
2.4核苷酸和氨基酸同源性分析
将本研究中得到的5株甘肃CSFV毒株E0基因序列与Genbank中的典型毒株HCLV(No.AF091507.01)、YI9908(No.KT716271.1)、CSFV-GZ-2009(HQ380231. 1)、Riems(AY259122.1)的E0基因核苷酸和氨基酸序列同源性比对如图4所示:基因序列分析可知与HCLV、HuN23/2013、CSFV-GZ-2009、Riems的序列同源性分别为:80.2%~96.3%;转化后的氨基酸同源性分别为:73.0%~95.4%;表明研究的甘肃5株CSFV毒株E0基因发生了一定的变异,但差异不大,其5株间的E0基因也存在一定变异。
从系统进化树中可以看出甘肃流行毒株均分布于独立的亚枝,在遗传关系上与CSFV-GZ-2009亲缘性接近,而YI9908的进化关系较远。
2.5 E0蛋白Rnase活性区域氨基酸分析
E0蛋白中两个具有Rnase活性的氨基酸序列别为:SLHGIWPE和EWNKHGWC,在甘肃5株E0蛋白的氨基酸序列分别位于28-35位和75-82位(图6)。分析发现甘肃5株CSFV毒株E0蛋白的SLHGIWPE基因相同,参考毒株HCLV和Riems的第35个氨基酸发生改变,E变为G。而EWNKHGWC氨基酸中GSJC01-E0的第75个氨基酸发生改变,E变为K,其他毒株氨基酸序列没有变化。

图4 不同CSFV毒株EO核苷酸、氨基酸同源性比对A:核苷酸同源性;B:氨基酸同源性

图5 甘肃河西地区CSFV流行毒株与参考毒株EO基因系统进化树

图6 CSFVEO蛋白两个Rnase活性区域的氨基酸序列比较
3 讨论
CSFV作为危害养猪业的重大疾病之一、建立其快速的检测方法对于该病的防控具有重要意义。目前农业部门关于CSFV的检测方法较多,比如酶联免疫
[1]Edwards S,Fukusho A,Lefevre P-C,et al.Classical swine fever:the global situation[J].Veterinary microbiology,吸附实验、免疫胶体金技术和RT-RCR技术[7]。目前RT-RCR技术已经作为病毒感染分子检测方法之一,其具有快速、敏感、特异性强等优点[8]。因此在我国不同省份常用该技术检测CSFV的流行状况[3,6],但不同的学者针对CSFV检测方法的建立采取了不同的靶基因,如E2、NS5B和3’-UTR基因等。本研究基于E0基因在进化中高度保守,通过分析CSFV典型毒株E0基因的序列特征,建立CSFV RT-PCR检测方法,实验结果表明本研究建立的方法特异性强,可用于猪瘟的检测、对猪细小病毒等反应均为阴性。
应用建立的CSFV RT-PCR检测方法分析甘肃省河西地区疑似病猪中CSFV的流行状况结果显示52份病料中14份病料为阳性,阳性率为26.92%,且张掖、嘉峪关、酒泉、武威、金昌均处在阳性病料,表明CSFV在河西地区广泛存在,最高感染率为33.33%,最低为20.00%,可见在甘肃猪瘟也作为猪场防控的重要疫病不能被忽视,这样结果与其他省份猪瘟的流行状况相似[9,10]。同时通过随机挑选进行基因测序表明本研究建立的猪瘟CSFV的检测方法的可用于甘肃地区猪瘟感染的流行病学分析。
近年,由于长期免疫CSFV使CSFV基因在一定程度上发生突变,从而造成免疫失败[9,11],而在CSFVE0蛋白中存在两个具有Rnase活性的氨基酸序列,这与病毒可以持续感染机体存在一定的关系,而且在病毒复制过程中发挥作用[12],因此研究CSFVE0蛋白的分子特征具有重要意义。本研究通过分析5株CSFV E0蛋白的基因和氨基酸序列,其与典型毒株的核苷酸同源性为80.2%~96.3%,氨基酸同源性为73.0%~95.4%,可见同源性较高,可能为相似毒株感染所致,但5株之间的核苷酸和氨基酸也存在一定的差异,这种差异是否会导致致病差异有待研究。分析发现甘肃5株CSFV毒株E0蛋白的SLHGIWPE基因相同,参考毒株HCLV和Riems的第35个氨基酸发生改变,E变为G。而EWNKHGWC氨基酸中GSJC01-E0的第75个氨基酸发生改变,E变为K,其他毒株氨基酸序列没有变化,这种差异是否会导致毒性差异也需确认。
总之,本研究根据猪瘟病毒基因组中高度保守的E0蛋白核苷酸序列,建立了RT-PCR快速检测方法,检测结果特异性较高,该方法检测甘肃省河西地区CSFV感染结果表明该地区广泛存在CSFV感染,感染率为26.92%,且该地区流行CSFV的E0基因同源性较高,可能为相似病毒感染。
2000,73(2):103-19.
[2]Moennig V.The control of classical swine fever in wild boar[J].Frontiers in microbiology,2015,(6).
[3]吴旭锦,朱小甫.猪瘟病毒RT-nPCR检测方法的建立及陕西部分地区猪瘟病毒E0基因分子特征分析 [J].西北农林科技大学学报(自然科学版),2014,10(005).
[4]Leifer I,Hoffmann B,Hper D,et al.Molecular epidemiology of current classical swine fever virus isolates of wild boar in Germany[J].Journal of General Virology,2010,91(11):2687-97.
[5]Postel A,Schmeiser S,Bernau J,et al.Improved strategy for phylogenetic analysis of classical swine fever virus based on full-length E2 encoding sequences[J].Vet Res,2012,43(1):50.
[6]曾咏芳,曹佳媛,杨可妍,等.猪瘟病毒广西流行毒株E0基因的克隆与分析[J].动物医学进展,2015,36(1):31-5.
[7]涂长春.猪瘟国际流行态势,我国现状及防制对策[J].中国农业科学,2003,36(8):955-60.
[8]段震,刘景华.动物病毒学第二版[M].北京:科学出版社,l997.
[9]王琴,徐璐,范学政,等.2011年我国部分地区猪瘟病毒分子流行病学研究[J].中国兽医杂志,2014,(7):3-5.
[10]宋建国,韩庆彦,王佳,等.甘肃省猪瘟流行史及其现状[J].畜牧与兽医,2012,11(24).
[11]王博扬,邵卫星,吕占军,等.2012年我国部分地区猪瘟流行病学调查及E2部分基因遗传演化分析[J].动物医学进展,2014,35(5):50-56.
[12]Van Gennip H,Hesselink A,Moormann R,et al.Dimerisation of glycoprotein Erns of classical swine fever virus is not essential for viral replication and infection[J].Archives of virology,2005,150(11):2271-86.
(编辑:高真贞)
S852.65+1
A
1006-799X(2016)11-0065-03
国家自然科学基金项目(31260616),甘肃农业大学伏羲杰出人才项目。
陈绍博(1984-),男,甘肃景泰人,硕士研究生,研究方向为兽医微生物与免疫学。
曾巧英(1968-),女,博士,教授,研究方向为动物疫病的分子致病机理及免疫防制。
