美味猕猴桃品种‘金魁’离体叶片不定芽诱导及生根培养基筛选
2016-08-12黄胜男张计育毛妮妮宣继萍贾晓东郭忠仁
黄胜男, 张计育, 毛妮妮, 王 刚, 宣继萍, 贾晓东, 翟 敏, 郭忠仁,①
〔1. 江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014; 2. 江苏丘陵地区镇江农业科学研究所, 江苏 镇江 212400〕
美味猕猴桃品种‘金魁’离体叶片不定芽诱导及生根培养基筛选
黄胜男1, 张计育1, 毛妮妮2, 王刚1, 宣继萍1, 贾晓东1, 翟敏1, 郭忠仁1,①
〔1. 江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京 210014; 2. 江苏丘陵地区镇江农业科学研究所, 江苏 镇江 212400〕
美味猕猴桃; 离体叶片; 诱导培养基; 生根培养基
猕猴桃(Actinidiaspp.)果实酸甜适中,含丰富的VC和多种矿质元素及氨基酸,其种子中还含有大量的亚麻酸、不饱和脂肪酸等成分[1],被誉为“水果之王”。湖北省农业科学院果茶蚕桑研究所从野生猕猴桃品种‘竹溪2号’(‘Zhuxi No. 2’)中实生驯化选育出美味猕猴桃〔Actinidiachinensisvar.deliciosa(A. Chev.) A. Chev.〕品种‘金魁’(‘Jinkui’)[2],其果实耐贮性强[3]、植株较抗涝,适宜在易涝地区种植。
猕猴桃属植物为雌雄异株植物,采用种子播种的繁殖方式易造成品种退化,难以保持母本的优良性状[4];而采用嫁接和扦插的繁殖方法则分别存在周期长、成活率低等问题[5],并且在栽培过程中易发生病害[6]。采用组织培养法获得的试管苗能保持品种的优良性状,且性状稳定、繁殖速度快[7]。作者以美味猕猴桃品种‘金魁’组培无菌苗叶片为实验材料,对其不定芽诱导培养基及生根培养基进行筛选,以期建立高频遗传转化体系,为猕猴桃优良品种的繁殖推广奠定基础。
1 材料与方法
1.1材料
美味猕猴桃品种‘金魁’ 种植于江苏省中国科学院植物研究所经济植物研究中心实验基地,于2015年2月从田间剪取枝条进行水培,待长出新芽后剥去新芽的鳞片和展开的叶片,在无菌操作台上依次用体积分数75%乙醇处理30 s,质量体积分数0.1%HgCl2处理8 min,无菌水冲洗5遍;吸干表面水分后,接种到添加了2.0 mg·L-16-BA 和0.1 mg·L-1NAA的MS培养基(含30 g·L-1蔗糖和5.6~5.8 g·L-1琼脂粉, pH 5.8)上, 在温度(22±2) ℃、 光照时间16 h·d-1、 光照度1 500 lx条件下培养获得无菌苗, 培养3或4代后进行实验。
1.2方法
1.2.1不定芽诱导培养基的筛选以MS培养基为基本培养基,分别添加2.0和3.0 mg·L-16-BA以及0.1、0.2和0.3 mg·L-1NAA,共6种激素组合。以上述无菌苗叶片为外植体,每种培养基接种12个外植体(接种2瓶,每瓶6个),重复3次。在上述培养条件下先暗培养21 d(经预实验确定),再光照培养14 d后统计再生不定芽的外植体数和不定芽再生率。
1.2.2不定芽生根培养基的筛选将叶片上再生的不定芽分别接种到添加0.5、0.6、0.7和0.8 mg·L-1IBA的1/2MS培养基上。每种培养基接种12个不定芽(接种2瓶,每瓶6个),重复3次。在上述培养条件下光照培养28 d后,统计生根的不定芽数和不定芽生根率。
1.3数据处理
按照公式“再生率=(再生不定芽的外植体数/接种的外植体数)×100%”;“生根率=(生根的不定芽数/接种的不定芽数)×100%”计算不定芽的再生率和生根率;并采用SPSS 16.0软件进行单因素方差分析(one-way ANOVA,P=0.05)。
2 结果与分析
2.1不定芽诱导培养基的筛选结果
在添加不同质量浓度6-BA和NAA的MS培养基上诱导美味猕猴桃品种‘金魁’离体叶片再生不定芽。6种激素水平下,‘金魁’离体叶片不定芽的再生状况见表1。‘金魁’离体叶片的再生过程见图1。
由表1可见:在含有3.0 mg·L-16-BA和0.2 mg·L-1NAA的MS培养基上,不定芽再生率最高,达到94.4%,基本上显著高于其他培养基(P=0.05),且不定芽数量最多、长势最好,茎叶分化最为明显;在含有3.0 mg·L-16-BA和0.1 mg·L-1NAA的MS培养基上,不定芽再生率也较高,为83.3%,且不定芽数量也较多、长势较好;而在含有2.0 mg·L-16-BA和0.1 mg·L-1NAA的MS培养基上,不定芽再生率最低,为41.7%,基本上显著低于其他培养基,且不定芽数量少、长势较差。因此,‘金魁’离体叶片不定芽诱导的最适培养基为含有3.0 mg·L-16-BA和0.2 mg·L-1NAA的MS培养基。
表1在含有不同质量浓度6-BA和NAA的MS培养基上美味猕猴桃品种‘金魁’离体叶片不定芽再生状况的比较1)
Table 1Comparison on regeneration status of adventitious buds frominvitroleaf of cultivar ‘Jinkui’ ofActinidiachinensisvar.deliciosa(A. Chev. ) A. Chev. on MS media containing different mass concentrations of 6-BA and NAA1)
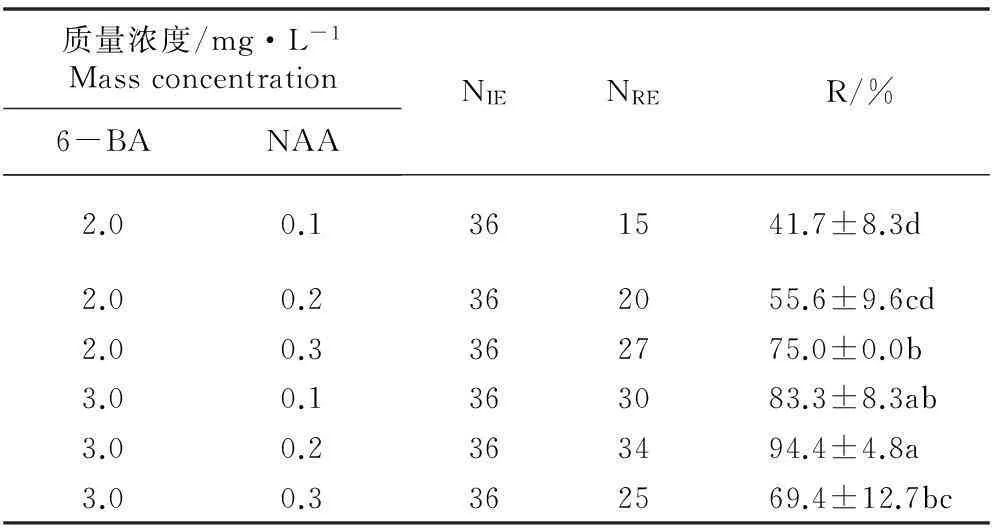
质量浓度/mg·L-1Massconcentration6-BANAANIENRE R/%2.00.1361541.7±8.3d2.00.2362055.6±9.6cd2.00.3362775.0±0.0b3.00.1363083.3±8.3ab3.00.2363494.4±4.8a3.00.3362569.4±12.7bc
1)NIE: 接种的外植体数Number of inoculated explants; NRE: 再生不定芽的外植体数Number of explants with adventitious bud; R: 不定芽再生率Regeneration rate of adventitious bud. 同列中不同的小写字母表示差异显著(P=0.05) Different small letters in the same column indicate the significant difference (P=0.05).

A: 接种的离体叶片Inoculatedinvitroleaves; B: 经光照培养后形成的不定芽Adventitious buds formed by light culture; C: 由单个不定芽形成的丛生芽Multiple buds from single adventitious bud; D: 生根的不定芽 Adventitious buds rooted.
图1美味猕猴桃品种‘金魁’离体叶片的再生过程
Fig. 1Regeneration process ofinvitroleaf of cultivar ‘Jinkui’ ofActinidiachinensisvar.deliciosa(A. Chev. ) A. Chev.
将 ‘金魁’的离体叶片接种到不定芽诱导的最适培养基上暗培养20 d后,离体叶片即可再生出嫩绿色小芽,转入光照培养后小芽渐变成深绿色(图1-A,B);培养35 d后可长成丛芽(图1-C)。
2.2不定芽生根培养基的筛选结果
在添加不同质量浓度IBA的1/2 MS培养基上诱导美味猕猴桃品种‘金魁’不定芽的生根,其生根状况见表2。
由表2可见:随着IBA浓度的逐渐升高,‘金魁’不定芽的生根率逐渐升高,其中,在含有0.7 mg·L-1IBA的1/2MS培养基上不定芽的生根效果最好,培养35 d后生根率达到100.0%,生根率显著高于其他培养基(P=0.05),且不定根数量最多;而当IBA浓度达到0.8 mg·L-1时,生根率又出现降低的情况(仅为55.6%),这说明IBA浓度过高会对‘金魁’不定芽生根产生一定的抑制作用。因此,‘金魁’不定芽生根的最适培养基为含有0.7 mg·L-1IBA的1/2MS培养基。在此生根培养基上光照培养20 d后不定芽即发生不定根,培养35 d后可形成良好根系(图1-D)。
表2在含有不同质量浓度IBA的1/2MS培养基上美味猕猴桃品种‘金魁’不定芽生根状况的比较1)
Table 2Comparison on rooting status of adventitious buds of cultivar ‘Jinkui’ ofActinidiachinensisvar.deliciosa(A. Chev. ) A. Chev. on 1/2 MS media containing different mass concentrations of IBA1)
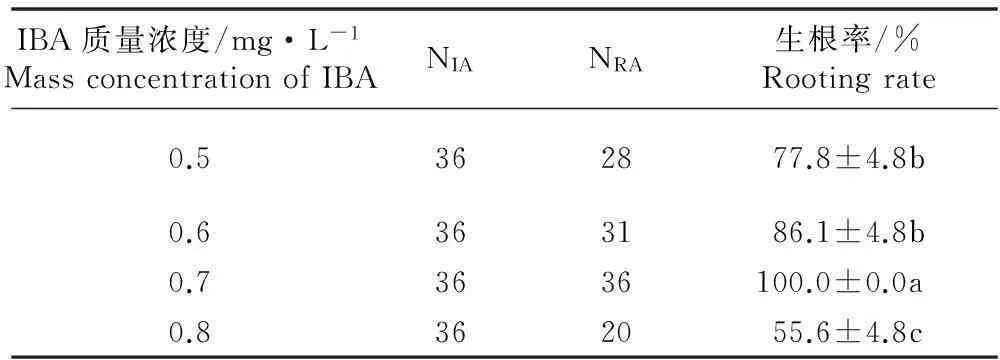
IBA质量浓度/mg·L-1MassconcentrationofIBANIANRA生根率/%Rootingrate0.5362877.8±4.8b0.6363186.1±4.8b0.73636100.0±0.0a0.8362055.6±4.8c
1)NIA: 接种的不定芽数Number of inoculated adventitious buds; NRA: 生根的不定芽数Number of rooting adventitious buds. 同列中不同的小写字母表示差异显著(P=0.05) Different small letters in the same column indicate the significant difference (P=0.05).
3 讨 论
隆前进[4]的研究结果表明:外植体类型对不定芽分化具有重要影响,在出芽率方面,叶片出芽率最高,叶柄次之。基于此,作者以‘金魁’的离体叶片为外植体筛选适宜其不定芽诱导和生根的培养基,结果表明:在含有3.0 mg·L-16-BA和0.2 mg·L-1NAA的MS培养基上暗培养21 d的不定芽再生率最高(94.4%),在含有0.7 mg·L-1IBA的1/2MS培养基上不定芽的生根率最高(100.0%),表明这2种培养基分别适合于美味猕猴桃品种‘金魁’离体叶片的不定芽诱导及生根。
在生根培养过程中,IBA浓度对生根率有影响。赵许朋等[8]的研究结果表明:当IBA 质量浓度低于0.8 mg·L-1时,‘红阳’猕猴桃(Actinidiachinensis‘Hongyang’)不定芽的根长、平均根数和生根率随 IBA质量浓度的提高而增加,而当IBA质量浓度高于0.8 mg·L-1时这3个指标则降低。本实验中,含有0.7 mg·L-1IBA的培养基生根的效果最好,且与吴秀华等[5]建立的‘海沃德’猕猴桃(A.chinensisvar.deliciosa‘Hayward’)叶片再生体系中最适生根培养基的IBA质量浓度一致,不定芽生根率都达到100.0%。表明不同品种猕猴桃试管苗培养过程中的生根培养条件具有一定的共性。
[1]袁云香. 猕猴桃营养成分的提取工艺研究进展[J]. 江苏农业科学, 2013, 41(2): 221-223.
[2]陈庆红. 猕猴桃优良品种——金魁[J]. 果树实用技术与信息, 2002(1): 13.
[3]黄宏文. 中国猕猴桃种质资源[M]. 北京: 中国林业出版社, 2013.
[4]隆前进. 猕猴桃组织培养和快繁技术研究[D]. 金华: 浙江师范大学化学与生命科学学院, 2010.
[5]吴秀华, 张艳玲, 周月, 等. ‘海沃德’猕猴桃叶片高频直接再生体系的建立[J]. 植物生理学报, 2013, 49(8): 759-763.
[6]汪克强, 周建峰, 王晓兵. 红阳猕猴桃的栽培管理技术[J]. 西北园艺, 2010(6): 13-15.
[7]张海平, 周建峰, 任目瑾. 海沃德猕猴桃组织培养快速繁育技术研究[J]. 陕西林业科技, 2011(2): 8-11.
[8]赵许朋, 罗克明, 周月, 等. ‘红阳’猕猴桃叶盘高频直接再生体系的建立[J]. 生物工程学报, 2013, 29(11): 1599-1606.
(责任编辑: 郭严冬)
Screening on induction and rooting media of adventitous buds frominvitroleaf of cultivar ‘Jinkui’ ofActinidiachinensisvar.deliciosa
HUANG Shengnan1, ZHANG Jiyu1, MAO Nini2, WANG Gang1, XUAN Jiping1, JIA Xiaodong1, ZHAI Min1, GUO Zhongren1,①
(1. Institute of Botany, Jiangsu Province and Chinese Academy of Sciences, Nanjing 210014, China; 2. Hilly Area of Jiangsu Province, Zhenjiang Institute of Agricultural Sciences, Zhenjiang 212400, China),J.PlantResour. &Environ., 2016, 25(1): 105-107
In order to establish high frequency regeneration system of cultivar ‘Jinkui’ ofActinidiachinensisvar.deliciosa(A. Chev. ) A. Chev., the optimum media for induction and rooting of adventitious buds were screened by takinginvitroleaf of sterile seedling as explant. The results show that the optimum medium for induction of adventitious buds of ‘Jinkui’ is MS medium containing 3.0 mg·L-16-BA and 0.2 mg·L-1NAA with regeneration rate of 94.4%. The optimum medium for rooting of adventitious buds is 1/2MS medium containing 0.7 mg·L-1IBA with rooting rate of 100.0%.
Actinidiachinensisvar.deliciosa(A. Chev. ) A. Chev.;invitroleaf; induction medium; rooting medium
10.3969/j.issn.1674-7895.2016.01.14
2015-08-20
国家自然科学基金资助项目(31401854); 江苏省自然科学基金资助项目(BK20140760); 江苏省现代农业——研究开发示范类项目(BE2015350); 泰州市科技支撑计划(农业)项目(TN201511)
黄胜男(1990—),女,江苏徐州人,硕士研究生,主要从事猕猴桃分子生物学方面的研究。
S663.4; Q813.1+2
A
1674-7895(2016)01-0105-03
