丹参多酚酸盐改善扩张性心肌病心肌功能的作用机制
2016-08-11王曦烨单晓彤王伊林
王曦烨, 单晓彤, 王伊林, 李 丹, 赵 明, 许 良
( 1. 内蒙古民族大学化学化工学院, 通辽 028042;2. 天然产物化学及功能分子合成自治区重点实验室, 通辽 028042; 3. 内蒙古民族大学附属医院, 通辽 028042)
丹参多酚酸盐改善扩张性心肌病心肌功能的作用机制
王曦烨1,2, 单晓彤3, 王伊林3, 李丹1,2, 赵明3, 许良1,2
( 1. 内蒙古民族大学化学化工学院, 通辽 028042;2. 天然产物化学及功能分子合成自治区重点实验室, 通辽 028042; 3. 内蒙古民族大学附属医院, 通辽 028042)
摘要将代谢组学与分子生物学方法相结合, 研究了丹参多酚酸盐治疗扩张性心肌病的作用机制. 采用主成分分析(PCA)法, 分析了健康组、 模型组及丹参多酚酸盐给药组大鼠血清代谢轮廓, 采用正交校正的偏最小二乘判别分析(OPLS-DA)法寻找潜在的生物标记物, 共鉴定得到磷酯酰丝氨酸[16∶0/18∶1(9Z)]、 溶血磷脂(16∶0)、 溶血磷脂[20∶4(5Z,8Z,11Z,14Z)]、 溶血磷脂[22∶6(4Z,7Z,10Z,13Z,16Z,19Z)]、 胆固醇硫酸酯、 胆汁酸、 γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚9种潜在的生物标记物. 其中, γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚的含量在模型组中下降, 经丹参多酚酸盐治疗后含量上升. 通过Western bloting法和酶联免疫吸附法证实丹参多酚酸盐通过影响体内与γ-亚麻酸和9′-羧基-γ-生育酚相关的超氧化物岐化酶(SOD)、 丙二醛(MDA)及其下游Bcl-2和Bax蛋白分子表达量, 从而减少氧化应激所致的心肌细胞凋亡数量, 达到治疗阿霉素所致扩张型心肌病的目的.
关键词扩张型心肌病; 丹参多酚酸盐; 代谢组学; 质谱; 氧化应激
阿霉素(ADR)属蒽环类抗癌药物, 其独特的嗜心肌作用可引起心腔扩大及室壁变薄等扩张型心肌病样改变[1], 发病机制并不完全明确, 目前没有特效药物能阻止阿霉素所致扩张性心肌病的发生.
丹参是唇形科植物丹参(Salvia miltiorrhiza Bge.)的干燥根和根茎, 在《本草纲目》中早有记载, 且评价颇高. 丹参具有“祛瘀止痛, 补血生血, 逐血生新”等功效. 药理学研究发现, 丹参具有改善血液循环、 降低心肌耗氧量及减少心律失常等药理作用[2,3]. 丹参多酚酸盐(Salvianolatemiltiorrhiza)是中药丹参的有效提取物. 陈成等[4]研究发现, 丹参多酚酸盐可通过影响心肌肌球蛋白重链, 从而提高心衰大鼠心脏功能. 方凌燕等[5]报道了丹参多酚酸盐可上调心肌组织中micRNA表达水平, 促进心肌梗死大鼠的血管重生. 张殿福等[6]报道了丹参多酚酸盐可通过抗炎和抗氧化等途径治疗心血管方面疾病. 迄今, 有关丹参多酚酸盐的药理作用研究多是基于分子生物学、 细胞生物学及药代动力学等方面, 而丹参多酚酸盐治疗扩张性心肌病的代谢组学研究鲜见报道.
代谢组学是一门关于生物体内源性代谢物整体及其变化规律的科学, 当正常机体受到毒性物质、 代谢障碍或生理因素的影响时, 代谢物的种类和浓度会发生显著变化. 目前, 代谢组学方法已被广泛应用[7~9], 但通过代谢组学方法推断得到的代谢通路缺少分子生物学方面的实验验证.
本文将代谢组学与分子生物学方法相结合, 对正常大鼠、 扩张性心肌病大鼠及应用丹参多酚酸盐干预后大鼠的血清中内源性小分子进行分析检测, 推断代谢通路, 并利用Westernbloting法与酶联免疫吸附实验对代谢通路进行验证, 进而阐述扩张性心肌病的发病机制及丹参多酚酸盐的治疗机制, 从而为丹参多酚酸盐治疗扩张性心肌病提供理论依据.
1实验部分
1.1试剂与仪器
甲醇和甲酸(色谱纯, 美国ThermoFisher公司); 提取用乙醇(分析纯, 北京化工厂); 去离子水由Milli-Q纯水仪制备(美国Millipore公司); 阿霉素, 批号为 1206E4(深圳万乐药业有限公司); 注射用丹参多酚酸盐, 批号为061121(上海第一生化制药厂);Bax,Bal-2和GAPDH内参抗体(Wanleibio公司); 超氧化物歧化酶(SOD)、 丙二醛(MDA)和ELISA试剂盒(深圳欣博胜生物有限公司).
AcquityUPLCSystem超高效液相色谱仪、WatersxevoG-2SQTOF质谱仪和AcquityBEH-C18色谱柱(50mm×2.1mm, 1.7μm)(美国Waters公司);GEVIVIDE9彩色超声波诊断仪(美国GE公司);DYY-7C电泳仪、DYCZ-40D转移槽、DYCZ-24DN双垂直蛋白电泳仪和WD-9413B型凝胶成像系统(北京六一公司).
1.2实验过程
1.2.1扩张性心肌病模型的建立健康Wister雄性大鼠24只, 每只体重200g, 常温(20 ℃)条件下, 每日日照14h, 正常饮食, 适应7d环境后, 随机分为正常组(C组)(n=8)、 模型组(M组)(n=8)和给药治疗组(T组)(n=8).M组腹腔注射ADR2mg/kg, 3次/周, 间隔2周, 再注射1周, 总共6次;T组腹腔注射ADR后, 用丹参多酚酸盐以40mg/kg灌胃, 3次/周, 间隔2周, 再灌胃1周, 总共6次;C组腹腔注射0.9%(质量分数)NaCl(10mL/kg), 方法同ADR注射方法, 停药后自由饮食4周[10]. 在丹参多酚酸盐给药组大鼠末次给药24h后, 将3组大鼠全部麻醉处死, 取血, 以3000r/min转速离心, 分别收集空白C组、M组和T的血清, 于-80 ℃储存备用.
1.2.2血液样品的收集和制备血液样品检测前, 于4℃融化样品, 在100μL样品中加入400μL乙腈, 涡旋振荡30s, 在4 ℃下以12000r/min转速离心10min, 上层清液用0.22μm滤膜过滤, 待测.
1.2.3大鼠心脏彩超检测应用GEVIVIDE9彩超机对各组大鼠于第7周末进行多普勒心脏超声检测, 图1为C组、M组和T组大鼠的心脏超声图. 由表1可见, 与C组比较,M组左室舒张末期内径(LVIDd)、 左心室收缩末期内径(LVSd)明显增大, 左心室后壁(LVPWDd)明显变薄, 射血分数(LVEF)减低(P<0.05), 符合扩张性心肌病改变, 说明造模成功; 而T组大鼠与M组大鼠相比较,LVIDd,LVSd,LVPWDd和LVEF值均有向正常大鼠改变的趋势, 具有统计学意义(P<0.05), 说明丹参多酚酸盐对扩张性心肌病有明显的治疗作用.

Fig.1 Heart color doppler ultrasound of control group(A), model group(B) and treatment group(C)Table 1 Effect of salvianolate miltiorrhiza on ventricular structure and ejection fractionin rats with dilated cardiomyopathy

GroupLVIDd/mmLVSd/mmLVPWDd/mmLVEF(%)C4.73±0.41**1.74±0.1**2.1±0.33**85.5±3.23**M5.83±0.592.08±0.191.73±0.0770.4±5.69T5.26±0.33**1.99±0.18**1.91±0.09**76.2±3.19**
**P<0.01(vs.modelgroup).LVIDd:leftventricularinternaldiastolicdiameter;LVSd:leftventricularenddiastolicdiameter;LVPWDd:leftventriculardiastolicposteriorwalldiastolicdimension;LVEF:leftventricularejectionfraction.
1.2.4大鼠左室心肌氧化应激验证实验病理取材在第7周末, 将大鼠在麻醉状态下于腹正中线剪开, 腹主动脉抽血处死, 在无菌状态下将大鼠左肋剪开, 暴露心脏, 将心脏取出, 剪下一部分左室壁部分心肌标本, 根据细胞量加入9倍体积的磷酸盐缓冲溶液, 吹散成细胞悬液, 用液氮反复冻融3次后在4 ℃下以12000r/min转速离心10min, 上层清液为实验所需蛋白组织匀浆, 于-20 ℃保存[11]. 采用ELISA法检测各组大鼠SOD和MDA氧化应激指标, 另采用Westernbloting技术检测各组大鼠心室肌Bcl和Bax蛋白.
1.2.5色谱及质谱分析条件色谱分析条件: 柱温40 ℃, 二元线性梯度洗脱: 流动相A为含0.1%(体积分数)甲酸的水溶液,B为甲醇. 流动相梯度组成: 1~3min, 8%~85%B; 3~6min, 85%~100%B; 6~8min, 100%B; 8~9min, 100%~8%B; 9~11min, 8%B. 流速0.4mL/min, 样品进样量10μL.
质谱分析条件:ESI离子源, 采用正、 负离子模式, 扫描范围m/z 100~1000. 正离子模式: 毛细管电压3kV, 锥孔电压40V, 离子源温度100 ℃, 雾化温度400 ℃, 壳气流速800L/h; 负离子模式: 毛细管电压2.5kV, 锥孔电压40V, 离子源温度80 ℃, 雾化温度150 ℃, 壳气流速600L/h.MS2碰撞能量为10~30eV. 质谱以亮氨酸脑啡肽作内标, 甲酸钠校正质量轴.
1.2.6潜在的生物标记物筛选及解析用MasslynxV4.1软件对超高效液相色谱-质谱联用数据进行峰提取、 峰对齐及归一化处理, 用EZinfo2.0软件进行PCA和OPLS-DA分析, 根据VIP值(VIP>1.0)和P值(P<0.05) 筛选出潜在的生物标志物. 通过HMDB及METLIN等精确质量检索数据库, 筛选出最有可能的化合物, 最终通过数据库标准图谱确定标志物的化学结构.

Fig.2 Base peak intensity chromatograms(BPI) under the ESI+ mode(A, C, E) and ESI- mode(B, D, F)(A), (B) Control group; (C), (D) model group; (E), (F) treatment group.
2结果与讨论
2.1代谢轮廓分析
利用UPLC-Q-TOFMS的正、 负离子模式对各组大鼠进行分析, 得到3 组基峰离子流色谱图(图2). 由图2可见, 各组大鼠的血液代谢产物得到了良好分离, 正离子模式下相应信号大于负离子模式, 并且检测到的物质多于负离子模式. 在正、 负离子模式下, 某些对应峰在3组色谱图间存在明显差异, 表明这些检测结果可能具有统计学意义.
2.2代谢差异分析
PCA分析作为无监督的模式识别方法可以反映数据的原始状态, 直观地显示不同样品间的整体差异, 故首先对各组大鼠血液样品进行PCA分析. 由图3可见, 在正离子模式(R2X=0.9018, Q2=0.8352)和负离子模式(R2X=0.8609, Q2=0.8254)下, 3组血液样本均可明显区分, 表明扩张性心肌病造模成功, 而丹参多酚酸盐对该疾病有明显的治疗效果.
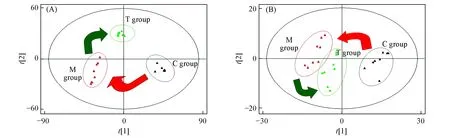
Fig.3 PCA score plots obtained from the metabolic profiles of the control group, model group and treatment group under positive(A) and negative ion modes(B)

Fig.4 OPLS-DA score plots(A, C) and S-plots(B, D) obtained from the metabolic profiles of the control group and model group under positive(A, B) and negative ion modes(C, D)
为了找到引起扩张性心肌病的潜在生物标记物, 需要利用有监督的识别模式OPLS-DA分析. 有监督的模式识别方法可以扩大组间差异, 但需要利用外部模型验证方法排列实验来证明模型的有效性. 由图4(A)和(C)可见, 在正离子模式(R2Y=0.9987, Q2=0.9854)和负离子模式(R2Y=0.9935, Q2=0.9577)下, 正常组与模型组大鼠血液样本仍可被明显区分. 为寻找潜在的生物标记物, 采用OPLS-DA对正常组和模型组样本数据进行分析, 得到正、 负离子模式下的S-Plot图[图4(B)和(D)], 图中“S”曲线的每一个点代表一个变量, 变量对分类的重要程度由VIP值的大小来衡量, 变量离远点越远,VIP值越大. 根据VIP值(VIP>1.0)和P值(P<0.05)筛选出潜在的生物标志物.
2.3主要生物标记物的分析
通过与数据库标准谱图进行比对, 共鉴定出9种潜在的生物标记物(见表2), 分别为磷酯酰丝氨酸[16∶0/18∶1(9Z)]、 溶血磷脂(16∶0)、 溶血磷脂[20∶4(5Z,8Z,11Z,14Z)]、 溶血磷脂[22∶6(4Z,7Z,10Z,13Z,16Z,19Z)]、 胆固醇硫酸酯、 胆汁酸、 γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚. 其中, 模型组相对于正常组, 胆固醇硫酸酯的含量升高, 其它成分含量下降; 大鼠经丹参多酚酸盐治疗后, γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚的含量相对于模型组明显升高, 其它成分含量未发生明显变化, 表明丹参多酚酸盐可能通过影响γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚的代谢通路从而达到治疗扩张性心肌病的目的. 将UPLC-QTOFMS数据导入HemI软件[12], 对γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚进行了热图分析, 结果示于图5.

Table 2 Potential biomarkers between control group and model group

Fig.5 Heatmap of metabolites between control(C) group, model(M) group and treatment(T) groupa. γ-linolenic acid; b. docosapentaenoic acid; c. 9′-carboxy-γ-chromanol.
9′-羟基-γ-生育酚是维生素E(VitaminE)酯水解为酚羟基后的代谢产物,Jiang等[13]通过实验证实, 生育酚可影响维生素E的形式, 起到抗炎和抗癌的作用.Kamal等[14,15]发现, 维生素E和生育酚均具有强烈的抗氧化作用, 而生育酚还具有保护血管内皮、 减少氧化自由基对血管壁的破坏及扩张微小动脉的作用. 本研究发现,ADR所致扩张型心肌病大鼠心肌组织中的SOD和Bcl表达水平明显下降, 而MDA和Bax表达明显上升, 表明ADR可致大鼠心肌细胞发生氧化应激, 并使心肌细胞凋亡数量增加, 工作的心肌细胞数量减少, 从而导致心功能降低, 心脏扩大. 扩张型心肌病模型血清中9′-羟基-γ-生育酚的表达基本消失, 而经丹参多酚酸盐干预后大鼠血清中9′-羟基-γ-生育酚的表达明显升高, 说明丹参多酚酸盐对ADR所致扩张性心肌病的氧化应激途径有积极的治疗作用.
γ-亚麻酸是人体必需的多不饱和脂肪酸, 它具有降脂、 杀菌、 抗炎、 抗血栓和抗氧化应激等多种生物学功能[16~18]. γ-亚麻酸由亚油酸分解产生, 扩张型心肌病患者心肌及血浆中亚油酸缺乏, 这可能是引起扩张型心肌病的发病因素[19], 而经STS干预治疗后, γ-亚麻酸在血浆中的表达升高, 说明丹参酮多酚酸盐对ADR所致扩张型心肌病大鼠脂肪酸代谢通路具有调节作用.
二十二碳五烯酸(EPA)属于不饱和ω-3型不饱和脂肪酸, 是人体必需由外界摄入的脂肪酸, 在生物体内多个系统具有较强的生物功能, 具有调节血脂、 软化血管、 促进生长发育和提高人体免疫功能等作用[20,21]. 生物体细胞量代谢的60%~90%来源于外周血中游离脂肪酸的氧化, 而当扩张型心肌病发生时, 心脏本身射血分数降低, 可能导致机体全身细胞处于乏氧状态, 全身细胞迅速消耗掉外周血当中游离的不饱和脂肪酸为其供能, 继而引发能量能量代谢障碍; 当应用STS干预治疗扩张型心肌病大鼠后, 二十二碳五烯酸含量升高, 通过其抗氧化作用可以减少对心肌细胞的损害, 从而提高了心脏射血功能, 这证明了丹参酮多酚酸盐对扩张型心肌病大鼠的脂肪酸代谢及能量代谢具有调节作用.
2.4代谢通路的验证性分析
2.4.1第7周末大鼠左心室心肌组织SOD和MDA表达超氧化物歧化酶(SOD)是生物体内天然的氧化酶, 可有效清除氧化自由基, 保护细胞受到氧化自由基攻击; 而丙二醛(MDA)则是氧化应激发生指标, 二者若互为平衡, 则生物体处于健康状态, 若MDA表达增多, 表明SOD的表达减少, 可推断氧化应激的发生[22,23]. 由图6可见, 与C组比较,M组大鼠心肌组织内SOD含量明显下降(P<0.01), 丹参多酚酸盐组大鼠较M组大鼠心肌组织内SOD含量明显上升(P<0.01); 与C组比较,M组大鼠心肌组织内MDA含量明显上升(P<0.01), 丹参多酚酸盐组大鼠较M组大鼠心肌组织内MDA含量明显下降(P<0.05), 说明应用丹参多酚酸盐可有效减轻ADR对心肌细胞的氧化应激损伤.
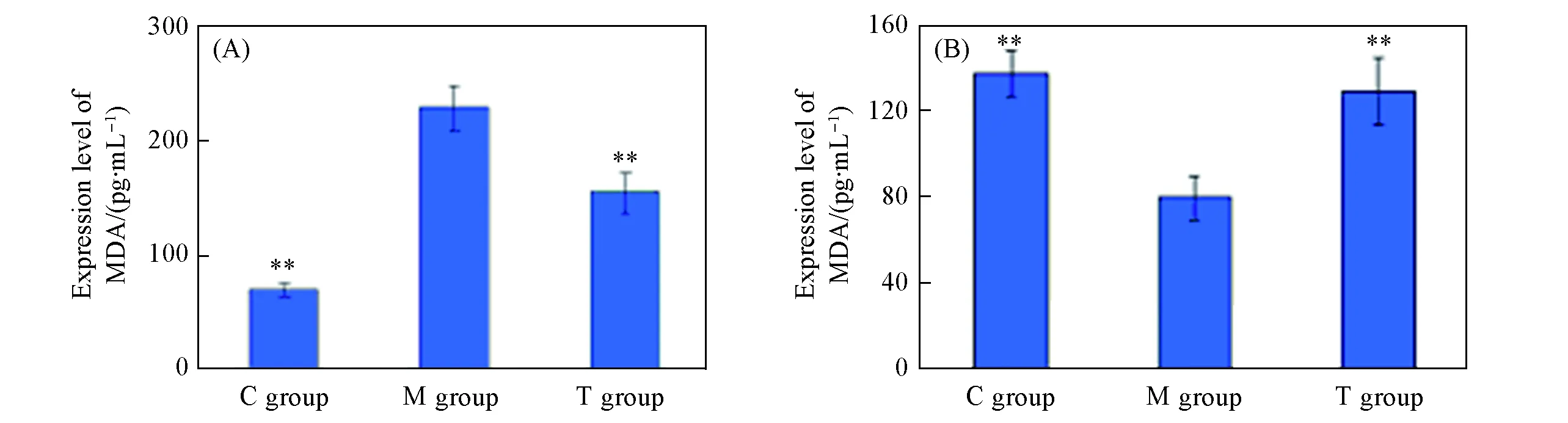
Fig.6 Expression levels of MDA(A) and SOD(B) protein of rats left ventricular myocardial tissue in control group, model group and treatment group*P<0.05, **P<0.01(vs. model group).

Fig.7 Western blot analysis(A) and expression levels(B) of Bcl-2 and Bax protein of rats left ventricular myocardial tissue in control group, model group and treatment group**P<0.01(vs. model group).
2.4.2第7周末大鼠左心室心肌组织Bax和Bcl-2表达Westernbloting技术是检测蛋白的重要半定量技术, 目标蛋白与内参蛋白的比值可以反映目标蛋白表达量的相对变化. 图7(A)中,Bax和Bcl-2蛋白为目标蛋白, 而β-actin为内参蛋白,Bax/β-actin及Bcl-2/β-actin可以反映Bax和Bcl-2的相对表达量.Bcl-2是氧化应激“下游”的抗凋亡因子, 而Bax是氧化应激“下游”的凋亡因子,Bax可与Bcl-2结合形成二聚体, 从而减少抗凋亡分子与Bcl-2的同源二聚体化, 促进细胞凋亡[24,25]. 如图7(B)所示, 与M组大鼠相比,C组大鼠左室心肌细胞中Bcl-2表达明显减少(P<0.05), 而Bax表达增多(P<0.05), 表明M组大鼠左室心肌组织中异常凋亡正在发生;与M组相比,T组大鼠Bcl-2表达趋于正常(P<0.05), 而Bax表达下降(P<0.05), 说明丹参多酚酸盐具有通过调节抗氧化分子表达水平抗心肌细胞凋亡的作用, 从而改善了扩张型心肌病大鼠的心脏功能.
3结论
将代谢组学与分子生物学方法相结合, 研究了丹参多酚酸盐治疗扩张性心肌病的作用机制. 通过代谢组学方法共鉴定了磷酯酰丝氨酸、 溶血磷脂、 溶血磷脂、 溶血磷脂、 胆固醇硫酸酯、 胆汁酸、 γ-亚麻酸、 二十二碳五烯酸和9′-羧基-γ-生育酚等9种内源性代谢产物. 实验结果表明, 丹参多酚酸盐通过影响脂肪酸代谢和抗氧化等通路发挥治疗作用, 其中抗氧化通路是其减少心肌损伤的重要作用途径. 本文阐述了丹参多酚酸治疗ADR所致扩张型心肌病的作用机理, 为临床治疗扩张性心肌病提供理论依据.
参考文献
[1]QuilesJ.L.,HuertasJ.R.,BattinoM.,MataixJ., Toxicology, 2002, 180, 79—95
[2]HanY.M.,OhH.,NaM.,KimB.Y.,JeongD.G.,RyuS.E.,SokD.E.,AhnJ.S., Biol. Pharm. Bull., 2005, 28(9), 1795—1797
[3]YangZ.X.,LinQ.,MaL., World Journal of Integrated Traditioal and Western Medicine, 2012, 7(2), 93—96(杨志霞, 林谦, 马利. 世界中西医结合杂志, 2012, 7(2), 93—96)
[4]ChenC.,ZhouX.G.,QiuS.D.,ChenH.,ChenY.Z.,LinX.M., Chinese Journal of Integrated Traditional and Western Medicine, 2015, 35(7), 871—876(陈成, 邹襄谷, 邱山东, 陈慧, 陈永忠, 林秀明. 中国中西医结合杂志, 2015, 35(7), 871—876)
[5]FangL.Y.,LiuY.Y.,LiG.D.,LingY.,LiangY.B.,DengY.L.,YuL., Int. J. Cardiovasc. Dis., 2015, 42(4), 256—260(方凌燕, 刘衍宇, 李国达, 凌云, 梁一波, 邓玉丽, 余丽. 国际心血管病杂志, 2015, 42(4), 256—260)
[6]ZhangD.F.,WangM.W.,WangL.S.,TangJ.J.,ChenB.,WangW.,YangZ.J.,CaoK.J., Chinese Journal of Integrative Medicine on Cardi-/Cerebrovascular Disease, 2008, 6(11), 1304—1306(张殿福, 王明伟, 王连生, 唐建金, 陈波, 王伟, 杨志健, 曹克将. 中西医结合心脑血管病杂志, 2008, 6(11), 1304—1306)
[7]WangY.B.,XiaoD.,LiX.Y.,DaiY.L.,YueH.,LiuS.Y., Chem. J. Chinese Universities, 2015, 36(10), 1894—1899(王一博, 肖丹, 李晓宇, 戴雨霖, 越皓, 刘淑莹. 高等学校化学学报, 2015, 36(10), 1894—1899)
[8]ZhangR.X.,LiuS.,PiZ.F.,SongF.R.,LiuZ.Q., Chem. J. Chinese Universities, 2014, 35(6), 1146—1151(张瑞兴, 刘舒, 皮子凤, 宋凤瑞, 刘志强. 高等学校化学学报, 2014, 35(6), 1146—1151)
[9]DongJ.,CaiX.M.,ZouL.J.,ChenC.,XueX.Y.,ZhangX.L.,LiangX.M., Chem. Res. Chinese Universities, 2011, 27(5), 750—755
[10]ZhouR.,YangC.H.,WangQ.,WangF.Z., Chinese Journal of Integrative Medicine on Cardi-/Cerebrovascular Disease, 2009, 7(11), 1315—1317(周荣, 杨彩虹, 王强, 王凤芝. 中西医结合心脑血管病杂志, 2009, 7(11), 1315—1317)
[11]ZhaoH.,LiH.T.,GuD.W.,LiS.X.,FangY.S.,HanC.P., Tianjin Med. J., 2012, 40(1), 64—66(赵红, 李海涛, 顾定伟, 李素新, 方艳淑, 韩春萍. 天津医药, 2012, 40(1), 64—66)
[12]DengW.K.,WangY.B.,LiuZ.X., Plos One, 2014, 9(11),e111988[2014-11-05].doi:10.1371/journal.pone.0111988
[13]JiangQ.,YinX.M.,LillM.A.,DanielsonM.L.,DanielsonM.L.,FreiserH.,HuangJ.J., PNAS, 2015, 105(51), 20464—20469
[14]KamalA.A.,KhalidS.H., BMC Vet. Res., 2012, 8, 45—52
[15]AliS.F.,WoodmanO.L., Oxid. Med. Cell Longev., 2015,e150829[2015-05-17].doi: 10.1155/2015/150829
[16]LiuW.N.,LeungK.N., Plos One, 2015, 10(12),e0143684[2015-12-02].doi: 10.1371/journal.pone.0143684
[17]DongJ.M.,WuR.H.,YuanC.L.,ZhouL.J., Journal of Hygiene Research, 2003, 32(3), 299—301(董杰明, 吴瑞华, 袁昌鲁, 周连甲. 卫生研究, 2003, 32(3), 299—301)
[18]ChanikulC.,SukanyaJ.,SarochaP.,PattsarunC.,SarinyaS.,MayuraV.,KobkulL., J. Biotechnol., 2016, 218(20), 85—93
[19]ZhuN.,WilliamE.,GanyY., Chin. J. Cardiol., 1998, 26(1), 12—14
[20]HuangM.F.,WuG.P.,JiaoB.N., Food and Drug, 2007, 9(2), 69—71(黄明发, 吴桂苹, 焦必宁. 食品与药品, 2007, 9(2), 69—71)
[21]RachelA.M.,ElaineA.Y.,EricD.C.,SaurabhM.,MichaellM.B., Nutrients, 2015, 7(12), 10282—10289
[22]YangQ.H.,TangS.S., Chin. Pharm., 2009, 20(30), 2336—2337(杨群华, 唐省三. 中国药房, 2009, 20(30), 2336—2337)
[23]ZhouS.X.,ZhangY.L.,ZhouY.,LeiJ., Chin. J. Hypertension, 2008, 16(10), 907—911(周淑娴, 张玉玲, 周艳, 雷娟. 中华高血压杂志, 2008, 16(10), 907—911)
[24]DuB.,ChenW.,ChenJ.L.,PangQ.F., Chinese Journal of Hospital Pharmacy, 2015, 35(23), 2071—2074(杜斌, 陈炜, 陈俊良, 庞庆丰. 中国医院药学杂志, 2015, 35(23), 2071—2074)
[25]ButinarB.,BucarM.M.,MarianiC.,RasporP., Food Chem., 2011, 128(2), 505—512
(Ed.:D,K)
†SupportedbytheNationalNaturalScienceFoundationofChina(Nos. 81560702, 81260682).
doi:10.7503/cjcu20150984
收稿日期:2015-12-26. 网络出版日期: 2016-04-07.
基金项目:国家自然科学基金(批准号: 81560702, 81260682)资助.
中图分类号O657
文献标志码A
MechanismofSalvia MiltiorrhizaontheImprovementofMyocardialFunctioninPatientswithDilatedCardiomyopathy†
WANGXiye1,2,SHANXiaotong3,WANGYilin3,LIDan1,2,ZHAOMing3*,XULiang1,2*
(1. College of Chemistry and Chemical Engineering, Inner Mongolia University for the Nationalities, Tongliao 028042, China;2. Key Laboratory of Natural Product Chemistry and Functional Molecular Synthetic of Autonomous Region, Tongliao 028042, China;3. Affiliated Hospital of Inner Mongolia University for the Nationalities, Tongliao 028042, China)
AbstractMetabonomics combined with molecular biology were used to investigate the mechanisms of anti-dilated cardiomyopathy treated by depside salt from Salvia miltiorrhiza. The serum metabolic profiling of control group, model group and treatment group were analysed by principle component analysis(PCA). The potential biomarkers were selected with the help of orthogonal partial least squares discriminant analysis(OPLS-DA). As results, nine potential biomarkers including the PS[16∶0/18∶1(9Z)], LysoPC(16∶0), LysoPC[20∶4(5Z, 8Z, 11Z, 14Z)], LysoPC[22∶6(4Z, 7Z, 10Z, 13Z, 16Z, 19Z)], cholesterol sulfate, taurohyocholate, γ-linolenic acid, docosapentaenoic acid and 9′-carboxy-γ-chromanol were identified respectively. In addition, the relative content of γ-linolenic acid, docosapentaenoic acid and 9′-carboxy-γ-chromanol decreased in the model group, while increased in the treatment group. With the help of western bloting and enzyme-linked immunosorbent method, we confirmed that the depside salt from Salvia miltiorrhiza influenced the expression levels of superoxide disproportionation(SOD), malondialdehyde(MDA), Bcl-2 and Bax protein molecule(the proteins mentioned above were related with γ-linolenic acid and 9′-carboxyl-γ-tocopherol), and then reduced the amount of the apoptosis myocardial cell induced by oxidative stress, and treated the the dilated cardiomyopathy caused by adriamycin finally.
KeywordsDilated cardiomyopathy; Salvia miltiorrhiza; Metabonomics; Mass spectrometry; Oxidative stress
联系人简介: 许良, 男, 博士, 教授, 主要从事天然产物化学研究.E-mail:nmgxl66@163.com
赵明, 男, 博士, 主任医师, 主要从事心血管疾病研究.E-mail:langzhe73@163.com
