MWCNTs-rGO/PDDA-AuNPs复合膜修饰电极对莱克多巴胺的灵敏检测
2016-08-11宋天铭吕超志何婧琳杨荣华
寻 艳, 曹 忠, 宋天铭, 吕超志, 刘 峰, 何婧琳, 杨荣华
(长沙理工大学化学与生物工程学院, 电力与交通材料保护湖南省重点实验室,微纳生物传感与食品安全检测协同创新中心, 长沙 410114)
MWCNTs-rGO/PDDA-AuNPs复合膜修饰电极对莱克多巴胺的灵敏检测
寻艳, 曹忠, 宋天铭, 吕超志, 刘峰, 何婧琳, 杨荣华
(长沙理工大学化学与生物工程学院, 电力与交通材料保护湖南省重点实验室,微纳生物传感与食品安全检测协同创新中心, 长沙 410114)
摘要采用自组装方法, 将聚二烯丙基二甲基氯化铵(PDDA)功能化的金纳米颗粒(AuNPs)负载于多壁碳纳米管(MWCNTs)-还原型氧化石墨烯(rGO)夹层, 再涂覆于玻碳电极(GCE)上, 制备了纳米复合膜修饰电极MWCNTs-rGO/PDDA-AuNPs/GCE. 采用透射电子显微镜(TEM)和紫外-可见光谱(UV-Vis)对修饰膜的形貌及结构进行表征. 探讨了其对莱克多巴胺(Rac)的循环伏安行为, 结果表明MWCNTs-rGO/PDDA-AuNPs纳米复合物对Rac表现出显著的电催化氧化特性. 采用差分脉冲伏安法测得该复合膜修饰电极对Rac检测的线性范围为0.036~4.5 μmol/L, 检出限为6.35 nmol/L(S/N≥3), 且显示出良好的抗干扰能力、 稳定性及重现性. 采用该方法检测猪血清及猪尿样中的Rac, 回收率达95.4%~105.9%, 表明该复合膜修饰电极对实际样品中Rac的检测具有潜在应用价值.
关键词莱克多巴胺; 还原型氧化石墨烯; 聚二烯丙基二甲基氯化铵; MWCNTs-rGO/PDDA-AuNPs复合物; 食品安全检测
莱克多巴胺(Rac)又称苯乙醇胺、 雷托巴胺、 权莱克、 金莱多巴或培林, 为“瘦肉精”的一种, 最初作为传统“瘦肉精”克伦特罗(Cle)的替代品出现, 可促进动物肌肉生长, 提高动物的蛋白质含量, 减少胴体脂肪含量[1,2], 从而改变胴体瘦肉和脂肪比例, 同时还能提高动物的日增重和饲料利用率, 被广泛地应用于畜牧业和养殖业[3]. 但由于Rac属于激素类添加剂, 存在激素残留问题, 易对动物机体产生毒副作用[4,5], 长期食用会导致染色体畸变, 诱发恶性肿瘤及心血管疾病等[6], 还可引起糖尿病人发生酮中毒或酸中毒[7], 因此我国及一些欧洲国家将其列为动物饲养中的违禁添加剂[8]. 此外,Rac还曾在体育比赛中被作为兴奋剂使用. 因此, 研究和开发Rac的分析技术, 对于临床药物代谢研究、 食品安全及兴奋剂检测均具有重要意义.
目前, 检测Rac的方法主要包括液相色谱法[9]、 气相色谱-质谱联用法[10]、 高效液相色谱-质谱联用法[11]、 比色法[12]和毛细管电泳法[13]等, 这些方法因仪器设备笨重, 价格昂贵, 检测时间较长而难以实现在线连续检测. 电化学传感器检测Rac操作简单、 成本低廉, 具有良好的选择性和灵敏度, 因而备受关注. 目前, 用于检测Rac的化学修饰电极主要分为4种类型: 第1种是分子印迹型化学修饰电极[14~17], 如Zhang等[14]以目标物Rac为模板、 以甲基丙烯酸为聚合单体合成分子印迹聚合物, 将其热聚合到多壁碳纳米管(MWCNTs)修饰的丝网印刷电极上, 然后洗脱掉模板分子, 利用分子印迹膜识别Rac过程中电流的改变, 实现对Rac的定量检测. 这种方法能够选择性地识别目标分子从而使之具有较强的抗干扰能力, 但是分子印迹膜的机械稳定性较差, 难以多次重复使用. 第2种是免疫型化学修饰电极[18~20], 如Wang等[18]制备了一种具有三维结构的Cu/Cu2O@rGO纳米复合物, 并用该纳米复合物吸附Rac的抗体, 用于对Rac的定量检测, 检出限达7.5pg/mL, 检测线性范围为0.1~10ng/mL, 显示出较好的灵敏度和选择性. 但是生物活性物质(如抗体)的制备和纯化条件苛刻、 操作繁琐、 费时费力, 且抗体的应用在稳定性和成本等方面受到诸多限制, 无法满足大批量样品的快速检测. 第3种为直接氧化型化学修饰电极[21~23], 如Liu等[22]提出用功能化的多壁碳纳米管修饰玻碳电极, 利用MWCNTs优异的性能实现对Rac的直接电化学定量检测.Bai等[23]利用直接还原的方法还原氧化石墨烯和金生长溶液, 制得石墨烯/金纳米棒复合膜(G/GNRs), 以此为传感界面用于对Rac进行直接电化学检测, 显示出较好的灵敏性和抗干扰能力. 第4种为催化氧化型化学修饰电极[24,25], 如Yang等[24]制备了一种有序介孔碳材料修饰电极, 实现对Rac的直接电催化氧化. 催化氧化型修饰电极的特点是具有较好的灵敏性和选择性, 操作、 取材简单, 成本低廉; 且Rac含有酚羟基, 有较高的电活性, 可在电极表面被催化氧化, 但在普通电极上较难被催化氧化. 因此, 寻找一种高导电性、 催化性能好、 稳定性高且特异性强的新型电极修饰材料是研究的关键.
石墨烯(GO)作为一种新型碳材料, 具有石墨的特殊结构, 碳原子间通过sp2杂化形成二维芳环片层结构[26], 因其优异的电学、 力学等性能[27], 而在电化学材料等领域中被广泛应用[26,28]. 然而, 单片层结构的GO容易发生不可逆团聚而形成多层石墨烯, 甚至石墨. 因此, 如何获得具有良好溶解性、 稳定性的分散体系以及片层堆叠少的GO是其应用研究中面临的主要挑战. 在GO功能化过程中, 碳纳米管是一种最能保持GO本质性质的掺杂剂, 主要原因是碳纳米管充当了类似导线的作用, 弥补了电子传递的缺陷, 并且有效地阻止GO的不可逆团聚. 而且这种复合材料具有特殊的层状性能、 储存稳定性和化学稳定性[29], 使之有望用作电化学传感材料中催化剂的载体, 起到提高负载金属催化剂的负载量以及复合物催化性能的作用.
基于此, 本文采用自组装法制备了MWCNTs-GO复合物, 并将其作为催化剂载体, 通过静电引力作用负载上聚二烯丙基二甲基氯化铵(PDDA)功能化的金纳米(AuNPs), 形成一种新型复合材料修饰电极.PDDA具有弱还原性, 能在水热条件下还原GO和Au3+, 生成还原型氧化石墨烯(rGO)及Au纳米粒子; 并且PDDA作为一种聚电解质, 可起到稳定剂的作用, 能有效防止反应产物的团聚. 此外, 吸附在MWCNTs-rGO表面的PDDA还能作为AuNPs颗粒生长的晶核, 使得AuNPs颗粒能有效沉积在MWCNTs-rGO的表面, 从而达到提高复合材料电催化性能的作用. 实验结果表明, 该修饰电极对Rac的氧化具有较高的电催化活性, 检出限达到6.35nmol/L, 在食品安全检测领域具有潜在的应用价值.
1实验部分
1.1试剂与仪器
氧化石墨烯(GO)和多壁碳纳米管(MWCNTs)购自南京吉仓纳米科技有限公司; 聚二烯丙基二甲基氯化铵溶液(PDDA, 分子量2.0×105~3.5×105, 质量分数20%)购于美国Aldrich公司; 莱克多巴胺(Rac)、 克伦特罗(Cle)、 沙丁胺醇(Sal)和苯乙醇胺-A(Pea)均购自德国Dr.EhrenstorferGmbH公司; 硼氢化钠和氯金酸等购自上海国药集团化学试剂有限公司; 猪血清和猪尿样品由中国科学院亚热带农业生态研究所提供. 实验所用试剂均为分析纯, 用水均为超纯水(在25 ℃下电阻率≥18.3MΩ5cm).
电化学实验均采用CHI-760B型电化学工作站(上海辰华仪器有限公司)完成. 采用常规的三电极系统: 修饰电极为工作电极, 铂丝电极为对电极, 银/氯化银(饱和氯化钾)电极作为参比电极. 磷酸盐缓冲溶液(PBS)由0.01mol/L磷酸二氢钠和0.01mol/L磷酸氢二钠母液配制, 其pH值用0.10mol/LHCl调节, 采用pHS-3C型酸度计(上海金鹏分析仪器有限公司)测定. 纳米溶胶溶液的吸收光谱采用岛津UV-2201型紫外-可见分光光度计测定. 修饰电极表面形貌采用JEM-1230LV型透射电子显微镜(TEM, 日本电子株式会社)进行表征.
1.2羧基化MWCNTs的制备
将200gMWCNTs加入体积比为3∶1的浓硫酸/浓硝酸的混合酸中(40mL), 在150 ℃的油浴锅中搅拌加热回流15min, 取出, 待混合液冷却后以12000r/min的转速离心处理5min, 弃去上层清液, 将下层沉淀即羧基化MWCNTs用超纯水洗涤3次, 以除去过量的酸, 将产物置于真空干燥箱中于75 ℃下干燥过夜, 最后将产物研磨粉碎备用.
1.3MWCNTs-rGO/PDDA-AuNPs纳米复合物的制备
MWCNTs-GO复合物的制备: 取5mg羧基化MWCNTs加入到10mL1mg/mL的氧化石墨烯(GO) 溶液中, 超声分散2h, 得到均一悬浊溶液, 然后以12000r/min的转速离心10min, 以除去未发生自组装的MWCNTs. 将上层清液以16000r/min的转速离心10min, 以除去未发生自组装的GO, 所得沉淀即为MWCNTs-GO复合物.
PDDA包裹的AuNPs(PDDA-AuNPs)的制备: 参照文献[30]方法, 将50μLPDDA(质量分数为20%)、 200μL0.5mol/LNaOH及100μLHAuCl4(10mg/mL) 加入到40mL超纯水中, 混合均匀后, 在100 ℃的油浴锅中加热回流至混合液的颜色变为紫红色且再无颜色变化为止.
MWCNTs-rGO/PDDA-AuNPs纳米复合物的制备: 取3mLMWCNTs-GO(1.0mg/mL)、 1mL8.45mol/L硼氢化钠、 30μLPDDA和6mLPDDA-AuNPs混合均匀后, 于冰水浴条件下处理30min, 再置于100 ℃的油浴锅中回流40min, 得到黑色均一的悬浮液, 以10000r/min离心10min, 弃去上层清液, 将所得沉淀用超纯水清洗3次, 然后用6mL无水乙醇溶解, 超声分散1~3h后, 置于4 ℃的冰箱中保存备用.
1.4MWCNTs-rGO/PDDA-AuNPs复合纳米材料修饰电极的制备
取8μLMWCNTs-rGO/PDDA-AuNPs复合物分散液, 采用滴涂法涂覆于抛光的玻碳电极表面, 室温下自然晾干后置于4 ℃的冰箱中保存.PDDA-AuNPs/GCE和MWCNTs-rGO/GCE修饰电极均按上述方法制备.
1.5样品的前处理
1.5.1猪血样的处理取5mL猪血液, 加入一定量Rac标准品, 于4500r/min转速下离心15min, 取1mL上层清液置于5mL玻璃离心管中, 加入2mL0.1mol/LHClO4溶液, 超声处理20min, 然后置于80 ℃水浴中加热30min, 冷却后以4500r/min转速离心15min, 倾出上层清液, 将沉淀用1mL0.1mol/LHClO4溶液洗涤, 离心(同上)并合并上清液; 再重复1次洗涤步骤, 合并上层清液, 向其中加入约1gNaCl和2mL体积比为2∶3的异丙醇-乙酸乙酯混合液. 振荡萃取20min, 放置5min后移出有机相置于5mL离心管中, 按以上步骤重复萃取2次, 合并有机相, 并吹干待用, 或用5mL0.01mol/LPBS缓冲液(pH=6.5)溶解, 于4 ℃保存备用.
1.5.2猪尿样的处理取5mL猪尿液, 加入一定量Rac标准品, 再加入20mL0.1mol/LHClO4溶液, 超声20min, 混合均匀, 置于80 ℃水浴中加热30min. 用1mol/L的NaOH溶液调节pH至9.5±0.1, 加入8gNaCl和25mL体积比为2∶3的异丙醇-乙酸乙酯混合液, 振荡萃取20min. 然后放置5min, 取上层有机相, 用25mL体积比为2∶3的异丙醇-乙酸乙酯混合液重复萃取1次, 合并有机相, 在60 ℃水浴下浓缩至干, 溶于5mL0.01mol/L的PBS(pH=6.5)溶液中, 于4 ℃保存备用.
2结果与讨论
2.1传感界面形态和结构的表征

Fig.1 TEM images of PDDA-AuNPs(A) and MWCNTs-rGO/PDDA-AuNPs hybrids(B)
图1示出了PDDA-AuNPs及MWCNTs-rGO负载PDDA-AuNPs后(MWCNTs-rGO/PDDA-AuNPs)的透射电子显微镜照片. 由图1(A)可见, 以PDDA为保护剂和还原剂制得的AuNPs的粒径约为20nm, 粒径分布较均匀. 由图1(B)可见,PDDA功能化的AuNPs较均匀地分散在基底载体MWCNTs-rGO复合物上, 得到了具有较大比表面积的复合物膜, 同时由于MWCNTs-rGO为夹层结构, 因此部分AuNPs不能被清晰地观察到.
实验中制备的MWCNTs-rGO/PDDA-AuNPs复合物非常稳定, 在4 ℃冰箱中保存6个月后性质仍然保持不变. 这是因为还原态氧化石墨烯表面存在大π键的芳环, 可以与MWCNTs的侧面通过π-π电子云堆叠结合在一起, 同时还原态氧化石墨烯边缘的含氧基团及羧基化MWCNTs表面的含氧基团可以有效地提高复合物在溶液中的分散性. 而且复合物层间及表面的MWCNTs可以有效地防止还原石墨烯的团聚, 从而保持石墨烯良好的导电能力以及高比表面积等特殊的性质, 为AuNPs提供了大量的附着位点, 这不仅有利于增加目标检测物Rac的富集量, 而且还能起到催化和信号放大的作用[31,32].
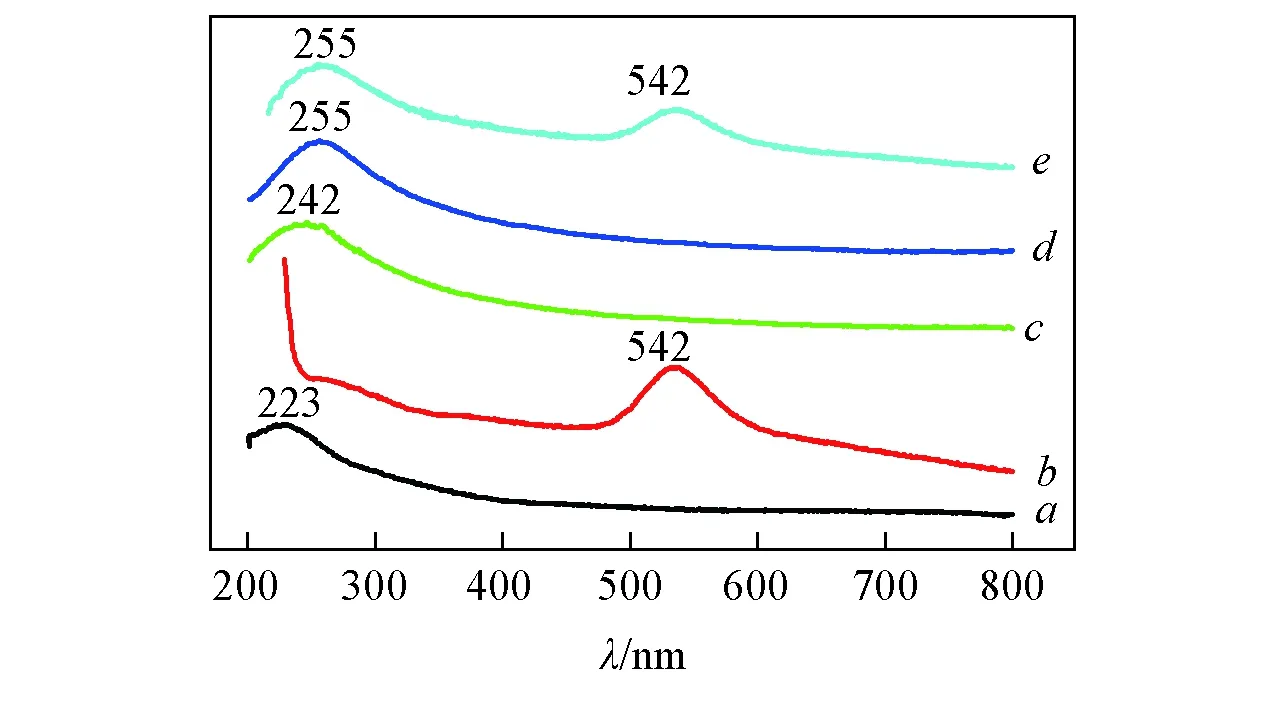
Fig.2 UV-Vis absorption spectra of GO(a), PDDA-AuNPs(b), MWCNTs-GO(c), MWCNTs-rGO(d) and MWCNTs-rGO/PDDA-AuNPs hybrids(e)

2.2电化学有效面积的计算

Fig.3 Q-t curves for the bare GCE(a), MWCNTs-rGO/GCE(b) and MWCNTs-rGO/PDDA-AuNPs/GCE(c) in 0.2 mmol/L K3[Fe(CN)6] with pulse width of 0.25 s
计时电量法是电化学研究体系中用于测量固体电极面积的有效方法. 本文考察了不同修饰电极在0.2mmol/LK3[Fe(CN)6]溶液中的计时电量行为, 所得Q-t曲线如图3所示. 根据Cottrell方程:
(1)
可得Q-t1/2之间呈线性关系, 依据Q-t1/2关系曲线的直线斜率, S=2nFACD1/2/π1/2(A为工作电极的有效面积; C为探针分子的浓度; D为扩散系数, 约为6.057×10-6cm2/s; F为法拉第常数), 可以计算出电极的有效面积. 实验测得裸GCE,MWCNTs-rGO/GCE和MWCNTs-rGO/PDDA-AuNPs/GCE电极的有效表面积分别为0.0701, 0.159和0.259cm2, 说明复合物MWCNTs-rGO具有较大的比表面积, 是一种性能优良的载体. 当负载上PDDA-AuNPs后, 所得MWCNTs-rGO/PDDA-AuNPs复合物的有效面积进一步增大, 可以增加Rac被催化氧化的活性位点及对Rac的总吸附量, 从而提高对目标分子检测的灵敏度, 降低其检出限.
2.3莱克多巴胺在电极表面的电催化氧化行为
为了探讨Rac在修饰电极上的电催化氧化特性, 考察了裸GCE,PDDA-AuNPs/GCE,MWCNTs-rGO/GCE和MWCNTs-rGO/PDDA-AuNPs/GCE在0.01mol/LPBS缓冲溶液中对Rac的循环伏安(CV)行为, 结果如图4所示.
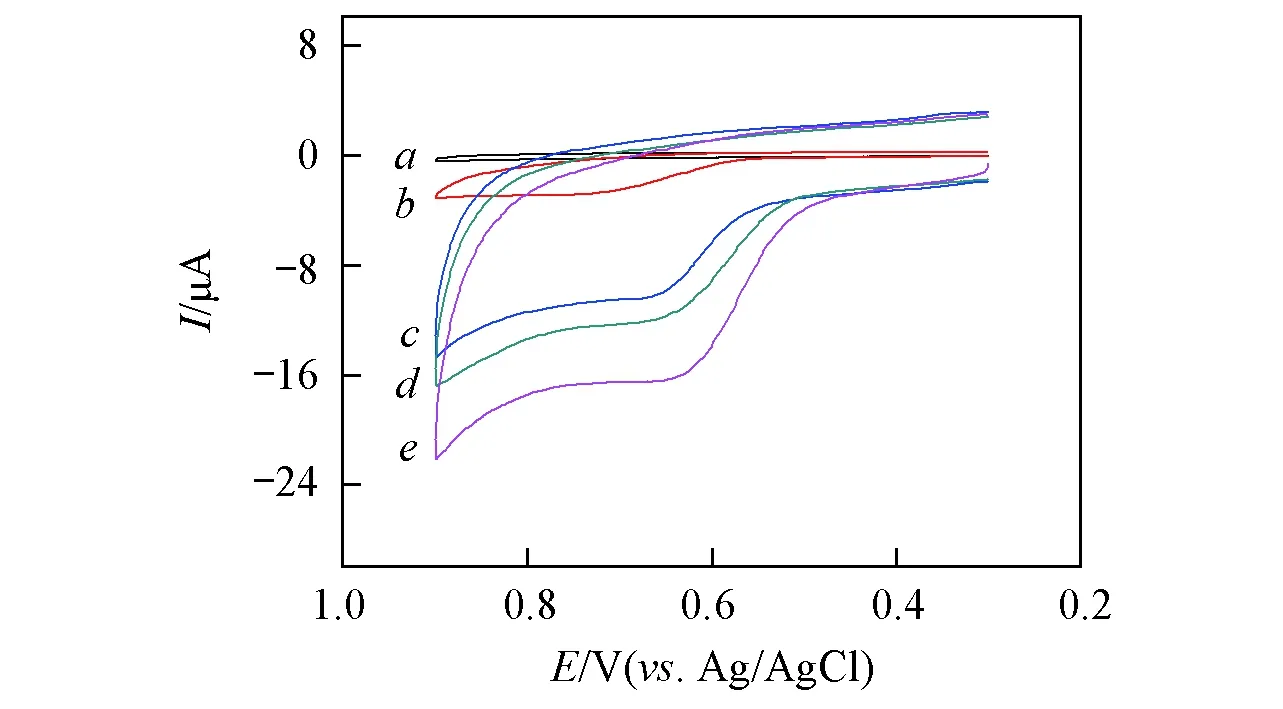
Fig.4 CV curves for the oxidation of Rac at bare GCE without(a) and with(b) 3.6×10-6 mol/L Rac, and at PDDA-AuNPs/GCE(c), MWCNTs-rGO/GCE(d) and MWCNTs-rGO/PDDA-AuNPs/GCE(e) in PBS(0.01 mol/L, pH=6.5) containing 3.6×10-6 mol/L Rac Scan rate: 50 mV/s.
图4曲线a和b分别示出了不存在及存在Rac时裸GCE的循环伏安行为, 可见Rac在裸GCE上的电化学行为是一个不可逆的氧化过程, 氧化峰电位约0.75V, 且过电位较大. 这印证了Rac在普通电极上较难被氧化的结论. 图4曲线c和d示出了PDDA-AuNPs和MWCNTs-rGO复合物修饰电极对Rac的循环伏安行为, 可见修饰电极的响应信号比裸GCE明显增强, 且峰电位发生负移. 然而, 相比于前三者,MWCNTs-rGO/PDDA-AuNPs/GCE(图4曲线e)对Rac的氧化峰电流显著增大, 且其峰电位负移至约0.65V, 与裸GCE相比, 其阳极过电位降低约100mV, 说明该复合材料修饰电极对Rac显示出较好的电催化氧化性能, 这可能是由于在MWCNTs-rGO复合物上负载了PDDA功能化的AuNPs, 而AuNPs具有比表面积大及表面活性高等特点, 从而有效提高了复合材料的电子传导能力, 增大了复合材料的比表面积, 导致其对Rac的催化氧化活性大大提高.
2.4pH对催化氧化莱克多巴胺的影响
考察了MWCNTs-rGO/PDDA-AuNPs/GCE在不同pH值的PBS缓冲液中, 对2.64×10-6mol/L的Rac溶液的DPV行为,Rac的氧化峰电流和峰电位随pH变化的关系如图5所示. 由图5(A)可见, 当缓冲溶液的pH值由4.0增至6.5时,Rac的氧化峰电流也随之增大, 在pH=6.5时氧化峰电流达到最大值; 继续增大PBS缓冲液的pH, 峰电流随之减小. 因此, 选择pH=6.5 的PBS缓冲体系作为检测Rac的最优pH值. 由图5(B)可见,pH值与峰电位具有良好的线性关系, 说明氧化Rac的过程涉及质子的转移, 其线性拟合方程为Epa=0.887-0.0541pH, 线性相关系数R=0.999, 根据能斯特方程Ep=E0-nRT/zFpH(式中: n为反应转移的质子数; z为转移的电子数), 当n=z时, Epa=常数-0.0592pH, 而此处的能斯特斜率为0.0541, 由此可推算出n=0.914 z, 即n≈z, 说明Rac在该修饰电极上的电化学行为是一个等电子等质子的过程.

Fig.5 Effects of pH on the oxidation peak current(A) and peak potential(B) of 2.64×10-6 mol/L Rac in 0.01 mol/L PBS
2.5莱克多巴胺在修饰电极上的氧化机理
循环伏安法是一种常用来推断反应机理及电极反应可逆程度的有效手段. 本文采用循环伏安法考察了Rac在MWCNTs-rGO/PDDA-AuNPs/GCE上的电化学行为. 为进一步探讨Rac在该复合膜修饰电极上的氧化机理, 考察了扫描速率与氧化Rac的峰电流和峰电位的关系, 结果如图6所示.

Fig.6 CV curves of MWCNTs-rGO/PDDA-AuNPs/GCE responding to Rac at different scan rates(A), plots of peak current vs. scan rate(B) and peak potential vs. logarithmic scan rate(C) Scan rate/(mV·s-1): a. 10; b. 25; c. 50; d. 75; e. 100; f. 125.
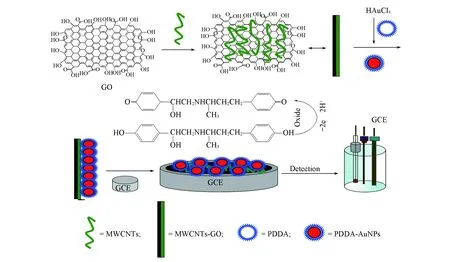
Fig.7 Schematic diagram for preparation of MWCNTs-rGO/PDDA-AuNPs/GCE modified GCE and its detecting of Rac
图6(A)示出了不同扫描速率下Rac在修饰电极上的CV行为. 由图6(A)可见,Rac在电极上的电化学行为是一个不可逆的氧化过程, 其峰电流随着扫描速率v的增大而增加[图6(B)], 峰电流与扫描速率成正比, 其线性拟合方程为Ip=2.07+0.0936v(R=0.998), 表明Rac在修饰电极上的电催化氧化是一个受吸附控制的过程. 由图6(C)可知峰电位与扫描速率对数呈现较好的线性关系, 线性拟合方程为Ep=0.5426+0.06757lgv(R=0.999), 根据Laviron公式[33]:
(2)
式中: E0′为式电位; T为温度; α为电子传递系数; n为电子传递数; k0为标准异相电子传递速率常数; F为法拉第常数. 而Epa=0.5426+0.06757lgv, 对比式(2)得αn=0.8820, 常温下不可逆电极反应的α=0.4~0.6, 因此参与Rac氧化过程的电子数n≈2, 这与文献[24]结果一致. 而2.4节得出Rac在修饰电极上氧化过程为一个等电子和等质子的过程, 因此Rac在修饰电极上的氧化转移的质子数也为2, 根据其结构推断在修饰电极上的氧化反应机理如图7所示.
2.6莱克多巴胺的电化学检测
在优化的实验条件下, 采用DPV法以MWCNTs-rGO/PDDA-AuNPs/GCE复合膜修饰玻碳电极对不同浓度的Rac进行电化学检测, 所得结果如图8所示. 由8(B)可见,Rac的浓度与氧化峰电流呈线性关系, 线性拟合方程为Ip=0.7509+0.3825c; 线性相关系数R=0.9986, 检测的线性范围为3.6×10-8~4.6×10-6mol/L, 检出限为6.35×10-9mol/L(S/N≥3). 与已报道的催化氧化型方法[24,25]相比, 该方法具有较低的检出限及较宽的线性范围, 表明该复合膜修饰电极对检测Rac具有优异的响应性能.

Fig.8 DPV curves of MWCNTs-rGO/PDDA-AuNPs/GCE responding to different concentrations of Rac in 0.01 mol/L PBS(pH=6.5)(A) and linear plot of response current vs. concentration(B) c/(mol·L-1): a. 3.6×10-8; b. 6.60×10-8; c. 3.96×10-7; d. 7.92×10-7; e. 1.45×10-6; f. 2.90×10-6; g. 3.60×10-6; h. 4.50×10-6. Accumulation potential: -0.3 V, accumulation time: 120 s.
2.7电极的稳定性与重现性
对该复合膜修饰电极的稳定性进行了测试, 即每天测试其对Rac的响应, 记录其氧化峰电流, 15d内峰电流波动幅度较小, 其电流响应的平均值为(1.234±0.085)×10-6A(n=21), 电流响应变化的相对标准偏差为6.4%. 使用21d后样品在修饰电极上的响应信号为最初的83.33%, 表明该修饰电极具有良好的稳定性.
采用同一批次相同条件下制备的6只修饰电极检测1.45×10-6mol/L的Rac, 所得结果的相对标准偏差为4.1%, 表明该电极具有良好的重现性. 而且, 用同一支修饰电极对1.45×10-6mol/L的Rac连续检测5次, 相对标准偏差为1.7%, 说明该电极具有良好的重复性.
2.8干扰实验
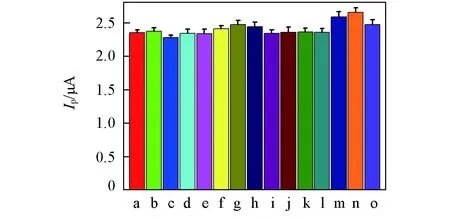
Fig.9 Effect of interferring substance on the modified electrode a. Rac; b. L-Leucine; c. L-Cysteine; d. L-Arginine; e. L-Alanine; f. L-Glycine; g. ascorbic acid; h. I-; i.j.l. Zn2+; m. Cle; n. Sal; o. Pea.
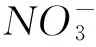
2.9分析应用
采用MWCNTs-rGO/PDDA-AuNPs复合膜修饰电极对实际样品中猪血清及猪尿样中的Rac进行了检测. 在预处理过的猪血清和猪尿样中均未检测到Rac. 采用标准加入法, 分别向预处理过的猪血清和猪尿样溶液中加入不同浓度的Rac, 用修饰电极进行检测并计算回收率. 由表1可知, 测得的回收率在95.4%~105.9%之间, 说明该传感器具有较好的准确性, 可以用于实际样品的检测.

Table 1 Application of MWCNTs-rGO/PDDA-AuNPs/GCE for determination of
3结论
制备了MWCNTs-rGO/PDDA-AuNPs复合膜修饰电极, 循环优安测试结果表明该电报对Rac显示出优异的电催化氧化活性, 且Rac在该电极上的电化学行为为两电子两质子转移过程. 将其应用于猪血清及猪尿样品中Rac的检测, 回收率达到95.4%~105.9%, 并显示出良好的稳定性、 重现性、 选择性和灵敏性, 表明该修饰电极在食品安全检测领域具有很好的应用前景.
参考文献
[1]SainzR.D.,KimY.S.,DunsheaF.R.,CampbellR.G., Aust. J. Agr. Res., 1993, 4, 1449—1455
[2]EisemannJ.,HuntingtonG.,NienaberJ., Faseb J., 1995, 9, 192
[3]BoydR.D.,BaumanD.E.,FoxD.G.,ScanesC.G., J. Anim. Sci., 1991, 69, 56—75
[4]Martinez-NavarroJ.F., Lancet, 1990, 336, 1311
[5]BolerD.D.,ShreckA.L.,FaulknerD.B.,KilleferJ.,McKeithF.K.,HommJ.W.,ScangaJ.A., Meat Sci., 2012, 92, 458—463
[6]BarbosaJ.,CruzC.,MartinsJ.,SilvaJ.M.,NevesC.,AlvesC.,RamosF.,DaSilveiraM.I., Food Addit. Contam., 2005, 22, 563—566
[7]CourtheynD.,BizecB.L.,BrambillaG.,BrabanderH.F.D.,CobbaertE.,WieleM.V.,VercammenJ.,WaschK.D., Anal. Chim. Acta, 2002, 473, 71—82
[8]ZuoP.,ZhangY.,LiuJ.,YeB.C., Talanta, 2010, 82, 61—66
[9]TurbergM.E.,RodewaldJ.M.,ColemanM.R., J. Chromatogr. B, 1996, 675, 279—285
[10]WangL.,LiY.Q.,ZhouY.K.,YangY., Chromatographia, 2010, 71, 737—739
[11]NielenM.W.F.,LasaromsJ.J.P.,EssersM.L.,OosterinkJ.E.,MeijerT.,SandersM.B.,ZuidemaT.,StolkerA.A.M., Anal. Bioanal. Chem., 2008, 391, 199—210
[12]ZhouY.,WangP.L.,SuX.O.,ZhaoH.,HeY.J., Talanta, 2013, 112, 20—25
[13]WangW.Y.,ZhangY.L.,WangJ.Y.,ShiX.,YeJ.N., Meat Sci., 2010, 85, 302—305
[14]ZhangH.C.,LiuG.Y.,ChaiC.Y., Sensor. Actuat. B: Chem., 2012, 168, 103—110
[15]KongL.J.,PanM.F.,FangG.Z.,HeX.L.,YangY.K.,DaiJ.,WangS., Biosens. Bioelectron., 2014, 51, 286—292
[16]KongL.J.,PanM.F.,FangG.Z.,QianK.,WangS., Anal. Bioanal. Chem., 2012, 404, 1653—1660
[17]LiuH.L.,LiuD.R.,FangG.Z.,LiuF.F.,LiuC.C.,YangY.K.,WangS., Anal. Chim. Acta, 2013, 762, 76—82
[18]WangH.,ZhangY.,LiH.,DuB.,MaH.M.,WuD.,WeiQ., Biosens. Bioelectron., 2013, 49, 14—19
[19]WangM.H.,KangM.M.,GuoC.P.,FangS.M.,HeL.H.,JiaC.X.,ZhangG.H.,BaiB.,ZongW.,ZhangZ.H., Electrochim. Acta, 2015, 182, 668—675
[20]HanJ.,GaoH.F.,WangW.W.,WangZ.X.,FuZ.F., Biosens. Bioelectron., 2013, 48, 39—42
[21]WuC.,SunD.,LiQ.,WuK.B., Sens. Actuat. B: Chem., 2012, 168, 178—184
[22]LiuZ.,ZhouY.K.,WangY.Y.,ChengQ.,WuK.B., Electrochim. Acta, 2012, 74, 139—144
[23]BaiW.Q.,HuangH.Y.,LiY.,ZhangH.Y.,LiangB.,GuoR.,DuL.L.,ZhangZ.W., Electrochim. Acta, 2014, 117, 322—328
[24]YangX.,FengB.,YangP.,DingY.L.,ChenY.,FeiJ.J., Food Chem., 2014, 145, 619—624
[25]RajkumarM.,LiY.S.,ChenS.M., Colloid. Surface. B, 2013, 110, 242—247
[26]MatthewJ.A.,VincentC.T.,RichardB.K., Chem. Rev., 2010, 110(1), 132—145
[27]LeeC.,WeiX.,KysarJ.W.,HoneJ., Science, 2008, 321, 385—388
[28]FanZ.J.,YanJ.,ZhiL.J.,ZhangQ.,WeiT.,FengJ.,ZhangM.L.,QianW.Z.,WeiF., Adv. Mater., 2010, 22, 3723—3728
[29]ShinM.K.,LeeB.,KimS.K.,LeeJ.A.,SpinksG.M.,GambhirS.J.,WallaceG.G.,KozlovM.E.,BaughmanR.H.,KimS.J., Nat. Commun., 2012, 3, 650—657
[30]ChenH.J.,WangY.L.,WangY.Z.,DongS.J.,WangE.K., Polymer, 2006, 47, 763—766
[31]YinH.S.,ZhouY.L.,MaQ.,AiS.Y.,JuP.,ZhuL.S.,LuL.N., Process Biochem., 2010, 45, 1707—1712
[32]DangG.J.,WangM.,WangZ.Q.,LiH.Y.,ZhangQ.S., Chem. J. Chinese Universities, 2014, 35(12), 2680—2687(党国举, 王淼, 王昭勍, 李海燕, 张全生. 高等学校化学学报, 2014, 35(12), 2680—2687)
[33]LavironE., J. Electroanal. Chem. Interfacial Electrochem., 1979, 101, 19—28
(Ed.:N,K)
†SupportedbytheNationalNaturalScienceFoudationofChina(Nos.21275022, 21545010, 31527803).
doi:10.7503/cjcu20160026
收稿日期:2016-01-13. 网络出版日期: 2016-04-15.
基金项目:国家自然科学基金(批准号: 21275022, 21545010, 31527803)资助.
中图分类号O657.1; O646.54
文献标志码A
MWCNTs-rGO/PDDA-AuNPsNanocompositeModifiedElectrodeforSensitiveDetectionofRactopamine†
XUNYan,CAOZhong*,SONGTianming,LÜChaozhi,LIUFeng,HEJinglin,YANGRonghua
(Collaborative Innovation Center of Micro/nano Bio-sensing and Food Safety Inspection, Hunan Provincial Key Laboratory of Materials Protection for Electric Power and Transportation, School of Chemistry and Biological Engineering, Changsha University of Science and Technology, Changsha 410114, China)
AbstractA nanocomposite film of MWCNTs-rGO/PDDA-AuNPs was fabricated through self-assembly method. The surface morphologies of different composite modified glassy carbon electrodes(GCEs) were characterized by means of TEM and UV-Vis spectroscopy, and the cyclic voltammetry behaviors of ractopamine(Rac) were investigated. The results showed that the MWCNTs-rGO/PDDA-AuNPs composite exhibited significantly electrocatalytic activity towards oxidation of Rac. The results of differential pulse voltammetry showed that the electrode possessed a linear range of 0.036—4.5 μmol/L and a detection limit of 6.35 nmol/L(S/N≥3) with good stability, reproducibility and selectivity. The electrode can be well applied to determination of Rac in pork serum and pork urine with a recovery rate of 95.4%—105.9%, suggesting a potential application for actual samples in food security field.
KeywordsRactopamine; Reductive graphene oxide; Poly(diallyldimethylammonium chloride); MWCNTs-rGO/PDDA-AuNPs composite; Food safety inspection
联系人简介: 曹忠, 男, 博士, 教授, 主要从事纳米生物传感与食品安全检测.E-mail:zhongcao2004@163.com
