桃核承气汤对糖尿病大鼠大血管纤维病变Toll样受体通路作用研究*
2016-08-11武海阔
徐 阳,王 军,武海阔
(天津中医药大学第一附属医院,天津 300193)
桃核承气汤对糖尿病大鼠大血管纤维病变Toll样受体通路作用研究*
徐阳,王军,武海阔
(天津中医药大学第一附属医院,天津300193)
[目的]通过免疫印记法检测实验性Ⅱ型糖尿病大鼠下肢股血管中Toll样受体-2(TLR-2)、Toll样受体-4 (TLR-4)表达,并通过观察桃核承气汤对相关指标影响,揭示糖尿病大血管纤维化病变的发病机制,及中药桃核承气汤在糖尿病血管纤维化中的干预作用。[方法]雄性SD大鼠170只,随机分为5组:A-正常对照组(n=30),余140只造糖尿病模型模,造模成功123只,随机分为4组:B-模型对照组(n=31)、C-中药高剂量治疗组(n=30)、D-中药中剂量治疗组(n=31)、E-中药低剂量治疗组(n=31);A组不予药物干预,B组每日给予0.9%生理盐水10 mL/kg灌胃,C组每日给予桃核承气汤1.8g/kg,D组每日给予桃核承气汤0.9g/kg,E组每日给予桃核承气汤0.45g/kg。药物干预第1周、12周、20周,按计划处死大鼠,各组分别取材,保存标本,免疫印记法检测TLR-2、TLR-4沉积部位及表达情况。[结果]TLR-2、TLR-4在糖尿病大鼠股动脉中均显著表达,中药桃核承气汤干预可有效降低TLR-2及TLR-4的表达。[结论]糖尿病大血管病变可能与Toll样受体通路有关,中药组方桃核承气汤对糖尿病大血管病变有明显改善作用,可减缓纤维化进程,其干预作用于用药剂量和用药时间相关。
大血管纤维化;桃核承气汤;Toll样受体2;Toll样受体-4
糖尿病的发病率在全球呈快速增长趋势,其已经成为另一大严重影响人类生命质量的慢性疾病。研究发现糖尿病患者截肢标本中,血管病变是以内膜的纤维性增厚为主脂质沉积以纤维成分所占比例大[1]。本研究从Toll样受体(TLRs)通路探讨糖尿病血管纤维病变机制,并阐明活血化瘀药物干预糖尿病血管纤维病变机制。
1 材料与方法
1.1实验材料
1.1.1实验动物清洁级雄性SD大鼠170只,2月龄,体质量160~200 g,由天津实验动物中心提供。
1.1.2实验药物桃核承气汤(桃仁∶大黄∶桂枝∶甘草∶芒硝=2∶2∶1∶1∶1),由天津中医药大学颗粒剂药房制作,每克颗粒剂相当于生药10 g,根据人与大鼠体表面积换算,人桃仁用药剂量为30 g时,大鼠的用药剂量约为每日0.90 g/kg。生理盐水:天津大家制药有限公司生产。精蛋白锌胰岛素注射液:400 IU/瓶,由江苏万邦生化医药有限公司生产。
1.1.3实验仪器血糖仪:德国罗氏活力型血糖仪。稳压电泳仪:六一仪器,北京。高速离心机:Sigma,美国。水浴箱:精宏实验设备有限公司,上海。干燥消毒烤箱(DHG-9246A):精宏试验设备有限公司,上海。台式离心机:Eppendorf公司,德国。转膜仪:六一仪器,北京。灌胃针、注射器、10 mL玻璃瓶、止血钳、直剪、试管、吸管等。
1.1.4实验试剂Toll样受体-2(TLR-2)一抗:Abcam,英国。Toll样受体-4(TLR-4)一抗:Abcam,英国。Lysis buffer:Sigma,美国。Western Lightning® -ECL,Enhanced Chemiluminescence Substrate:Perkin Elmer,美国。牛血清白蛋白:Sigma,美国。GAPDH内参抗体:赛尔生物,天津。辣根过氧化酶(HRP)标记二抗:赛尔生物,天津。DAB显色试剂盒:中衫金桥,北京。
1.2实验方法
1.2.1实验分组造模前分组:A-正常对照组(n= 30)、其余实验组(n=140);按计划造模,造模意外死亡大鼠9只,另8只大鼠未成模,剔除实验。造模后分组:A-正常对照组(n=30)、B-模型对照组(n= 31)、C-中药高剂量治疗组(n=30)、D-中药中剂量治疗组(n=31)、E-中药低剂量治疗组(n=31);其中A组为正常血糖组;B、C、D、E组共123只大鼠非禁食状态下血糖维持在25.0 mmol/L左右。
1.2.2实验干预所有大鼠适应性喂养2周后,A组继续予普通饲料喂养,其余各组高脂高糖喂养,诱导胰岛素抵抗,4周后,B、C、D、E 4组分别造糖尿病模型。B、C、D、E组共123只大鼠成功制成糖尿病模型后,稳定血糖1周,维持非禁食状态血糖25.0 mmol/L左右,开始进入实验二阶段。
A组不予药物干预,B组给予0.9%生理盐水10mL/(kg·d)灌胃,C组给予桃核承气汤1.8g/(kg·d),D组给予桃核承气汤0.9 g/(kg·d),E组给予桃核承气汤0.45 g/(kg·d)。连续药物干预第1周、12周、20周,按计划处死大鼠,各组分别取材,保存标本,待动物实验结束后进行下一步检测分析。
1.3检测分析
1.3.1取材方法严格按照上述方法饲养,分别于第1、12、20周,每组随机选取10只大鼠(数量不足时按实际情况选取),禁食24 h后,用10%的水合氯醛3 g/kg麻醉,麻醉成功后将大鼠仰卧位固定在大鼠固定板上,先用清水湿润股内侧及腹股沟区的鼠毛,然后再用剪子剪去鼠毛进行备皮,备皮后常规消毒手术区皮肤。根据股动脉搏动情况确定股动脉的位置和走行方向,沿股动脉走向纵向切开皮肤,用蚊式钳钝性分离组织,以暴露股动脉鞘。分离时动作要轻柔,不得用刀剪等锐利器械,以防损伤血管和神经。股动脉鞘内有并行的股动脉、股静脉、股神经,直径由粗到细,其中呈粉红色且触之有搏动的粗大血管即为股动脉。用眼科镊顺着血管走向钝性分离股动脉约4~5 cm,两端剪断,磷酸盐缓冲液(PBS)冲洗,平均分成两部分,一部分采用4%多聚甲醛进行固定,另一部分置于无菌冻存管中,-80℃冰箱保存。
1.3.2标本TLR-2、TLR-4免疫印记检测蛋白印迹(Western blotting)法:1)将组织剪成小块,并置于匀浆器中。匀浆器中加入适量的含有蛋白酶抑制剂的蛋白裂解液,冰上作用并不断的对组织样本进行匀浆处理,收集裂解后的细胞碎片及释放出的蛋白。然后利用BSA蛋白定量法对各样本的蛋白浓度进行分析。2)SDS-PAGE凝胶电泳分离蛋白:配制分离胶为10%的SDS-PAGE凝胶。取32 μL总蛋白+8 μL的5×Loading Buffer经煮沸3min后立即冰置3 min,上样。100 V电压电泳。3)电转膜:电泳分离后的蛋白电转至硝酸纤维素膜上(Millipore,USA),350 mA,120 min,在4℃进行。4)封闭:将硝酸纤维素膜做标记以区分正反面及左右侧,浸入Blotto封闭液中,室温摇床上轻轻摇动1.5 h。5)与一抗的结合:在摇床上4℃轻轻摇动过夜。6)在1× TBST中摇动浸洗3次×5 min,洗去非特异结合的一抗。7)与二抗的结合:将上膜和下膜分别浸入含相应HRP标记二抗的Blotto中,室温轻轻摇动2 h。8)在1×TBST中摇动浸洗3次×5min,洗去非特异结合的二抗。9)最后用Western Lightning®-ECL,EnhancedChemiluminescenceSubstrate(PerkinElmer,NEL100001EA)检测,显影。
1.4统计学处理所有统计计算均用SAS v9.1.3统计分析软件进行,计量资料以均数±标准差(±ss)表示,正态分布计量资料组间比较单因素方差分析,偏态分布计量资料组间比较Kruskal-Wallis H检验。P<0.05为差异有统计学意义。
2 实验结果
实验过程顺利,各组死亡大鼠共15只:A组1只,B组5只,C组2只,D组3只,E组4只,实验结束时各组实验大鼠数量为:A组9只,B组6只,C组8只,D组8只,E组7只。
2.1大鼠股动脉TLR-2 Western blotting检测分析见表1。
表1 各组大鼠股动脉TLR-2比较(±ss)Tab.1 Comparison of TLR-2 from the femoral artery of rat in each group(±ss)

表1 各组大鼠股动脉TLR-2比较(±ss)Tab.1 Comparison of TLR-2 from the femoral artery of rat in each group(±ss)
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05,;与高剂量组比较,△P<0.05,;与中剂量组比较,▲P<0.05,。
组别动物数 第1周 动物数 第12周 动物数 第20周A组 10 0.137±0.054 10 0.053±0.017 9 0.083±0.045 B组 10 0.462±0.105* 10 0.819±0.160* 6 0.846±0.337* C组 10 0.337±0.116*# 10 0.213±0.039*# 8 0.327±0.081*#D组 10 0.380±0.096*△ 10 0.364±0.091*#△ 8 0.495±0.200*#E组 10 0.457±0.124*△ 10 0.618±0.160*△▲ 7 0.557±0.282*
实验第1周:除模型组、中剂量组、低剂量组组间比较无统计学差异(P>0.05),其余各组间比较均有统计学差异(P<0.05)。实验第12周:除模型组与低剂量组组间比较无统计学差异(P>0.05),其余各组间比较均有统计学差异(P<0.05)。实验第20周:除模型组与低剂量组及各中药组组间比较无统计学差异(P>0.05),其余各组间比较均有统计学差异(P<0.05)。
用药1周后高剂量组即可表现出对TLR-2的干预作用,而用药至12周,中剂量组与高剂量组均对TLR-2起到的干预作用,但高剂量组干预作用较中剂量组明显。用药至20周,高剂量组与中剂量组干预效果相近。
2.2各组大鼠股动脉TLR-4 Western blotting检测分析见表2。实验第1周:正常对照组与各组间比较有统计学差异(P<0.05),模型组与各组及各中药组组间比较无统计学差异(P>0.05)。实验第12周:除模型组与低剂量组组间比较无统计学差异(P>0.05),其余各组间比较均有统计学差异(P<0.05)。实验第20周:除中药各组组间比较无统计学差异(P>0.05),其余各组间比较均有统计学差异(P<0.05)。用药1周后各中药组未表现出对TLR-4的干预作用,而用药至12周,中剂量组与高剂量组均对TLR-4起到的干预作用,但高剂量组干预作用较中剂量组明显。用药至20周,各中药组对TLR-4干预效果相近。
表2 各组大鼠股动脉TLR-4比较(±ss)Tab.2 Comparison of TLR-4 from the femoralartery of rats in each group(±ss)
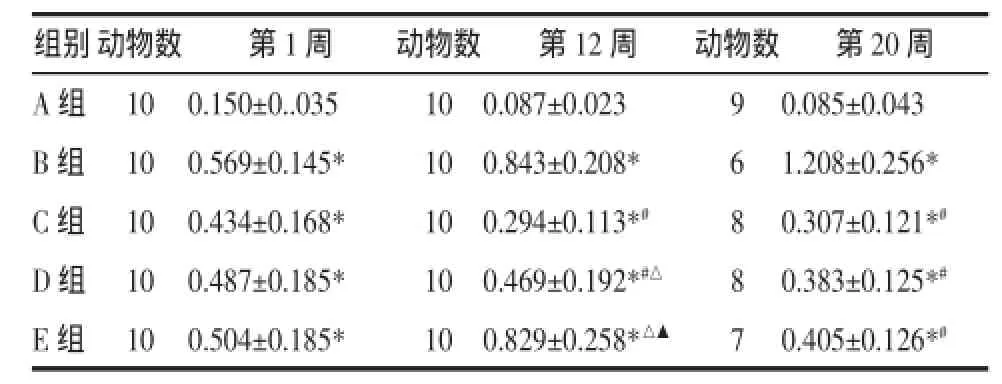
表2 各组大鼠股动脉TLR-4比较(±ss)Tab.2 Comparison of TLR-4 from the femoralartery of rats in each group(±ss)
注:与正常组比较*P<0.05;与模型组比较#P<0.05;与高剂量组比较△P<0.05;与中剂量组比较▲P<0.05。
组别动物数 第1周 动物数 第12周 动物数 第20周A组 10 0.150±0..035 10 0.087±0.023 9 0.085±0.043 B组 10 0.569±0.145* 10 0.843±0.208* 6 1.208±0.256* C组 10 0.434±0.168* 10 0.294±0.113*# 8 0.307±0.121*#D组 10 0.487±0.185* 10 0.469±0.192*#△ 8 0.383±0.125*#E组 10 0.504±0.185* 10 0.829±0.258*△▲ 7 0.405±0.126*#
2.3各组大鼠TLR-2、TLR-4 Western blotting灰度值观察及分析见图1。TLR-2:模型组大鼠TLR-2表达高于普通对照组(P<0.05);中药干预1周后,中药高剂量组TLR-2表达有所降低(P<0.05),中药中剂量组与中药低剂量组TLR-2表达未见明显降低(P>0.05);中药干预12周后,中药高剂量组与中药中剂量组TLR-2表达明显降低(P<0.05),以中药高剂量组下降较为明显(P<0.05),中药低剂量组TLR-2表达有所降低(P<0.05);中药干预20周后,中药高剂量组TLR-2表达降低(P<0.05),中药中剂量组和中药低剂量组TLR-2表达未见明显降低(P>0.05)。TLR-4:模型组大鼠TLR-4表达明显高于普通对照组(P<0.05)。中药干预1周后,各中药干预组TLR-4表达无明显降低(P>0.05);中药干预12周后,中药高、中剂量组TLR-4表达明显降低(P<0.05),中药低剂量组TLR-4表达未见明显降低(P>0.05);中药干预20周后,中药高、中、低剂量组TLR-4表达明显降低(P<0.05)。
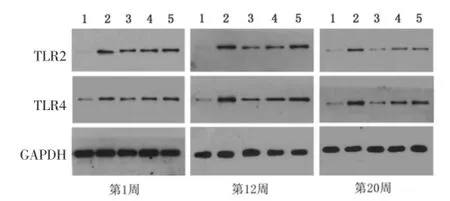
图1 各组大鼠TLR-2、TLR-4 Western blotting灰度值Fig.1 Gray value of TLR-2,TLR-4 of Western blotting of rats in each group
3 讨论
前期研究发现糖尿病足患者血管病变是以内膜的纤维性增厚为主,脂质沉积以纤维成分所占比例大[2]。TGF-β1、CTGF、胶原蛋白Ⅰ、胶原蛋白Ⅲ均在中、晚期糖尿病大鼠的大血管中显著增加,提示糖尿病大血管病变可能与纤维化有关[3-4]。
TLRs是近年发现的先天性免疫系统中的细胞跨膜受体和病原模式识别受体之一。在TLRs与天然免疫应答关系研究中,倍受关注的是TLR-2和TLR-4[5],其在介导肾[6]、心[7]、肝[8]、肺[9]、皮肤[10]等多种组织器官纤维化进程中起十分重要的作用,可能是最主要的致纤维化细胞因子[11-12]。TLRs在动脉纤维化过程中可能起着“分子开关”的重要作用[13-16]。
桃核承气汤出自张仲景《伤寒论》,桃核承气汤可以通过增强超氧化物歧化酶(SOD)的含量和抑制一氧化氮合酶(NOS)的基因表达,增强抗自由基的作用,起到保护血管内皮细胞的作用[17-18],也可以加抑制肝纤维化大鼠TGFβ1的表达,达到抗肝纤维化作用[19]。桃核承气汤对胶原的降解作用增强,使基质合成和降解向平衡方向发展[20],进而达到降低血管纤维化的目的。预示通过活血化瘀药物干预,有逆转糖尿病大血管纤维化病变这一发展过程的可能性。
TLR-2、TLR-4在糖尿病大鼠股动脉中均显著表达,提示糖尿病大鼠大血管的纤维病变可能与Toll样受体通路开放及TLR-2、TLR-4高表达有关。中药桃核承气汤干预可有效降低TLR-2及TLR-4的表达,可明显改善大血管病变情况,减缓纤维化进程,其干预作用于用药剂量和用药时间相关。在本实验中发现,中药桃核承气汤干预12周时,各不同剂量组间TLR-2及TLR-4降低存在差异,以高剂量组降低最为明显,但干预20周时各不同剂量组间TLR-2及TLR-4降低差异消失,表明中药干预可能存在一定药效蓄积作用,这也为我们的进一步研究提供了方向。
[1]Yu Y,Lyons TJ.Alethal tetrad in diabetes:hyperglycemia,dyslipidemia,oxidative stress,and endothelial dysfunction[J].Am J Med Sci,2005,330(5):227-232.
[2]李晓军,郭建恩,庞宗然,等.糖尿病足患者截肢动脉组织的超微病理结构研究[J].中国中医基础医学杂志,2011,17(4):411-412.
[3]王军,徐阳,袁向科,等.实验性糖尿病鼠大血管病变TGF-β 和CTGF的表达及中药的干预作用[J].天津中医药,2012,29(3): 266-269.
[4]丁志明,武海阔,王军.胶原蛋白Ⅰ、胶原蛋白Ⅲ在糖尿病大鼠血管病变中的表达及中药的干预[J].天津中医药,2012,29(6).
[5]常晓彤,辇晓峰,王振辉.Toll样受体信号转导途径研究进展[J].生理科学进展,2011,42(5):340-342.
[6]李在楠,严瑞,聂梦琪,等.Toll样受体4在肾间质纤维化中的表达及意义[J].贵州医药,2013,10(10):867-873.
[7]康晓敏,吕宏娟,王霞,等.Toll样受体4在血管紧张素Ⅱ致高血压小鼠心脏纤维化中的作用[J].中华老年心脑血管病杂志,2012,14(10):1077-1081.
[8]彭莉,肖建华.TLR介导的信号通路在肝纤维化中的作用[J].微生物学免疫学进展,2011,4(4):84-87.
[9]周韶炜,邵伯棕,陈宣辰,等.shRNA特异性静默大鼠肺泡巨噬细胞TLR2基因对染尘大鼠肺纤维化的抑制作用[J].中国工业医学杂志,2013,26(02):88-90.
[10]刘磊,方峰,叶波平.TLR3及其在皮肤纤维化疾病中作用的研究进展[J].药物生物技术,2013,1(1):81-84.
[11]何征宇,朱也森.Toll样受体4与人体纤维化疾病的关系[J].上海交通大学学报(医学版),2009,29(7):873-877.
[12]武海阔,陈浩,王军.Toll样受体在大血管病变中作用[J].辽宁中医药大学学报,2014,1(01):95-97.
[13]周立华,李军,邹娜姝,等.TLR2和TLR4相关疾病与药物的研究进展[J].细胞与分子免疫学杂志,2014,30(7):767-770.
[14]Dunzendorfer S,Lee HK,Tobias PS.Flow-dependent regulation of endothelial Toll-like receptor 2 expression through inhibition of SP1 activity[J].Circ Res,2004,95:684-691.
[15]Walton KA,Hsieh X,Gharavi N,et al.Receptors involved in the oxidized1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphorylcholine-mediated synthesis of interleukin-8.Arole forToll-like receptor 4 and a glycosylphosphatidylinositol-an-chored protein[J].J Biol Chem,2003,278(32):661-666.
[16]Claudia Monaco,Scott M.Gregan,Tina J.Navin,et al.Toll-Like Receptor-2 Mediates Inflammation and Matrix Degradation in Human Atherosclerosis[J].Circulation,2009,120:2462-2469.
[17]孙文斌,徐莉,何赛萍.桃核承气汤对蓄血证大鼠血管MMP-2,TIMP-2基因表达的影响[J].浙江中医药大学学报,2008,32(1): 38-40.
[18]何赛萍,徐莉.桃核承气汤对蓄血证大鼠血管内皮细胞保护作用的实验研究[J].中医研究,2008,21(4):11-14
[19]赵治友,邬亚军,张俊.加味桃核承气汤对肝纤维化大鼠TGFβ1蛋白表达的影响[J].浙江中医药大学学报,2010,34(2):166-168.
[20]赵治友,邬亚军,林庚庭,等.加味桃核承气汤对四氯化碳所致肝纤维化模型大鼠TIMP-1蛋白表达的影响[J].中西医结合肝病杂志,2007,17(1):32-34.
(本文编辑:马英,张震之)
Study of Taohe Chengqi Tang on Toll-like receptor passage in diabetic vascular fibrosis with rats
XU Yang,WANG Jun,WU Hai-kuo
(The First Affiliated Hospital of Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]Using Western blotting to detect the expression of TLR-2,TLR-4 which from the diabetes rats in lower limb femoral vessels,and observing by Taohe Chengqi Tang(THCQT)impact on related indicators,revealing intervention mechanisms of THCQT on diabetic vascular fibrosis.[Methods]The 170 male SD rats were divided into five groups,A-the normal control group(n=30),other 140 making diabetes model and succeed 123,randomly divided into 4 groups:B-model control group(n=31),C-Chinese high-dose treatment group(n=30),D-medicine dose treatment group(n=31),E-low dose treatment group(n=31).A group was no drug intervention,group B received 0.9%saline 10 mL/(kg·d)orally,group C was given THCQT 1.8 g/kg,D group was given THCQT 0.9 g/kg,E group was given THCQT 0.45 g/kg.Drug intervention first weeks,12 weeks,20 weeks,the rats were sacrificed according to plan,the groups were drawn,preserved specimens,Western blotting detection TLR-2 and TLR-4 expression.[Results]TLR-2 and TLR-4 has significant expression in diabetic rat femoral artery,TCD THCQT can effectively reduce the expression of TLR-2 and TLR-4.[Conclusion]Diabetic vascular disease may be associated with Toll-like receptor pathway and apoptosis,TCD THCQT can obviously improve diabetic vascular lesions,and slow down the fibrosis process,its intervention effect associated with dosage and duration.
macrovascular fibrosis;THCQT;Toll-like receptor-2;Toll-like receptor-4
R587.1
A
1672-1519(2016)05-0299-04
10.11656/j.issn.1672-1519.2016.05.11
国家自然科学基金项目(81173268)。
徐阳(1982-),女,硕士,主治医师,主要从事中医糖尿病足与周围血管病相关研究工作。
2015-12-20)
