酶法制备花生粕醒酒多肽
2016-08-10宁庆鹏王常青白云云山西大学生命科学学院山西太原030006
宁庆鹏,王常青*,方 甜,白云云,陈 彤(山西大学生命科学学院,山西 太原 030006)
酶法制备花生粕醒酒多肽
宁庆鹏,王常青*,方 甜,白云云,陈 彤
(山西大学生命科学学院,山西 太原 030006)
摘 要:为更合理有效地利用花生粕资源,制备具有醒酒作用的花生粕多肽,本实验以Alcalase AF 2.4L蛋白酶酶法制备花生粕醒酒肽,经分级分离后,通过体外和动物实验验证其醒酒效果。结果表明,花生粕醒酒肽制备最佳工艺条件为:酶解时间3 h、酶解温度35 ℃、pH 9.5及料液比1∶30(m/V)。该条件下乙醇脱氢酶(alcohol dehydrogenase,ADH)激活率及多肽得率均较高。经分级分离后,分子质量在1 000~3 000 D的多肽对ADH激活作用最强,激活率为30.47%。G25凝胶色谱分析表明,花生粕多肽中小于3 000 D的多肽占89.55%,ADH激活率为29.25%。动物实验证明,花生粕多肽对小鼠有显著的防醉醒酒作用。小鼠血液乙醇含量测定结果表明,高剂量的花生粕多肽在60~90 min内能显著降低小鼠血液中的乙醇含量。
关键词:花生粕;醒酒肽;蛋白酶;乙醇脱氢酶激活率
引文格式:
宁庆鹏, 王常青, 方甜, 等.酶法制备花生粕醒酒多肽[J].食品科学, 2016, 37(13): 173-177.DOI:10.7506/spkx1002-6630-201613031. http://www.spkx.net.cn
NING Qingpeng, WANG Changqing, FANG Tian, et al.Preparation of polypeptides with sobering effect from peanut meal by enzymatic hydrolysis[J].Food Science, 2016, 37(13): 173-177.(in Chinese with English abstract) DOI:10.7506/ spkx1002-6630-201613031. http://www.spkx.net.cn
花生粕是花生果经浸出或压榨提取油脂后的副产品[1-2],其中粗蛋白含量为50%~55%,粗脂肪含量为3%~5%,粗纤维含量为4%~7%,此外还含有丰富的黄酮类物和多种矿质元素[3-4],可开发利用价值较高。在花生粕中,总氨基酸占总蛋白含量的39.65% ,其中必需氨基酸占总蛋白含量的10.85%[5-6],是一种营养价值较高的植物性蛋白资源。但目前我国各地的花生粕主要被用于饲料和肥料,尚未得到合理利用。随着我国食品工业与绿色循环经济的发展要求,花生粕的开发与利用受到人们越来越多的重视。近年来的研究表明,小分子的多肽极易被人体吸收,有些多肽还具有一定的生物活性,如以玉米为原料制备的醒酒多肽[7-9],以沙棘籽制备的抑菌多肽[10]等。目前已有关于花生粕抗氧化肽的研究报道[11-13],但未见到用花生蛋白或花生粕制备醒酒肽的研究报道。本实验用花生粕为原料酶法制备醒酒多肽,研究了该醒酒肽的酶解工艺条件,并进行醒酒肽的乙醇脱氢酶(alcohol dehydrogenase,ADH)激活率实验和小鼠醒酒实验,以期为开发花生粕的新型醒酒产品奠定基础。
1 材料与方法
1.1 材料与试剂
花生粕购于青岛长寿食品有限公司,粗蛋白含量为55.42%。
Alcalase AF 2.4L蛋白酶(酶用量为10 U/mg pro)诺维信生物技术有限公司;ADH(300 U/mg)、氧化性辅酶Ⅰ 上海源聚生物科技有限公司;肌红蛋白、胸腺肽、杆菌肽酶、还原性谷胱甘肽(均为分析纯) 美国Sigma公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2600型紫外-可见分光光度计 尤尼柯(上海)仪器有限公司;Sephadex凝胶色谱系统、UVD-680-3紫外检测仪 上海金达生物科技有限公司;旋转蒸发仪上海申升科技有限公司;数显恒温水浴提取器 国华电器有限公司;卷式超滤-纳滤膜组件 北京安德膜分离技术工程有限公司;SC-3614低速离心机 安徽中科中佳科学仪器有限公司。
1.3 方法
1.3.1 花生粕多肽的制备
花生粕粉末过100 目筛后,加入5 倍(m/V)的清水浸泡提取4 h,4 000 r/min离心弃上清液除水溶性蛋白,取沉淀再加2 倍(m/V)的清水,水洗3 次,然后将得到花生粕沉淀低温烘干备用。取水洗干燥后的花生粕沉淀,按料液比为1∶25(m/V)加入清水,根据蛋白的含量加入Alcalase AF 2.4L(酶用量为5 000 U/g pro),在酶适宜的条件下酶解2 h。酶解结束后沸水浴使酶失活,冷却至室温后,调节pH值至中性,4 000 r/min离心10 min,取上清酶解多肽液浓缩备用[14-16]。
1.3.2 花生粕多肽得率的测定
根据GB 5009.5—2010《食品中蛋白质的测定》[17]测定酶解后水溶性蛋白含量和总蛋白含量;根据QB/T 2879—2007《海洋鱼低聚肽粉测定》[18]中三氯乙酸沉淀法测定酶解前蛋白含量。

1.3.3 ADH激活率的测定
采用瓦勒-霍赫法[19]测定花生粕多肽对ADH的激活作用。按下式计算ADH酶活力。
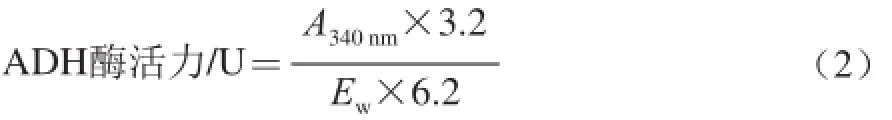
式中:A340 nm为340 nm波长处每分钟吸光度的增大值;Ew为每毫升酶液中含酶量/(mg/mL);6.2为还原型辅酶Ⅰ(NADH)的克分子吸光系数;3.2为反应液的总体积/mL。在规定条件下每分钟还原l μmol NAD+时所需酶量定义为U。按下式计算ADH激活率。

式中:E样品为样品反应液的酶活力/U;E空白为空白反应液的酶活力/U。
1.3.4 酶解条件的单因素试验
以多肽得率和ADH激活率作为评价指标,分别进行酶解时间(1、2、3、4、5 h)、酶解pH值(7.0、8.0、9.0、10.0、11.0)、酶解温度(20、30、40、50、60 ℃)和料液比(1∶15、1∶20、1∶25、1∶30)的单因素试验。
1.3.5 酶解条件的正交试验设计
为了得到高ADH激活率的花生粕多肽,以单因素试验为基础,选取适宜的酶解温度、酶解时间、酶解pH值以及料液比进行L9(34)正交试验。
1.3.6 花生粕多肽的超滤分级与分离
选用截留分子质量为5 000、3 000、1 000 D的超滤膜,得到分子质量为>5 000、3 000~5 000、1 000~3 000、<1 000 D的4 个组分。将所得的4 个组分多肽和原酶解液分别真空浓缩到相同总氮含量后,取样进行分子质量分析和ADH激活率分析。
1.3.7 不同分子质量花生粕多肽的分布
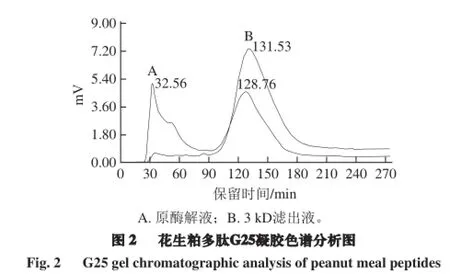
采用Sephadex G-25凝胶色谱分析,Marker为肌红蛋白(17 000 D)、胸腺肽(3 108 D)、杆菌肽酶(1 486 D)和还原性谷胱甘肽(307 D),检测波长为220 nm。以Marker的分子质量对数(lgMw)作为横坐标,洗脱体积(Ve)作为纵坐标绘制曲线,得到回归方程:Ve=-64.718 lgMw+350.320。根据峰面积归一法和方程计算不同分子质量多肽的分布及含量[20-21]。
1.3.8 小鼠的防醉和醒酒翻正反射实验
1.3.8.1 防醉实验
参照文献[22]将灌胃醉酒的小鼠仰卧至四肢朝上,保持姿势30 s作为翻正反射消失的指标。取40 只体质量为(20±2)g雄性昆明小鼠,在(25±3) ℃、相对湿度(50±10)%的封闭环境中饲养1 周,实验前12 h禁食不禁水,随机分为4 组:乙醇模型组,花生粕多肽低、中、高剂量组。市售解酒药建议摄入量为20.2 mg/d,实验动物给药量根据人体摄入量的5、10、20 倍,得到花生粕多肽低、中、高剂量为100、200、400 mg/(kg·d)(以体质量计,下同),乙醇模型组小鼠灌胃剂量为0.1 mL/10 g的生理盐水,实验组小鼠灌胃0.1 mL/10 g剂量的花生粕多肽溶液,30 min后所有小鼠均灌胃相同剂量的酒精含量为56 mL/100 mL的白酒。记录各组给酒后翻正反射消失时间和翻正反射恢复时间及小鼠醉酒只数。
为了验证方法的可行性,本文讨论了3种不同的设计例子。第一个例子是在四边形阵列天线内沿正方形产生电场分布。为此,引入8个辅助偶极子组成的接收天线阵列,偶极子天线阵列沿着正方形电场均匀分布。相邻偶极子天线之间的距离为80 mm(约0.67λ,λ是自由空间中的波长)。通过求解式(3),可以得到四边形天线阵列最优的激励分布,如表1的第二列所示。图6比较了电场分布模拟结果和测试结果,两者吻合较好。
1.3.8.2 醒酒实验
方法与实验指标与1.3.8.1节相同,区别在于小鼠先灌酒后灌胃样液。
1.3.9 小鼠血液中乙醇含量的测定
取体质量为(20±2) g雄性小鼠,随机分为3 组:乙醇模型组和花生粕多肽低、高剂量组(100、400 mg/(kg·d)),每组25 只。各组先灌样液,实验组灌胃0.1 mL/10 g样液,乙醇模型组灌胃0.1 mL/10 g生理盐水。30 min后,3 组均灌胃0.1 mL/10 g剂量的56 mL/100 mL的白酒,在灌胃30、60、90、120、150 min时眼眶取血,参照血液酒精含量的检验方法GA/T 842—2009《血液酒精含量的检验方法》[23]中顶空气相色谱法测定血液中乙醇含量。
1.4 数据统计分析
单因素与正交试验重复3 次,除去异常值,取平均值作为结果。数据用SPSS 18.0软件处理,正交试验结果采用方差分析,醒酒与防醉实验采用t检验分析,结果用±s表示。
2 结果与分析
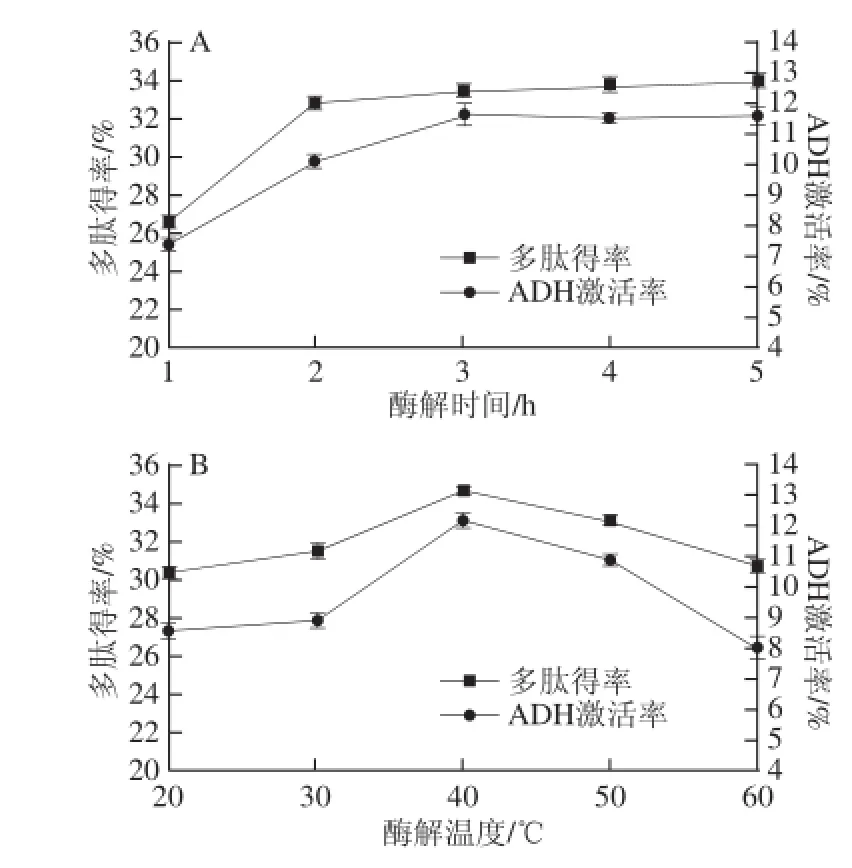
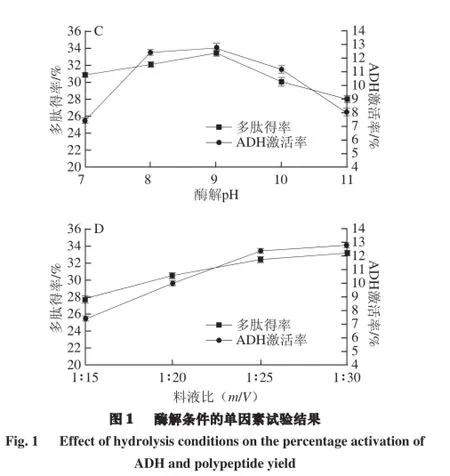
由图1可知,随酶解时间延长,多肽得率与ADH激活率在前3 h增长迅速,3 h后增长变缓,故选3 h为正交试验的基础条件。酶解温度为40 ℃时,多肽得率与ADH激活率均达到最大值,所以选取40 ℃为正交试验的基础条件。而多肽得率和ADH激活率在pH 7.0~8.0间迅速上升,pH 9.0~11.0间迅速下降,pH 9.0时多肽得率及ADH激活率均比其他条件时要高,因此选择pH 9.0作为下一步正交试验的条件。而料液比在1∶25时酶解多肽得率和ADH激活率均较高,继续增加料液比多肽得率和ADH激活率提高缓慢,故选取为正交试验的基础条件。
2.2 酶解条件的正交试验结果

表 1 酶解条件的正交试验设计与结果Table 1 Orthogonal array designarrangement andcorrespondingexperimental results for the optimization of hydrolysis conditions试验号 A酶解时间/h B酶解温度/℃ C酶解pH D料液比(m/V) 多肽得率/% ADH激活率/% 1 1(2.5) 1(35) 1(8.5) 1(1∶20) 32.81 11.37 2 1 2(40) 2(9.0) 2(1∶25) 35.45 9.30 3 1 3(45) 3(9.5) 3(1∶30) 41.21 15.44 4 2(3.0) 1 2 3 47.67 17.51 5 2 2 3 1 33.65 7.27 6 2 3 1 2 48.77 13.35 7 3(3.5) 1 3 2 47.32 13.47 8 3 2 1 3 49.03 9.29 9 3 3 2 1 36.53 8.58 k112.04 14.12 11.34 9.41 k213.04 8.95 11.80 12.04 k310.45 12.46 12.39 14.08 R 2.59 5.17 1.05 4.67
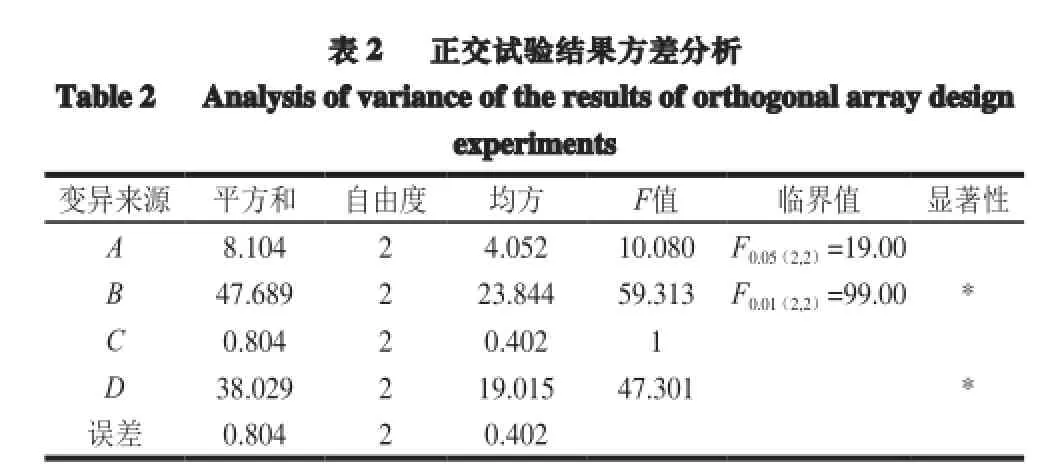
正交试验的9 个试验条件的平均多肽得率为41.38%,ADH的平均激活率为11.73%。由表1可知,4 个因素对ADH激活率影响次序为:B(酶解温度)>D(料液比)>A(酶解时间)>C(酶解pH值)。正交试验以多肽的ADH激活率为主要指标进行分析,最终得到制备的最佳酶解工艺条件为A2B1C3D3,即酶解时间3 h、酶解温度35 ℃、酶解pH 9.5及料液比1∶30。验证实验表明,该条件下所制备的多肽的ADH激活率为18.25%,高于正交试验表中的各试验号,此时多肽得率为40.05%也在较高水平。由方差分析可知(表2),酶解温度和料液比对ADH激活率影响显著,而酶解pH值和时间对ADH激活率影响不明显(P>0.05)。
注:*.差异显著(P<0.05)。
2.3 花生粕多肽分离及分子质量分布分析

表 3 不同种类花生粕溶液的ADH激活率对比结果Table 3 Comparison of percentageADH activation by peanut meal protein,peanutmeal proteinhydrolysateanditsultrafiltration fraction <3000D样品 花生粕蛋白未酶解液 未分级原酶解液 <3 000 D滤出液ADH激活率/% 2.36 20.41 29.25

表 4 各级花生粕多肽的分子质量分布Table 4 Molecularweightdistributionof peanut meal peptides样品 指标 >5 000 D 3 000~5 000 D 1 000~3 000 D<1 000 D分级分离液 ADH激活率/% 7.24 30.47 5.53未分级原酶解液 多肽分子质量分布/% 35.27 8.80 42.41 13.52 <3 000 D滤出液 多肽分子质量分布/% 6.79 3.66 60.12 29.43
由表3、4可知,花生粕蛋白未酶解液的ADH激活率为2.36%,可能是由于花生粕蛋白中含有部分游离氨基酸,而分子质量大于5 000 D的多肽未表现出ADH激活作用,分子质量在1 000~3 000 D的多肽对ADH的激活率最高为30.47%,分子质量在3 000~5 000 D与小于1 000 D的多肽ADH激活率较小,分别为7.24%和5.53%。为了简化分离工艺,实验选取小于3 000 D的分离液进行ADH激活率的测定和G25凝胶色谱分析。由图2可知,该分离液中具有高A D H激活率的1 000~3 000 D的多肽纯度从42.41%提高到了60.12%,ADH激活率也由原酶解液的20.41%上升到29.25%,省去了多级分离的繁琐步骤,且激活率较高,为开发与生产花生粕醒酒肽提供了依据。
2.4 小鼠翻正反射实验结果
2.4.1 防醉实验

注:**.与模型组相比差异极显著(P<0.01);*.与模型组相比差异显著(P<0.05)。表6同。
由表5可知,低剂量组对于延缓小鼠醉酒和缩短醉酒时间有一定作用,但作用不显著(P>0.05)。中剂量组与高剂量组对于延缓醉酒及缩短醉酒时间,分别表现为显著差异(P<0.05)和极显著差异(P<0.01),说明剂量与防醉之间有一定的依存关系,同时也显示了该多肽具有防醉酒作用。
2.4.2 醒酒实验
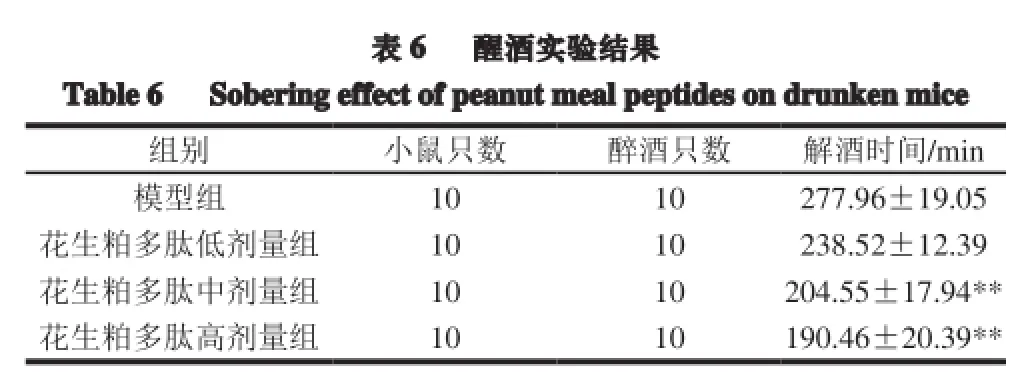
表 6 醒酒实验结果Table6 Sobering effect of peanutmeal peptides on drunken mice组别 小鼠只数 醉酒只数 解酒时间/min模型组 10 10 277.96±19.05花生粕多肽低剂量组 10 10 238.52±12.39花生粕多肽中剂量组 10 10 204.55±17.94**花生粕多肽高剂量组 10 10 190.46±20.39**
由表6可知,与模型组比较,低剂量组不具有显著的醒酒作用。而中、高剂量组的醒酒作用均表现为极显著性差异(P<0.01),说明当剂量达到200 mg/(kg·d)时,该多肽具有良好的醒酒效果,继续加大剂量并不能显著提高醒酒效果。
2.5 小鼠血液中乙醇含量
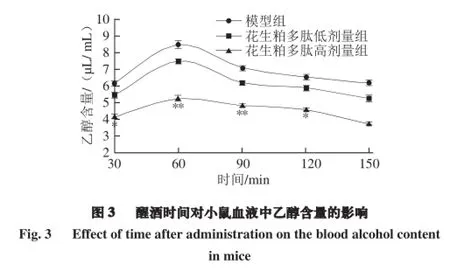
如图3所示,各组动物在灌胃乙醇60 min后,血液中乙醇含量达到最大值,随着时间的延长,乙醇被机体代谢,使血液中的乙醇含量逐渐下降。花生粕多肽低剂量组中血液乙醇含量下降趋势与模型组相近,t检验表明两组间无显著差异性(P>0.05)。而花生粕多肽高剂量组在灌胃后,乙醇含量始终明显低于模型组,在30、120 min处血液中乙醇含量表现出显著降低(P<0.05),在60、90 min时,乙醇含量极显著降低(P<0.01)。说明高剂量花生粕多肽在酒后60~90 min的时间段内醒酒效果最好。
3 结 论
有研究表明,具有ADH激活率作用的多肽能够在肝脏中产生稳定的辅酶(NAD+),提高ADH的活性,促进三羧酸循环,乙醇代谢为乙醛或乙酸,从而降低血液中乙醇的含量[24-25]。本研究采用Alcalase AF酶解花生粕蛋白制备出有ADH激活作用的醒酒肽,并确定了该多肽的最佳制备工艺条件为:酶解时间3 h、酶解温度35 ℃、酶解pH 9.5及料液比1∶30;在此条件下制备的多肽得率为40.05%,ADH激活率为18.25%。由超滤分离分段得到分子质量在3 000 D以下的多肽组分,比未分级的多肽原液ADH激活率显著提高,到达了29.25%。凝胶色谱的分析表明,在3 000 D以下的超滤分离液中,1 000~3 000 D的多肽组分占60.12%,小于1 000 D的多肽占29.43%,其共占总质量的89.55%。小鼠醒酒和防醉实验表明,该多肽在200 mg/(kg·d)的剂量下有良好的醒酒和防醉作用。在灌酒后的60~120 min的时间段内,对于降低血液中乙醇含量有显著作用。
参考文献:
[1] 谢秋涛, 单杨, 李高阳.花生饼粕中活性成分的提取及其综合利用[J].食品工业科技, 2012, 33(14): 417-420.
[2] REDDY N, CHEN L H, YANG Y Q.Thermoplastic films from peanut proteins extracted from peanut meal[J].Industrial Crops and Products,2013, 43: 159-164.DOI:10.1016/j.indcrop.2012.06.051.
[3] 孔涛, 米平, 赵雪淞, 等.碱法提取花生粕蛋白质工艺条件的优化[J].江苏农业科学, 2013, 41(7): 277-279.DOI:10.3969/ j.issn.1002-1302.2013.07.102.
[4] KAIN R J, CHEN Z X, SONDA T S.Study on the effects of enzymatic hydrolysis on the physical, functional and chemical properties of peanut protein isolates extracted from defatted heat pressed peanut meal flour (Arachis hypogaea L.)[J].Pakistan Journal of Nutrition,2009, 8(6): 818-823.DOI:10.3923/pjn.2009.818.825.
[5] 李建军, 蔡桢, 汪天明, 等.花生粕营养成分分析[J].安徽农业科学,2012, 40(7): 3999-4000.DOI:10.3969/j.issn.0517-6611.2012.07.059.
[6] 梅娜, 周文明, 胡晓玉, 等.花生粕营养成分分析[J].西北农业学报,2007, 16(3): 96-99.DOI:10.3969/j.issn.1004-1389.2007.03.025.
[7] 王晓杰, 郑喜群, 刘晓兰.预处理方法对玉米醒酒肽有效成分的影响[J].食品研究与开发, 2012, 33(16): 8-11.DOI:10.3969/ j.issn.1005-6521.2012.06.003.
[8] 郭辉, 何慧, 韩樱.玉米肽对小鼠酒后肝脏乙醇脱氢酶活力的影响及醒酒机理[J].食品科学, 2011, 32(11): 265-269.
[9] 吴晖, 王蓓蓓, 李丽丽, 等.玉米粗肽的可控酶法制备及其体外醒酒活性的研究[J].食品与发酵工业, 2009, 35(9): 88-92.
[10] 陈彤, 王长青, 连伟帅, 等.沙棘籽渣酶解产物的体内外抑菌作用[J].食品科学, 2015, 36(11): 91-94.DOI:10.7506/spkx1002-6630-201511018.
[11] LIU J, CHEN L W, JI K M.An endurance-enhancing effect of peanut meal protein hydrolysate in mice: possible involvement of a specific peanut peptide[J].Journal of Animal Physiology and Animal Nutrition,2014, 98(5): 830-837.DOI:10.1111/jpn.12140.
[12] XIAO C Q, ZHENG L, SU G W.Effect of solution pH and activated carbon dosage on the decolourization ability, nitrogen components and antioxidant activity of peanut meal hydrolysate[J].International Journal of Food Science & Technology, 2014, 49(12): 2571-2577.DOI:10.1111/ijfs.12587.
[13] 柳杰.花生粕抗氧化肽的研究[D].无锡: 江南大学, 2010: 1-3.
[14] 王连翠.酶法制备芝麻粕多肽的工艺研究[J].食品科学, 2009,30(20): 220-222.
[15] 张洪微, 魏文毅, 唐彦君, 等.酶法制备绿豆多肽的研究[J].黑龙江八一农垦大学学报, 2007, 19(1): 69-74.DOI:10.3969/ j.issn.1002-2090.2007.01.018.
[16] 朱玉端, 李小强, 董怀灿, 等.双酶法酶解制备怀山药多肽的研究[J].食品工业, 2012, 33(9): 80-82.
[17] 中国国家标准化管理委员会.GB 5009.5—2010中华人民共和国国家标准 食品安全国家标准 食品中蛋白质的测定[S].北京: 中国标准出版社, 2010.
[18] 訾艳, 王常青, 陈晓萌, 等.具有α-淀粉酶抑制活性的白芸豆多肽的制备及其热稳定性研究[J].食品科学, 2015, 36(13): 190-195.DOI:10.7506/spkx1002-6630-201513035.
[19] SULTATOS L G, PASTINO G M, ROSENFELD C A, et al.Incorporation of the genetic control of alcohol dehydrogenase into a physiologically based pharmacokinetic model for ethanol in humans[J].Toxicological Sciences, 2004, 78(1): 20-31.DOI:10.1093/ toxsci/kfh057.
[20] 连伟帅, 王常青, 于书佳, 等.沙棘籽酶解多肽的抗氧化性能研究[J].食品工业科技, 2013, 34(22): 128-131.
[21] 李小凡, 王常青, 訾艳, 等.香菇柄中水溶性蛋白的提取及组成分析[J].食品工业科技, 2015, 36(9): 342-346.
[22] 谷峰, 汪德清, 邓心新, 等.枳葛片对急性酒精中毒小鼠翻正反射及血液中各项生物化学参数的影响[J].中国临床康复, 2005, 9(11): 134-136.DOI:10.3321/j.issn:1673-8225.2005.11.075.
[23] 中国国家标准化管理委员会.GA/T 842—2009血液酒精含量的检验方法[S].北京: 中国标准出版社, 2009.
[24] 吕杰, 何慧, 范允卿, 等.酶膜耦合连续法制备玉米肽解酒及防醉研究[J].食品科学, 2012, 33(17): 241-244.
[25] 张湲婷, 严嵬, 袁明, 等.帕珠丸对急性酒精性肝损伤小鼠解酒保肝作用研究[J].青海医学院学报, 2014, 35(4): 255-259.DOI:10.13452/ j.cnki.jqmc.2014.04.009.
DOI:10.7506/spkx1002-6630-201613031
中图分类号:TS255.6
文献标志码:A
文章编号:1002-6630(2016)13-0173-05
收稿日期:2015-09-10
作者简介:宁庆鹏(1990—),男,硕士研究生,研究方向为食品生物技术与功能食品开发。E-mail:2427988759@qq.com
*通信作者:王常青(1956—),男,教授,学士,研究方向为食品生物技术与功能食品开发。E-mail:wcq@sxu.edu.cn
Preparation of Polypeptides with Sobering Effect from Peanut Meal by Enzymatic Hydrolysis
NING Qingpeng, WANG Changqing*, FANG Tian, BAI Yunyun, CHEN Tong
(College of Life Science, Shanxi University, Taiyuan 030006, China)
Abstract:For more reasonable and effective utilization of peanut meal resources, we investigated the preparation of polypeptides with sobering effect by enzymatic hydrolysis of peanut meal with Alcalase AF 2.4L.Polypeptide fractions were separated and their sobering effect was evaluated in vitro and in animals.The results showed that the optimal hydrolysis conditions for preparing polypeptides with sobering effect were determined to be 3 h hydrolysis at 35 ℃ and pH 9.5 with a solid-to-solvent ratio of 1:30 (m/V).Under these conditions, the percentage activation of alcohol dehydrogenase (ADH) and peptide yield were significantly improved.The fraction with molecular weight in the range of 1 000-3 000 D had the highest activating effect on ADH, with a percentage activation of 30.47%.G25 gel permeation chromatographic analysis showed that the yield of peanut meal peptides with molecular weight less than 3 000 D was 89.55%, giving a percentage activation of ADH of 29.25%.Animal experiments proved that the peanut meal polypeptides could significantly prevent alcoholism and sober up drunken mice.They at high dosages could significantly reduce blood alcohol content in mice in 60-90 min.
Key words:peanut meal; peptide with sobering effect; protease; percentage activation of alcohol dehydrogenase
