子痫前期患者组织因子、组织因子途径抑制物与血清可溶性血管内皮生长因子受体1的相关性
2016-08-10蔡翼飞孙丽洲
蔡翼飞,孙丽洲
(1.南京医科大学附属常州市妇幼保健院 妇产科,江苏 常州,213003; 2.南京医科大学附属第一医院 妇产科,江苏 南京,210036)
子痫前期患者组织因子、组织因子途径抑制物与血清可溶性血管内皮生长因子受体1的相关性
蔡翼飞1,孙丽洲2
(1.南京医科大学附属常州市妇幼保健院 妇产科,江苏 常州,213003; 2.南京医科大学附属第一医院 妇产科,江苏 南京,210036)
摘要:目的探讨子痫前期患者外周血组织因子(TF)、组织因子途径抑制物(TFPI)与及可溶性血管内皮生长因子受体1(sFlt-1)水平的相关性。方法酶联免疫吸附试验(ELISA)检测健康孕妇、非重度子痫前期孕妇、重度子痫前期孕妇血浆TF、TFPI水平以及血清sFlt-1水平;免疫组化检测各组胎盘TF抗原的表达。结果3组患者血浆及胎盘TF、血清sFlt-1水平均有显著差异,且随病变程度的增加逐渐升高。3组TF/TFPI比值有显著差异,随病变程度的增加亦逐渐升高。与非重度PE组相比,重度PE组血清sFlt-1水平显著升高(P<0.05)。在子痫前期患者中,血浆TF、TF/TFPI比值与血清sFlt-1水平呈正相关。3组中胎盘TF表达与血清sFlt-1水平无相关性。在TF>165.9 pg/mL组中,血浆、胎盘TF、血浆TFPI与血清sFlt-1水平呈正相关。结论子痫前期患者血浆TF、TF/TFPI比值与血清sFlt-1水平存在正相关关系。
关键词:组织因子; 组织因子途径抑制物; 可溶性血管内皮生长因子受体1; 子痫前期
妊娠期高血压疾病是指妊娠与血压升高并存的一组疾病,是产科特有疾病之一,发病率为5~12%[1]。研究[2]表明组织因子(TF)及组织因子途径抑制物(TFPI)的变化引起的凝血功能异常与子痫前期(PE)的发病有关。可溶性血管内皮细胞生长因子受体-1(sFlt-1)浓度改变引起内皮细胞机能障碍可能也是子痫前期发病原因之一[3]。动物实验[4]发现抑制TF表达可使sFlt-1及活性氧的释放减少,从而逆转胎盘血管生成障碍,恢复胎盘血流,阻断氧化应激。本研究观察正常妊娠与子痫前期孕妇外周血中TF、TFPI、sFlt-1以及胎盘中TF的表达水平,现报告如下。
1材料与方法
1.1一般资料
选取2013年10月—2016年3月在常州市妇幼保健院住院剖宫产终止妊娠者84例,包括正常健康孕妇28例,子痫前期孕妇56例(其中重度28例,非重度28例)。3组年龄、体质量、采血时孕周、孕次无显著差异(P>0.05),见表1。子痫前期的诊断及分类标准参照中华医学会妇产科学分会妊娠期高血压疾病学组《妊娠期高血压疾病诊治指南(2015)》。排除标准:慢性高血压、糖尿病及心、肝、肾、甲状腺、血液系统,自身免疫等疾病的患者,以及使用纤溶药物、肝素的妇女。
1.2方法
1.2.1标本采集、处理和保存:每位孕妇均在入院时抽取静脉血2管各3 mL。一管用以检测TF及TFPI,另一管用以检测sFlt-1。具体方法:TF标本采用3.8%枸橼酸钠抗凝,比例为9∶1。黄疸、脂血的标本放弃,重度溶血的标本重新采血。3 000 r/min×30 min离心分离血浆,置于-80 ℃冻存。sFlt-1标本:静脉血样本待自凝,3 500 r/min×5 min离心分离血清,置-80 ℃冻存。剖宫产胎盘娩出后,立即剪取近脐带附着处无钙化部位约1 cm×1 cm×1 cm胎盘组织,用灭菌生理盐水冲净后置入4%中性多聚甲醛固定,常规脱水处理后,石蜡包埋并制成3 μm厚的连续切片。
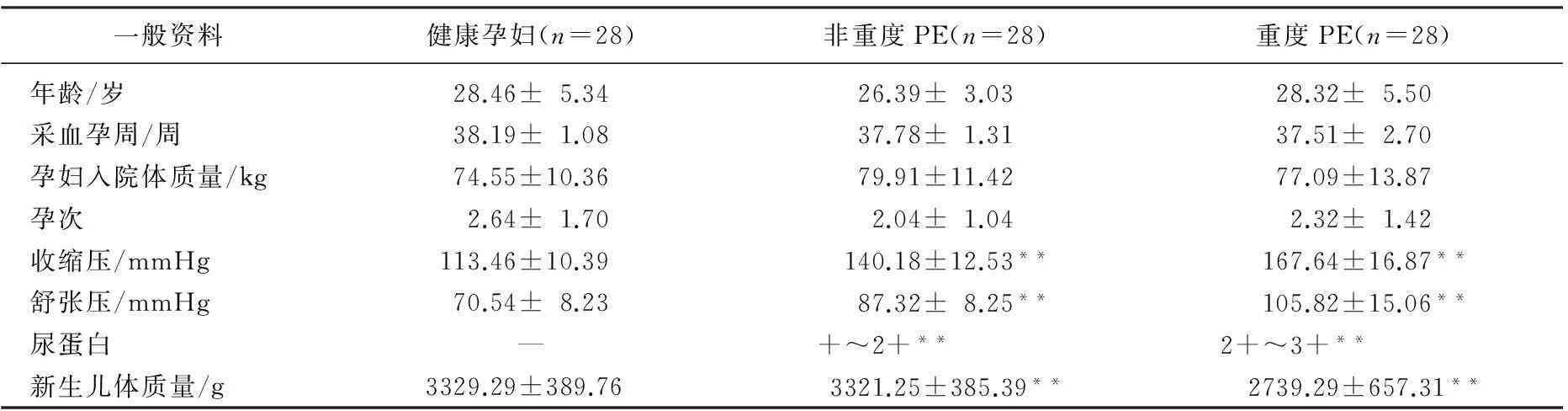
表1 3组患者一般资料比较
与健康孕妇比较,**P<0.01。
1.2.2血浆 TF、TFPI及血清sFlt-1检测:检测方法均采用ELISA法测定,定量检测采用F.A.M.E型酶标仪(德国Hamilton Bonadua公司)。TF、TFPI试剂盒由上海晨易生物科技有限公司提供,最低可测范围为1.0 pg/mL,批内和批间变异系数分别为5.4%和7.6%。sFlt-1试剂盒由上海恒远生物科技有限公司提供,最低可测范围为100 ng/L,批内和批间变异系数分别为4.6%和6.8%。
1.2.3免疫组化法测定:经HE染色判断切片质量后,采用链霉菌抗生物素蛋白-过氧化物酶连接(sP)法,在同一时间、同一条件下进行免疫组化检测。兔抗人TF多克隆抗体为上海鼎冀生物科技有限公司产品。染色步骤按SP试剂盒说明书进行,水煮法修复抗原,一抗滴度为1∶50,PBS(磷酸缓冲盐溶液)代替一抗作为阴性对照。显微镜下观察切片中滋养细胞免疫染色情况,TF染色阳性反应为细胞有棕黄色颗粒沉着。根据细胞内染色强度进行分级:0级为细胞内无染色或染色不清或呈均匀一致淡黄色,与背景一致;1级为膜或浆内可见少量淡黄色颗粒,明显高于背景;2级为膜或浆内可见较多深棕色颗粒;3级为膜或浆内可见大量深棕色或褐色颗粒。同时,根据染色阳性细胞百分率进行分级:0级为无阳性细胞;l级为阳性细胞百分率<25%;2级为阳性细胞百分率在25~50%;3级为阳性细胞百分率>50%。以上两项分级数相加:得分0~1分为“-”,2分为“+”,3~4分为“2+”,5~6分为“3+”。
1.3统计学分析
使用Empower Stats(基于R软件)进行统计学分析,根据数据分布类型用均数±标准差或中位数(四分位数Q1-Q3)描述;两组间比较根据数据分布类型采用t检验或Kruskal Wallis秩和检验,多组间比较采用方差分析或Kruskal Wallis秩和检验。指标间相关性分析采用Spearman相关性分析;P<0.05为差异有统计学意义。
2结果
2.1外周血指标比较
健康孕妇、非重度子痫前期、重度子痫前期患者血浆TF(P=0.002)、血清sFlt-1(P<0.001)水平有显著差异,且随病变程度的增加而逐渐升高。血浆TFPI水平在3组间无显著差异,但3组TF/TFPI比值有显著差异(P=0.002)。非重度子痫前期组的血浆TF/TFPI比值、血清sFlt-1水平均显著高于健康孕妇组。重度子痫前期组的血浆TF水平、TF/TFPI比值以及血清sFlt-1水平均显著高于健康孕妇组。重度子痫前期组血清sFlt-1水平显著高于非重度子痫前期组(P<0.05)。胎盘免疫组化结果见图1,子痫前期胎盘组织中TF定位与健康晚孕组相同,主要分布于胎盘合体滋养细胞胞膜,阳性染色均呈棕色、褐色。根据细胞内染色强度以及染色阳性细胞百分率分别进行分级并相加后评分,3组胎盘TF表达水平有显著差异(P<0.001),且随病变程度的增加逐渐升高。非重度、重度子痫前期组胎盘TF表达均显著高于健康组。见表2。

表2 3组孕妇外周血TF、TFPI、sFlt-1含量及胎盘TF免疫组化评分比较
与健康孕妇组比较,**P<0.01; 与非重度PE组比较,#P<0.05。

A.健康孕妇;B.子痫前期(非重度);C.重度子痫前期图1 在各组中滋养叶细胞TF表达情况 (IHC×400倍,SP法)
2.2外周血血浆TF、TFPI水平、TF/TFPI比值及胎盘TF水平与血清sFlt-1水平的关系
在健康孕妇组中,血浆TF、TFPI水平、TF/TFPI比值及胎盘TF水平与血清sFlt-1水平均无相关性。在非重度子痫前期组中,血浆TF、TF/TFPI比值与血清sFlt-1水平呈正相关。在重度子痫前期组,血浆TF、TFPI、TF/TFPI比值与血清sFlt-1水平呈正相关,其相关性依次递减。见表3。
以28例健康孕妇组TF水平为基础,计算TF的95%参考值范围(88~165.90 pg/mL)后,将子痫前期孕妇(n=56)分为2组(TF≤165.90 pg/mL组29例,TF>165.90 pg/mL组27例),进一步分析各指标与血清sFlt-1水平的关系。在TF>165.90 pg/mL组中,血浆、胎盘TF评分、血 浆TFPI分别与血清sFlt-1水平呈正相关。TF≤165.90 pg/mL组中,4种指标与血清sFlt-1水平无显著相关性。见表4。

表3 外周血血浆TF、TFPI、TF/TFPI比值及胎盘TF水平与血清sFlt-1水平的相关性

表4 TF≤165.90 pg/mL组与TF>165.90 pg/mL组外周血TF、TFPI、TF/TFPI比值及胎盘TF表达与血清sFlt-1水平的相关性
3讨论
子痫前期发病机制目前尚未明确。“两阶段学说”[1]提示,滋养细胞血管入侵子宫内膜不充分,导致胎盘缺氧。胎盘组织形成多数微血栓,向母体血管释放合体滋养细胞碎片和血管介质。胎盘缺氧诱发的循环因子的释放属于系统性炎症反应的一部分,后者导致血管反应性的改变,并引起内皮细胞损伤。广泛的内皮功能异常引起子痫前期的临床症状,其中包括凝血病、各种因微血管血栓引起的器官损伤。TF及其所属的凝血系统参与上述过程,并与炎症[5]、内皮损伤[6-7]等其他因素互相作用,最终导致临床症状的出现。研究[2]显示,子痫前期妇女中,高凝状态变化往往在临床症状出现前已经存在。因此,研究TF与子痫前期的发病关系,首先是研究其凝血功能。
TF的经典作用是激活凝血级联。在现代凝血过程概念中,体内凝血过程几乎都是由外在途径启动(TF/FⅦa复合物)。作为TF-FⅦa复合物的唯一生理抑制剂,通常将TFPI与TF一起进行研究。关于子痫前期血浆TF及其主要抑制剂TFPI的作用的研究结果并不一致。根据不同的研究,子痫前期血浆TF水平的升高[8]或者不变[9-10]均有报道。这些互相冲突的数据可能因为研究设计和方法不同,但也可能与诊断标准[11]或者种族差异性[11]有关。本研究中发现,健康孕妇、非重度子痫前期、重度子痫前期患者血浆TF水平有显著差异,且随病变程度的增加逐渐升高。2组子痫前期患者TF水平均显著高于健康孕妇。血浆TFPI在3组间无显著差异,但是3组间TF/TFPI有显著差异,随程度的增加亦逐渐升高。由于TFPI和TF相互作用可以调节人体内的血栓形成,故而与单一指标相比,TF/TFPI比值更能反映二者对于凝血功能的影响效果。本研究结果也提示,随子痫前期严重程度的递增,高凝状态亦不断增强。
近来的研究[12]证实,子痫前期患者,特别是重度子痫前期,胎盘中TF的浓度和mRNA的表达较正常妊娠妇女均升高。与之相反,子痫前期患者胎盘中总TFPI浓度和mRNA的表达低于正常妊娠妇女。这也提示孕妇体内TF/TFPI的失衡状态可能是造成子痫前期发生的原因。本研究观察到胎盘中TF的表达在3组间有显著差异,随病变程度的增加亦逐渐升高。这也与血浆中TF的水平变化相一致。本研究通过ELISA方法检测的血浆TF是指循环中微颗粒( MP) 上的TF。MP是一类膜性小囊泡,经过细胞表面的各种化学或物理刺激,细胞膜上的磷脂酰丝氨酸( PS)外翻,微颗粒脱落。主要来源于血小板、内皮细胞、单核细胞、血管平滑肌细胞和肝细胞[13-15]以及妊娠合体滋养细胞(合体滋养细胞微绒毛膜STBM)。血浆与胎盘TF的水平变化呈一致性表现,提示子痫前期患者血浆中的TF可能主要来源于胎盘。
Flt-1(又名VEGFR-1)即血管内皮生长因子受体-1,对血管内皮生长因子(VEGF-A)有高度亲和性,后者对于胎盘血管发育、增生,内皮细胞的存活,血管通透性以及内皮窗孔等至关重要。sFlt-1是FLt-1的变体。缺氧时,FLt-1基因选择性剪接后形成sFlt-1的mRNA,合成sFlt-1并分泌进入母体血液循环,与VEGF及PLGF连接,降低其生物学作用,进而引起高血压、蛋白尿等子痫前期经典症状。同样,在人类子痫前期的发病机制中,sFlt-1作为血管内皮缺氧的结果,也作为消耗VEGF及PLGF导致子痫前期临床表现的原因。作为可以预测子痫前期的指标,sFlt-1升高者,子痫前期的发病率升高5~6倍[16-17]。本研究证实血清sFlt-1水平在3组间有显著差异,其水平随子痫前期严重程度的递增逐渐升高。
有研究[18-19]显示,子痫前期孕妇血清及脐血中C5a升高。尽管免疫失调以及补体激活(C5a)的触发因素尚不明确,但是TF在该模型中对于胎盘及胎儿损伤是必要的。子痫前期与复发性流产及FGR在发病机制上有相似之处,例如都存在内皮损伤,血栓症-炎症-血栓症恶性循环,血浆和(或)胎盘TF、sFlt-1升高等。实验提示sFlt-1能诱导滋养细胞上TF的表达,但应用TF单抗所产生的减少sFlt-1并出现最终的逆转效果提示,TF与sFlt-1表达之间的影响关系至少是双向的,TF可能位于sFlt-1蛋白表达信号传递通路的上游。本研究中发现,在人类子痫前期患者中,外周血中TF与sFlt-1水平存在正相关,这在重度与非重度患者中均得到证实。而基于TF参考值范围将子痫前期患者分组后,在TF高于参考值上限组中得到了进一步证实,并且胎盘与血浆中的TF均与血清sFlt-1水平存在正相关。这可能与TF的非凝血功能有关。作为一种跨膜糖蛋白,TF的细胞内区域具有信号转导功能(与FⅦa结合后),引起一系列非凝血细胞生物过程,例如合成细胞因子、黏附分子和生长因子[20-21]。但调控sFlt-1表达的机制尚不清楚。
本研究结果显示,在重度与非重度组中,TF/TFPI比值与血清sFlt-1水平变化呈正相关;在重新分组后,TF高于参考值上限组中,血浆TFPI与血清sFlt-1水平变化呈正相关。这也意味TF凝血与非凝血功能在子痫前期发病中同时发挥作用。
参考文献
[1]谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:64-71.
[2]He S,Bremme K,Blomback M.Acquired deficiency of antithrombin in association with a hypercoagulable state and impaired function of liver and/or kidney in preeclampsia[J].Blood Coagul Fibrinolysis,1997,8:232-238.
[3]Sircar M,Thadhani R,Karumanchi S A.Pathogenesis of preeclampsia[J].Nephrol Hypertens,2015,24:131-138.
[4]Patricia R,Nico R,Donald T,et al.Pravastatin prevents miscarriages in mice role of tissue factor in placental and fetal injury[J].Blood,2009,113(17):4101-4109.
[5]周莉莉,韩悦,朱倩,等.组织因子微颗粒的检测及其在出凝血异常中的临床意义[J].中国实验血液学杂志,2012,20(4):937-938.
[6]熊钰,楼懿婷,蔡旭,等.子痫前期孕妇分娩前后出凝血功能动态改变[J].中国实用妇科与产科杂志,2013,29(3):200-203.
[7]PAyala T,Buitrago T,Poveda A,et al.Increased tissue factor and thrombomodulin expression and histopathological changes in placentas of pregnancies with preeclampsia[J].Journal of Neonatal Medicine,2016,9:31-39.
[8]Teng Y,Jiang R,Lin Q,et al.The relationship between plasma and placental tissue factor,and tissue factor pathway inhibitors in severe pre-eclampsia patients[J].Thromb Res,2010,126:e41-45.
[9]Dusse L M,Carvalho M G,Getliffe K,et al.Total plasma tissue factor pathway inhibitor levels in pre-eclampsia[J].Clin Chim Acta,2008,388:230-232.
[10]Godoi L C,Gomes K B,Alpoim P N,et al.Preeclampsia:the role of tissue factor and tissue factor pathway inhibitor[J].J Thromb Thrombolysis,2012,34:1-6.
[11]Lara C G,Karina B G,Patricia N A,et al.Preeclampsia the role of tissue factor and tissue factor pathway inhibitor[J].J Thromb Thrombolysis,2012,34:1-6.
[12]Teng Y,Jiang R,Lin Q,et al.The relationship between plasma and placental tissue factor,and tissue factor pathway inhibitors in severe pre-eclampsia patients[J].Thrombosis Research 2010,126:e41-e45.
[13]周莉莉,韩悦,朱倩,等.组织因子微颗粒的检测及其在出凝血异常中的临床意义[J].中国实验血液学杂志,2012,20(4):937-938.
[14]SORO E,ROMERO R,RICHANIK,et al.Preeclampsia and pregnancies with small-for-gestational age neonate have different profiles of complement split products[J].Journal of Maternal-Fetal and Neonatal Medicine,2010,23(7):646-657.
[15]Jana P,Ludek S,Jana U,et al.The role of tissue factor in normal pregnancy and in the development of preeclampsia:A review[J].Biomed Pap Med Fac Univ,2015,159(2):192-196.
[16]刘晓洁,韩磊,韩健,等.子痫前期孕妇凝血功能及血小板变化的研究[J].第三军医大学学报,2014,36(9):962-965.
[17]吕敬媛,徐海莲,陈鹤.Glycodelin与IL-17在子痫前期患者底蜕膜中的表达及相关性分析[J].黑龙江医药科学,2012,35(1):8-10.
[18]夏丽.转录因子Smad4、NF-κB在子痫前期胎盘组织中的表达及其与凋亡和侵袭基因表达的关系[J].海南医学院学报,2015,21(10):1375-1377.
[19]陆胜,季雄娟.血清胱抑素C联合尿微量白蛋白检测在妊娠期高血压疾病早期肾损害诊断中的价值[J].实用临床医药杂志,2014,18(16):188-190.
[20]束萍凤,王鹏.子痫前期患者子宫动脉和肾动脉血流动力学评估及其与内皮功能、侵入功能的关系[J].海南医学院学报,2015,21(11):1532-1535.
[21]何艳红,王志坚,靳瑾,等.子痫前期患者细胞间粘附分子-1 K469E及血小板内皮细胞粘附分子-1 C373G的基因多态性[J].南方医科大学学报,2014(04):552-555.
收稿日期:2016-04-17
中图分类号:R 714.24
文献标志码:A
文章编号:1672-2353(2016)15-071-05
DOI:10.7619/jcmp.201615020
Correlation between tissue factor,tissue factor pathway inhibitor and sFlt-1 in patients with preeclampsia
CAI Yifei1,SUN Lizhou2
(1.Department of Gynecology and Obstetrics,Changzhou Maternal and Child Health Care Hospital,Changzhou,Jiangsu,213003; 2.Department of Gynecology and Obstetrics, The First Affiliated Hospital of Nanjing Medical University,Nanjing,Jiangsu,210036)
ABSTRACT:ObjectiveTo explore the correlation between tissue factor(TF),tissue factor pathway inhibitor(TFPI)and soluble fms-like tyrosine kinase-1 (sFlt-1) in the patients with preeclampsia.MethodsThe plasma levels of TF and TFPI and the serum level of sFlt-1 were detected by ELISA method in normal pregnant women,non-severe preeclampsia pregnant women and severe preeclampsia pregnant women.The expression of placental TF antigen was detected by immuno histochemistry in three groups.ResultsThe plasma and placental TF,serum sFlt-1 levels had significantly differences in the three groups,and increased gradually with the increase of the degree of the lesions.There was a significant difference in TF/TFPI ratio among the three groups,and gradually increased with the increase of the degree of pathological changes.Compared with the non severe PE group,the serum sFlt-1 level was significantly higher in the severe PE group (P<0.05).In preeclampsia patients,plasma TF,TF/TFPI ratio were positively correlated with serum sFlt-1 level.There was no correlation between the expression of TF in placenta and the serum level of sFlt-1 among the three groups.In the group with TF>165.9 pg/mL,plasma,placental TF,plasma TFPI were positively correlated with serum sFlt-1 level.ConclusionThere is a positive correlation between plasma TF,TF/TFPI ratio and serum sFlt-1 level in patients with preeclampsia.
KEYWORDS:tissue factor; tissue factor pathway inhibitor; soluble vascular endothelial growth factor receptor 1; preeclampsia
