微生物胞外聚合物在环境工程中的应用进展
2016-08-10叶小青彭亭瑜姬玉欣何丽玲刘安娜金仁村
叶小青,彭亭瑜,姬玉欣,何丽玲,刘安娜,金仁村
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
微生物胞外聚合物在环境工程中的应用进展
叶小青,彭亭瑜,姬玉欣,何丽玲,刘安娜,金仁村
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
摘要:微生物胞外聚合物(EPS)具有可以充当吸附剂、絮凝剂、混凝剂及固定微生物等潜能.系统综述了基于EPS在环境工程领域中的应用研究进展,详细阐述了EPS在土壤中污染物去除及土壤修复的研究成果,指出了EPS作为生物絮凝剂的优势,并对EPS的作用机理进行探讨,以期为EPS在环境工程中的深入研究给予借鉴和指导.
关键词:微生物胞外聚合物;吸附剂;生物絮凝剂;环境工程;作用机理
微生物产生的胞外聚合物(extracellular polymeric substances,EPS)的主要成分是一些高分子物质,如多糖、蛋白质、核酸等[1].EPS填充并形成了细菌之间的空间,进而构筑了聚集体.微生物被EPS包埋在其内,因而EPS为细胞固定化提供了场所,尤其是直接覆盖于细菌细胞壁外的附着型EPS,其特殊的位置决定着它的成分及数量必然影响污泥的表面特性、生物絮凝能力、沉降性能及脱水性能等,因而在活性污泥中扮演重要角色[2].近年来,环境工程中有关EPS的研究主要集中在废水生物处理领域.龙向宇等[3]在2012年研究了EPS在废水生物除磷中的作用.试验结果表明,EPS中不仅含有以高价阳离子沉淀物或络合物形式存在的无机磷,而且含有以细菌细胞分泌物或代谢产物形式存在的有机磷.蒋勗欣等[4]在2014年对EPS在活性污泥中的动态变化进行了研究,考察了普通絮体污泥颗粒化过程中EPS 的组分变化和分布情况.
本文在对国内外文献进行分析的基础上,对EPS在环境工程(包括给水处理、废水絮凝和沉降、废水脱色、污泥脱水、金属去除和回收、毒性有机化合物的去除等)中的应用进行了总结,对EPS的作用机理进行了分析,并对未来研究进行了展望.
1水处理
1.1给水处理
最近一些研究报道了由不同细菌菌株产生的EPS的应用,这些EPS主要用于给水处理[5-8].例如,烧杯试验发现,由芽孢杆菌(Bacillussp.)合成的EPS处理含高岭土原水,浊度去除率可达86%,尽管仍低于Al2(SO4)3的95%和Fe2(SO4)3的96%[7],也不失为一种备选水处理剂.此外,EPS和Fe2(SO4)3的结合处理效果更好.EPS应用于原水处理时没有残余的铁离子和铝离子积累.Li等[6]在2009年调查了由地衣芽孢杆菌(B.licheniformis)合成的EPS,并指出其可用于饮用水处理.此类EPS在饮用水处理方面展现出良好的絮凝性能,COD和浊度的最大去除率分别是61.2%和95.6%.而且在不同温度下(4 ℃和25 ℃)处理效果均不错.根据Li等[6]的研究,由地衣芽孢杆菌合成的EPS处理饮用水是安全的.EPS可以由不同的菌株合成,例如芽孢杆菌(B.subtilis)、乙酰微杆菌(Exiguobacteriumacetylicum)、克雷伯氏杆菌(Klebsiellaterrigena)、金黄色葡萄球菌(Staphylococcusaureus)、产碱假单胞菌(Pseudomonaspseudoalcaligenes),而且假单胞菌合成 EPS的剂量为10 mg/L时可以去除河水84.1% ~ 93.6%的浊度[5].EPS也能够去除河水水样中的革兰氏阳性菌(金黄色葡萄球菌(S.aureus)、粪链球菌(Streptococcusfaecalis))和革兰氏阴性菌(大肠杆菌(Escherichiacoli)、产酸克雷伯氏菌(K.oxytoca)).Buthelezi等[5]指出细菌EPS在水处理中可以成为明矾的潜在替代品.河水中的天然有机物(NOM)存在很大的健康隐患.由铜绿假单胞菌(P.aeruginosa)和恶臭假单胞菌(P.putida)合成的EPS能够去除NOM[9].此外,由于EPS的无毒性和可生物降解性,作为备用絮凝剂有其优势.虽然一些研究已经提倡EPS应用于河流或饮用水治理,但是这项技术尚未被广泛接受.生物法处理饮用水并非最佳选择,可能存在微生物污染.为了安全起见,需要外加过滤、消毒等单元操作.EPS在饮用水处理应用中的安全问题尚需进一步研究.
1.2工业废水处理
在工业废水处理中,絮凝是去除悬浮物(SS)最常用的方法之一.最近研究表明EPS在废水处理中可以替代传统的化学絮凝剂.Gong等[10]在2008年指出由沙雷氏菌(Serratiaficaria)合成的EPS有望应用于多种工业废水(啤酒、酱油酿造、肉类加工和纸浆生产废水)的处理.而由芽孢杆菌(B.mucilaginosus)合成的EPS能去除淀粉废水85%以上的悬浮物和68.5%的COD[11].EPS也可用于处理猪场废水,处理效果稍优于传统的絮凝剂,浊度和COD去除率分别可达91%和42%[12].Lian等[13]在2008年曾报道由芽孢杆菌(B.mucilaginosus)合成的EPS可用于处理市政废水、酿造废水和制药废水,COD去除率为74.6%、70.5%和66.2%;BOD去除率为42.3%、77.4%和41.7%;SS去除率为93.3%、93.6%和88.4%.另据报道,混合菌群能产生絮凝性能更优的EPS.这种EPS由葡萄球菌(Staphylococcussp.)和假单胞菌(Pseudomonassp.)混合菌群产生,可成功应用于靛蓝印染废水处理(COD去除率达到80%)[14].Li等[15]在2013年揭示了由类芽孢杆菌(Paenibacilluselgii)(B69)合成的EPS中的多糖可使废水中COD和浊度去除率分别达到68%和83%.目前大多数关于EPS废水处理的研究都仅限于实验室规模,处理效果还需中试及生产性试验检验.
染料导致纺织工业废水的颜色变化、有机负荷和毒性的增加[16].未经处理的纺织工业废水排放进入天然水体势必会对水生生物造成危害[16-17].最近,生物吸附法被认为是治理有毒工业废水最具潜力的技术之一.细菌的吸附能力归因于细胞壁表面的EPS(主要是杂多糖和脂质),它包含不同的官能团(例如氨基、羧基、羟基、磷酸等),这些官能团产生染料和细胞壁之间的吸引力[16-19].一些研究表明EPS作为生物吸附剂具有潜在适用性[14,17-18,20-21].
Buthelezi等[18]在2008年报道了由几种不同菌种(如芽孢杆菌Bacillus、微小杆菌Exiguobacterium、克雷伯氏菌Klebsiella、假单胞菌属Pseudomonas和葡萄球菌Staphylococcus)合成的EPS可有效去除染料.使用EPS作为生物吸附剂时的废水脱色效率为20% ~ 99.9%[18].EPS对品红染料具有高效的脱色率(93%),而对六价铬离子去除率只有28%(铬离子初始浓度为280 mg/L)[18].生物吸附能力和脱色效率取决于EPS浓度、pH、温度、离子强度、接触时间、染料浓度、染料结构和微生物种类[16].Inbaraj等[21]在2008年研究了在不同温度和pH下由芽孢杆菌(Bacillussp.)合成的EPS对于碱性棕1染料的脱色效果,并发现染料吸附速率随溶液温度的增加而增加,而吸附容量随温度下降而降低.在pH为5 时染料吸附率最大[21].在乳制品废水中由克雷伯氏菌(K.mobilis)产生的EPS在水溶液中能高效地吸附分散的染料,分散紫HFRL去除率为91%[19].在批次系统中,由变形杆菌(Proteusmirabilis)合成的EPS能高效地处理水溶液中的碱性蓝54[17],最大吸附容量为2.005 g/g EPS.根据Zhang等[17]在2009年的研究,EPS上有大量的结合位点,强大的范德华力可吸附染料分子.EPS最终可完全嵌入被吸附的染料分子内.Solís等[16]在2012年发现菌胶团的脱色率高于单一细菌.Zhang等[14]在2007年观察到由葡萄球菌(Staphylococcussp.)和假单胞菌(Pseudomonassp.)分泌的EPS可以处理印染废水.据Liu等[20]在2009年报道,从反冲洗污泥中提取的EPS在亚甲蓝和固蓝水溶液中显示出高脱色率(82.9%和77.8%).总而言之,EPS是性能良好的生物吸附剂,可去除和回收不同废水中的染料.随着对EPS吸附认知的不断深入,它有望成为一种节能有效的染料处理技术.
1.3垃圾渗滤液处理
混凝-絮凝工艺可用于去除垃圾渗滤液中的有机物,也可以治理稳定老化的垃圾渗滤液,并且比膜分离和使用吸附剂更便捷和便宜[21].细菌EPS可代替传统的化学混凝剂和絮凝剂应用在渗滤液的处理中.Zouboulis等[23]在2004年发现根单胞菌(Rhizomonassp.)产生的EPS对于去除溶液中的腐殖酸相当有效,并且可减少渗滤液中45%的COD,处理效果堪比明矾或聚合氯化铝.在pH为7 ~ 7.5时,添加20 mg/L的EPS可使腐殖酸的去除率高达85%.在这种情况下,使用EPS的优点是不需调整pH即可获得最佳去除效果.添加500 mg/L明矾得到的COD去除效果与仅添加50 mg/L EPS的效果相同.使用EPS处理垃圾渗滤液也有利于消除或降低处理后渗滤液中铝或铁的浓度.
生产EPS的菌种可在渗滤液原位处理时生长.“低龄”(不超过5年)垃圾填埋场的渗滤液通常含有大量有机物,可以作为细菌菌株生产EPS合适的原材料[23-24].渗滤液渗入土壤或地下水是垃圾填埋场面临的主要环境问题.减少渗滤液的排放,在排放前对垃圾渗滤液进行有效的收集和处理是垃圾填埋工程的重要内容,也是有待改进的环节[22].在这种情况下,EPS具有非常显著的生态效应,其适应性强,能在不同环境中使用.鉴于此,生产EPS的细菌可以作为生物屏障用于地下水保护.细菌EPS和菌体本身形成生物屏障,堵塞含水层从而将地下区域中毗邻空间分开.这样,生物膜阻止了渗滤液进一步渗透污染土壤和地下水.含水层生物堵塞可以通过在目标位置添加微生物和营养物质实现[25-26].鉴于EPS在生物技术方面的开发潜力(环境污染物的生物修复和化学药品的合成),生产EPS的细菌有待进一步研究.合成EPS的菌株可被分离出来研究其在污染区生物修复的可能应用.在这种情况下,EPS生产菌株应用于垃圾填埋场渗滤液处理时,将其与渗滤液分离是有利的.在地下和地表环境生物修复过程中探索可能的微生物应用还有很大空间.尤其是从根本上了解EPS在堵塞处理中发挥的确切作用,影响堵塞效率的因素以及它们的形态对堵塞土壤或含水层材质的影响.
表1列出了EPS在处理不同类型污水中的应用.由表可知,处理不同类型的废水水质有其适合的EPS,并非所有微生物菌群产生的EPS都可以治理同一种废水,需要通过相关实验寻找效果最佳的EPS,因而废水类型与可产生EPS的菌体相匹配.由表还可知,不同种类的EPS去除效果相差较大.

表1 EPS在不同类型水质中的应用
1.4污泥脱水
污泥机械脱水操作过程中会使用大量化学絮凝剂,这使得在污水处理厂中污泥脱水的成本昂贵.污泥中EPS的浓度和特性是影响污泥脱水效率的重要参数[27-29].近年来,EPS已经被作为絮凝剂应用于污泥脱水的研究中.添加由克雷伯氏菌(Klebsiellasp.)合成的EPS与添加最适浓度的化学絮凝剂(如明矾、聚合氯化铝和聚丙烯酰胺)相比,具有相似的污泥脱水性能[30].用EPS预调理污泥最终得到干污泥固体含量为17.5%(w/w)和污泥过滤比阻为3.36×1012m/kg.Yang等[30]在2012年还发现EPS和明矾结合使用可使过滤比阻从10.87×1012m/kg降至1.72×1012m/kg,干固体含量从13.1%增加到21.3%.据Zhang等[31]在2010年的研究表明:0.17%(w/w)EPS与1.3%(w/w)CaCl2结合使用与传统的化学絮凝剂相比,可增强污泥脱水性能.此外,EPS在中性pH值时表现出很好的污泥调理性能.关于EPS在污泥脱水中应用的详细研究仍旧缺乏,还需要结合污泥种类和浓度、阳离子种类及其浓度的影响,对EPS在污泥脱水过程中的真正潜力进行系统评估.
2金属去除和回收
目前,EPS在废水处理领域的另一个突出贡献是重金属的去除.废水中去除重金属的过程可通过活性污泥中EPS的絮凝和沉淀过程实现[32].由几种不同菌种产生的EPS(如芽孢杆菌Bacillus、盐单胞菌Halomonas、草螺菌Herbaspirillum、假单胞菌Pseudomonas和类芽孢杆菌Paenibacillus)被认为是工业废水处理中颇具应用前景的絮凝剂[33].在这项研究中,当添加最适浓度的EPS(1~10 mg/L)时可观察到Pb2+、 Zn2+和Hg2+的去除率较高(大于50%),而且EPS仅在高浓度(1 000 mg/L)时才能有效去除Cd2+.通过提升温度(高达45 ℃)可显著增强EPS对Cd2+的去除能力(达95%).能分泌EPS的假单胞菌(Pseudomonassp.)(菌株EJ01)被观察到能够耐受培养基中的Cd2+(2 mmol/L及以上),并且其耐受力与菌体产生的EPS浓度直接相关[34].
鉴于EPS处理重金属废水的成功应用,EPS在矿物浮选过程中也得到了很好的发展.由土壤微生物合成的EPS被吸附在矿物表面,会影响矿物质固定重金属的能力.Mikutta等[35]在2012年研究了在钙饱和膨润土和铁矿中由枯草芽孢杆菌(B.subtilis)合成的EPS对Pb2+、Cu2+和Zn2+的吸附动力学.膨润土比铁矿(7.9 mg/g)吸附更高的EPS-C(18.5 mg/g).在吸附期间,EPS改变了膨润土的化学性质,并且其对低分子量组分和EPS-N的摄取优于其他组分.与矿物质结合的EPS能提高膨润土对Pb2+、Cu2+和Zn2+的吸附率.另一方面,EPS聚合了铁矿并改变了矿物EPS结合体的结构.铁矿选择性地保留EPS中高分子量和富含P的组分,并且它对铁矿吸附金属有负面影响.EPS结合位点的数量和吸附容量与蛋白质、多糖和腐殖质的含量有关,因为它们携带有羧基、羟基和胺基等官能团[32,36].金属离子还可以累积在细菌细胞质内或吸附在细胞壁上[37].
3有毒有机物的去除
EPS具有去除废水、污泥和土壤中多种有毒有机物的能力.微生物降解多环芳烃(PAHs)被认为是最可行的生物修复技术[38].据报道,细菌产生的EPS可用于去除污染土壤中的PAHs[38-40].原位接种可降解PAHs的细菌,其产生的EPS能够有效清理受PAHs污染的土壤和沉积物[38].Jia等[39]在2011年报道EPS对PAHs的降解具有至关重要的作用.EPS和PAHs的相互作用被认为是自发和放热的过程,EPS和PAHs的联结主要受疏水作用控制.EPS具有表面活性,使疏水性底物溶解.有机菲(PHE)降解过程主要发生在硅胶油-水界面.细菌通过分泌EPS来克服PHE的传质限制,从而促进PHE在硅油中的溶解.EPS能够促进PHE在水中的传质,从而提高PHE的生物有效性.Liu等[40]报道细菌产生的EPS能够提高与土壤结合的有机菲的释放程度.Jia等[39]观察到菌胶菌(Zoogloeasp.)和黑曲霉(Aspergillusniger)经过35 d可降解30%以上的有机芘.对于这两种微生物,有机芘的降解会随着EPS浓度的增加而加速.增加EPS与芘接触的比表面积也可以促进芘降解.迄今为止,关于EPS去除有毒有机物的报道大部分尚停留在实验室研究.
4土壤修复和再生
最近,通过专门选择的微生物来降低污染土壤中的碳氢化合物和重金属的技术越来越受关注[42].生物降解最近被认为是最具潜力的土壤修复技术之一,尤其是在受到碳氢化合物污染的两极地区[43].许多研究集中在生物膜反应器对难降解化合物的修复[44].生物膜由EPS承载的微生物群落组成.生物膜具有更高的微生物量,可以降解难降解化合物,而且生物膜可通过EPS来固定化合物[44].同时可加强基因在生物膜微生物群落中的转移,并且它们的趋化性使得生物膜适合于生物修复[44].在最近的研究中,生物膜显示了非常强(97%)的生物降解能力[26].生物修复的成功应用依赖于微生物的降解能力和原位环境条件[43].生物修复可以通过基因工程来提高效率.微生物的趋化性能、混合培养生物膜和理化条件的优化是基因工程的关注点[44].现在有必要对生物膜和生物膜内的基因转移进行大量研究,因为这些研究可以促进污染土壤生物膜治理技术的发展.
EPS可以用于减缓固体在径流水中的传输、阻碍重金属的运输、稳定土壤和减少粉尘的产生[45].EPS可以通过好氧生物反应器内的纯培养或混合培养产生.EPS可以从培养基中分离并可提取产生非反应性(非交联)材料.这种非反应性材料可以作为低密度干燥固体转运,也可将其与干燥EPS、水混合产生一种粘性液体或凝胶应用于土壤表面.也可以直接将干燥的EPS加入土壤,然后再加水来使用EPS.EPS能在土壤中形成凝胶与土壤分子结合.EPS在土壤表面粘附、聚集形成生物膜和保护罩对水吸收、养分积累等过程起到重要的作用.细菌中EPS的分泌被认为在促进沉积物表面耐腐蚀性方面起到粘结作用[46].蓝藻已被作为土壤的粘附剂应用于干旱地区[47].本土土壤细菌的天然产物在土壤修复中的应用引出生物-地理-市政工程的概念[48].来自根瘤菌(Rhizobiumtropici)的EPS能提高土壤强度,并且有助于控制土壤被侵蚀,提高边坡的稳定性.在传统方法(土隔膜和植被覆用)不适用的情况下,此方法特别适用(见表2).
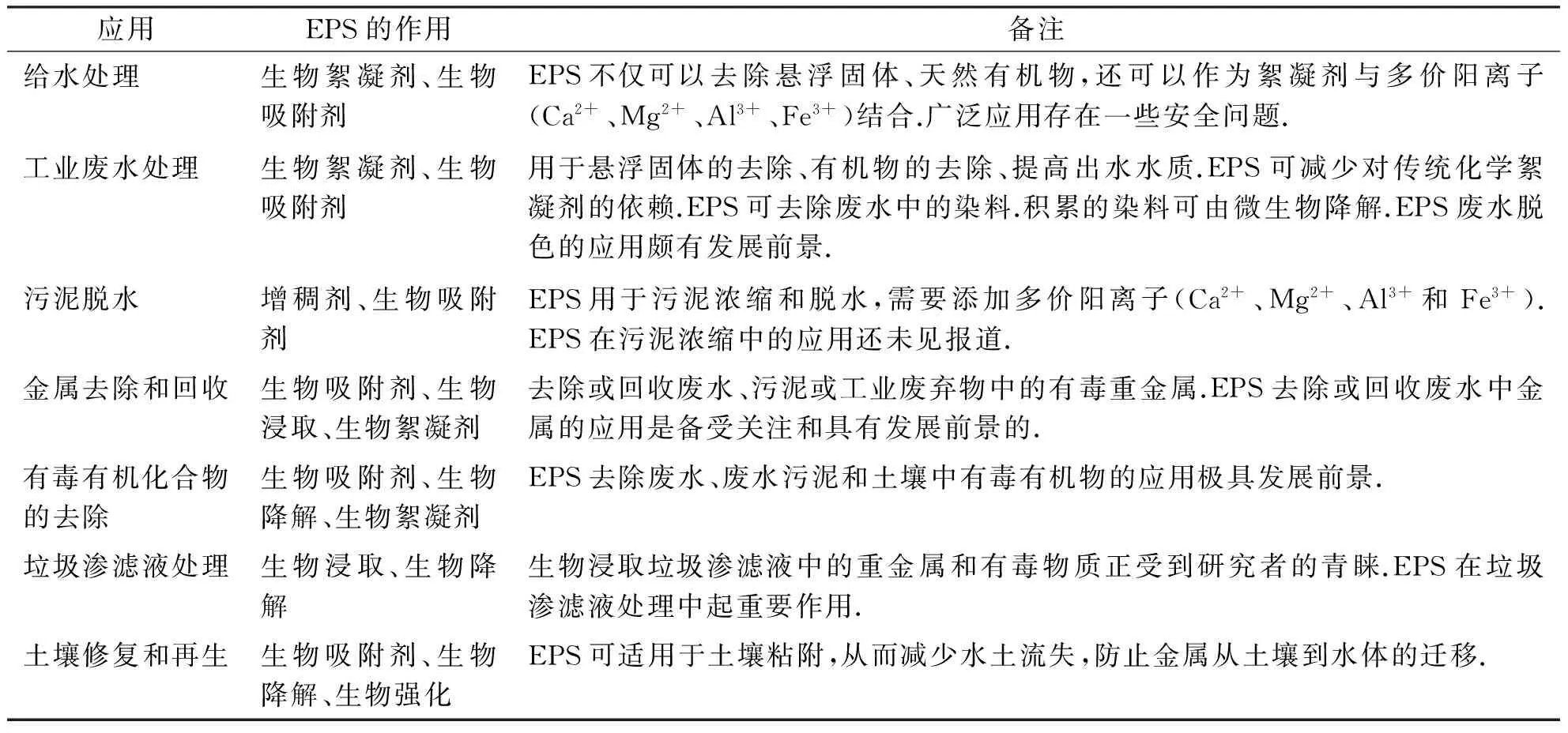
表2 EPS在环境污染控制中的潜在应用
5结论
随着公众环境意识的提高和燃料资源的缺乏,发展可循环利用的生物聚合物来代替合成聚合物越来越受到关注.对那些可处理废水、污泥和渗滤液的细菌EPS的生产需求也会逐渐增长.微生物产生的EPS本身具有的吸附、絮凝、降解以及生物浸取功能是其能在以上8个方面应用中发挥作用的关键因素.其中,EPS在水处理、废水絮凝和沉降以及废水脱色应用中主要充当吸附剂和絮凝剂的角色,可以有效地分离废水中的悬浮固体和有机物.在污泥脱水中,EPS起到增稠剂的作用,并且多价阳离子的存在和浓度对污泥脱水效果具有重要影响.通过生物浸取和生物降解,EPS可去除或回收废水、垃圾渗滤液中的重金属和有毒有机物.EPS在土壤修复和再生中的应用最近备受关注,它主要利用生物降解和吸附功能来去除土壤中碳氢化合物和重金属.同时它还可以稳定土壤,阻碍污染物在土壤中的运输,进而防止污染物向大气和水体扩散.总而言之,EPS的环境应用很具有发展前景,但是目前还缺少相关的技术和理论支持,在投入大规模的生产应用前还需要进行大量的研究和反复试验.今后的研究重点是:1)目前EPS的提取过程较为繁琐且产量低,是现有EPS研究和应用的主要障碍之一.因此,未来的工作应该完善现有的提取方法,寻找EPS的高产微生物;2)加大对EPS组成和作用原理的研究力度,加深对EPS的认识;3)开发先进的分析技术,提高研究效率和准确度.
参考文献:
[1] BROWN M J, LESTER J N. Metal removal in activated sludge: the role of bacterial extracellular polymers[J]. Water Research,1979,13(9):817-837.
[2] 周健,龙腾锐,苗利利.胞外聚合物EPS对活性污泥沉降性能的影响研究[J].环境科学学报,2004,24(4):613-618.
[3] 龙向宇,方振东,唐然,等.胞外聚合物在生物除磷中作用的研究[J].环境科学学报,2012,32(4):784-789.
[4] 蒋勗欣,李军,马挺,等.好氧污泥颗粒化中胞外聚合物(EPS)的动态变化[J].环境科学学报,2014,34(5):1192-1198.
[5] BUTHELEZI S P, OLANIRAN A O, PILLAY B. Turbidity and microbial load removal from river water using bioflocculants from indigenous bacteria isolated from wastewater in South Africa[J]. Biotechnol,2009,8(14):3261-3266.
[6] LI Z, ZHONG S, LEI H Y, et al. Production of a novel bioflocculant by Bacillus licheniformis X14 and its application to low temperature drinking water treatment[J]. Bioresource Technology,2009,100(14):3650-3656.
[7] MA F, ZHENG L, CHI Y. Applications of biological flocculants (BFs) for coagulation treatment in water purification: turbidity elimination[J]. Chemical and Biochemical Engineering Quarterly,2008,22(3):321-326.
[8] NONTEMBISO P, SEKELWA C, LEONARD M V, et al. Assessment of bioflocculant production by Bacillus sp. Gilbert, a Marine bacterium isolated from the Bottom sediment of Algoa Bay[J]. Marine Drugs,2011,9(7):1232-1242.
[9] WANG Z, HESSLER C M, XUE Z, et al. The role of extracellular polymeric substances on the sorption of natural organic matter[J]. Water Research,2012,46(4):1052-1060.
[10] GONG W X, WANG S G, SUN X F, et al. Bioflocculant production by culture of Serratia ficaria and its application in wastewater treatment[J]. Bioresource Technology,2008,99(11):4668-4674.
[11] DENG S D, BAI R B, HU X H, et al. Characteristics of a bioflocculant produced by Bacillus mucilaginosus and its use in starch wastewater treatment[J]. Applied Microbiology and Biotechnology,2003,60(5):588-593.
[12] ZHANG C L, CUI Y N, WANG Y. Bioflocculant produced from bacteria for decolorization, Cr removal and swine wastewater application[J]. Sustain Environ Res,2012,22(2):129-134.
[13] LIAN B, CHEN Y, ZHAO J, et al. Microbial flocculation by Bacillus mucilaginosus: Applications and mechanisms[J]. Bioresource Technology,2008,99(11):4825-4831.
[14] ZHANG Z Q, LIN B, XIA S Q, et al. Production and application of a novel bioflocculant by multiple-microorganism consortia using brewery wastewater as Carbon source[J]. Journal of Environmental Sciences - China,2007,19(6):667-673.
[15] LI O, LU C, LIU A, et al. Optimization and characterization of polysaccharide-based bioflocculant produced by Paenibacillus elgii B69 and its application in wastewater treatment[J]. Bioresource Technology,2013,134(2):87-93.
[17] ZHANG Z, XIA S, WANG X, et al. A novel biosorbent for dye removal: extracellular polymeric substance (EPS) of Proteus mirabilis TJ-1[J]. Journal of Hazardous Materials,2009,163(1):279-284.
[18] BUTHELEZI S P. Application of bacterial bioflocculants for wastewater and river water treatment[D]. Durban: University of KwaZulu-Natal,2008.
[19] WANG S G, GONG W X, LIU X W, et al. Production of a novel bioflocculant by culture of Klebsiella mobilis using dairy wastewater[J]. Biochemical Engineering Journal,2007,36(2):81-86.
[20] LIU W, YUAN H, YANG J, et al. Characterization of bioflocculants from biologically aerated filter backwashed sludge and its application in dying wastewater treatment[J]. Bioresource Technology,2009,100(9):2629-2632.
[21] INBARAJ B S, CHIU C P, HO G H, et al. Effects of temperature and pH on adsorption of basic brown 1 by the bacterial biopolymer poly(gamma-glutamic acid)[J]. Bioresource Technology,2008,99(5):1026-1035.
[22] RENOU S, GIVAUDAN J G, POULAIN S, et al. Landfill leachate treatment: Review and opportunity[J]. Journal of Hazardous Materials,2008,150(3):468-493.
[23] ZOUBOULIS A I, CHAI X L, KATSOYIANNIS I A. The application of bioflocculant for the removal of humic acids from stabilized landfill leachates[J]. Journal of Environmental Management,2004,70(1):35-41.
[24] FUSCONI R, GODINHO M J, HERNANDEZ I L, et al. Gordonia polyisoprenivorans from groundwater contaminated with landfill leachate in a subtropical area: Characterization of the isolate and exopolysaccharide production[J]. Brazilian Journal of Microbiology,2006,37(2):168-174.
[25] ROSS N, VILLEMUR R, DESCHNES L, et al. Clogging of a limestone fracture by stimulating groundwater microbes[J]. Water Research,2001,35(8):2029-2037.
[26] CHANDRAN P, DAS N. Degradation of diesel oil by immobilized Candida tropicalis and biofilm formed on gravels[J]. Biodegradation,2011,22(6):1181-1189.
[27] MORE T T, YAN S, TYAGI R D, et al. Potential use of filamentous fungi for wastewater sludge treatment[J]. Bioresource Technology,2010,101(20):7691-7700.
[28] HOUGHTON J I, QUARMBY J, STEPHENSON T. Municipal wastewater sludge dewaterability and the presence of microbial extracellular polymer[J]. Water Science and Technology,2001,44(2/3):373-379.
[29] HOUGHTON J I, STEPHENSON T. Effect of influent organic content on digested sludge extracellular polymer content and dewaterability[J]. Water Research,2002,36(14):3620-3628.
[30] YANG Q, LUO K, LIAO D X, et al. A novel bioflocculant produced by Klebsiella sp and its application to sludge dewatering[J]. Water and Environment Journal,2012,26(4):560-566.
[31] ZHANG Z, XIA S, ZHANG J. Enhanced dewatering of waste sludge with microbial flocculant TJ-F1 as a novel conditioner[J]. Water Research,2010,44(10):3087-3092.
[32] GUIBAUD G, TIXIER N, BOUJU A, et al. Relation between extracellular polymers’ composition and its ability to complex Cd, Cu and Pb[J]. Chemosphere,2003,52(10):1701-1710.
[33] LIN J, HARICHUND C. Production and characterization of heavy-metal removing bacterial bioflocculants[J]. Afr J Biotechnol,2012,11:9619-9629.
[34] CHIEN C C, LIN B C, WU C H. Biofilm formation and heavy metal resistance by an environmental Pseudomonas sp.[J]. Biochemical Engineering Journal,2013,78(5):132-137.
[35] MIKUTTA R, BAUMGRTNER A, SCHIPPERS A, et al. Extracellular polymeric substances from Bacillus subtilis associated with minerals modify the extent and rate of heavy metal sorption[J]. Environmental Science & Technology,2012,46(7):3866-3873.
[36] LESMANA S O, FEBRIANA N, SOETAREDJO F E, et al. Studies on potential applications of biomass for the separation of heavy metals from water and wastewater[J]. Biochemical Engineering Journal,2009,44(1):19-41.
[37] BROWN M J, LESTER J N. Metal removal in activated sludge: the role of bacterial extracellular polymers[J]. Water Research,1979,13(9):817-837.
[38] ZHANG Y, WANG F, YANG X, et al. Extracellular polymeric substances enhanced mass transfer of polycyclic aromatic hydrocarbons in the two-liquid-phase system for biodegradation[J]. Applied Microbiology and Biotechnology,2011,90(3):1063-1071.
[39] JIA C, LI P, LI X, et al. Degradation of pyrene in soils by extracellular polymeric substances (EPS) extracted from liquid cultures[J]. Process Biochemistry,2011,46(8):1627-1631.
[40] LIU A, AHN I S, MANSFIELD C, et al. Phenanthrene desorption from soil in the presence of bacterial extracellular polymer: observations and model predictions of dynamic behavior[J]. Water Research,2001,35(3):835-843.
[41] DENNIS M L, TURNER J P. Hydraulic conductivity of compacted soil treated with biofilm[J]. Journal of Geotechnical & Geoenvironmental Engineering,1998,124(2):120-127.
[42] PETER O B.Chapter 7: biological remediation of hydrocarbon and heavy metals contaminated soil[M] // Pascucci S Soil Contamination. Rijeka: InTech,2011.
[43] AISLABIE J, SAUL D J, FOGHT J M. Bioremediation of hydrocarbon-contaminated polar soils[J]. Extremophiles Life Under Extreme Conditions,2006,10(3):171-179.
[44] SINGH R, PAUL D, JAIN R K. Biofilms: implications in bioremediation[J]. Trends in Microbiology,2006,14(9):389-397.
[45] GERBERSDORF S U, JANCKE T, WESTRICH B, et al. Microbial stabilization of riverine sediments by extracellular polymeric substances[J]. Geobiology,2008,6(1):57-69.
[46] DROPPO I G. Biofilm structure and bed stability of five contrasting freshwater sediments[J]. Marine and Freshwater Research,2009,60(7):690-699.
[47] PRASANNA R, JAISWAL P, KAUSHIK B D. Cyanobacteria as potential options for environmental sustainability - promises and challenges[J]. Indian Journal of Microbiology,2008,48(1):89-94.
[48] IVANOV V, CHU J. Applications of microorganisms to geotechnical engineering for bioclogging and biocementation of soil in situ[J]. Reviews in Environmental Science and Biotechnology,2008,7(2):139-153.
收稿日期:2015-04-10
基金项目:国家级大学生创新创业训练计划项目(201210346001);国家自然科学基金项目(51278162).
通信作者:金仁村(1979—),男,教授,博士,主要从事水污染控制和环境生物技术研究.E-mail:jrczju@aliyun.com
doi:10.3969/j.issn.1674-232X.2016.04.010
中图分类号:X703
文献标志码:A
文章编号:1674-232X(2016)04-0387-07
Application Progress of Microorganism Extracellular Polymeric Substances in Environmental Engineering
YE Xiaoqing, PENG Tingyu, JI Yuxin, HE Liling, LIU Anna, JIN Rencun
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
Abstract:Extracellular polymeric substances (EPS) have the potential to serve as adsorbent, flocculant, coagulant and immobilization of microorganism, etc. Basing on the EPS application in environmental engineering, this study reviews the function of EPS in pollutants removal and soil restoration systematically, points out the advantages of EPS as the bioflocculant, and discusses the mechanism of EPS to provide an guidance for the in-depth study of EPS in environmental engineering.
Key words:microorganism extracellular polymeric substances; adsorbent; bioflocculant; environmental engineering; mechanism
